
ЗМІСТ
Вступ………………………………………………………………….…..3
РОЗДІЛ 1. Властивості карбонільних сполук
1.1. Будови і властивості сечовини…...…...…….……………….…...…5
1.2. Реакції конденсації карбонільних сполук..........................................10
1.3. Способи одержання спіросполук………………………...….……....21
РОЗДІЛ 2. Синтез спірокарбону та його похідних
2.1. Одержання спірокарбону та його похідних………………...…….26
2.2 Застосування спырокарбону та його похідних……………………32
Висновки…………………………………………………………..….37
Список використаних джерел……………….……………..38
ВСТУП
На сучасному етапі розвитку сільського господарства все частіше постають проблеми підвищення ефективності його виробництв. Якими шляхами збільшити продуктивність рослинництва? Як забезпечити тваринництво раціональною базою кормів? У вирішенні цієї проблеми сьогодні приходить на допомогу використання синтетичних препаратів, що є аналогами природних біологічно активних сполук, які виявляють високу фізіологічну активність щодо сільськогосподарських рослин і тварин, тим самим підвищуючи їх продуктивність.
Мета: дослідити способи синтезу спірокарбону та його похідних на основі аналогів сечовини.
Предмет роботи: синтез нітрогенвмісних гетероциклічних сполук.
Об’єкт дослідження: синтез спірокарбону та його аналогів.
Завдання:
Провести аналіз літератури з питання синтезу спіросполук.
Провести синтез похідних спірокарбону та відібрати найбільш раціональний.
Робота включає в себе зміст, вступ, основну частину, висновки и список використаних джерел.
Основна частина складається з двох розділів.
Перший розділ являє собою літературний огляд, в якому описані будова та властивості сечовини та її аналоги. Розглядаються реакції конденсації, та синтез похідних піримідину.
Другий розділ включає методики синтезу спіросполук.
Як базові реакції для одержання вихідних сполук нами використовувалися синтез за механізмом альдольно-кротонової конденсації та реакція Кляйзена-Шмідта (реакція конденсації ароматичних альдегідів з аліфатичними карбонільними сполуками). Отримані ненасичені карбонільні сполуки підлягали кислій каталітичній конденсації з сечовиною (або її метилпохідних і сульфурпохідних) в середовищі органічних розчинників.
Розділ 1
ВЛАСТИВОСТІ КАРБОНІЛЬНИХ СПОЛУК
1.1 Будова та властивості сечовини
Сечовина та її аналоги [1-13]

1.1
Сечовина (карбамід) — хімічна сполука, диамід карбонатної кислоти. Білі кристали, розчинні в полярних розчинниках (воді, етанолі, в розчині амоніаку). Сечовина відкрита Руелем в 1773 р. і ідентифікована Праутом в 1818 р. Особливе значення сечовини в історїї органічної хімії придав факт її синтезу з неорганічних речовин Вьолером в 1828 р [1-4]:
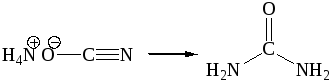
1.1
Це перетворення є першим синтезом органічних сполук з неорганічних. Вьолер одержав сечовину нагріванням амоній ціоната, одержаного взаємодією калій ціанату з амоній сульфатом. Ця подія завдала перший удар по віталізму — вчення про життєву силу.
Фізичні властивості [3-7]
Безбарвні кристали, без запаху, кристалічна решітка тетраедрична (а = 0,566 нм, b= 0,4712 нм, c = 2); піддається поліморфним перетворенням.
Сечовина добре розчинна в полярних розчинниках (вода, розчин амоніаку), при зниженні полярності розчинника розчинність знижується, нерозчинна в неполярних розчинниках (алкани, хлороформ). Внаслідок таутомерії утворює ізосечовину (1.2) [3.5]:

У водних розчинах сечовина існує у вигляді йонів H2NCON+H3 та H2NC(NH)O– (К 1,5·10–14; 25 С). Стійка до дії таких окисників, як Н2О2 та KMnO4. У хімічному відношенні сечовина виявляє властивості амідів, але, на відміну від останніх, у сечовини більш виражені основні та нуклеофільні властивості. З сильними кислотами утворює солі. Здатна утворювати комплексні сполуки з багатьма речовинами.
У водних розчинах кислот або лугів сечовина гідролізується, утворюючи вуглекислий газ і амоніак. При нагріванні до 150 °С і вище утворює біурет (1.3) і як побічний продукт – ціанурову кислоту (1.4):

Розплавлена сечовина взаємодіє з лужними металами та їх амідами з утворенням солей ціанаміду[9-11]:
H2NCONH2 + Na→ NaHCN2 + 0,5H2 + NaOH;
H2NCONH2 + NaNH2→NaHCN2+ H2O + NH3
Сплавлення з нітратом амонію призводить до утворення іміносечовини – гуанідину (1.5) [12,13]:

При алкілуванні утворює алкілзаміщені сечовини складу RNHCONH2. Взаємодія зі спиртами приводить до виникнення уретанів – H2NCOOR; з карбоновими кислотами та їх функціональними похідними (ангідридами, хлорангідридами, естерами) утворює N-ацилпохідні сечовини – уреїди RCONHCONH2. Уреїди – кристалічні речовини з високими Тпл. При взаємодії сечовини з дикарбоновими кислотами утворюються уреїди двох типів: кислі – уреїдокислоти (урові кислоти) H2NCONHCO(CH2)nCOOH і середні, або циклічні, наприклад парабанова кислота (1.6), сечова кислота (1.7) [9,11]:

Нагрівання сечовини з деякими арилангідридами дикарбонових кислот приводить до утворення відповідних імідів (наприклад, із фталевого ангідриду при 150 °С – фталімід). З амінами аліфатичного ряду сечовина вступає в реакцію поліконденсації з утворенням високомолекулярних продуктів типу H2N(CH2)n[NHCONH(CH2)n]n, з аніліном дає феніл- і дифенілсечовину; з гідразином – семікарбазид H2NCONHNH2 і гідразоформамід (H2NCONH)2 [6,9,13].
Існує декілька методів якісного визначення сечовини: утворення осадів нітрату сечовини H2NCONH2·HNO3 або оксалату сечовини H2NCONH2·H2C2O4; забарвлення солянокислих розчинів сечовини у фіолетово-пурпуровий колір при додаванні фурфуролу, біуретова реакція. Для кількісних визначень сечовини гідролізують за наявності H2SO4 або уреази і визначають NH3 (відтитровують або визначають реактивом Неслера) або окиснюють титруванням слабколужним розчином гіпоброміту калію з наступним визначенням його надлишку або об’єму виділеного азоту (за А. П. Бородіним) [3,6,8].
У промисловості сечовину добувають реакцією взаємодії амоніаку з карбону (ІV) оксидом (Ф. І. Базаров, 1870 р.); проміжним продуктом у цьому синтезі є карбомат амонію [1,2,5]:
2NH3
+ CO2![]() H2NCOONH4;
H2NCOONH4;
∆H°298 = –38,0 ккал/г-моль
H2NCOONH4![]() H2NCONH2
+ H2O;
H2NCONH2
+ H2O;
∆H°298 = +6,7 ккал/г-моль.
Ці реакції зворотні; ступінь перетворення СО2 на карбонат амонію й останнього на сечовину залежить від температури, тиску, вагових співвідношень між вихідними сполуками, від домішок інертних газів і води, а також часу перебування речовин, які реагують, у реакційному об’ємі. Обидві реакції проводяться безперервно та одночасно при температурі 160–200 оС і тиску 50 атм.
Сечовина та її похідні широко використовують у фармацевтичній промисловості вона є вихідною сполукою для синтезу речовин: фенобарбіталу, вероналу, бромуралу та багатьох інших; входить до складу гігієнічних (зубні пасти) і косметичних кремів. Широко використовується в сільському господарстві: у тваринництві застосовують як домішки до кормів для жуйних тварин; у рослинництві – як висококонцентроване (46,55% N2) азотне добриво, яке підходить для всіх типів ґрунтів і вноситься під усі культури; похідні сечовини – активні гербіциди. На основі сечовини одержують карбамідні смоли, ціанати К і Na, гідразин, гідразоформамід, ціанурову кислоту та її естери, метиламін. Продукти конденсації сечовини з деякими діамінами (наприклад H2N(CH2)3NH2) використовують для одержання синтетичного волокна урилону [11-13].
Комплексоутворення [4,5]
Сечовина утворює комплекси з багатьма сполуками, наприклад, з гідроген пероксидом CO(NH2)2-H2O2, використовується як зручна і безпечна форма «сухого» гідроген пероксида. Здатність сечовини утворювати комплекси з алканами використовується для депарафінування нафти. При чому сечовина утворює комплекси тільки з н-алканами тому, що розгалуження карбонового ланцюга не можуть пройти в циліндричні канали кристалів сечовини [4].
Сечовина та її аналоги використовуються для одержання мінеральних добрив, лікарських препаратів. На основі сечовини і її аналогів синтезуються різні гетероциклічні сполуки[5].
