
- •1.Эпидемиология рака
- •2.Экологические факторы и производственные вредности в развитии раковых заболеваний
- •3. Важнейшие меры профилактики рака
- •1. Природа и причины рака
- •2. Питание и рак.
- •3. Курение и рак.
- •4. Окружающая среда, жилище и профилактика рака.
- •5. Внутренняя среда организма, образ жизни и профилактика рака.
- •6. Клиническая профилактика и ранняя диагностика рака. Особенности профилактики злокачественных опухолей основных локализаций.
- •7. Химиопрофилактика рака
- •4. Факультативные и облигатные предраки
- •5. Задачи смотровых кабинетов в выявлении онкологических заболеваний
- •Обще онкологический осмотр
- •Основные особенности опухолевого роста
- •Глава 5 молекулярные механизмы опухолевого роста
- •9. Принципы классификации злокачественных опухолей по международной системе tnm
- •10. Клинические группы онкологических больных
- •11. Деонтология в онкологии
- •12. Лечение болевого синдрома у онкологических больных
- •13. Задачи медицинской реабилитации онкологических больных
- •14. Санаторно-курортное лечение онкологических больных
- •15. Методы рентгенологической диагностики злокачественных опухолей
- •16. Цитологической исследование в диагностике злокачественных опухолей
- •18. Маркеры см. Учебник
- •19. Иммуногистохимическая диагностика опухолей
- •21. Пути и механизмы метастазирования злокачественной опухоли
- •23. Что называют анатомической зоной
Основные особенности опухолевого роста
Глава 5 молекулярные механизмы опухолевого роста
ОПУХОЛЕВЫЙ ПРОЦЕСС КАК БИОЛОГИЧЕСКОЕ ЯВЛЕНИЕ
Опухолевый процесс - это процесс, сопровождающийся прибавлением клеточной массы. Для новообразований характерен автономный тип роста. В норме количество клеток регулируется посредством точной балансировки двух противоположных процессов - клеточного деления и клеточной элиминации. При онкологическом заболевании прибавление клеточной массы опережает клеточную гибель либо за счет активации процессов пролиферации, либо вследствие угнетения процессов апоптоза, а чаще всего - при сочетанном нарушении этих процессов. Существенно, что дисбаланс регуляции количества клеток вызван неспособностью трансформированного клона реагировать на внешние сигналы; таким образом, объем клеточной массы перестает зависеть от потребностей организма, что и подразумевается под понятием «автономность».
На протяжении всего XX века ученые пытались сформулировать, какие конкретные признаки отличают опухолевые клетки и ткани от их нормальных предшественников. Прогресс в данной области, представляющей основу для разработки направлений противоопухолевой терапии, затруднялся биологическим разнообразием проявления новообразований. Тем не менее к настоящему времени удалось выделить и классифицировать несколько четких, подкрепленных молекулярногенетическими данными тенденций. Наиболее ясное обобщение этих признаков представлено в работе основоположников молекулярной онкологии D. Hanahan и R. Weinberg, появившейся на страницах журнала Cell (? 1 за 2000 г.). По мнению авторов, все или почти все опухоли характеризуются несколькими неотъемлемыми чертами.
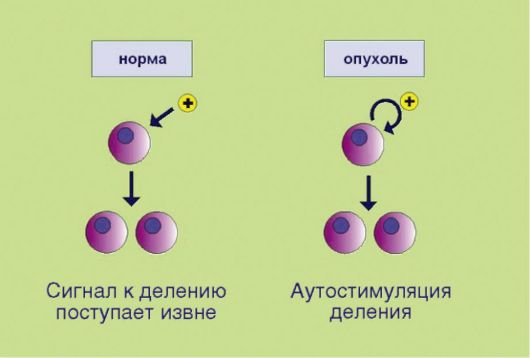 Рис.
5.1. Аутостимуляция
пролиферативного сигнала
Рис.
5.1. Аутостимуляция
пролиферативного сигнала
1. Самодостаточность в отношении сигналов пролиферации, связанная e аутопродукцией факторов роста, соответствующих рецепторов или других компонентов сигнального промитотического каскада(рис. 5.1). Существенно, что нормальная клетка никогда не делится сама по себе; для запуска пролиферативной программы необходим сигнал извне, доставляемый эндокринной системой (гормоны), паракринными механизмами (тканевые факторы роста), или через синаптические окончания нейронов (нейротрофика). Таким образом, увеличение количества клеток в норме происходит лишь в том случае, если многоклеточный организм-хозяин продуцирует сигналы к наращиванию клеточной массы. Трансформированная клетка продуцирует подобные сигналы сама для себя, вне зависимости от потребностей организма, что и приводит к безостановочному делению опухолевого клона.
2. Потеря чувствительности к сигналам, сдерживающим процесс пролиферации, обусловленная инактивацией супрессорных (антимитотических) белков (рис. 5.2). Клоны, обладающие аномальной способностью к аутостимуляции пролиферативного каскада, могут возникать в организме достаточно часто, что связано с постоянным мутационным процессом в клетках организма. Однако все многоклеточные представители живой природы выработали в процессе эволюции несколько уровней защитных систем, препятствующих несанкционированному накоплению клеток. В случае появления клеток со способностью к аутокринной стимуляции деления организмхозяин продуцирует сдерживающие сигналы, доставляемые к клеткам
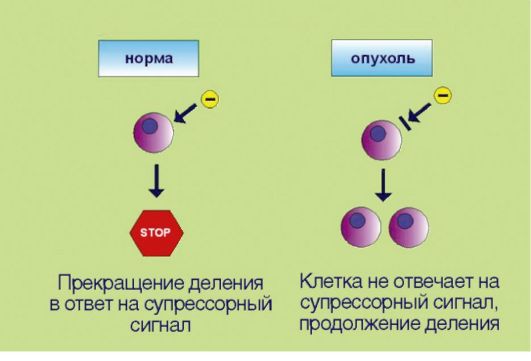 Рис.
5.2. Потеря
чувствительности к сигналам, прекращающим
клеточное деление
Рис.
5.2. Потеря
чувствительности к сигналам, прекращающим
клеточное деление
в виде гуморальных факторов и направленные на прекращение пролиферации. Трансформированные клетки в отличие от нормальных утратили способность к восприятию таких сигналов. Подобная нечувствительность к супрессорным воздействиям может происходить в результате утраты соответствующих мембранных рецепторов или других компонентов сигнальных каскадов, участвующих в проведении экстрацеллюлярного сигнала к клеточному ядру.
3. Замедление процессов программируемой клеточной гибели, опосредованное дисбалансом биохимической регуляции процессов апоптоза (рис. 5.3). В повседневной жизни слово «смерть» всегда подразумевает негативный эмоциональный оттенок. Напротив, в условиях функционирования многоклеточных живых систем физиологическое значение гибели клеток в значительной мере зависит от контекста этого события. Принято выделять 2 основные разновидности клеточной смерти: непрограммируемая и программируемая. Непрограммируемая гибель клеток (некроз) происходит в результате выраженных неблагоприятных воздействий (гипоксия, ожог и т.д.). Подобное событие может негативно отражаться на структуре и функции органа и сопровождаться формированием рубцовой ткани. Программируемая клеточная гибель в отличие от некроза является ювелирно управляемым, энергозатратным процессом, направленным на сохранение и поддержание морфофункциональных характеристик органов и тканей. Наиболее
|
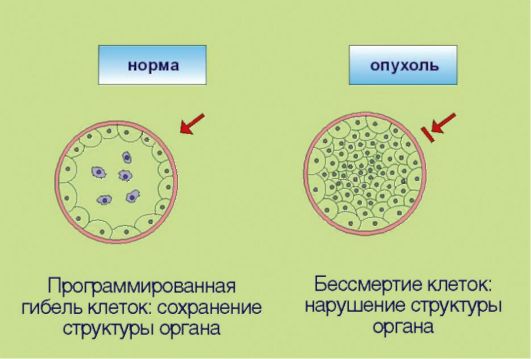 Рис.
5.3. Иммортализация
(бессмертие)
Рис.
5.3. Иммортализация
(бессмертие)
изученная разновидность программируемой клеточной гибели - апоптоз - обеспечивает «плановую» элиминацию клеток; этот процесс особенно выражен в тканях с высокой интенсивностью обновления клеток - в эпителии ЖКТ, коже, крови. Помимо этого клетка способна распознавать собственные повреждения ДНК и другие биохимические изменения, представляющие угрозу с точки зрения злокачественной трансформации. При появлении подобных нарушений запускается «суицидная» программа, приводящая к самоуничтожению потенциально опасных клеток. Раковые клетки в отличие от нормальных утратили способность к самоэлиминации, что позволяет им сохранять жизнеспособность, несмотря на наличие повреждений ДНК и ассоциированных с гиперпролиферацией стрессовых условий существования.
4. Неограниченный репликативный потенциал клеток (преодоление «лимита Хэйфлика»), сопряженный с реактивацией экспрессии фермента теломеразы и как следствие отсутствием физиологического укорачивания теломер (рис. 5.4). Представим, что в организме возник клон клеток, обладающий способностью к аутостимуляции деления, не чувствительный к супрессорам митоза и утративший способность к самоэлиминации посредством апоптоза. Даже эти клетки, обладающие целым набором характеристик злокачественной трансформации, не смогут сформировать клинически распознаваемую опухоль! В многоклеточных организмах существует еще один уровень защиты: ограничение
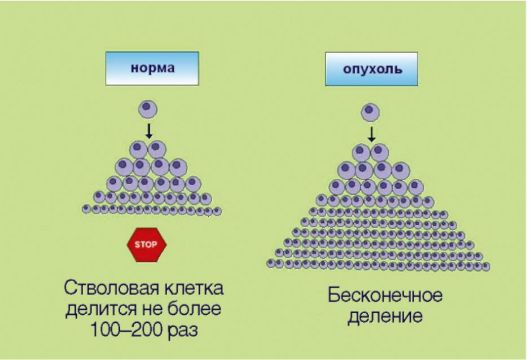 Рис.
5.4. Неограниченный
репликативный потенциал (бесконечное
деление)
Рис.
5.4. Неограниченный
репликативный потенциал (бесконечное
деление)
репликативного потенциала делящихся клеток. В 1961-1962 гг. американский ученый L. НауШек установил, что нормальные клетки могут делиться не более 100-150 раз, после чего весь клон (т.е. исходная клетка и ее потомки, обладающие соответственно меньшим резервом возможных делений) утрачивает возможность к самовоспроизведению. Этот феномен, зачастую называемый лимитом Хэйфлика, по крайней мере отчасти лежит в основе биологических механизмов старения: установлено, что репликативный потенциал клеток уменьшается с возрастом индивидуума. Более того, преодоление лимита Хэйфлика является необходимым условием злокачественной трансформации; демонстрацией этого свойства является тот факт, что в лабораторных условиях только опухолевые клетки могут подвергаться многолетнему культивированию, в то время как долгосрочные культуры нормальных клеток получить не удается. Неограниченный репликативный потенциал опухолевых клеток принято объяснять активацией фермента теломеразы, которая компенсирует наблюдаемое в ходе клеточного деления физиологическое укорочение концевых участков хромосом. Теломераза, по-видимому, является одной из самых перспективных молекулярных мишеней для противоопухолевой терапии.
|
5. Стимуляция процессов ангиогенеза в опухоли, вызванная экспрессией трансформированными клетками ангиогенных факторов и направленная на удовлетворение повышенных потребностей быстроделящихся неопластичес-
 Рис.
5.5. Индукция ангиогенеза
Рис.
5.5. Индукция ангиогенеза
ких компонентов в оксигенации (рис. 5.5). Длительное время опухолевым клеткам приписывалась полная самодостаточность. Предполагалось, что трансформированный клон пролиферирует сам по себе, а все остальные элементы опухоли - строма, сосуды, фибробласты - являются лишь пассивными вспомогательными компонентами. Изменение этих представлений связано с именем выдающегося американского ученого J. Folkman, который совмещал повседневную работу врачахирурга с основополагающими, фундаментальными исследованиями в области экспериментальной онкологии. J. Folkman предположил и экспериментально доказал, что опухолевые клетки могут сформировать клинически распознаваемое новообразование лишь в том случае, если они продуцируют факторы неоангиогенеза. Таким образом, формирование сосудистой сети опухоли происходит не само по себе, а за счет активных, управляемых трансформированными клетками биологических процессов. К настоящему времени идентифицированы десятки факторов, провоцирующих или, наоборот, ингибирующих ангиогенез. Примечательно, что разработка антиангиогенных препаратов считается одним из самых перспективных направлений в онкологии. Дело в том, что во взрослом организме практически не происходит формирования новых сосудов (исключение составляют посттравматическая регенерация тканей и некоторые процессы, связанные с репродуктивным циклом у женщин). Предполагается, что антиангиогенные препараты должны обладать прекрасным
терапевтическим индексом, т.е. эффективно тормозить рост опухолевой массы без каких-либо побочных воздействий на организм.
|
6. Способность к инвазии и метастазированию, ассоциированная с продукцией опухолью гистолитических ферментов (протеаз), а также факторов, угнетающих локальный иммунитет (рис. 5.6). Эта особенность злокачественной трансформации почти всегда упоминается как ключевой компонент опухолевого роста. Внимание к инвазии и метастазированию связано с клинической значимостью данных процессов: именно они компрометируют результаты хирургического лечения рака и приводят к летальному исходу у онкологических больных. В контексте сказанного отметим, что ни один из перечисленных признаков опухолевого роста не является достаточным для клинической манифестации онкологического процесса. В частности, процесс метастазирования нетрансформированных клеток характерен для заболевания женской репродуктивной системы - эндометриоза, которое никоим образом не является онкологической патологией.
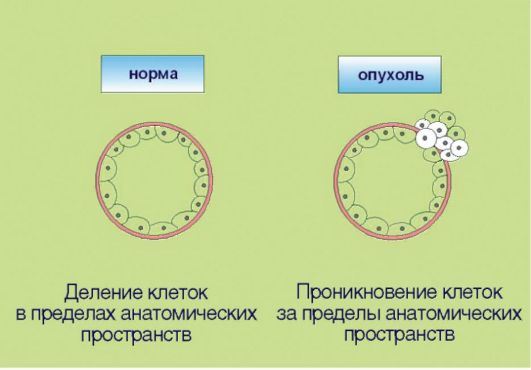 Рис.
5.6. Инвазия
и метастазирование
Рис.
5.6. Инвазия
и метастазирование
7. Геномная нестабильность, опосредованная инактивацией систем репарации ДНК и нарушениями в молекулярном контроле клеточного цикла (рис. 5.7). Для опухолевой клетки характерно ускоренное накопление мутаций, что по крайней мере отчасти связано со снижением эффективности процессов репарации ДНК. Подобная особенность приводит к чрезвычайной биологической пластичности новообразований, которые способны быстро приспосабливаться
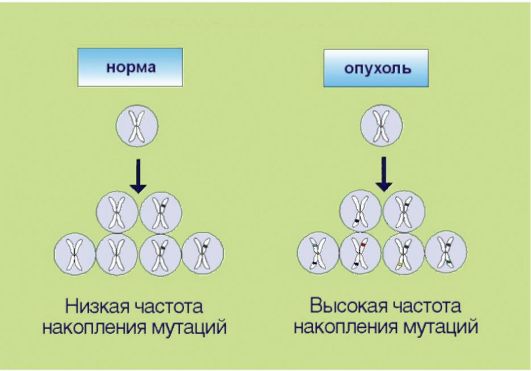 Рис.
5.7. Геномная
нестабильность
Рис.
5.7. Геномная
нестабильность
к изменяющимся условиям метаболизма и разнообразным лечебным воздействиям. Существенно, что геномная нестабильность, по-видимому, является основным свойством опухолевых клеток, обеспечивающим «терапевтическое окно» при назначении цитостатических препаратов. Ранее полагали, что механизм лечебного действия цитостатиков связан с избирательным подавлением делящихся клеток. Это утверждение остается в силе, однако нуждается в важном дополнении. Противоопухолевый эффект химиотерапии и радиации связан с индукцией повреждений ДНК, которые действительно проявляются лишь в процессе клеточного деления; однако опухолевые клетки, по крайней мере в теории, обладают большей чувствительностью к ДНК-повреждающим агентам, так как их способность к репарации химических изменений структуры нуклеиновых кислот ниже, чем у неизменных компонентов органов и тканей.
|
8. Перестройка стромальных компонентов, создающая более благоприятные условия для эволюции злокачественного клона (рис. 5.8). Длительное время предполагалось, что элементы стромы образуют лишь пассивный каркас для размножающихся опухолевых клеток. В последние годы установлено, что подобное утверждение далеко от истины. Многочисленные факты свидетельствуют о том, что стромальные компоненты опухолей заметно отличаются от таковых в нормальных тканях; некоторые исследователи даже настаивают
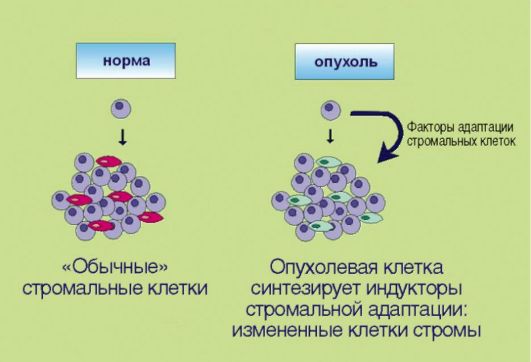 Рис.
5.8. Адаптация
стромальных клеток к особенностям
опухолевого роста
Рис.
5.8. Адаптация
стромальных клеток к особенностям
опухолевого роста
на том, что фибробласты, инфильтрирующие эпителиальные новообразования, содержат соматические мутации, отличные от таковых в опухолевых клетках и необходимые для жизнедеятельности злокачественного новообразования. Продемонстрированы многочисленные случаи симбиоза трансформированных клеток и окружающих их фибробластов. В частности, независимость малигнизированного эпителия от внешних пролиферативных сигналов может обеспечиваться не аутокринной стимуляцией как таковой, а секрецией факторов роста фибробластами, населяющими опухоль. В свою очередь, эпителиальные клетки секретируют целый спектр биологически активных веществ, регулирующих адаптацию стромальных элементов к потребностям опухолевого роста.
Подобная «диссекция» ключевых признаков опухолевого роста имеет существенное практическое значение. Эмпирический подход, сопряженный со случайным перебором тысяч биологически активных химикатов, постепенно замещается научно обоснованным, молекулярно-направленным поиском действительно специфических противораковых средств, направленных на активацию или инактивацию ключевых биохимических компонентов опухолевой трансформации. Первые подобные средства уже внедрены в практическую медицину. По-видимому, их количество увеличится в ближайшие годы в десятки раз, что приведет к существенному улучшению результатов противоопухолевой терапии.
|
Онкогены и антионкогены
До самого последнего времени количество «теорий рака» измерялось сотнями. К наиболее значимым следует отнести вирусные, иммунологические, канцерогенные и гормонально-метаболические концепции, которые были предметом горячих споров в середине ХХ столетия. Понимание природы опухолевого роста стало принимать более очерченные формы лишь в течение двух последних десятилетий прошлого века благодаря бурному развитию молекулярной онкологии. Первый серьезный прорыв произошел в 1970-х годах, в процессе изучения молекулярных основ вирусного канцерогенеза. При проведении серии экспериментов, направленных на идентификацию «онкологически значимых» фрагментов генома вируса саркомы Рауса, выяснилось, что за всю картину злокачественной трансформации отвечает лишь один-единственный ген, который назвали онкогеном src. Позже было установлено, что подобный принцип характерен для большинства известных онкогенных вирусов. Однако значение опытов на вирусах лимитировалось тем фактом, что данная разновидность опухолевого патогенеза наблюдалась только у животных (мышей, крыс, птиц), при этом причастности вирусов к опухолям у человека доказать не удавалось. Разработка метода гибридизации нуклеиновых кислот привела к новому революционному открытию: оказалось, что все вирусные онкогены имеют гомологов в составе человеческого генома. Более того, данные гомологи являются необходимым компонентом клеточной жизнедеятельности; они отвечают за такие важнейшие процессы, как пролиферация, дифференцировка и т.д. Венцом примерно 10-летней серии экспериментов стало доказательство факта активации онкогенов в опухолях (вследствие увеличения количества копий и/или функциональной модификации). К середине 1980-х годов онкогенная теория рака приобрела стройность. Ее основные положения можно сформулировать следующим образом.
|
1. Онкогеном называется ген, который: а) в норме оказывает активирующее влияние на процессы пролиферации и/или препятствует клеточной гибели; б) активируется в опухолях; в) проявляет трансформирующие свойства в экспериментах по трансфекции.
2. Онкогены необходимы для нормального функционирования (обновления) тканей; их работа находится под строгим контролем сигнальных систем организма. Соматическая мутация
в онкогене приводит к независимости клетки от внешних регулирующих влияний, т.е. клеточный клон, находясь в условиях аутостимуляции, приобретает способность к неконтролируемому размножению. Генетические повреждения в онкогенах могут возникать вследствие случайного мутационного процесса, однако вероятность мутаций существенно повышается при увеличении канцерогенной нагрузки.
3. При вирусном канцерогенезе у животных вирус содержит уже активированную версию онкогена и, таким образом, является лишь транспортной формой последнего. У человека, напротив, большинство опухолей возникает за счет активации (мутации) эндогенных онкогенов.
4. Активация одного онкогена почти всегда компенсируется. Процесс злокачественной трансформации требует сочетанных нарушений в нескольких онкогенах.
К настоящему моменту идентифицированы сотни онкогенов. Они принадлежат к самым разнообразным классам белков и могут выполнять широкий спектр клеточных функций. Наиболее хорошо изучены протеинкиназы - ферменты, осуществляющие регуляцию активности белков-мишеней посредством фосфорилирования. Протеинкиназы делятся на 2 класса: тирозинкиназы и серин-треониновые киназы. Тирозинкиназы несколько легче поддаются изучению, поэтому сведения об их причастности к возникновению опухолей представлены в достаточно обширном объеме. К наиболее исследованным тирозинкиназам относятся мембранные белки EGFR, HER2, KIT, цитоплазматические ферменты SRC, ABL и т.д. В качестве примеров серин-треониновых киназ, вовлеченных в процесс онкогенеза, можно привести белки АКТ, PKC и т.п. Большую известность получили работы, посвященные изучению ГТФаз, особенно онкобелков семейства RAS. Значительное число известных онкогенов кодирует регуляторы транскрипции; к наиболее изученным ядерным онкобелкам относятся MYC, FOS и JUN.
|
Несмотря на кибернетическую очевидность причастности к данной проблеме противоположно направленных процессов, т.е. механизмов сдерживания клеточного роста, молекулярные основы негативной регуляции количества клеток почти не обсуждались вплоть до открытия антионкогенов. Антионкогеном (супрессорным геном) называется ген, который: а) в норме оказывает инактивирующее влияние на процессы пролиферации и (или) способствует кле-
точной гибели; б) инактивируется в опухолях; в) осуществляет реверсию злокачественного фенотипа в экспериментах по трансфекции. К концу 1980-х годов было установлено, что практически каждая опухоль содержит множественные мутации в антионкогенах, выражающиеся как в виде делеций, так и в форме микромутаций. Вероятно, инактивирующие повреждения супрессорных генов встречаются существенно чаще, чем активирующие мутации в онкогенах, что соответствует бытовой логике «ломать - не строить». В целом открытие антионкогенов стало заметным этапом в истории молекулярной онкологии, добавив целостности и логичности к имевшимся до этого воззрениям.
Наиболее известным супрессорным геном является ген р53. Он кодирует небольшой белок, осуществляющий огромное число разнообразных защитных функций. В частности, р53 дирижирует ответом клетки на повреждение ДНК посредством взаимодействия с другими регуляторными белками и, в зависимости от ситуационного контекста, инициирует процессы блокировки клеточного цикла, репарации ДНК, апоптоза. Помимо этого р53 является фактором транскрипции, т.е. регулирует уровень экспрессии целого ряда генов. Другой хорошо изученный супрессорный ген - RB1 - участвует в контроле деления клеток. К супрессорным генам с определенными оговорками можно отнести практически все гены, участвующие в поддержании геномной стабильности. Наследственные мутации во многих из них - BRCA1, BRCA2, MLH1, MSH2 - являются причиной так называемых семейных раковых синдромов.
|
Значимым событием первого десятилетия XXI века является открытие принципиально нового класса биологически активных молекул - микроРНК, которые представляют собой очень короткие некодирующие последовательности (около 20 нуклеотидов). МикроРНК способны связываться с комплементарными участками кодирующих РНК, что приводит к угнетению трансляции и (или) деградации последних. К настоящему моменту идентифицировано примерно 5 сотен микроРНК. Каждая из этих молекул отвечает за функционирование десятков генов-мишеней. Таким образом, микроРНК являются уникальным инструментом координации процессов функционирования генов. Многочисленные работы свидетельствуют о несомненной роли микроРНК в онкогенезе. Различные представители этого класса молекул могут выполнять как онкогенные, так и антионкогенные функции.
Современная наука полагает, что для возникновения трансформированного клеточного клона необходимо как минимум 5-9 мутаций в разных онкогенах и антионкогенах; меньшее количество мутаций почти всегда компенсируется защитными системами организма. Подобная особенность объясняет возрастное распределение онкологических заболеваний: большинство опухолей проявляют себя лишь во второй половине жизни, так как для их манифестации необходима целая цепь мутационных событий.
Генетические нарушения в опухолях
Опухоли характеризуются широким спектром различных генетических нарушений. Многие онкогены и антионкогены поражаются посредством микромутаций - небольших изменений в последовательности ДНК, проявляющихся микроделециями, микроинсерциями или нуклеотидными заменами (рис. 5.9). Подобный тип нарушений лежит в основе активации онкогенов RAS, BRAF, EGFR, инактивации супрессорного гена р53 и т.д.
Большинство опухолей также характеризуется нестабильностью на уровне протяженных участков хромосом, поэтому для новооб-
|
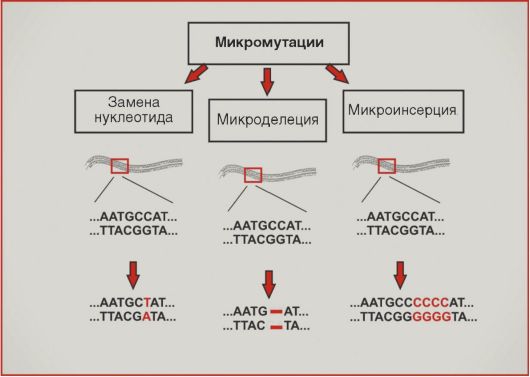 Рис.
5.9. Микромутации
Рис.
5.9. Микромутации
разований исключительно типичны нарушения копийности генетического материала (рис. 5.10). Увеличение копийности онкогенов обозначается термином «амплификация»; последняя приводит к возрастанию количества соответствующих белковых продуктов. Подобный механизм активации характерен для онкогеновHER2, NMYC, cyclin D1. Значительно чаще амплификаций встречаются делеции участков хромосом; подобный механизм повреждений типичен для супрессорных генов RB1, APC, p16. Транслокации - перестройки хромосом, приводящие к изменению уровня экспрессии генов или образованию химерных белков, - в большей степени характерны для онкогематологической патологии. Наиболее известна транслокация BCR-ABL, приводящая к образованию так называемой филадельфийской хромосомы и наблюдаемая при хроническом миелолейкозе.
В последние годы внимание исследователей все больше привлекают нарушения экспрессии генов в трансформированных клетках (рис. 5.11). По крайней мере отчасти изменения активности транскрипции онкогенов и генов-супрессоров обусловлены метилированием цитозинов в промоторных последовательностях. Статус
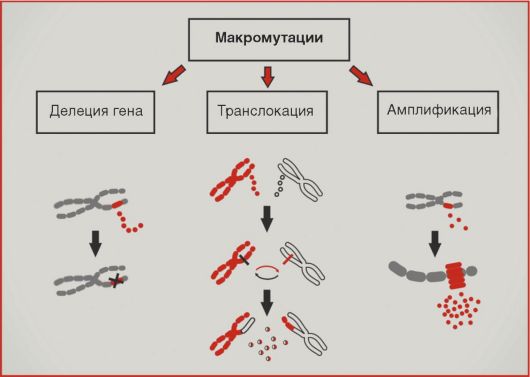 Рис.
5.10. Макромутации
Рис.
5.10. Макромутации
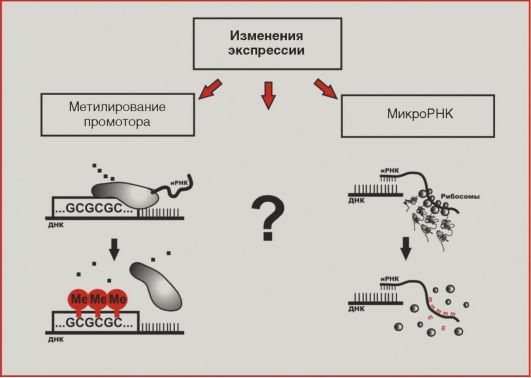 Рис.
5.11. Изменения
экспрессии
Рис.
5.11. Изменения
экспрессии
метилирования по цитозину наследуется при делении клетки, поэтому метилированный цитозин иногда называют 5-м основанием ДНК. Наконец, как упоминалось выше, недавние открытия молекулярных биологов демонстрируют существенную роль изменений экспрессии микроРНК в формировании молекулярного портрета опухолевой клетки. Следует заметить, что многие аспекты механизмов регуляции экспрессии в норме и при патологии остаются неизученными.
Методы анализа молекулярных нарушений в опухолях
Методическая база молекулярной биологии характеризуется исключительной сложностью и разнообразием. Мы кратко остановимся лишь на тех лабораторных подходах, которые имеют прямое или косвенное отношение к клиническим аспектам онкологической диагностики.
|
Основным методом молекулярной биологии по праву считается полимеразная цепная реакция (ПЦР; polymerase chain reaction - PCR), изобретенная K. Mullis в 1983 г. Принцип ПЦР основан на праймерзависимой энзиматической амплификации фрагментов ДНК,
позволяющей накапливать любую генетическую последовательность в неограниченных количествах. ПЦР не имеет предела чувствительности и специфичности, при этом данный метод является относительно доступным для рутинного применения. ПЦР используется для стандартного анализа генетических фрагментов с целью обнаружения изменений нуклеотидной последовательности. Одна из разновидностей ПЦР - RT-PCR (reverse-transcriptase PCR) - применяется для анализа экспрессии генов; в данном случае на матрице клеточной РНК с помощью фермента обратной транскриптазы синтезируется копия комплементарной ДНК (кДНК), которая, в свою очередь, служит непосредственным материалом для ПЦР-анализа.
Помимо молекулярно-биологических методик в лабораторной онкологии используются различные усовершенствования морфологических и цитогенетических методов. Наибольшую популярность получил метод иммуногистохимии (ИГХ), позволяющий визуализировать белки с помощью специфичных меченых антител. К его преимуществам следует отнести относительною простоту и возможность анализировать локализацию белков-мишеней, к недостаткам - полуколичественный характер получаемых результатов. Активно внедряется в практику метод флюоресцентной гибридизации in situ (fluorescent in situ hybridization - FISH), основанный на комплементарном взаимодействии меченых генов-зондов с соответствующими участками хромосом. Этот подход применяется для выявления транслокаций и амплификаций генетического материала.
Большой резонанс получили разработки, направленные на системный анализ геномных изменений. Наибольшего прогресса достигла так называемая транскриптомика, т.е. исследования изменений экспрессии в опухолях. Принцип соответствующих методик подразумевает гибридизацию тотальной клеточной РНК (кДНК) с полным набором генов человека, зафиксированным на крошечной пластинке - микрочипе. Интенсивность комплементарного связывания генов-зондов с генами-мишенями оценивается с помощью ультратонких сканеров; затем полученные результаты подвергаются сложнейшей компьютерной обработке, позволяющей выявить гипер- и гипоэкспрессируемые гены. Подобный подход позволяет провести идентификацию принципиально важных компонентов опухолевой прогрессии, однако его внедрение в клиническую практику на сегодняшний день остается затруднительным.
|
Достижения экспериментальной онкологии
Каждый год в онкологии происходят сенсационные события, в корне меняющие представления о некоторых фундаментальных аспектах злокачественного роста.
Огромный интерес научной общественности привлекли сообщения о существовании стволовых клеток опухолей. Ранее новообразования расценивались как относительно гомогенные структуры, состоящие из равноправных клеток. Даже если в некоторых неоплазмах и наблюдалась определенная гетерогенность, ее считали пассивным следствием нестабильности ракового генома. Недавно в серии экспериментов были представлены доказательства существования иерархии опухолевых клеток, что позволяет рассматривать новообразование как своеобразный «орган». Весьма вероятно, что многим типам малигнизаций присуще наличие так называемых стволовых клеток. Последние в отличие от «дифференцированных» клеток опухоли представляют собой лишь небольшую часть опухолевой массы (< 1 %), при этом они не только способны к неограниченному самовоспроизведению, но и отличаются по некоторым фенотипическим характеристикам от основной клеточной популяции новообразования. К сожалению, подобные наблюдения ставят под сомнение существующие стратегии поиска противоопухолевых препаратов, так как основным источником мишеней для последних являются преобладающие, «дифференцированные» клетки трансформированной ткани.
Многие поколения онкологов были воспитаны на принципах абластики и антибластики. Одной из производных этих принципов следует считать абсолютную, фатальную опасность для организма единичных опухолевых клеток, оставшихся после оперативного вмешательства и цитостатической терапии. Результаты некоторых исследований последних лет заставляют предположить, что единичные опухолевые клетки могут существовать в организме на протяжении многих лет после проведенного лечения. Факторы, ассоциированные с прогрессией этих «дремлющих» клонов в клинически распознаваемые рецидивы заболевания, остаются неизвестными. Представления о возможности длительного бессимптомного существования злокачественных клеточных пулов в организме объясняют многие временные закономерности, наблюдаемые в практической онкологии, и заставляют рассматривать опухоль не как изолированный, абсолютно автономный патологический процесс, а лишь как компонент
|
сложной и взаимосвязанной системы биологических взаимодействий с организмом хозяина.
Метастазирование объясняет 90 % случаев летальных исходов онкологических заболеваний. Процесс метастазирования всегда рассматривался как изолированное взаимодействие отщепившихся опухолевых клеток с органом-мишенью. К настоящему моменту стали накапливаться данные о том, что управление процессом метастазирования по крайней мере отчасти может модулироваться первичной опухолью. Доказано, что некоторые неоплазмы секретируют биологически активные вещества, которые доставляются с кровотоком к сайтам метастазирования и способствуют пролиферации трансформированных клеток. Подобные наблюдения имеют непосредственную клиническую перспективу: не исключено, что лекарственное противодействие взаимоотношениям между первичной опухолью и отдаленными метастазами может замедлить прогрессию онкологического заболевания.
КЛИНИЧЕСКИЕ АСПЕКТЫ МОЛЕКУЛЯРНОЙ ОНКОЛОГИИ
Главным практическим достижением молекулярной онкологии следует считать почти исчерпывающее раскрытие проблемы наследственного рака. Для преобладаюшего числа известных семейных опухолевых синдромов уже разработаны лабораторно-диагностические алгоритмы, предусматривающие ДНК-анализ соответствующих генов. С каждым годом увеличивается количество молекулярно-диагностических тестов, направленных на оптимизацию выбора терапии онкологических заболеваний. К наиболее информативным тестам следует отнести анализ мутации гена EGFR, обладающий уникально высокой предиктивной значимостью в отношении ответа опухолей легкого на терапию гефитинибом или эрлотинибом. Развиваются подходы, направленные на прогнозирование эффективности и безопасности применения фторпиримидинов, производных платины, иринотекана и т.д.
|
Популярной областью прикладных исследований является разработка методов молекулярной детекции единичных опухолевых клеток. Ожидается, что подобные подходы позволят улучшить прогнозирование региональных и отдаленных рецидивов злокачественного процесса, осуществлять мониторинг трансформированного клона, а в далекой перспективе - способствовать ранней диагностике
новообразований. Следует подчеркнуть, что сегодня работы, направленные на выявление диссеминированных опухолевых клеток, носят преимущественно экспериментальный характер и пока не внедрены в рутинную клиническую практику.
Помимо молекулярной диагностики, молекулярная онкология формирует направления поиска новых противоопухолевых препаратов. К настоящему времени в практической медицине уже используется более десятка так называемых таргетных лекарств, разработка которых основывалась не на эмпирическом подборе неспецифических цитостатических веществ, а на целенаправленном синтезе антагонистов онкоассоциированных молекул. Наибольшую популярность в клинике получили антитела и низкомолекулярные ингибиторы, направленные на подавление активности белков EGFR, HER2, модуляторов ангиогенеза и т.д.
Лекция №1
Опухоль (тумор, бластома, неоплазма, онкос) - это патологическое неограниченное разрастание тканей, в основе которого лежит размножение относительно автономных клеток. Проблема опухолевого роста чрезвычайно важна для человечества и его медицины, т.к. 20% всех людей погибает от опухолей, это 2-е место после сердечно-сосудистых заболеваний. Опухоли возникают у людей любого возраста, но чаще после 40 лет, причём 80% после 50 лет. Опухоли поражают представителей всех классов животного мира, нередко н растения. Таким образом, возникновение опухолевого роста - не случайность, а биологическая закономерность. И чем сложнее устроен организм, тем больше он страдает от опухолей. Проблемы опухолевого роста изучает наука онкология. Она имеет ряд подразделов. Одним из её важнейших разделов является экспериментальная онкология. И основной прогресс в изучении проблем закономерностей, механизмов опухолевого роста как раз и зависит от успехов экспериментальной онкологии. Родоначальником её является Мстислав Александрович Новинский, наш соотечественник, магистр ветеринарных наук, который в 1876 г. впервые в мире начал успешно пересаживать опухоли от больных собак: здоровым. Он дал начало методу трансплантации опухолей, с помощью которого удалось воспроизводить опухоли, чтобы их изучать. И сегодня метод трансплантации применяется очень широко в изучение закономерностей опухолевого роста. Но, кроме трансплантации, пользуются еще и методом индукции опухолевого роста, т.е. вызывания его с помощью химических, физических, вирусных, гормональных воздействий. Кроме того, широко используют 3-й методический прием: клеточные и тканевые культуры, где ин витро, т.е. "в пробирке", растут и человеческие опухолевые клетки. Основная проблема - злокачественные опухоли, причем у человека известно 100 видов самостоятельных злокачественных опухолевых заболеваний.
Основные свойства злокачественных опухолей (многие из них характерны и для доброкачественных опухолей).
I. Относительная автономность - самая характерная особенность. Это резкое уменьшение чувствительности к регулирующих воздействиям со стороны организма н соседних клеток. Автономный рост это нерегулируемый рост. Клетка становится как бы глухой, слабо реактивной как к стимулирующим, так и угнетающим различным функциональным влияниям организма и соседних клеток. Эти влияния могут быть нейрогуморальными, эндокринными, местными.
Примером автономности по отношению к общим регуляторным влияниям организма может служить прогрессирующая утрата гормональной зависимости. Опухоль, растущая из гормонально зависимых тканей, все меньше и меньше подчиняется этим гормональным воздействиям. Другим примером может служить снижение потребностей в сывороточных факторах, стимулирующих размножение клеток, и уменьшение чувствительности к гуморальным ингибиторам пролиферации. Опухолевые клетки размножаются, растут и без соответствующих сывороточных факторов. Примером неподчинения местным регулирующим влияниям может служить резкое снижение или утрата способности к контактному торможению. Дело в том, что нормальные клетки, встречая себе подобных, благодаря действию специфических гуморальных ингибиторов, прекращают движение и размножение, образуя упорядоченные клеточные структуры. А опухолевые клетки в подобных случаях наползают на соседок, продолжая делиться. Опухолевая клетка хуже реагирует и на внутриклеточные изменения. Например, у нее недостаточно эффективно работают ферментные системы, ремонтирующие поломы ДНК. Автономность зависит в большой степени от изменения свойств поверхностных мембран, на которых находятся белковые рецепторы, воспринимающие регуляционные влияния. Их опухолевая клетка меньше синтезирует, а также разрушает протеазами. Кроме того, автономность зависит и от низкого содержания в опухолевых клетках Са и циклического аденозин монофосфата, посредством которых осуществляется в регулирующие влияния. Сниженная реактивность опухолевых клеток уменьшает их компенсаторно-восстановительные возможности. Отчасти с этим связана большая повреждаемость опухолевых клеток под влиянием лучевых, химиотерапевтических воздействий, гипертермии. Поставить опухолевую клетку под контроль - значит победить опухоль. Мы говорим об относительной автономности опухоли, потому что она живёт за счёт организма, имеет общий с ним обмен веществ и не всегда полностью выходит из-под гормональной регуляторной зависимости. Между опухолями и организмом имеется сложные иммунологические отношения.
II - "Рост "из себя" и некоторые другие особенности опухолевого роста. Когда говорят, что опухоль "растет из себя", имеют в виду, что она растет за счёт размножения своих клеток со стойко измененными свойствами, передаваемыми по наследству. При этом соседние клетки не становятся опухолевыми. То же относится к метастазирование. Очень важно, что опухоли свойственна безграничная пролиферация клеток. Культура опухолевых клеток бессмертна, иммортальна, в то время, как нормальные клетки гибнут, дав определенное число поколений, разное для различных видов животных, у млекопитающих 30-50 делений (лимит Хайфлика). Как правило, опухоли имеет клоновое происхождение, т.е. происходят из одной трансформированной клетки, но, благодаря генетической нестабильности, в клетках растущей опухоли происходит большое количество мутаций.
Иногда возникает несколько точек роста однотипных опухолей. Например, на коже, в желудке, в грудной железе. В 6% случаев констатируют двухсторонний рак грудной железы. Из-за этого явления возможен послеоперационный рецидив рака.
Опухолевые клетки обычно размножаются не быстрее, чем могут размножаться нормальные клетки исходной ткани, часто - гораздо медленнее, при этом размножается лишь небольшая часть их, а другая часть находится в покое, не размножаются, а часто, обычно в центре опухолевого узла, отмирает, главным образом из-за недостатка кровообращения. Но темп размножения клеток растущей опухоли превышает темп гибели. Однако, возникшие опухолевые зачатки часто не прогрессируют, а погибают под влиянием защитных сил организма или находятся в покое. Об этом говорит такой факт: при— тщательном морфологическом исследовании опухолевые зачатки обнаруживаются более чем у половины лиц старше 65 лет, умерших от других заболеваний. Вместе с тем, смертность от рака в этом возрасте лишь 18% а не 50. Значит, большинство опухолевых зачатков не развивается, а остаются в покое или погибают. Причем начало роста опухоли, как видно, под влиянием созревающих механизмов противоопухолевой резистентности. из опухолевого зачатка совпадает с прорастанием в неё стромы и сосудов, что стимулируется особыми БАВ самой опухоли. Другой пример: почти у всех плодов человека, а у детей моложе 3 мес. в 1% случаев, в мозговой зоне надпочечников находят нейробластомные злокачественные клетки. А заболевает нейробластомой не 1:100, а 1:300000 детей. Т.о. возникновение опухолевого зачатка еще не значит, что у человека появится клинически выраженная опухоль.
III - Анаплазия (катаплазия, дисдифференцировка). Это сниженная, но не утраченная, способность дифференцировке, созревать: исчезновение ряда свойств, характерных для дифференцированной, зрелой клетки, и приобретение ряда свойств незрелой, эмбриональной клетки. Эти свойства изменяются независимо друг от друга, в большей или меньшей степени, т.е. каждая опухоль имеет свою мозаику свойств. Анаплазия злокачественных опухолей достигает такой степени, что некоторые авторы отождествляют злокачественную опухолевую клетку с эмбриональной. Рассматривают разные проявления анаплазии. 1) Так, говорят о морфологической анаплазии. Это сходства морфологические между опухолевой и эмбриональной клеткой. 2) Говорят о функциональной анаплазии. Под ней понимают неспособность, или сниженную способность многих злокачественных опухолей вырабатывать соответствующие гормоны, секреты, неспособность адекватно возбуждаться, сокращаться и т.д., т.е. выполнять физиологические функции нормальной ткани. Есть понятие о 3) биохимической или обменной анаплазии. Это сближение биохимических свойств опухолевой и эмбриональной клеток по антигенному составу. Опухолевые клетки возобновляют синтез белков, характерных для эмбрионального периода данного органа. Обмен углеводов или энергетический обмен. Опухолевая клетка располагает обоими источниками энергии: дыханием и гликолизом. Но нормальная ткань в аэробных условиях обычно полностью обеспечивает себя энергией за счет дыхания, а гликолиз подавляется механизмом эффекта Пастера. И лишь при гипоксии пускается в ход анаэробный гликолиз. А опухоль постоянно живет в условиях гипоксии из-за крайне замедленного кровотока и из-за бедности капиллярной сети. Кровоток в крупной опухоли составляет всего лишь от 2 до 15% по сравнению с нормальным кровотоком.
Опухоль получает только половину энергии за счет дыхания, а остальное за счет расточительного гликолиза, который в 19 раз менее эффективен по выходу энергии, по сравнению с дыханием. Но и в аэробных условиях гликолиз в опухолевой ткани осуществляется достаточно интенсивно. Это объясняется тем, что в опухолевой клетке много гексокиназы с повышенным сродством к глюкозе. Она фосфорилирует глюкозу до глюкозо-6-фосфата и вовлекает её в гликолитический цикл обмена веществ. Эта гексокиназа выходит из-под тормозных влияний организма (автономность) и даже появляется в сыворотке большинства больных со злокачественными опухолями. Это один из диагностических признаков (не очень надёжных) наличия злокачественной опухоли в организме. Опухолевая клетка жадно связывает глюкозу своей поверхностной мембраной и вовлекает в обмен. 0на"насасывает"глюкозу даже в том случае, если ее концентрация в 10 000 раз меньше нормы. За это опухоль называют ловушкой глюкозы.
0на потребляет так много глюкозы, что у больных диабетом исчезает даже гипергликемия и глюкозурия, ко вновь появляются после удаления опухоли. При очень больших злокачественных опухолях, которые встречаются редко, гипогликемия может достигать такой степени, что развивается гипогликемическая кома, от которой человек погибает. И при злокачественной опухоли весом от 1 до 18 кг для компенсации, недопущения опасной гипогликемии больным приходилось вводить за сутки от 825 до 2250 г чистой глюкозы в растворе. Недоокисленные продукты гликолиза выделяются с мочой, что увеличивает отношение углерода к азоту в моче к этот симптом называется дизоксидативной карбонурией (один из не абсолютно достоверных симптомов, указывающих на наличие в организме злокачественной опухоли). Вследствие постоянного гипогликемического давления - гипогликемии или тенденции к ней, стимулируется глюконеогенез, главный поставщик глюкозы. Это превращение в глюкозу углеводных остовов аминокислот и липидов за счёт распада белков мышц, кожи и за счёт распада липидов жировой ткани. Это может иногда привести к истощению, кахексии. Раньше считали целесообразным ограничивать опухолевых больных в углеводах, чтобы "не кормить" опухоль. Это оказалось ошибкой. Наоборот, при введении больным глюкозы до 4-х крат ной гипергликемии наблюдается торможение опухолевого роста и уменьшается метастазирование, т.к. интенсивный гликолиз приводит к накоплению огромно го количества молочной кислоты, концентрация которой в опухолевых клетках увеличивается в 10-30 раз, а рН опухолевой ткани может снижаться даже до 5и ниже. В этих условиях повышается проницаемость мембран лизосом, активируются их кислые гидролазы. Опухоль становится более уязвимой для лучевой, химиотерапии, гипертермии. В клинике получен хороший результат от комплексного лечения больных со злокачественной опухолью Применяют введение глюкозы, лучевая или химиотерапия, нагревание опухоли локальное, если нет метастазирования, если есть - общее, локальное - напр. с помощью УВЧ, СВЧ. Опухоль нагревается на несколько градусов выше, чем окружающая ткань т.к. в опухоли плохое кровообращение, а при гипертермии оно снижается ещё больше, вплоть до стазов. Особо высокая лечебный эффект даёт ферромагнитная гипертермическая терапия, при которой мельчайшие частички сверхчистого железа вводят в кровь, с помощью магнитов их фиксируют в области опухоли, после чего локально нагревают излучателями.
Обмен нуклеиновых кислот и белков. Синтез белков запрограммирован в ДНК и идет с непосредственным участием РНК. В норме в клетке жестко контролируется синтез ДНК. Он осуществляется благодаря генетической репрессии основных ферментов синтеза ДНК, таких как тимидинкиназа и ДНК-полимеразы. Кроме того, имеются и белковые ингибиторы этих ферментов, т.е. если они появятся в клетке, то все равно не смогут работать. Таким образом, клетка может в норме размножаться только тогда, когда появится определенный стимул. А в опухоли ферментные системы синтеза ДНК работают на полную мощность (автономность) - клетки постоянно делятся. Наряду с этим непрерывно образуются большие количества РНК. Это происходит, во-первых, из-за высокой активности ферментов синтеза; во-вторых, из-за того, что происходит рециклизация. Рекциклизация - это вовлечение в цикл синтеза продуктов распада, которые обычно теряются клеткой, а синтез идет за счет новых нуклеотидов. Опухолевая клетка утилизирует продукты распада для синтеза новых молекул ДНК. И третье, в опух. клетке сняты механизмы обратной связи, регулирующие синтез РНК в нормальной клетке, - торможение синтеза продуктами синтеза. Опух. клетка постоянно синтез, большое количество РНК и в опухоли накапливается белок, а распад его снижен, потому что ферментов катаболических не хватает, и это накопление белка обеспечивает постоянное деление клетки. При этом опух. клетка успешно конкурирует с др. клетками организма за азотсодержащие вещества (аминокислоты и др.). А при голодании организма она продолжает размножаться за счет азота других тканей, потому опухоль называют также ловушкой азота.
В опухоли образуются и белки, которые могут быть носителями антигенных свойств, отличных от таковых норм, зрелой ткани, Это 1) эм6риональные специфические антигены, т.е. восстановление синтеза белков, которые когда-то синтезировались в клетке в эмбриональном периоде, в том числе онкобелки, возникающие вследствие функционирования особых генов рака - онкогенов. 2) В клетке могут появляться случайные опухолевые антигены вследствие мутации, количество которых, как указывалось, в опухолевых клетках увеличено. 3) В опухоли может синтезироваться антигены специфичные для вирусов, который вызвал трансформацию клетки, если опухоль вирусной этиологии. Вообще, опухолям свойственно упрощение белкового состава, по сравнению со зрелой клеткой. В том числе и утрата гормональной зависимости из-за уменьшения и прекращения синтеза белковых рецепторов гормонов и их разрушения под влиянием протеолитических ферментов самой опухоли. Обмен белков нарушен не только в самой опухоли, но и во всем организме опухолевого больного, в частности это выражается в том, что уменьшено количество альбуминов, но увеличено кол-во фибриногена в плазме крови.
Липидный обмен. Здесь главное состоит в том, что опухоль во много раз больше содержит холестерина, чем нормальная ткань. Это связано тоже с автономностью: не происходит угнетения синтеза холестерина его избытком. В опухоли увеличено количество фосфолипидов, а в крови и других тканях фосфолипиды и нейтральные жиры уменьшены.
В связи с обменной стоит физико-химическая анаплазия. Она проявляется в увеличении водородных ионов, калия, натрия, осмотического и онкотического давления, воды, отрицательного заряда клетки, проницаемости клеточных мембран. Содержание двухвалентных ионов кальция и магния уменьшено. С биохимической анаплазией тесно связано и другое свойство, типичное для злокачественных опухолей –
4-е свойство или системное действие на организм опухоли или влияние опухоли на организм, не связанное с непосредственным поражением органов и тканей самой опухолью или её метастазами. Дело в том, что онкологические больные чаще гибнут не от резкого истощения, не от кахексии, а от нарушения нейроэндокринной регуляции обмена веществ, от дисфункции и дистрофии жизненно-важных органов и особенно часто от различных присоединившихся инфекций вследствие сниженного иммунитета. Мы уже говорили, что опухоль функционирует как ловушка глюкозы и азота. Это стимулирует глюконеогенез (главный поставщик глюкозы). Опухоль начинает потреблять углеводы, азот, жиры тканей. Уже это неблагоприятно сказывается на трофике тканей и может, хотя и сравнительно редко, приводить к кахексии. При гипогликемии возникает гипертрофия и гиперфункция коры надпочечников, усиливается секреция глюкокортикоидов, прежде всего кортизола, который стимулирует глюконеогенез преимущественно в лимфоидном аппарате. Это приводит к его атрофии, а значит к снижению иммунитета. Кроме того, иммунитет организма со злокачественной опухолью снижается и в силу действия ряда других факторов, на которых мы остановимся позднее. Если глюконеогенез будет не в состоянии компенсировать гипогликемию, то по механизму обратной связи перестанет вырабатываться инсулин, а значит мышечные и некоторые другие ткани не смогут в должной мере ассимилировать глюкозу и аминокислоты. Для сбережения азота и поддержания реактивности организма больным со злокачественными опухолями надо рекомендовать продукты, достаточно богатые белком, давать достаточно сахара, фруктов, витаминов, кроме фолиевой кислоты. Низкобелковый рацион стимулирует канцерогенез. Кроме того, к системному действию относится снижение окислительно-восстановительных процессов во всём организме, а также довольно часто встречающаяся гиперкальциемия - увеличение кальция в крови, вплоть до летального исхода из-за этого увеличения. При этом возникает остеолизис вследствие образования в опухоли паратгормона и простагландина Е-2. С увеличением концентрации простагландинов в крови в большой мере ввязана иммунодепрессия. В опухоли могут образовываться любые гормоны, преимущественно пептидного строения, нейропептиды, другие биологически активные вещества. Это усугубляется тем, что в результате повышения проницаемости клеточных мембран опухолевых клеток и её отмирания в организм поступают клеточные ферменты. К системному действию относится и упоминавшиеся изменения содержания в плазме крови белковых и жировых веществ, а также нарастающая дизергия и анергия сосудов организма по отношению к адреналину и норадреналину. Т. о. в организме больного со злокачественной опухолью складывается неблагоприятная метаболическая ситуация с нарушением регуляции функций и иммунодепрессией. К этому надо прибавить нарушение вкуса и аппетита, что часто бывает у опухолевых больных и все это объясняет гибель больных иногда ещё до того, как будут существенно поражены опухолью и метастазами жизненно-важные органы.
V. Инвазивно-деструктивный рост, т.е. прорастание окружающих тканей и повреждение, гибель их. Инвазивный рост злокачественной опухоли объясняется многими факторами. В процессе роста внутритканевое давление в опухоли увеличивается. Клетки злокачественной опухоли имеют свойство активно двигаться, благодаря актомиозиновым сократительным элементам. Из-за сиаловых кислот они имеют на поверхности высокий отрицательный заряд, благодаря которому они отталкиваются друг от друга, т.е. расталкиваются. Опухолевые клетки лишены контактного торможения, которое блокирует движение и размножение нормальных клеток. В опухолевой клетке мало кальция и магния, необходимых для построения правильных, устойчивых тканевых агрегатов.
Двигающаяся опухолевая клетка выделяет ряд ферментов: лизосомные гидролазы, нейтральные протеазы, коллагеназу, которые разрушает межклеточное вещество, прокладывая движущейся клетке дорогу. Вместе с тем, опух. клетки стимулируют пролиферацию фибробластов, благодаря чему строится соединительно-тканная строма, которая несёт сосуды. Кстати, развитие сосудов также стимулируется опухолью .Деструкция - повреждение окружающих тканей - объясняется, главным образом, голоданием клеток, потому что участки нормальной ткани окружённой опухолевыми клетками, которые успешно конкурируют за глюкозу и азотосодержащие вещества, благодаря этому вокруг опухолевой клетки образуется "мертвая зона", в которой не могут жить нормальные клетки. Можно отметить, что инвазивный рост характерен не только для злокачественных опухолей. Железистый эпителий молочных желёз при беременности инвазирует окружающую жировую ткань, ворсинки плаценты инвазируют стенку матки. Но в этих случаях инвазия тотчас прекращается после включения соответствующей гормональной стимуляции. А опухолевая инвазия не подчиняется регулирующим влияниям организма.
VI. Метастазирование. Метастазы - это новые очаги роста в результате переноса опухолевых клеток по кровеносным и лимфатическим сосудам. Соответственно, различают метастазы гематогенные и лимфогенные. Однако метастазирующие клетки могут переноситься и другими жидкостями организма (например, цереброспинальной), а также внедряться в ткани при прямом контакте (губы).
В процессе метастазирования различают ряд этапов. 1) Инфильтрация сосудистой стенки и выход в кровь или лимфу. Опухолевые клетки могут проходить между эндотелиальными клетками, через поры в них или непосредственно отрываться, вываливаясь в просвет сосуда, т.к. часть сосудистой стенки в опухоли может состоять из опухолевой ткани. Этот процесс может начаться очень быстро после возникновения роста злокачественной опухоли 2) Циркуляция в крови или движение по лимфососудам. В крови опухолевые клетки повреждаются из-за перепадов давления. Большинство их гибнет в лёгочных микрососудах. 3) Фиксация опухолевых клеток в кровеносных капиллярах или региональных лимфоузлах. Часть опухолевых клеток может проходить лимфоузлы и достигать крови. Прилипанию клеток способствуют мукополисахариды, содержащие сиаловые кислоты на поверхности опухолевых и эндотелиальных клеток, а также тромбопластические энзимы, выделяемые опухолевыми клетками и тромбоцитами. При этом фибринный слой микротромбов, внутри которых содержатся опухолевые клетки, предохраняет их от контакта с клетками защитной системы - лимфоцитами и другими клетками. Способствует фиксации опухолевых клеток и повреждение сосудов. 4) Выход во внесосудистое пространство (экстравазация). 5) дремлющее состояние опухолевых клеток. При этом клетки иногда сохраняют потенциальную способность к размножению очень долго, например, при меланоме, раке молочной железы, толстого кишечника - 20-40 лет. 6) Размножение опухолевых клеток, чаще - единичной клетки с образованием метастатического зачатка. При этом выживает, в среднем, 1 клетка из 1 миллиона, вышедших в кровь, лимфу. 7) Образование стромы и васкуляризация метастатического узла. 8) Рост метастатического узла с образованием зрелого метастаза.
Надо иметь в виду, что выжившие опухолевые клетки могут начать размножаться только в благоприятных для этого условиях. Поэтому разные опухоли имеют свои излюбленные локализации метастазов .Одни опухоли дают метастазы преимущественно в печень, другие в лёгкие, третьи в ЦНС, четвертые в кости и т. д. Этим же объясняется поздние метастазы, возникающие иногда через десятилетия после удаления основного опухолевого узла. В этих случаях опухолевые клетки, как видно, "дожидаются" ослабления защитных сил организма. Однако надо считаться и с тем, что благодаря генетической нестабильности, свойства опухолевых клеток метастаза могут меняться, в том числе и в сторону увеличения злокачественности, что также может способствовать началу безудержной пролиферации. Какие же условия способствует образованию метастазов из опухолевых клеток, застрявших в каких-то органах и тканях? Это, прежде всего, механическое воздействие - травмы, массаж и др. В дальнейшем было установлено, что такое же влияние оказывает гипоксия, гепатотропные яды - четырехлористый углерод и хлороформ. Причем, чем больше застревает клеток, тем скорее они начинают расти. Что касается других условий, способствующих появлению метастазов, то это, во-первых, продолжительность и скорость роста самой опухоли. Чем дольше и быстрее растет основной опухолевый узел, тем, обычно, больше шансов появления метастазов. Тем более, что в процессе роста опухолевых клеток продолжается изменение и селекция более злокачественных клеток. Очень важно знать, что травма самой опухоли очень способствует метастазированию. Когда опухоль пальпируют, она мириады клеток посылает в лимфатические или кровеносные сосуды. То же когда делают биопсию, пункцию опухоли. Было установлено, что когда хирурги делают операцию очень аккуратно, не дотрагиваются до опухоли, то результаты оказывались вдвое лучше, по сравнению с тем, когда хирурги оперируют неаккуратно. Любое угнетение резистентности организма приводит к бурному росту как самой опухоли, так и способствует образованию не только первичных, но и вторичных, и третичных метастазов, когда метастазы в свою очередь дают метастазы.
Лучшей профилактикой метастазов остается наиболее раннее и минимально травматичное удаление основного опухолевого узла. Иногда после этого рассасываются и отдаленные мелкие метастазы.
VII. Прогрессия. Это стойкие изменения одного или нескольких свойств опухоли в сторону злокачественности, т.е. усиление злокачественности опухоли, а не увеличение её массы. Причем прогрессия одних признаков происходит независимо от других. Например, уменьшение гормональной зависимости может не сопровождаться усилением способности давать метастазы и т.д. Это очень важное свойство, благодаря чему доброкачественная опухоль превращается в злокачественную. Важным, но не единственным механизмом прогрессии является селекция более злокачественных элементов. Существует свойство опухолевых клеток, противоположное прогрессии. Это
VIII. реверсия, т.е. уменьшение злокачественных свойств опухоли, а не уменьшение размеров опухолей (регрессия). Она встречается редко в естественных условиях, а в эксперименте её легко наблюдать: при пассажах, особо при выращивании в культуре опухолевых клеток животных и человека. Они могут превращаться в доброкачественные, а затем и в нормальные клетки. В настоящее время известно много индукторов дифференцировки опухолевых клеток. Ими оказались и многие противоопухолевые препараты, т.е. они не убивает опухолевые клетки, а вызывают их дифференцировку, созревание. И при этом реверсия, связанная с процессом дифференцировки, идёт в направлении, обратном опухолевому превращению клетки: путём включения иди выключения функции определенных генов, что приводит к появлению необходимых рецепторов на поверхности, нормализации в клетке уровня Са, цАМФ и др. Клетка становится регулируемой, нормальной. В естественных условиях, например, злокачественная нейробластома у детей, примерно в 10% случаев благодаря реверсии превращается в доброкачественную ганглионеврому, а некоторые дети полностью выздоравливают, благодаря полной нормализации клеток. Достоверно известны случаи, к сожалению, редкие, полного самоизлечения при запущенной иноперабельной опухоли. В 1/3 таких случаях это происходит после острых инфекций с высокой температурой. Чаще это наблюдается при злокачественной нейробластоме, злокачественной гипернефроме, злокачественной меланоме, хорионической карциноме Реже при других опухолях. Часть этих случаев связаны с реверсией, а часть, по-видимому, с мобилизацией каких-то сил резистентности.
Роль онковирусов в развитии опухоли (+1й и 2й вопросы)
ЗАБОЛЕВАЕМОСТЬ И СМЕРТНОСТЬ ОТ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Основными статистическими показателями, свидетельствующими о распространенности злокачественных новообразований, являются показатели заболеваемости и смертности. Впервые в мире учет этих данных был организован в СССР в 1948 г. Изучение и анализ количественных показателей заболеваемости злокачественными новообразованиями различных групп населения и смертности от них позволяют органам управления системы здравоохранения разрабатывать и совершенствовать программы противораковой борьбы.
Ежегодно на основании основных источников информации из числа первичных документов «Извещений о больном с впервые в жизни установленным диагнозом рака или другого злокачественного новообразования» (форма ? 090/у) и «Контрольных карт диспансерного наблюдения больных злокачественными новообразованиями» (форма ? 030-6/у) составляется «Отчет о заболеваниях злокачественными новообразованиями» по форме ? 7 и «Отчет о больных со злокачественными новообразованиями» по форме ? 35. На основании отчета по форме ? 7 определяется структура заболеваемости, рассчитываются показатели заболеваемости злокачественными новообразованиями, выявляются особенности распространенности онкологических заболеваний.
На основании отчета по форме ? 35 выявляются контингенты больных со злокачественными новообразованиями, состоящих на учете, сведения об умерших от злокачественных новообразований, сведения о лечении больных злокачественными новообразованиями, подлежащих специальному лечению. На основании полученных данных рассчитывают:
1. Показатели заболеваемости злокачественными новообразованиями:
• интенсивный - впервые выявленные больные со злокачественными опухолями (в абсолютных цифрах)/средняя годовая численность населения территории (рассчитывается на 1000, 10 тыс., 100 тыс. населения);
• стандартизованный - рассчитывается для выравнивания влияния различной возрастной структуры на заболеваемость.
Показатель заболеваемости характеризует частоту возникновения новых случаев болезни в течение определенного времени. Кумулятивный показатель заболеваемости характеризует категорию лиц, заболевших данным заболеванием за определенный промежуток времени, численность всей группы в начале периода.
2. Показатели смертности от злокачественных новообразований:
• интенсивный - умершие больные злокачественными опухолями (в абсолютных цифрах)/средняя годовая численность населения территории (рассчитывается на 1000, 10 тыс., 100 тыс. населения);
• стандартизованный - рассчитывается для выравнивания влияния различной возрастной структуры на смертность.
Особенности распространенности онкологических заболеваний выявляются путем сравнительного изучения влияния соответствующих показателей, их частоты, структуры на заболеваемость (смертность). Распространенность онкологических заболеваний как показатель позволяет оценить, какая доля населения в определенный период времени имеет данную патологию.
В Российской Федерации отмечается тенденция к росту заболеваемости злокачественными новообразованиями и смертности от них.
Заболеваемость населения Российской Федерации злокачественными новообразованиями
В России с 2000 по 2005 г. количество больных с впервые в жизни установленным диагнозом злокачественного новообразования увеличилось на 4,6 % и достигло 469 195 человек.
Интенсивный показатель заболеваемости в России в 2007 г. составил 341,3 на 100 тыс. населения (в 1997 г. - 293,07 на 100 тыс. населения). В структуре онкологической заболеваемости в РФ в целом преобладали злокачественные новообразования следующих локализаций: опухоли трахеи, бронхов, легкого (13,8 %), кожи (11,0 %;
|
вместе с меланомой - 12,4 %), желудка (10,4 %), молочной железы (10,0 %), ободочной кишки (5,9 %), прямой кишки, ректосигмоидного соединения и ануса (4,8 %), лимфатической и кроветворной тканей (4,4 %), тела матки (3,4 %), почек (3,1 %), поджелудочной железы (2,9 %), шейки матки (2,7 %), яичников (2,6 %), мочевого пузыря (2,6 %).
Интенсивный показатель заболеваемости злокачественными новообразованиями мужского населения РФ в 2007 г. составил 343,5 на 100 тыс. населения. В структуре заболеваемости мужского населения России лидировали рак легкого (21,9 %), рак желудка (11,3 %), немеланомные новообразования кожи (9,3 %), рак предстательной железы (7,7 %), рак ободочной (5,2 %) и прямой (5,2 %) кишки.
Интенсивный показатель заболеваемости злокачественными новообразованиями женского населения РФ в 2007 г. составил 339,4 на 100 тыс. населения. У женщин чаще всего наблюдались рак молочной железы (19,8 %), немеланомные новообразования кожи (13,3 %), рак желудка (7,5 %), рак ободочной кишки (7,0 %), рак тела (6,8 %) и шейки (5,2 %) матки.
Число зарегистрированных новых случаев злокачественного новообразования у детей в 2005 г. составило 2382 (в 2001 г. - 2571). Первое место в структуре онкологической заболеваемости детского населения России занимают лейкозы (33,0 %), далее следуют опухоли головного мозга и других отделов нервной системы (18 %), почек (7,5 %), костей и суставных хрящей (6 %), мезотелиальных и мягких тканей (5,1 %). Среди гемобластозов чаще других встречаются лимфолейкоз (56,5 %), лимфо- и ретикулосаркомы (17,1 %), лимфогранулематоз (9,5 %). Максимальная заболеваемость мальчиков и девочек отмечается в 0-4 года (14,3 на 100 тыс. населения). На эту возрастную группу приходится пик заболеваемости злокачественными новообразованиями мягких тканей, мочевого пузыря, печени, яичка, почки и острым лимфолейкозом. С возрастом увеличивается заболеваемость опухолями костей и суставных хрящей, яичников, щитовидной железы. Примерно одинаковая заболеваемость во всех возрастных группах наблюдается при злокачественных новообразованиях ЦНС. В среднем в 2001-2005 гг. максимальная заболеваемость детей злокачественными новообразованиями отмечалась в Республике Алтай, Пензенской и Калининградской областях (6,8-7,1 на 100 тыс. детей).
|
Смертность населения Российской Федерации от злокачественных новообразований
В 2005 г. в России от злокачественных новообразований умерли 285 402 человека: 52 787 - от рака легкого, 38 429 - от рака желудка, 36 393 - от рака ободочной и прямой кишки, 22 830 - от рака молочной железы. Средний возраст умерших от злокачественных новообразований составил 65 лет. Среди регионов России максимальный стандартизованный показатель смертности наблюдался в Магаданской (249,7 на 100 тыс. мужчин и 137,4 на 100 тыс. женщин), Сахалинской областях (233,4 на 100 тыс. мужчин) и Чукотском автономном округе (193,8 на 100 тыс. женщин).
Стандартизованный показатель смертности мужчин в 2,2 раза превышает таковой для женщин (соответственно 1532,3 и 683,5 на 100 тыс. населения). В структуре смертности мужчин первые 3 места занимали рак легкого (28,7 %), желудка (14,3 %), ободочной и прямой кишки (10,5 %). С 2000 по 2005 г. в России смертность от злокачественных новообразований у мужчин понизилась на 2,6 %. Отмечен рост смертности мужского населения от рака ободочной (на 13,5 %) и прямой (на 7,5 %) кишки, почки (на 11,1 %), поджелудочной железы (на 8,6 %), печени (на 1,8 %) и мочевого пузыря (на 1,5 %). Первое место по приросту занимал рак предстательной железы (29,5 %). Максимальное влияние на сокращение средней продолжительности жизни мужчин оказывает смертность от рака легкого (0,42 года), желудка (0,21 года) и от гемобластозов (0,11 года).
С 2000 по 2005 г. в России смертность от злокачественных новообразований у женщин понизилась на 0,8%, при этом она оставалась стабильной от рака полости рта, глотки, прямой кишки, шейки матки и мочевого пузыря. Первое место по приросту смертности занимал рак поджелудочной железы (12,2 %). Смертность от злокачественных новообразований сокращает продолжительность жизни у женщин на 1,9 года, у мужчин - на 1,7 года. Максимальное влияние на сокращение средней продолжительности жизни женщин оказывает смертность от рака молочной железы (0,35 года), желудка (0,2 года), ободочной кишки (0,13 года) и от гемобластозов (0,13 года). Женщина, умершая от злокачественного новообразования, теряет больше лет жизни, чем мужчина (соответственно 16 и 14 лет).
|
В 2005 г. в России от злокачественных новообразований умерли 1048 детей в возрасте от 0 до 14 лет. В структуре смертности детского населения от злокачественных новообразований в 2005 г. 33,1 %
приходилось на лейкозы, 26,1 %-на опухоли ЦНС, 10,6 % - на лимфомы, 7,3 % - на опухоли мезотелиальных и мягких тканей и 4,8 % - на опухоли костей и суставных хрящей.
Возрастно-половые особенности
Злокачественные новообразования встречаются во всех без исключения возрастных группах. Структура заболеваемости и смертности различна для каждого пола и возраста, что прежде всего определяется физиологическими особенностями организма и подверженностью факторам риска.
В процессе старения и в кризовые половые периоды все клетки организма, находящиеся в нормальной тканевой среде, подвержены ритмическим физиологическим изменениям. В жизни человека наиболее опасные для здоровья критические периоды приходятся на 7, 14, 21, 29-30, 36, 42, 59-60, 63, 68 лет. Частота ритмических изменений функций организма и компенсаторные микромолекулярные изменения в клетках в определенных фазах ритмических колебаний приводят к повышению чувствительности мембран и структурных единиц клеток к действию канцерогенных веществ. Между временем воздействия канцерогенного агента и раковой манифестацией проходит определенный латентный период, продолжительность которого зависит от половых и возрастных индивидуальных особенностей организма (типа нервной системы, состояния иммунной и эндокринной систем) и подверженности организма модифицирующим факторам. Возрастно-половые различия в структуре статистических показателей связаны не только с половыми и возрастными особенностями возникновения и развития злокачественных новообразований, но и с изменениями, наблюдающимися в последнее время в популяции, а также случайными колебаниями и различиями, связанными с диагностикой и регистрацией злокачественных новообразований.
|
В 2007 г. в России число больных с впервые в жизни установленным диагнозом злокачественного новообразования достигло 485 387 человек (женщины составили 53,4 %, мужчины - 46,6 %).
Анализ статистических данных о структуре заболеваемости всех возрастных групп мужского и женского населения показывает, что у женщин в основном преобладают опухоли молочной железы (19,8 %), ободочной и прямой кишки (11,8 %), желудка (7,5 %), тела матки (6,8 %), шейки матки (5,2 %), а у мужчин - опухоли трахеи,
бронхов, легкого (21,9 %), желудка (11,3 %), ободочной и прямой кишки (10,7 %), предстательной железы (7,7 %), мочевого пузыря
(4,6 %).
Значительно выше показатели заболеваемости у лиц пожилого и старческого возрастов.
Региональные особенности распространения злокачественных новообразований
Региональными особенностями распространения злокачественных новообразований занимается онкоэпидемиология. Природные условия среды обитания, генетические особенности этнических групп, населяющих определенную географическую зону, религиозные традиции, традиционные привычки питания - это далеко не весь перечень факторов, воздействующих на население и определяющих возрастные закономерности и структурные соотношения различных форм злокачественных новообразований. Многие факторы риска возникновения и развития новообразований обусловлены региональными особенностями условий жизни населения. Замечено, что у людей, проживающих в теплых климатических условиях, чаще наблюдаются системные заболевания (лейкозы, злокачественные лимфомы). По мнению исследователей, они обусловлены инициирующим влиянием вирусов и микроорганизмов, что связывают с благоприятными условиями для обитания и размножения инициирующих агентов. На показателях заболеваемости отражаются также стиль жизни и правила поведения людей, связанные с их религиозными убеждениями. Так, у мормонов, адвентистов, отказавшихся от употребления табака и алкоголя по религиозным соображениям, отмечается низкий уровень заболеваемости злокачественными новообразованиями отдельных локализаций.
|
ФАКТОРЫ, СПОСОБСТВУЮЩИЕ ВОЗНИКНОВЕНИЮ ОПУХОЛЕЙ
Наследственность
Наследственный фактор в возникновении злокачественных новообразований не означает, что рак наследуется из поколения в поколение. При отягощенном злокачественными новообразованиями
анамнезе по наследству передается повышенная чувствительность к воздействию некоторых канцерогенных агентов. Наследственная восприимчивость изучена и доказана лишь для некоторых заболеваний, при которых вероятность заболеть при наличии генетической предрасположенности составляет 80-90 %. Это редкие формы злокачественных новообразований - ретинобластома, меланома кожи, саркома сосудистой оболочки глаза и доброкачественные новообразования, такие, как пигментная ксеродерма, опухоли каротидных телец, полипоз кишечника, нейрофиброматоз. В научной литературе содержится много данных экспериментальных исследований о роли наследственности в происхождении рака. В числе первых форм новообразований, обративших на себя внимание исследователей, были опухоли женских половых органов. Описано много семей, где у трех кровных родственниц и более встречался рак одной и той же локализации (в частности, рак тела матки или рак яичников). Известно, что для кровных родственников больных риск заболеть той же формой рака несколько выше, чем в семье, где не было ни одного случая рака. При углубленном изучении злокачественных новообразований, связанных с наследственной предрасположенностью, было выявлено наличие унаследованного генетического дефекта, который в условиях нарушенного гомеостаза, под воздействием модифицирующих факторов окружающей среды и образа жизни организма, способствовал развитию рака или саркомы. Унаследованные мутации в генах, аномальные характеристики гомеостаза в значительной степени определяют вероятность генетически предрасположенных лиц заболеть раком. В настоящее время выявлено 38 мутаций гена BRCA1, тесно сцепленных с развитием опухолей молочной железы.
|
Наличие унаследованных мутаций в геноме клеток человека определяет генетическую предрасположенность как свидетельство возможности развития злокачественного новообразования с более высокой вероятностью, чем в случае его отсутствия. Описаны онтогенетические синдромы, при которых риск возникновения рака не превышает 10 %.
1. Гамартоматозные синдромы: множественный нейрофиброматоз, множественный экзостоз, бугорчатый склероз, болезнь Хиппеля-Линдау, синдром Пейтца-Джигерса. Эти синдромы наследуются по аутосомно-доминантному признаку и проявляются нарушениями дифференцировки с развитием опухолеподобных процессов в нескольких органах.
2. Генетически обусловленные дерматозы: пигментная ксеродерма, альбинизм, врожденный дискератоз, синдром Вернера. Эти синдромы наследуются по аутосомно-рецессивному типу и определяют предрасположенность к злокачественным новообразованиям кожи.
3. Синдромы с повышенной хрупкостью хромосом: синдром Блума, апластическая анемия Фанкони, наследуемые по аутосомно-рецессивному типу, определяющие предрасположенность к лейкемии.
4. Иммунодефицитные синдромы: синдром Вискотта-Олдрича, атаксия-телеангиэктазия, Х-связанный рецессивный признак и др. определяют предрасположенность к развитию новообразований лимфоретикулярной ткани.
Современные взгляды на этиологию и патогенез злокачественных новообразований с учетом наследственности, генов предрасположенности необходимо учитывать при формировании групп повышенного риска и контроля за ними с целью предупреждения возникновения и развития рака.
Эндокринные нарушения
В соответствии с современными взглядами развитие опухолей в органе или в тканях определяется следующей триадой факторов (Балицкий К.П. и др., 1983):
1) снижение иммунологической реактивности организма;
|
2) действие канцерогенного агента экзоили эндогенной природы;
3) нарушение функции органа или ткани.
Нормальная деятельность функциональных систем организма зависит от правильного функционирования гипоталамо-гипофизарно-надпочечниковой и симпатико-адреналовой систем.
Все эндокринные органы тесно связаны друг с другом, и нарушение функции одного из них оказывает прямое или косвенное влияние на все другие. Эндокринный баланс напрямую зависит от регулирующей функции нервной системы. Патологическая активность периферических эндокринных желез, нарушение регулирующей функции нервной системы и сдвиг метаболических процессов в тканях и органах организма способствуют образованию эндогенных канцерогенных веществ.
В.М. Дильман (1983) считал важным патогенетическим фактором возникновения рака повышение порога чувствительности гипоталамуса к воздействиям эндогенных факторов. При повышении порога
чувствительности гипоталамуса развивается компенсаторное усиление активности периферических эндокринных желез с выработкой избыточного количества гормонов, что приводит к нарушению метаболических процессов в тканях и клетках организма. Образующиеся при этом активные метаболиты способствуют повышению порога чувствительности тканей и клеток к различным видам канцерогенных веществ. Доказаны бластомогенные свойства эндогенно образующихся метаболитов триптофана, тирозина, эстрогенов и других веществ. Но конкретный механизм канцерогенного действия гормонов остается малоизученным. При изучении гормонального канцерогенеза выявлено, что эстрогены в определенных условиях не только усиливают пролиферативные процессы в тканях, но и оказывают генотоксическое действие. Повреждение генома клетки происходит под действием метаболитов эстрогенов, образующихся при активации ферментов гидроксилаз. Согласно теории N. Burnet (1970), постоянство генетического состава организма контролируется иммунной системой.
|
Сохранение генного гомеостаза и антигенного состава организма осуществляют иммунные механизмы, контролируемые гипоталамусом.
Возможность малигнизированной клетки дать начало опухолевому процессу, погибнуть сразу после негативного воздействия или сохраниться длительное время в латентном состоянии зависит от индивидуальных защитных механизмов организма (состояние эндокринной системы, обмена веществ, иммунологической реактивности, состояние нервной системы, особенности соединительной ткани и т.д.).
Нарушение метаболизма с избыточным содержанием в крови кортизола, инсулина, холестерина, влияющее на течение опухолевого процесса, В.М. Дильман назвал «синдромом канкрофилии». Синдром канкрофилии характеризуется усилением пролиферации соматических клеток и торможением деления лимфоцитов, что вызывает метаболическую иммунодепрессию, которая способствует развитию злокачественных новообразований.
Значение курения в возникновении злокачественных новообразований
Курение отнесено Международным агентством по изучению рака к группе абсолютных канцерогенов. Свыше 90 % всех случаев рака легкого у мужчин и 78 % у женщин связаны с курением. У активных курильщиков курение сигарет маскирует хронический неспецифичес-
кий, а часто и специфический воспалительный трахеобронхит, который при частых обострениях вызывает атипию клеток эпителия. При активном и пассивном курении сигарет табачный дым, содержащий наиболее активные ПАУ (3,4-бензпирен), ароматические амины, нитрозосоединения, неорганические вещества - радий, мышьяк, полоний и радиоактивный свинец, при непосредственном соприкосновении с внутренней стенкой бронхов и альвеолами способствует взаимовоздействию канцерогенов с мембраной чувствительных к канцерогенам клеток, повышая вероятность опухолевой трансформации. Часть канцерогенов попадает в желудок со слюной, а канцерогены с инертной способностью диффундируют в межтканевую жидкость и растворяются в крови, повышая содержание канцерогенных веществ в организме. Эксперты Международного агентства по изучению рака (г. Лион) определили, что с курением связано 85 % случаев смерти от рака легкого, 30-40 % - от рака мочевого пузыря и почек, 50-70 % - от рака пищевода, глотки и ротовой полости. Доказано, что никотин, специфически блокируя симпатические ганглии, вызывает снижение локального иммунитета в респираторном тракте, но сам не оказывает канцерогенного действия.
|
Некоторые ученые считают, что канцерогены табачного дыма и атмосферного воздуха действуют синергически. По статистическим показателям, отказ населения от курения снизил бы заболеваемость раком на 25-30 %, что для России составляет 98-117 тыс. случаев злокачественных новообразований в год.
Значение ультрафиолетового излучения
в возникновении злокачественных новообразований
Ультрафиолетовая (УФ) часть солнечного света, занимающая диапазон 2800-3400 А, обладает способностью проникать в ткани человека через кожный покров и повреждать клетки различных слоев кожи в зависимости от длины волны. Впервые канцерогенное действие УФ-лучей было описано и доказано G. Findlay в 1928 г. В настоящее время известно, что до 95 % случаев рака кожи возникает на открытых участках тела, подвергающихся длительному воздействию УФ-лучей. Но в то же время эпидемиологические исследования показали, что при адекватной фоторецепции канцерогенное действие солнечной радиации не проявляется, а, наоборот, происходит обратное развитие предраковых изменений кожи. Такие противоположные результаты воздействия солнечного света объясняются физическими свойствами составляющих его спектров. Солнечный свет состоит
из видимого излучения (собственно света) и невидимого (инфракрасного и УФ-излучения). Наиболее активным является УФ-излучение, которое состоит из длинноволнового (ультрафиолет А), средневолнового (ультрафиолет В) и коротковолнового (ультрафиолет С) спектров. Излучение длинноволнового спектра А обладает способностью глубоко проникать в ткани кожи и повреждать структуру соединительной ткани, создавая благоприятный фон для развития рака. Средневолновой спектр В характеризуется еще большей способностью повреждать клетки кожи, чем спектр А, но его активное действие проявляется только в летнее время (с 10 до 16 ч). Спектр С действует в основном на эпидермис, повышая риск возникновения меланомы. УФ-лучи оказывают не только местное иммунодепрессивное влияние, повреждая клетки Лангерганса, но и общее иммунодепрессивное действие на организм (Gallardo V. et al., 2000).
|
Резистентность кожи к канцерогенному воздействию солнечной радиации определяется содержанием в ней пигмента - меланина, который, поглощая УФ-лучи, препятствует их проникновению в глубину тканей. Меланин образуется в результате последовательных фотохимических реакций в клетках-меланоцитах. Под воздействием УФ-излучения меланоциты не только синтезируют меланин, но и начинают размножаться. В фазе деления меланоциты, как и все клетки живого организма, становятся очень чувствительными к различным негативным факторам и сами подвергаются риску канцерогенного воздействия солнечной радиации. Способность синтезировать и накапливать меланин в клетках организма у людей проявляется по-разному и определяет предрасположенность и резистентность человека к злокачественной опухоли. Замечено, что резистентность людей с более темной кожей (брюнеты) к канцерогенному воздействию УФ-лучей связана с обилием меланина в клетках базального, шиповидного и надшиповидного слоев эпидермиса, а предрасположенность к возникновению новообразований у людей с более светлой кожей (блондины) - с содержанием пигмента только в клетках базального слоя эпидермиса.
Среди факторов окружающей среды, обладающих способностью канцерогенного воздействия, УФ-излучение составляет 5 %.
Радиоактивные излучения
Проблема изучения радиационного воздействия на человека и соблюдение мер предосторожности от возможного облучения становятся все более актуальными. Это связано с массовым практическим
применением во всех сферах человеческой деятельности современных средств научно-технических достижений, основанных на действии ионизирующего излучения по принципу квантового усиления. Излучение вызывает в клетках ионизацию, расщепляя молекулы клеток на ионы, в результате чего одни атомы теряют электроны, а другие присоединяют их, образуя отрицательно и положительно заряженные ионы. По такому же принципу происходит радиолиз воды, содержащейся в клетках и межтканевых пространствах, с образованием свободных радикалов, обладающих высокой реакционной способностью в отношении различных макромолекулярных соединений клетки и ядерных структур. Изменения, происходящие в тканях при радиационном воздействии, во многом зависят от вида ткани и дозы облучения. Наиболее чувствительны к воздействию ионизирующего фактора ткани в период пролиферативной активности клеток, активного роста и развития.
|
К ионизирующим облучениям с активной канцерогенной способностью относятся:
1) α-частицы больших размеров, которые несут в себе положительный электрический заряд и обладают высокой токсичностью для живых клеток; α-частицы обладают почти нулевой проникающей силой. Но при введении в организм α-излучателей алиментарным или парентеральным путем они способны высвобождаться в глубоколежащих тканях;
2) β-частицы, которые несут в себе отрицательный заряд и, проникая на глубину 5 мм, оказывают разрушающее действие на живые клетки;
3) γ-лучи, воздействие которых на клетки менее токсично, а их проникающая способность зависит от интенсивности облучения;
4) нейтроны, образующиеся в результате распада ядер, обладают способностью глубоко проникать в живые клетки. Активные вещества при столкновении с нейтронами начинают вторично излучать α-, β-частицы и (или) γ-лучи.
Независимо от вида и способа воздействия канцерогенный эффект ионизирующего излучения основан на повреждении генетического аппарата.
Международной комиссией по радиологической медицине (МКРЗ) рекомендована предельно допустимая доза ионизирующего воздействия на человека - 1 мЭв/год (0,1 бэр/год) [Владимиров В.А., 2000].
Вирусный канцерогенез
Вирусный канцерогенез - это сложный процесс опухолеобразования, основанный на взаимодействии геномов клетки и онкогенного вируса. Согласно вирусно-генетической теории Л.А. Зильбера, любая клетка потенциально может образовывать вирус, так как содержит необходимую для этого информацию; она находится в генетическом аппарате (в ДНК-хромосомах) клетки. Гены, кодирующие образование компонентов эндогенных вирусов, являются частью нормального клеточного генома и называются провирусами или вирогенами. Они наследуются по законам Менделя как самые обычные гены и при воздействии определенных модифицирующих факторов способны инициировать возникновение рака. Одна и та же клетка может иметь в генетическом аппарате несколько вирогенов и образовывать несколько разных эндогенных вирусов. Последние содержат РНК и обратную транскриптазу - фермент, катализирующий «обратную» транскриптазу, т.е. синтез ДНК на матрице РНК. Наряду с эндогенными, в настоящее время обнаружены экзогенные онкогенные вирусы. Этиологическое значение экзогенных онкогенных вирусов уже доказано для некоторых форм злокачественных новообразований.
|
Онкогенные вирусы по содержащейся в них молекулярной структуре генома делят на ДНК- и РНК-содержащие (Fenner F., 1975):
• ДНК-содержащие вирусы способны индуцировать опухоль и трансформировать культуру клеток. К ним относятся: папилломавирусы (вирус папилломы человека - HPV); аденовирусы, герпесвирусы (вирус Эпштейна-Барр - EBV), гепаднавирусы (вирус гепатита В - HBV) (Tooze J., 1980; Galloway D., 1983);
• РНК-содержащие вирусы - ретровирусы, относящиеся к семейству Retro-viridae (Fenner F., 1975). Это семейство включает все вирусы, имеющие в качестве генома РНК-зависимую ДНКполимеразу (обратную транскриптазу). К ним относится вирус Т-клеточного лимфолейкоза взрослых (HTLV).
В качестве этиологических агентов ряда злокачественных новообразований определены представители некоторых семейств вирусов.
1. Человеческие папилломавирусы являются одними из ведущих этиологических факторов возникновения цервикально-интраэпителиальной неоплазмы (CIN) и рака шейки матки. Известно около 74 генотипов HPV. Из них выделяют:
- доброкачественные (типы 6 и 11), с которыми связывают появление остроконечных кондилом аногенитальной области и других доброкачественных поражений;
- злокачественные (типы 16, 18, 31, 33, 35, 52), которые чаще выявляют у больных с цервикально-эпителиальной неоплазмой и генитальным раком.
Вирус папилломы человека (ВПЧ), тип 16, связывают с развитием рака вульвы, влагалища, ануса, пищевода, миндалин.
Около 300 тыс. новых случаев рака шейки матки в мире связывают с HPV.
2. Герпесвирусы (EBV).
Длительная персистенция герпесвирусов в организме человека создает условия для действия инициирующих и промоцирующих факторов возникновения злокачественных новообразований (Струк В.И., 1987). Патогенез опухолей, ассоциированных с герпесвирусом, очень сложен и зависит от многих взаимосвязанных и разнообразных факторов (гормональных, иммунных, генетических). Вирусологические и электронно-микроскопические методы позволили выявить опухоли человека, ассоциированные с герпесвирусом: лимфома Беркитта, назофарингеальный рак и рак шейки матки. Клетками-мишенями для EBV являются В-лимфоциты человека. Механизм малигнизирующего действия герпесвирусов на В-лимфоциты пока не установлен, но возможность их мутагенного воздействия уже доказана: все вирусы группы герпеса в инфицированных ими клетках индуцируют хромосомные аберрации, транслокации участков хромосом, что является свидетельством канцерогенной опасности герпесвирусной инфекции.
|
3. Вирус гепатита (гепаднавирус - HBV).
Вирус гепатита, повреждая гепатоциты, является частым фактором в развитии гепатоцеллюлярного рака. По оценкам ВОЗ, около 80 % всех первичных злокачественных опухолей печени индуцированы этими вирусами. Около 200 млн человек на планете являются носителями вирусов HBV. Ежегодно в мире выявляется несколько сотен тысяч новых случаев гепатоцеллюлярного рака, ассоциированного с HBV. В странах Азии и Африки, где хроническое инфицирование вирусом гепатита В носит частый характер, до 25 % случаев первичного рака печени связывают с вирусом гепатита В или С.
4. Человеческий вирус Т-клеточной лейкемии (HTLV) впервые был выявлен в 1979-1980 гг. из опухолевых клеток взрослых, больных
Т-клеточной лимфомой-лейкемией (ATL) [Poiesz B. et al., 1981]. По данным эпидемиологов, область распространения патологии, ассоциированной с этим вирусом, ограничивается южными районами Японии и Индии. О вирусной этиологии острого лимфолейкоза у взрослых свидетельствуют исследования американских и японских ученых, которые показывают, что в 90-98 % случаев при типичных проявлениях данной патологии в крови определяются антитела к HTLV. В настоящее время известны веские аргументы в пользу вирусного происхождения лимфогранулематоза, саркомы Капоши, меланомы, глиобластомы.
В зависимости от вида вирусно-клеточного взаимодействия предполагается, что основная роль в инициации повреждений генетического материала клетки принадлежит литическим ферментам вирусного или клеточного происхождения либо непосредственному взаимодействию геномов клетки и вируса на уровне нуклеиновых кислот. Если клетка резистентна к вирусу, то не происходит ни репродукции, ни трансформации клетки. При контакте вируса с чувствительной к нему клеткой отмечается депротеинизация вируса с высвобождением нуклеиновой кислоты, которая последовательно внедряется сначала в цитоплазму, затем - в ядро клетки и клеточный геном. Таким образом, внедрившийся в клеточный геном вирус или его часть вызывают трансформацию клетки.
|
Особо следует отметить роль в канцерогенезе микробных агентов, в частности бактерии Helicobacter pylori (H. руЬп). Эпидемиологические исследования, подтверждающие увеличение частоты случаев рака желудка, ассоциированного с H. pylori, определили их инициирующую роль в процессе канцерогенеза. В 1994 г. Международное агентство по изучению рака отнесло эту бактерию к канцерогенам первого класса и определило ее как причину развития рака желудка у человека.
В настоящее время доказана также связь между инфицированием H. pylori и желудочной MALT-лимфомой. H. pylori как микроб не обладает выраженными болезнетворными свойствами, но способен в течение всей жизни персистировать в желудке хозяина, непрерывно раздражая слизистую оболочку желудка. Длительная колонизация H. pylori в слизистой оболочке желудка создает благоприятный фон для воздействия канцерогенных веществ на клетки герминативных зон и возможность самих бактерий индуцировать пролиферативные изменения эпителия с активацией протоонкогенов и генетической
неустойчивостью стволовых клеток, что приводит к развитию мутаций и геномным перестройкам.
Возможно, в патогенезе рака желудка могут иметь значение и различные штаммы H. pylori: риск развития этой болезни существенно увеличивают штаммы H. pylori, ассоциированные с белками CagA (цитотоксинассоциированный ген А) и VacA (вакуолизирующий цитотоксин A).
С Н. pylori связывают многократное увеличение риска возникновения рака. По оценке D. Forman (1996), основанной на эпидемиологических данных, с обсеменением H. руЬп может быть связано до 75 % случаев рака желудка в развитых странах и около 90 % - в развивающихся.
Химические соединения
Все живое и неживое составляющее природы состоит из химических элементов и соединений, обладающих различными свойствами в зависимости от строения их атома и структуры молекул. К настоящему времени зарегистрировано около 5 млн химических веществ, из них 60-70 тыс. - вещества, с которыми соприкасается человек.
|
Американским агентством защиты окружающей среды (EPA) были предложены следующие вопросы для определения принадлежности химических веществ к числу канцерогенов.
- Опасно ли химическое соединение для человека и при каких условиях?
- Каковы степень и характер риска при контакте с ним?
- Каковы должны быть экспозиция и доза вещества?
Эти вопросы послужили как бы характеристикой для возможных канцерогенных свойств некоторых химических веществ. В настоящее время известна обширная группа химических элементов и соединений канцерогенного действия, представляющая собой широко варьирующие по структуре органические и неорганические соединения с видовой и тканевой избирательностью невирусной и нерадиоактивной природы. Часть этих веществ - экзогенного происхождения: канцерогены, существующие в природе, и канцерогены, являющиеся продуктами человеческой деятельности (промышленной, лабораторной и т.д.); часть - эндогенного происхождения: вещества, являющиеся метаболитами живых клеток и обладающие канцерогенными свойствами.
По данным U. Saffiotti (1982), количество канцерогенов насчитывает 5000-50 000, из них с 1000-5000 контактирует человек.
Самые распространенные химические вещества с наибольшей канцерогенной активностью следующие:
1) ПАУ - 3,4-бензпирен, 20-метилхолантрен, 7,12-ДМБА;
2) ароматические амины и амиды, химические красители - бензидин, 2-нафтиламин, 4-аминодифенил, 2-ацетиламинофлю- орен и др.;
3) нитрозосоединения - алифатические циклические соединения с обязательной аминогруппой в структуре: нитрометилмочевина, ДМНА, диэтилнитрозамин;
4) афлотоксины и другие продукты жизнедеятельности растений и грибов (циказин, сафрол и т.д.);
5) гетероциклические ароматические углеводороды - 1,2,5,6- и 3,4,5,6-дибензкарбазол, 1,2,5,6-дибензакридин;
|
6) прочие (эпоксиды, металлы, пластмассы).
Большинство химических канцерогенов активизируются в организме при метаболических реакциях. Они называются истинными или конечными канцерогенами. Другие химические канцерогены, которые не нуждаются в предварительных превращениях в условиях организма, называются прямыми.
Согласно данным Международного агентства по изучению рака, до 60-70 % всех случаев рака в той или иной мере связаны с вредными химическими веществами, находящимися в окружающей среде и влияющими на условия жизни. С учетом степени их канцерогенности для человека, согласно классификации МАИР, выделяют 3 категории оценки химических соединений, групп соединений и производственных процессов.
1. Химическое соединение, группа соединений и производственный процесс или профессиональное воздействие канцерогенны для человека. Эту оценочную категорию используют только при наличии достоверных эпидемиологических доказательств, свидетельствующих о причинной связи между воздействием и возникновением рака. К этой группе относят такие загрязнители внешней среды, как бензол, хром, бериллий, мышьяк, никель, кадмий, диоксины, некоторые нефтепродукты.
2. Химическое соединение, группа соединений и производственный процесс или профессиональное воздействие, возможно, канцерогенны для человека. Эта категория разделена на под-
группы: с более высокой (2А) и более низкой (2Б) степенью доказательства. Кобальт, свинец, цинк, никель, продукты переработки нефти, 3,4-бензпирен, формальдегид - наиболее известные генотоксиканты этой группы, которые в значительной степени определяют антропогенную нагрузку на природу. 3. Химическое соединение, группа соединений и производственный процесс или профессиональное воздействие не могут быть классифицированы с точки зрения их канцерогенности для человека.
|
Экологические аспекты циркуляции канцерогенов во внешней среде
Среда обитания человека представлена бесчисленным количеством химических веществ. Канцерогенные вещества обладают способностью взаимодействовать друг с другом, активизироваться в благоприятных химических условиях, взаимопревращаться и длительное время сохраняться в любой органической и неорганической среде. Основными источниками распространения канцерогенов являются предприятия черной и цветной металлургии, химической, нефтехимической, нефтяной, газовой, угольной, мясной, целлюлозно-бумажной промышленности, предприятия сельского и коммунального хозяйства. Среда, загрязненная канцерогенными веществами, определяет характер контакта человека с ними и пути их поступления в организм. Содержание загрязнителей в атмосферном воздухе, воздухе производственных помещений, жилищ и общественных зданий обусловливает преимущественно ингаляционное воздействие веществ на организм. Водные загрязнители действуют на организм при пероральном поступлении с питьевой водой и через кожу - при использовании воды в целях личной гигиены. Кроме того, пероральное поступление веществ в организм имеет место при употреблении в пищу рыбы, морской капусты, а также сельскохозяйственных растений и мяса животных (химические вещества попадают в них при загрязнении почвы). С загрязненными продуктами питания в организм человека могут поступать свинец, ртуть, мышьяк, различные пестициды, азотистые соединения и другие вещества. В быту человек контактирует с химическими веществами, источниками которых являются строительные и отделочные материалы, краски, предметы бытовой химии, лекарственные средства, продукты неполного сгорания природного газа и т.д.
Циркуляция канцерогенов в природе между различными средами: водой, почвой, воздухом, а также их потребление, накопление и перенос в этих средах живыми организмами приводят к изменениям условий и характера природных процессов и нарушению баланса энергии и веществ в экологической системе. В качестве индикатора загрязнения принят 3,4-бензпирен - распространенный продукт неполного сгорания с высокой канцерогенной способностью.
|
Понятие о первичной и вторичной профилактике
Проведение профилактических мероприятий в онкологии осложняется многообразием предполагаемых этиологических факторов канцерогенеза. Многочисленные эпидемиологические и экспериментальные исследования показали связь между определенными факторами воздействия внешней среды (химические, физические и биологические) и образом жизни человека.
Комплекс социально-гигиенических мероприятий, направленных на максимальное снижение воздействия канцерогенных факторов внешней среды на чувствительные к ним клетки живого организма, а также стабилизация иммунологического статуса организма путем неспецифического воздействия на человека (пропаганда здорового образа жизни, правильного питания, отказ от вредных привычек и т.д.) называется первичной профилактикой злокачественных новообразований.
Комплекс медицинских мероприятий, направленных на выявление больных с предраковыми заболеваниями, с последующим их оздоровлением и наблюдение за ними называется вторичной профилактикой. Организация и проведение мероприятий по ранней диагностике рака также рассматриваются как компонент вторичной профилактики, а предупреждение рецидива рака как третичная профилактика рака.
Индивидуальная защита организма от злокачественных новообразований должна включать:
1) соблюдение правил личной гигиены;
2) безотлагательную лечебную коррекцию нарушенных функций организма;
3) правильное рациональное питание;
4) отказ от вредных привычек;
5) оптимизацию функций репродуктивной системы;
6) ведение здорового активного образа жизни;
7) высокое самосознание человека - четкое знание факторов канцерогенного воздействия на организм и мер предосторожности, знание особенностей течения, стадийности и зависимости эффективности лечения опухолей от своевременности их выявления.
|
Борьба с курением
С целью выработки у курильщиков индивидуальных мер защиты производители табачных изделий стали выпускать сигареты с фильтрами и дозиметрами. Предполагалось, что предупредительная надпись на пачках сигарет: «Курение опасно для вашего здоровья», а в некоторых случаях и изображения фотографий с лицами умерших от рака легкого окажут психологическое воздействие на самосознание курильщиков.
Административные органы, действующие на основе федерального закона о борьбе с курением, запрещают курение табака в общественных местах для предотвращения вредного воздействия табачного дыма на людей, вынужденных вдыхать загрязненный дымом воздух, состоящий в основном из канцерогенных нитрозоаминов. По некоторым результатам исследований, пребывание в сильно накуренном помещении в течение 4 ч равносильно активному выкуриванию 1-2 сигарет.
Под эгидой ВОЗ разработана Программа партнерства для стран Европы, направленная на объединение усилий с целью борьбы с курением и избавления курящих от табачной зависимости.
В РФ принят Федеральный закон от 10.07.01 ? 87-ФЗ «Об ограничении курения табака». Закон определяет правовые основы ограничения рекламы табака в целях снижения заболеваемости населения; регулирует деятельность по производству и оптовой торговле, розничной продаже и рекламе табачных изделий; предусматривает ограничение употребления табачных изделий на рабочих местах, в городском, пригородном транспорте, в закрытых спортивных сооружениях, образовательных организациях и организациях культуры, помещениях, занимаемых органами государственной власти; запрещает курение на территории медицинских учебных и научных центров; врач призван личным примером демонстрировать здоровый образ жизни.
|
Важными мероприятиями в социально-гигиенической профилактике являются пропаганда здорового образа жизни, создание и функционирование спортивных оздоровительных комплексов.
Гигиена питания
Среди факторов, способствующих возникновению злокачественных новообразований, алиментарный составляет 35 %. С пищей организм получает не только питательные вещества, но и неопределенное количество канцерогенных веществ, антигенные чужеродные белки, которые обладают способностью прямо или косвенно влиять на канцерогенез.
В некоторых случаях человек, ощущающий себя вполне здоровым, не подозревая, что он является потенциальным опухоленосителем из-за длительного латентного периода болезни, употребляет пищу с содержанием активных стимулирующих и высококалорийных ингредиентов, полезных для здорового организма. Однако этим создаются благоприятные условия для стимуляции прогрессирования патологически измененных (атипичных) клеток. Таким образом, содержание определенных компонентов употребляемой пищи покрывает энергетические затраты, связанные с функциональной деятельностью различных систем, а в организме опухоленосителя, т.е. субъективно здорового человека, может послужить незаменимым субстратом, в котором очень нуждалась опухолевая ткань.
Многочисленные экспериментальные данные позволяют выявить компоненты пищи, стимулирующие или тормозящие возникновение рака у человека и животных. Известны биохимические вещества с антиканцерогенным действием, способные подавлять активность ферментов, нейтрализовать избыток эстрогенов, адсорбировать и инактивировать канцерогенные агенты в организме. Антиканцерогенным эффектом обладают антиоксиданты, соли селена. К антиоксидантам относится широкий спектр биологически активных веществ, содержание которых в пище очень важно для профилактики рака, - токоферол, фосфолипиды, убихиноны, витамины группы K, флавоноиды. Биооксиданты определяют антиоксидантную способность тканей, имеющую важное значение для регуляции перекисного окисления липидов (ПОЛ) и предотвращения поражения мембраны клеток, что является существенным звеном злокачественной трансформации клеток (Бурлакова Е.Б. и соавт., 1975).
|
Учитывая антиканцерогенное действие перечисленных ингредиентов и важность их содержания в употребляемой пище для снижения риска возникновения рака, необходимо потреблять больше продуктов растительного происхождения, содержащих широкий спектр биологически активных веществ: фитостеролов, индолов, флавони-
нов, сапонинов, биофлавоноидов, β-каротина, ингибиторов ферментов, витаминов, микроэлементов, минеральных веществ и клетчатки. Продукты питания обладают потенциальной способностью влиять на канцерогенез: одни из них уменьшают метаболическую активность или усиливают детоксикацию канцерогенов, другие защищают ДНК при электрофильном канцерогенезе или сами оказывают противоопухолевое действие на клетки. Жиры, компоненты, образующиеся в процессе обработки продуктов, продукты гидролиза оказывают канцерогенное действие. Профилактической мерой для снижения риска возникновения рака служит исключение из пищевого рациона (или ограничение) продуктов, содержащих большое количество канцерогенов, - копченостей, маринадов, пищи, приготовленной с применением ранее использованного жира, консервов.
Европейская противораковая программа содержит следующие рекомендации по питанию:
1. Вероятность развития рака у разных индивидуумов в значительной мере определена генетически, но существующий уровень знаний не позволяет идентифицировать людей, подверженных высокому риску. Рекомендации должны быть приложены ко всей популяции для лиц старше 2 лет.
2. Специфические рекомендации по питанию:
- поступление калорий от сжигания жира не должно превышать 30 % общей энергетической ценности пищи, в том числе менее 10 % должны обеспечивать насыщенные жиры, 6-8 % - полиненасыщенные жиры, 2-4 % - мононенасыщенные;
- следует потреблять разнообразные свежие овощи и фрукты несколько раз в день;
|
- необходимо сбалансировать физическую нагрузку и рацион для сохранения нормальной массы тела;
- ограничить потребление соли, пищи, консервированной с помощью нитритов, нитратов и соли. Норма потребления соли - не более 6 г в день;
- ограничить потребление алкогольных напитков.
Важнейшие научные направления в онкологии
К важным и перспективным научным направлениям в онкологии можно отнести исследования по профилактике злокачественных новообразований, оптимизации паллиативной помощи, реабилитации, организации онкологической помощи в современных
социально-экономических условиях, возможностям компьютерных технологий, телемедицины, Интернета и др.
К перспективным направлениям в области диагностики злокачественных новообразований относятся:
• усовершенствование алгоритма диагностики опухолей и их рецидивов;
• внедрение ультразвукового исследования (УЗИ), компьютерной (КТ) и магнитно-резонансной (МРТ) томографии и других методов в дифференциальную диагностику и уточнение стадии опухолевого процесса;
• совершенствование методов интервенционной радиологии;
• разработка методов внутриполостной сонографии и эндоскопии для оценки распространенности опухолевой инфильтрации полых органов;
• внедрение методов иммуноморфологической диагностики и молекулярно-биологического исследования новообразований, оценки их биологической агрессивности и чувствительности к терапевтическому воздействию.
В области лечения злокачественных новообразований перспективны следующие научно-практические направления:
• дальнейшее изучение адекватности и правомерности эндоскопического и экономных методов лечения больных раком;
• обоснование показаний к выполнению расширенных, сверхрасширенных, комбинированных, симультанных операций, а также лимфаденэктомии при раке;
|
• выполнение и научный анализ результатов циторедуктивных операций при запущенных формах рака;
• поиск и испытания новых химио- и гормональных препаратов, иммуномодуляторов, антиоксидантов, модификаторов и протекторов противоопухолевой терапии;
• разработка новых схем комбинированной химио-, гормоно- и иммунотерапии для самостоятельного, адъювантного и неоадъювантного лечения;
• разработка комплексных программ улучшения качества жизни пациентов, получающих противоопухолевое лекарственное лечение;
• разработка новых технологий лучевой терапии при локализованных, местно-распространенных и генерализованных формах онкологических заболеваний;
• дальнейшие разработки радиомодификаторов различных направлений действия и их сочетаний;
• поиски оптимальных вариантов лучевой терапии с использованием различных видов и энергий пучков ионизирующих излучений при органосохраняющих и функционально щадящих операциях.
В области фундаментальных исследований высокую актуальность сохраняют следующие научные направления:
• разработка способов оценки генетической предрасположенности к онкологическим заболеваниям;
• исследование механизмов регуляции опухолевого роста;
• исследование и внедрение в клинику новых лабораторных методов оценки прогноза течения онкологических заболеваний и их чувствительности к антибластическим воздействиям;
• экспериментальное обоснование патогенетических подходов к лечению онкологических больных;
• разработка в эксперименте способов и путей адресной доставки цитостатиков;
• усовершенствование методов биотерапии опухолей.
Для освещения научных достижений, обобщения кооперированных исследований, наблюдений, дискуссий в России издаются журналы - «Вопросы онкологии», «Российский онкологический журнал», «Детская онкология», «Практическая онкология», «Паллиативная медицина и реабилитация», «Сибирский онкологический журнал», «Клиническая онкология». Онкохирурги могут найти много полезной информации в журналах «Хирургия», «Вестник хирургии им. И.И. Грекова», «Креативная хирургия и онкология». Последние годы ознаменовались развитием компьютерных технологий, Интернета, появились сайты, онкосерверы и другие достижения научнотехнического прогресса.
|
Динамика показателей излечения онкологических больных
Основными статистическими показателями, характеризующими эффективность лечебного компонента деятельности онкологической службы, являются численность контингента больных, состоящих на учете в онкологических учреждениях, и показатель их выживаемости.
К концу 2005 г. численность контингентов онкологических больных, состоящих на учете в специализированных учреждениях России, составила 2 386 766 человек (2 102 702 - в 2000 г.). Преобладали
больные раком кожи (13,2 %), молочной железы (17,7 %), шейки (6,6 %) и тела (6,9 %) матки, желудка (5,6 %). Незначительной была доля больных со злокачественными новообразованиями пищевода (0,4 %), гортани (1,7 %), костей и мягких тканей (1,6 %), предстательной железы (2,6 %), лейкозами (2 %).
Кумулятивный показатель, отражающий множество частных показателей онкологической помощи населению, в 2005 г. составил 0,64. Он возрос по сравнению с 2000 г. (0,54) за счет снижения доли больных с III-IV стадиями заболевания, увеличения индекса накопления контингентов онкологических больных, состоящих на учете, снижения летальности.
Вирусы – это микроскопические организмы, большинство из которых невозможно увидеть с помощью обычного микроскопа. В их состав входит небольшое количество ДНК- или РНК-генов, окруженных белковой капсулой. Жизнедеятельность вирусов направлена на проникновение в живые клетки, где происходит размножение инфекции. В процессе деления некоторые штаммы вирусов внедряют собственную ДНК в клетку-хозяина, что в дальнейшем может спровоцировать развитие ракового процесса.
Что такое вирус рака?
Вирус рака – это комплексное понятие, которое включает:
Инфекции, непосредственно вызывающие раковые заболевания.
Вирусы, действие которых направлено на развитие хронических воспалительных процессов.
Каждый онковирус, как правило, заражает только определенный тип клеток. В настоящее время в научном мире увеличивается количество информации о роли вирусов в образовании опухолевых процессов. Такие знания помогают ученым разрабатывать противораковые вакцины. Но, к сожалению, всеобщая вакцинация может предотвратить формирование нескольких видов новообразований до поступления вируса в организм.
Онковирусы и их классификация
Вирусы папилломы человека:
Папиллома вирус представляет собой более чем 150 родственных вирусов. Название патологии объясняется тем, что большинство из них вызывает образование папиллом у человека. Некоторые типы ВПЧ поражают только кожные покровы, а другие – слизистые оболочки ротовой полости, горла или репродуктивных органов у женщин.
ВАЖНО ЗНАТЬ: Прививка от рака девочкам
Все типы папилломатозной инфекции передаются через прямой контакт (прикосновение). У более чем 40 видов вируса инфицирование происходит через половой контакт. Большинство жителей земли заражаются вирусом папилломы в период активной половой жизни. Десяток штаммов данной инфекции способны вызвать раковое заболевание.
У большинства людей активацию вирусного поражения контролирует иммунная система. И только при понижении неспецифической резистентности организма существует риск формирования злокачественного новообразования.
Какие вирусы вызывают рак шейки матки? Уже несколько десятков лет медицинская наука идентифицировала несколько видов папиллома вирусов ответственных за возникновение опухоли шейки матки. Уже много лет во всем мире применяются специальные пап-тесты, которые показывают предраковые изменения в клетках шейки матки. Благодаря такому тестированию удается предотвратить развитие онкологии у женщин путем своевременного удаления видоизмененных тканей.
 Вирус
папилломы человека
Вирус
папилломы человека
Вирус папилломы человека также играет определенную роль в возникновении некоторых видов рака мужского полового органа, вульвы, ануса.
ЧИТАЙТЕ ТАКЖЕ: Прививка от рака шейки матки
Вирус Эпштейна-Барра:
Этот тип вируса герпеса известный по причине провоцирования мононуклеоза. Болезнь может передаваться при кашле, чихании или совместном пользовании столовыми приборами.
Герпес- вирусы, вызывающие рак, после проникновения в организм сохраняются в нем на всю жизнь. Инфекция концентрируется в белых кровяных клетках (В-лимфоциты).
ВЭБ-инфицирование организма может привести к возникновению рака носоглотки, лимфом и рака желудка, а также вызывать рак губы и ротовой полости.
Вирусы гепатита В и С:
Эти вирусные инфекции вызывают хроническое деструктивное воспаление печени, что в долгосрочной перспективе может подвергнуться раковому перерождению.
Вирусы гепатита передаются за счет совместного использования игл, полового акта или родов. Передача инфекции через переливание крови в современной медицинской практике практически отсутствует из-за тестирования донорской крови.
 Модель
вируса гепатита
Модель
вируса гепатита
Из этих двух вирусов, тип В наиболее вероятно вызывает развитие клинической симптоматики в виде гриппозного состояния или признаков желтухи (пожелтение кожных покровов и глаз). Практически во всех случаях гепатит В поддается полному излечению.
Для человека наибольшую опасность представляет вирус гепатита тип С, который вызывает хроническое воспаление печеночных тканей без внешних проявлений. Это заболевание крайне тяжело поддается лечению и может длительный период протекать бессимптомно. Хроническое течение гепатита С считается очень серьезным фактором риска печеночного рака.
После диагностики заболевания пациент подвергается специфическому лечению с целью замедления разрушающих процессов в печени и предотвращению образования злокачественного новообразования.
В медицинской практике существует вакцина для профилактики вирусного гепатита (только типа В), она рекомендует для всех детей и взрослых, которые регулярно подвергаются риску инфицирования.
Вирус иммунодефицита человека:
Проникновение в организм ВИЧ вызывает синдром приобретенного иммунодефицита, который напрямую не вызывает раковые заболевания. Но данное заболевание увеличивает риск онкологической патологии через снижение сопротивляемости организма.
Пути передачи ВИЧ-инфекции:
Незащищенный половой контакт с ВИЧ-инфицированным человеком.
Проведение инъекций или применение инструментов, не прошедших достаточную стерилизацию.
Пренатальная (до рождения) или перинатальная (во время родов) передача инфекции от матери к ребенку.
Грудное вскармливание матерей, живущих с ВИЧ.
Переливание препаратов крови, содержащих вирус.
Трансплантация органов от ВИЧ-инфицированных доноров.
Несчастные случаи в медицинских учреждениях, связанные с случайным травмированием инструментом с вирусной инфекцией.
ВИЧ-инфекция наиболее часто провоцирует возникновение Саркомы Капоши и рак матки, а также некоторые виды лимфоидных опухолей.
