
erohina_l.a._himiya_v_stroitelstve_2012
.pdfсочетание их пластичности с прочностью, твёрдостью и упругостью. Особые свойства металлов объясняются кристаллической структурой и особым типом химической связи – металлической связью. В металлическом кристалле распределение электронов изменяется, так как кристаллическая решётка металлов образована положительно заряженными ионами.
При образовании металлического кристалла из свободных атомов их сближение приводит к смыканию уровней электронов в непрерывные энергетические зоны. Внутренние электроны остаются каждый у своего атома. Они вместе с ядром образуют положительные ионы металлического кристалла. На внешнем уровне возникаютсвободныеэлектроны. Ихназывают«электроннымгазом».
Таким образом, металл можно представить в виде остова из положительно заряженных ионов, окружённого «электронным газом», компенсирующим силы взаимного отталкивания положительных ионов.
Высокая теплопроводность металлов объясняется способностью свободных электронов передвигаться по кристаллу и переносить энергию из более нагретой части в менее нагретую. При нагревании металла колебания атомов в кристаллической решетке становятся более интенсивными, что затрудняет движение электронов. С повышением температуры электрическое сопротивление металлов возрастает, что приводит к уменьшению электропроводности. При сильном охлаждении, температурах, близких к абсолютному нулю, наступает явление сверхпроводимости, когда почти исчезает сопротивление металла электрическому току.
Вследствие особенностей металлической связи для кристаллических решётокметалловхарактернавысокаяплотностьупаковкиивысокая симметриявней.
Большинство металлов кристаллизуются в одном из трёх типов кристаллической решётки (рис. 4):
Всхемах решёток а) и б) каждый атом окружен 12-ю другими на одинаковом расстоянии. Такое расположение соответствует самому плотному заполнению пространства. Степень заполнения пространства составляет 74,05%. Координационное число равно 12.
Вобъёмно-центрированной кубической решётке упаковка атомов более рыхлая, и координационное число составляет 8.
Большая прочность и твёрдость металлов объясняется максимально плотной упаковкой частиц и прочностью самих кристаллических решёток. Пластичность можно объяснить скольжением слоёв частиц, образующих металлическую решётку. Они сдвигаются относительно друг друга без разрыва, так как при этом сохраняются связи между слоями.
28
МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Ухтинский государственный технический университет» (УГТУ)
Л. А. Ерохина, Н. С. Майорова
Химия в строительстве
Учебное пособие
Ухта 2012
УДК 69:54 (075.8) Е 78
Ерохина, Л. А.
Химия в строительстве [Текст] : учеб. пособие / Л. А. Ерохина, Н. С. Майорова. – Ухта : УГТУ, 2012. – 168 с.
ISBN 978-5-88179-714-0
Данное учебное пособие подготовлено в соответствии с программой по направлению 270800 «Строительство» для бакалавров.
Пособие состоит из 2-х частей: 1 часть – лекционный курс, 2 часть – методические указания по проведению лабораторных и практических занятий по некоторым темам.
В лаборатории на опытах изучаются технологические процессы получения строительных материалов, их связь с химической наукой, приобретаются навыки в экспериментальной работе. Предусмотрены теоретические упражнения и лабораторные работы с вяжущими веществами для определения их активности и изучения свойств (№ 7, 8, 9). Студентам предлагаются упражнения с решением задач технологического характера по определению количества сырья при получении готового продукта, в процессе выполнения которых они знакомятся с химическими формулами и способами защиты строительных материалов от агрессивных факторов окружающей среды.
После каждого занятия есть контрольные вопросы для поиска ответов на них и задачи для самостоятельного решения.
Усвоение изложенного материала обеспечит уровень требований в соответствии с компетенциями по общекультурным (ОК-1, ОК-2, ОК-6) и профессиональным знаниям (ПК-1, ПК-2, ПК-5, ПК-17, ПК-19), которые необходимы студентам как будущим специалистам-строителям.
Учебное пособие рекомендовано к изданию Редакционно-издательским советом Ухтинского государственного технического университета.
Рецензенты: В. И. Крупенский, профессор, зав. кафедрой химии УГТУ, д.х.н.; А. А. Кочкин, доцент, зав. кафедрой ПГС, декан инженерно-строительного факультета Вологодского ГТУ, к.т.н.
©Ухтинский государственный технический университет, 2012
©Ерохина Л. А., Майорова Н. С., 2012
ISBN 978-5-88179-714-0
в машиностроении для отливки тяжёлых частей машин, маховиков, поршней, цилиндров и др. Это наиболее распространённый литейный сплав.
80-85% чугуна расходуется на получение стали. При переработке чугуна в сталь из него удаляют примеси серы, фосфора, кремния, содержание углерода снижается до 2,14% и менее. В результате выплавки из чугуна стали получают более пластичный материал, который подвергают легированию и раскислению.
С помощью раскисления восстанавливается железо, снижается красноломкость:
FeO + Mn = Fe + MnO или 2FeO + Si = 2Fe + SiO2.
Для полного удаления кислорода в конце процесса добавляется немного алюминия:
2FeO + Al = 2Fe + Al2O3.
По степени раскисления сталь делят на спокойную, полуспокойную и кипящую. Кристаллизация нераскисленной стали сопровождается выделением газообразного оксида углерода СО, металл как бы кипит. Такая сталь называется кипящей. Кипящие стали дешевле, но более деформативны, из них не делают ответственных конструкций.
Образующиеся оксиды кремния, марганца и алюминия переходят в шлак. Всё многообразие способов получения металлов разбивают на три процесса: пирометаллургические, гидрометаллургические и электрометаллургические процессы. Металлургические процессы, протекающие при высоких температурах, называются пирометаллургическими. Такие малоактивные металлы как: железо, цинк, свинец, медь и др. получают из оксидов восстановле-
нием углеродом.
Самым замечательным свойством металлов является очень высокая электрическая проводимость, которая объясняется наличием свободных подвижных электронов в атоме металла. Движением электронов объясняется и большая теплопроводность металлов и даже их непрозрачность. Так как металлы почти полностью отражают свет всех длин волн спектра, то они имеют цвет серебри- сто-белый (алюминий серебро, никель) или серебристо-серый (железо, свинец).
Механические свойства металлов – прочность, твёрдость, упругость – характеризуют их способность сопротивляться деформации и разрушению при воздействии внешних напряжений. Большая или меньшая пластичность зависит от структуры металлической кристаллической решётки. Важное значение при использовании металлов в качестве конструкционных материалов имеет
27
В результате науглероживания железо переходит в жидкое состояние и стекает в нижнюю часть печи.
Пустую породу в руде составляют в основном оксиды кремния SiO2, алюминия Al2O3 и другие оксиды, относящиеся к тугоплавким веществам. Для превращения тугоплавких примесей в более легкоплавкие соединения к руде добавляют флюс. В качестве флюса используют известняк или доломит.
Притемпературе900°Сизвестнякпревращаетсявоксидкальция(известь): СаСО3→СаО + СО2.
Оксид кальция, являясь активным веществом, при температуре 1000-1200°С взаимодействует с веществами пустой породы, образуя шлаки, состоящие глав-
ным образом из силикатов и алюмосиликатов кальция.
В зоне высоких температур параллельно с восстановлением оксидов железа частично восстанавливается кремний:
SiO2 + 2C = Si + 2CO.
Восстанавливаются марганец и фосфор, а сера превращается в сульфиды. Сульфид железа хорошо растворим в чугуне. Снижение сульфида железа в чугуне осуществляется с помощью образующейся извести, часть серы переходит в шлак в виде сульфида кальция (СаS). Расплавленное железо при температуре 1600-1750°С растворяет в себе углерод, цементит, кремний, марганец, фосфор, серу, и образуется чугун.
Шлак имеет плотность 2,5 г/см3, чугун – 6,9 г/см3, поэтому шлак собирается над чугуном, предохраняя его от окисления. Жидкий чугун и шлак легко отделяются друг от друга, вытекая из доменной печи через отверстия, расположенные на разных уровнях. Получаемый чугун содержит около 93% железа; от 2,5 до 5% углерода, а также 0,5-4% кремния; 1-3% марганца; 0,02-2,5% фосфора
и0,005-0,08% серы.
Взависимости от условий охлаждения получаются два вида чугуна: белый и серый. При быстром охлаждении чугуна углерод выделяется в виде цементита Fe3C, образуется белый чугун, который имеет высокую твёрдость, но очень хрупок, поэтому его перерабатывают на сталь (передельный чугун).
Выплавляют сталь кислородно-конверторным, мартеновским, бессемеровским способами, а для выплавки качественных и высоколегированных сталей всё более широкое применение получил электросталеплавильный метод, позволяющий производить плавку в вакууме под высоким давлением при температуре расплава свыше 3000°С.
При медленном охлаждении жидкого чугуна углерод выделяется в виде графита, образующийся чугун имеет серый цвет, поэтому его называют серым чугуном. Он характеризуется высокими литейными свойствами и применяется
26
|
Оглавление |
|
Часть 1 |
|
|
Введение. Связь химии с производством................................................... |
5 |
|
1. Формирование и состав горных пород................................................... |
7 |
|
2. Неорганические материалы с высокотемпературной обработкой..... |
14 |
|
2. 1 Керамические материалы.................................................................... |
14 |
|
2.2 |
Силикаты................................................................................................ |
17 |
2.3 |
Металлы ................................................................................................. |
24 |
3. Минеральные вяжущие вещества.......................................................... |
43 |
|
3.1 |
Воздушные вяжущие вещества............................................................ |
45 |
3.2 |
Гидравлические вяжущие вещества.................................................... |
50 |
3.3 |
Бетоны.................................................................................................... |
62 |
3.4 |
Асбестоцементные материалы............................................................. |
66 |
4. Строительные материалы органического происхождения................. |
68 |
|
4.1 |
Древесина............................................................................................... |
68 |
4.2 |
Полимеры............................................................................................... |
72 |
4.3 |
Битумы.................................................................................................... |
82 |
5. Лакокрасочные материалы..................................................................... |
85 |
|
6. Создание композиционных материалов............................................... |
88 |
|
Часть ΙΙ |
|
|
Лабораторные и практические работы ..................................................... |
91 |
|
Тема 1. Происхождение магматических, осадочных, метаморфических |
||
пород. Минеральный и химический составы пород, их изменение |
|
|
под воздействием выветривания скальных пород............................................. |
91 |
|
Тема 2. Реакции образования известняков, гипса и других |
|
|
химических осадков в природе. Получение вяжущих веществ, |
|
|
определение их активности.................................................................................. |
97 |
|
Тема 3. Образование глин, их минеральный состав, изменение |
|
|
минерального состава после обжига................................................................. |
101 |
|
Тема 4. Классы и марки стали, применяемые в строительстве. |
|
|
Воздействие агрессивной среды, коррозия стали, защита от коррозии |
|
|
металлических изделий....................................................................................... |
106 |
|
Тема 5. Гранулометрический, минеральный и химический |
|
|
составы песков. Кремнезём кристаллической и аморфной структуры. |
|
|
Использование в строительстве......................................................................... |
111 |
|
|
3 |
|
Тема 6. Минеральный состав и структура стекла, ситаллов, |
|
каменного литья, минеральных волокон. Их использование |
|
в строительстве.................................................................................................... |
114 |
Тема 7. Гидравлические вяжущие вещества, их разновидности, |
|
минеральный и химический состав цементов.................................................. |
117 |
Тема 8. Гидратация цементов, взаимодействие с добавками, |
|
условия формирования плотной структуры..................................................... |
120 |
Тема 9. Структура цементного камня, влияние условий |
|
твердения и добавок на формирование капиллярной структуры................... |
126 |
Тема 10. Фазовый состав воды в структуре цементного камня........... |
130 |
Тема 11. Воздействие агрессивной среды на цементный камень, |
|
коррозия бетона, методы защиты...................................................................... |
133 |
Тема 12. Древесина, химические процессы при получении из неё |
|
строительных материалов................................................................................... |
139 |
Тема 13. Органические вяжущие вещества в строительстве................ |
144 |
Тема 14. Полимеры в строительстве....................................................... |
147 |
Тема 15. Защита строительных материалов от агрессивной среды..... |
152 |
Тема 16. Укрепление поверхностного слоя материалов |
|
с помощью окраски, пропитки, импрегнирования.......................................... |
157 |
Тема 17. Зачётная работа по индивидуальным заданиям..................... |
161 |
Задача № 1.................................................................................................. |
165 |
Задача № 2.................................................................................................. |
165 |
Задача № 3.................................................................................................. |
166 |
Библиографический список ..................................................................... |
167 |
4
пространёнными минералами, содержащими соединения металлов, являются: силикаты, оксиды, сульфиды, карбонаты, сульфаты, фосфаты, галогениды.
Чёрные металлы.
Чёрными металлами называют сталь и чугун, которые получают из таких минералов как: магнетит Fe3O4, гематит Fe2O3, гетит Fe2O3 Fe(OH)3, хромистый железняк FeO · Сr2O3, боксит Al2O3 · H2O, пиролюзит MnO2, гаусманит Mn3O4, куприт Cu2O3, валентинит Sb2O3, сервантит Sb2O4 и сульфиды FeS2 (железный колчедан). Исходным сырьём для получения металлов являются руды.
Руда – это природное минеральное образование с таким содержанием полезных минералов, которое обеспечивает экономическую целесообразность их извлечения. Руду обрабатывают, отделяют пустую породу для увеличения концентрации металла. Большинство металлов в природе находится в окисленном состоянии, извлечение их основано на восстановлении и отделении от примесей.
Железо и его сплавы составляют основу современной техники. Основную массу железа выплавляют в виде чугуна и стали. Железную руду дробят и плавят в доменных печах, где поддерживают высокую температуру, сжигая кокс (специально обработанный уголь).
При сжигании угля образуется углекислый газ, который, проходя через слой раскалённого угля, восстанавливается до оксида углерода:
С+О2 = СО2 → СО2 + С = 2СО.
Оксид углерода восстанавливает руду (Fe2O3). По мере повышения температуры железо восстанавливается сначала при 400-500°С:
3Fe2O3 + CO = 2Fe3O4 + CO2.
При температуре 600°С превращается:
Fe3O4 + CO = 3FeO + CO2.
Притемпературе700-900°C железовосстанавливается до металлического:
FeO + CO = Fe + CO2.
При ещё более высокой температуре 1000-1100°С всё железо восстанавливается углеродом:
FeO + C = Fe + CO.
Восстановленное железо частично взаимодействует с оксидом углерода, образуя карбид железа:
3Fe + 2CO = Fe3C + CO2 .
25
Стеклянное волокно получают из расплава стекла, вытекающего через фильеры (отверстия диаметром от 2,5 до 6 мм), расположенные в дне выработочной части печи. Образуется стеклянная нить, наматываемая на барабан, вращающийся со скоростью 150-400 оборотов в минуту.
Другой способ – дутьевой, когда стеклянный расплав раздувается паром. Этим способом получают короткое волокно, используемое для получения теплоизоляционных изделий.
Стеклянное волокно используется главным образом в электротехнической промышленности, а также для тепло- и звукоизоляции. Скреплённое различными связующими (крахмал, полимеры, гипс, цемент, металл) стеклянное волокно армирует матрицы, и тогда получают такие композиционные материа-
лы как: стеклогипс, стеклобитум, стеклопласт и др. Из стеклобитума изготав-
ливают мягкую кровлю, кислотоустойчивые сосуды, звукоизоляционные изделия. Обработкой стеклянных нитей полимерами удалось получить материалы, обладающие большей прочностью, чем обычная сталь.
Стеклянное волокно с большим содержанием двуокиси кремния или глинозёма, а также чисто кварцевое служит для изоляции аппаратов, подвергающихся кратковременному или длительному воздействию высоких температур. Стеклянное волокно, насыщенное оксидами бора, кадмия, свинца и висмута, служит для изготовления легковесных экранов для защиты от тепловой радиации, нейтронов и радиоактивного излучения.
Протягивание стальных стержней при 1200°С под давлением до 150 кг/см2 стало возможным только после применения стеклянного волокна в качестве смазки.
2.3 Металлы
В технике к металлам относят как собственно металлы, так и сплавы, для которых также характерны металлические свойства: высокая электропроводимость и теплопроводность, металлический блеск, пластичность. Кроме того, они обладают специфическими механическими свойствами: большой прочностью при растяжении и сжатии, способностью к ковке, отрицательным коэффициентом электрической проводимости (понижением электрической проводимости с ростом температуры). Металлические свойства присущи металлам в твёрдом и жидком состоянии, пары металлов прозрачны и не проводят электрический ток.
К наиболее распространённым в природе металлам относятся: алюминий, железо, кальций, натрий, калий, магний, титан. Большая часть металлов находится в земной коре в виде химических соединений – минералов. Самыми рас-
24
Часть Ι
Введение
Связь химии с производством
Химия – наука о веществах и их превращениях. Человек с древних времён использовал то, что ему давала природа: строил жилища из природного материала, выплавлял металлы из руд, обжигал глину, известняк и не подозревал, что происходят химические процессы: из одного вещества получается другое. Можно ли ускорить процесс, получить материал с заданными свойствами? Почему одну разновидность глины надо обжигать при 1000°С, а другую при 1300°С? Почему известь надо обжигать, а гипс варить? С какими элементами сталь станет прочнее и почемувнутрибетонаонаможетразрушаться откоррозии?
Чтобы ответить на эти и другие вопросы надо знать природу материала, его молекулярное строение, состав, способность взаимодействовать с другими веществами. Нельзя с материалами работать наугад. За многие века накапливался опыт работы с каждым материалом, появилась наука и практика лабораторного анализа и эксперимента, научились получать чистыми химические элементы, соединять их длясозданиясплавовсновымисвойствами. Нонаэтоушливека.
Знания позволили человеку решать поставленные проблемы гораздо быстрее. Проникновение физики в химию и химии в другие области знания обогатило науку новыми направлениями, новыми материалами. Везде, где химия соприкасалась с другими отраслями производства, возникали «точки роста» новых наук. Изучение химических процессов в живых организмах привело к появлению биохимии, химический анализ горных пород привёл к развитию геохимии, химии полимеров, нефтехимии.
В основе современных строительных технологий лежат химические процессы. Строительство представляет собой важную ветвь химической технологии, использующей разные разделы неорганической, органической и коллоидной химии. Проблемы строительства решаются и совершенствуются с помощью разделов физической химии о создании поверхностно-активных веществ, об ускорении или замедлении твердения вяжущих материалов, их гидрофобизации. Изучение состава материала, плотности, взаимодействия с компонентами воздуха, с минерализованной водой, матрицы с армирующим компонентом и другими веществами приводят к оптимальному решению при создании и эксплуатации строительных конструкций. Знание химических свойств материалов позволяет правильно организовать их защитуотвоздействиявреднойсреды.
5
Совершенствованию строительных технологий способствуют достижения в химии: получение синтетических волокон, каучуков, пластмасс; склеивание разнородных материалов; использование катализаторов, сварки в строительной практике, тончайших защитных покрытий. Понимание законов химии, их использование исключительно важно при решении проблемы повышения эффективности производства и качества продукции, так как его ухудшение вызывается нежелательными химическими процессами, например коррозией металла или старением полимера, растрескиванием гидроизоляции и т. п. Химия создала материалы, из которых строят не только дома, но и самолёты, автомобили, элек- тронно-вычислительные машины, конструкционные материалы для станков, ракет и ядерных установок.
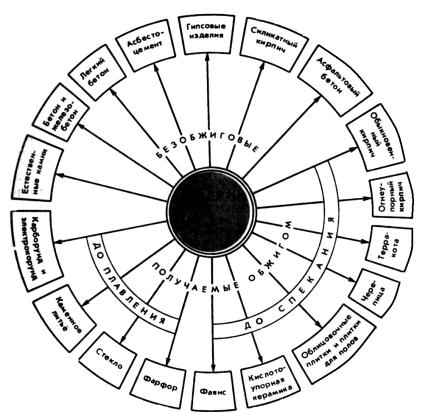
Поспособуполученияматериалыклассифицируютсогласносхеме(рис. 1).
Рис. 1 – Классификация естественных и искусственных каменных строительных материалов по способам получения [1]
6
≡SiONa + H2O → ≡SiOH + NaOH.
В случае полного завершения реакции получают в твёрдом остатке кар-
касный гидросиликат кальция:
SiOH + 2NaOH + CaCO3 → CaO · SiO2 · nH2O + Na2CO3.
Добавляя в шихту или в тонкоизмельченный стеклянный бой специальные пенообразователи, выделяющие при варке стекла газ и вспучивающие стекломассу (мелкодисперсный углерод, карбид кремния SiC, мел CaCO3, пиролюзит MnO2 и др.), получают пеностекло – стеклообразный теплоизоляционный материал. Вспенивают стекло при 700-900°С, получают пеноматериал с плотностью 0,15-0,5 г/см3, отличающийся высокой водостойкостью, теплостойкостью (до 400°С), морозостойкостью.
Ситаллы – это продукты направленной кристаллизации стекла при его термической обработке. Их называют стеклокерамикой. Это частично закристаллизованные стёкла с объёмной концентрацией кристаллических фаз от 20 до 95%. Микрокристаллы имеют размер до 200 мкм, образуются при введении катализатора (оксидов титана, хрома, никеля, железа, металлов платиновой группы) в расплав стекломассы. Изменяя состав стекла, тип катализатора и режим термообработки, получают ситаллы с различными кристаллическими фазами и заданными свойствами.
Технология производства ситаллов включает стадии варки стекла, формовки изделий и специальной термической обработки. Первые две стадии проводят обычными методами, третья стадия проходит в два этапа. Первый – при температуре размягчения стекла, когда зарождаются кристаллы; второй – отжиг изделий при более высокой температуре, но ниже температуры плавления стекла. Такая температура наиболее благоприятна для развития кристаллов, определяющих свойства готового изделия. От кристаллических веществ того же состава ситаллы отличаются пониженной хрупкостью и повышенной прочностью, в особенности – на изгиб. От стекла их отличает повышенная твёрдость, износостойкость, химическая и термическая устойчивость. Максимальная рабочая температура ситаллов превышает 1300°С.
В строительстве широко используются ситаллы, полученные с использованием металлургических шлаков (шлакоситаллы), зол – отходов ТЭЦ (золоситаллы) или горных пород (петроситаллы). Большинство их по химическому составу относится к силикатам или алюмосиликатам кальция, магния с участием оксидов на-
трия, железа. Их отличает высокая прочность, твёрдость, повышенная истираемостьистойкостькхимическимитермическимвоздействиям.
23
ную, Gr2O3 – жёлтую, CoO – синюю, Mn2O3 – фиолетовую, CoO + B2O3 – розовую, Cu2O – красный цвет и др.
Всё большее распространение для теплозащиты помещений получают так называемые низкоэмиссионные стёкла, покрытые тонкой плёнкой специального теплоотражающего материала, например, серебра. Такие стёкла хорошо пропускают внутрь помещений солнечный свет, но отличаются высоким коэффициентом отражения, благодаря чему тепло, образующееся внутри помещения, отражается от стекла обратно в помещение, а не излучается наружу.
Физические и физико-механические свойства силикатных стёкол разнообразны. В зависимости от состава плотность может колебаться от 2,2 (кварцевое стекло) до 8,0 г/см3 (свинцово-силикатное). Это прочные, но хрупкие материалы. Наибольшая прочность характерна для малощелочных алюмосиликатных стекол, наименьшая – для боро- и свинцовосиликатных стекол. Прочность стекла при сжатии (в зависимости от состава) находится в пределах 600-12500 МПа, при растяжении доходит до 10000 МПа. Термическая устойчивость стекла определяется коэффициентом линейного расширения: чем он меньше, тем выше термическая устойчивость. Наименьший коэффициент линейного расширения имеет кварцевое стекло – 5,8 · 10-7 град-1. Коэффициент линейного расширения оконного стекла находится в пределах 80-120 · 10-7 град-1. В зависимости от химического состава коэффициент теплопроводности стекла находится в пределах 0,36-0,83 Вт/м°С.
На стекло, используемое в строительстве, неизбежно действует вода. От её воздействия на поверхности стекла очень медленно начинается процесс выщелачивания: образуются тонкие прозрачные плёнки или белые непрозрачные налёты. Это гель кремнекислоты. Его можно смыть, и стекло становится прозрачным. Но если было взаимодействие с едкими щелочами, то смыть такую плёнку не удаётся, стекло теряет прозрачность.
При попадании влаги на поверхностный слой стекла происходит гидролиз входящих в его состав силикатов. Едкие щёлочи, образующиеся в результате гидролиза, хорошо растворимы, поэтому они вымываются водой, а кремневая кислота образует защитный гелеобразный слой. Этот слой и предохраняет внутренние слои стекла от гидролиза и разрушения. В виде тонкого порошка стекло уже при обычных условиях медленно реагирует с водой. При этом из структуры стекла выщелачивается в основном оксид натрия, переходя в раствор в виде гидроксида, а в остающемся твёрдом каркасе стекла место катионов натрия замещают атомы водорода в составе силанольных групп:
22
В основе получения и эксплуатации строительных материалов лежат фи- зико-химические, химические явления и процессы, энергетическая сторона которых имеет первостепенное значение. Понимание и раскрытие их базируется на фундаментальных законах и представлениях химии.
Характерная особенность строительства в последние годы – это быстрое освоение и продуктивное использование всего нового, что появляется в химической науке.
1. Формирование и состав горных пород
Горные породы являются основным сырьём для получения таких материалов как: природный камень, неорганические вяжущие вещества, стёкла, керамические изделия, компоненты для бетонов и растворов, изделий из органических вяжущих и др.
Химический анализ толщи Земли до глубины 16 км показал присутствие элементов всей таблицы Д. И. Менделеева. Но есть преобладающие вещества и редкоземельные, которых в породах всего 10-15%. Преобладают такие элементы как: кислород – 47%, кремний – 27,6%, алюминий – 8,8%, железо –
5,1%, кальций – 3,6%, натрий – 2,64%, калий – 2,6%, титан – 0,6%, – осталь-
ных ещё меньше, а всего их 92,2% от массы Земли. Эти элементы в чистом виде в природе не существуют, они составляют всё многообразие минералов, окислов, солей, простых веществ.
Минералом называют природное химическое соединение, однородное по химическому составу и физическим свойствам, возникшее в результате определённых физико-химических процессов, протекающих в земной коре.
По своему происхождению минералы бывают неорганогенные (из расплавленной магмы, растворов, паров, газов) и органогенные, образовавшиеся в результате отмирания различных растительных и животных организмов. По агрегатному или фазовому состоянию минералы могут быть твёрдыми (кварц, полевой шпат, слюда, и т. д.), жидкими (нефть, вода, самородная ртуть), газообразными (СО2). Минеральные тела могут находиться в коллоидальном состоянии, в котором частицы имеют ультрамикроскопические размеры – меньше 0,00001 мм. Большинство твёрдых минералов, образовавшихся из раскалённой магмы при медленном остывании под давлением, имеют кристаллическую структуру (кварц, полевой шпат, гематит, корунд). Если росту кристаллов не препятствуют соседние кристаллы, то они приобретают правильную форму: кубическую, ромбическую, октаэдрическую и т. д.
7
Другие образующие минералы остывали у поверхности земли под воздушными потоками или осаждались из воды, в результате чего сформировалась аморфная структура (вулканическое стекло, пемза, опал). Если разная структура (кристаллическая или аморфная), то у минералов будут разные свойства, даже если их химический состав одинаков.
Изверженные (магматические) горные породы образовались из магмы – расплавленной силикатной массы, содержащей пары воды и газы. Её главными составными частями являются: двуокись кремния SiO2 и оксиды алюминия Al2O3, железа Fe2O3, кальция CaO, магния MgO, натрия Na2O, калия K2O.
Растворяясь в воде и взаимодействуя с кислотами, они образуют многочисленный класс силикатов и алюмосиликатов, составляющих 85 весовых процентов земной коры. Таким путём и при остывании раскалённой магмы сформировались минералы, переходящие почти без изменений из магматических в осадочные породы, а затем в метаморфические. Это породообразующие минералы, названные так за их химическую и физическую стойкость: кварц, железо-магнезиальные силикаты (роговая обманка и др.), безводные алюмосиликаты (полевые шпаты), водные алюмосиликаты (слюды). Они образуют основной состав (с добавлением в долях процента других оксидов) гранитов, базальтов, диоритов и других минералов изверженных пород.
Находясь на поверхности земли, изверженные породы под воздействием влаги, газов и других факторов с течением времени покрываются мельчайшими трещинами, разрыхляющими верхние слои породы. Со временем камень начинает «шелушиться». Этот процесс называется выветриванием. В зависимости от условий граниты разрушаются через сотни и даже тысячи лет. В результате, породообразующие минералы после физического и химического выветривания изверженной породы появляются в осадочных породах: полевые шпаты, кварцевый песок, и другие.
Самым распространённым на Земле является минерал полевой шпат, состоящий из трёх соединений: ортоклаз – K2O ·Al2O3 ·6SiO2, альбит – Na2O ·Al2O3 ·6SiO2, анортит – СaO ·Al2O3 ·2SiO2. По сравнению с другими породообразующими минералами полевые шпаты наиболее химически неустойчивы. Они содержат в своём составе щелочные оксиды, которые при воздействии углекислоты превращают алюмосиликаты в водные соединения типа каолинита (Al2O3 ·mSiO2 ·nH2O) – основного породообразующего минерала глин, а также в аморфныйкремнезём(частичнокварц) иуглекислыйкалий(карбонаты):
K2Al2Si6O16 + CO2 + 2H2O = H2Al2Si2O8 · H2O + 4SiO2 + K2CO3.
8
Стекло.
Формование стеклоизделий осуществляют на специальных стеклоформующих машинах с использованием различных методов. Толстое листовое стекло формуют прокатом; оконное листовое стекло, трубы, стекловолокно – вытягиванием; стеклянная посуда, тара – прессованием; сортовая посуда, узкогорлая тара – выдуванием. Для производства высококачественного листового стекла применяют флоат-процесс, при котором расплавленную стекломассу разливают на поверхностьрасплавленного олова. Плотностьстеклаболеечемвдваразанижеплотности раскалённого олова: стекломасса растекается по его поверхности, образуя абсолютно плоский слой любой толщины. Слой стекла охлаждают, отверждают, извлекают споверхностиолова. Приэтомоловоостаётся жидким.
Для получения стёкол с особыми свойствами в состав шихты вводят неорганические добавки, которые в расплавленной стекломассе растворяются и входят в его структуру. Их делят на стеклообразующие и модифицирующие. К
стеклообразующим относят: B2O3, Al2O3, P2O5, As2O5, V2O5 и др. В структуре стекла атомы кремния замещают модифицирующие атомы металлов: K2O, MgO, BaO, ZnO, PbO и др. Каждый оксид изменяет свойства стекла: оксиды бора, алюминия и цинка повышают химическую стойкость стекла, оксиды алюминия и магния – прочность и термостойкость, оксиды фосфора, свинца, бария и цинка снижают температуру размягчения стекла, оксиды свинца и бария ещё повышают его коэффициент преломления (в хрустале).
Стекло, состоящее из двух компонентов: 75% SiO2 и 25% Na2O, применять почти невозможно из-за малой химической устойчивости, оно растворяется в воде. Такой состав идёт для изготовления жидкого стекла. Для производства строительных стёкол и улучшения физико-химических свойств в состав сырьевой смеси вводят до 4% оксида магния (в виде доломита) и до 2% оксида алюминия (в виде полевых шпатов, каолина). Вводят не все перечисленные стеклообразующие вещества разом, а в зависимости от назначения стекла. Например: введение в состав стекломассы трёхокиси мышьяка As2O3, селитры, сульфата натрия, хлорида натрия, окиси сурьмы значительно увеличивает прозрачность стекла. В их присутствии закись железа переходит в окись, менее окрашивающую стекломассу. Бор облегчает прохождение ультрафиолетовых лучей сквозь стекло – это увиолевое стекло, а окись церия их задерживает. Такое стекло необходимо для библиотек, витрин магазинов.
Высокоотражающие стёкла получают нанесением на поверхность стекла тонких плёнок металлов (Fe, Ni, Gr) или оксидов (NiO2, Cо3O4, Al2O3 + ZnO). Многие оксиды придают стеклу окраску. Например: Gr2O3, FeO + Fe2O3 – зелё-
21
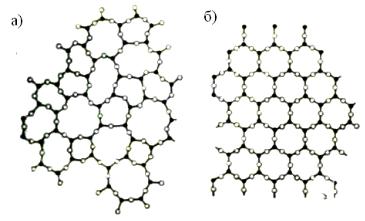
Аморфное состояние твёрдых тел отличается от кристаллического неполной упорядоченностью структуры – отсутствием в ней дальнего порядка (рис. 3).
Внутри аморфной структуры выделяют стеклообразное состояние, которое относят к твёрдым аморфным материалам, получаемым глубоким переохлаждением жидкостей. Застывая, получается стекло с характерными свойствами аморфных тел: изотропией, отсутствием определённой точки плавления, прозрачностью. По своей структуре стёкла ближе к жидкостям. Если их не поризуют, то они плотны. Структурные различия между стеклообразным и кристаллическим состояниями вещества с ковалентной решёткой демонстрирует рисунок 3, где показано строение кристаллического истеклообразногокремнезёма.
Рис. 3 – Схема строения аморфной (а) и кристаллической (б) структуры [2]
В стеклообразном кремнезёме относительно небольшое изменение части валентных углов между связями Si-O-Si приводит к заметному искажению последовательности соединения кремнекислородных тетраэдров. Вместо правильных шестиугольных «окон» в слое получается набор несимметричных «окон» с количеством атомов кремния от 4 до 8.
Практически любая жидкость (даже вода) может быть переведена в стеклообразное состояние при достаточно быстром охлаждении. Например, при скорости охлаждения 105-107 градусов в секунду многие металлические сплавы могут быть получены в стеклообразном состоянии (металлические стёкла или аморфные металлы).
20
Происходит каолинизация и карбонизация минералов, т. е. кремневая кислота в силикатах замещается угольной кислотой с образованием карбонатов. Из карбонатов породообразующим минералом в осадочных породах является и чаще встречается кальцит (известковый шпат) СаСО3. Реже встречается магнезит – МgСО3 и доломит – CaMg(CO3)2. В чистой воде, не содержащей углекислоту, кальцит растворяется в небольшом количестве (0,03 г на литр воды); магнезит практически не растворяется. Если вода содержит углекислоту, кальцит растворяется легко с образованием кислого углекислого кальция, хорошо растворимого в воде – Са(НСО3)2.
В природе известняки разрушаются под действием грунтовых вод, содержащих углекислоту, образующуюся при разрушении органических остатков. Таким же путём может разрушаться бетон, омываемый грунтовыми водами. Растворимость известняка ещё более увеличивается под воздействием сульфатов и хлоридов, а карбонаты, растворённые в воде, уменьшают её. Матовая поверхность известняка обусловлена высоким содержанием магния, а кристаллический блеск – наличием большого количества кристаллического кремнезёма – кремния. Если в известняках содержатся глины более 3-4%, то морозостойкость и водостойкость их снижаются, так как глины чрезвычайно влагоёмкий материал. Цвет известняков зависит от содержания в них углистых веществ, закисных соединений железа, пирита, оксидов железа и марганца.
Сульфиды (пирит FeS2) под воздействием кислорода и атмосферной влаги легко разрушаются. В процессе окислительно-восстановительной реакции образуются сернокислые газы, воздействующие разрушительно на другие минералы. Образующаяся серная кислота взаимодействует с большинством минералов и горных пород.
Так карбонаты превращаются в сульфаты:
CaCO3 + H2SO4 = CaSO4 + H2O + CO2.
Вода является основным агентом химического выветривания. Даже атмосферная вода содержит в себе в растворённом состоянии некоторое количество углекислоты, кислорода и становится сильным растворителем. Действие усиливает грунтовая вода, которая может содержать органические кислоты, карбонаты, сульфаты за счёт разложения растительных остатков и некоторых минералов. Под воздействием этих факторов происходит растворение, восстановление и гидратация (внедрениемолекулводывкристаллическуюрешётку) минералов.
Гидратация превращает сернокислый ангидрит в гипсовый камень:
CaSO4 + 2H2O → CaSO4 · 2H2O.
9
Процесс сопровождается увеличением объёма породы приблизительно
в1,5 раза и разрыхлением. Образовавшийся гипсовый камень имеет слабую твёрдость, по шкале Мооса – всего 2.
Из полевых шпатов образуются водные силикаты, из железомагнезиальных минералов – хлориты, ангидриты, переходящие в гипсовый камень. Появляются растворимые вещества: сульфаты, карбонаты, хлориды и нерастворимый остаток из водных окислов и силикатов, смешанных с устойчивыми породообразующими минералами: кварцем, цирконом, рутилом, эпидотом и др. Эти нерастворимые остатки являются основными компонентами глин и входят в состав песков.
Из растворимых веществ выносятся водой СаО и МgО, они поглощаются живыми организмами, образуя панцирь или раковину, остов водного растения. Кремнезём, переработанный морскими организмами, превращается в диатомиты, трепелы. Так формируются органогенные минералы, отложения химических осадков. Растворённый SiO2 в виде коллоида уносится водой и также усваивается морскими микроорганизмами. Часть растворённого кварца заполняет трещины в породах, высыхая образует кремень, который постепенно, цементируя рыхлые осадки, превращает их в конгломераты, песчаники, брекчии. Наиболее крепкими природными «цементами» являются кремнистый (кварц, опал или халцедон) и железистый растворы после испарения влаги. Известковый природный «цемент» менее прочен, ещё слабее гипсовые соединения и глиняная связка.
Химический состав осадочных пород имеет те же оксиды: в песчаниках преобладает SiO2 – до 78,33%, Al2O3 – до 4,77%; в глинистых породах – SiO2 содержится до 58,1%, Al2O3 – до 50%, железистых оксидов – до 6,47%, К2О – до 3,24%,
СаО– до3,11%, визвестняках кальцита– до42,6%, SiO2 – до5,2%, MgO – до7,9%.
Особую группу осадочных пород составляют органогенные углеродистые породы в виде твёрдых (угли, горючие сланцы), жидких (нефть) и газообразных веществ (метан). Эти горючие породы образовались при отсутствии кислорода
врезультате жизнедеятельности как растительных, так и животных организмов. В зависимости от стадии изменения различают: угли бурые, каменные и антрацит. Порода, состоящая из не полностью перегнивших растительных остатков, носит название торф.
Осадочные и изверженные породы, попадая в условия высокой температуры и давления, воздействия газов или растворов, просачивающихся в глубине, подвергаются метаморфизму, когда может измениться не только структура, но и минеральный состав породы. Формируются слоистые структуры – силика-
10
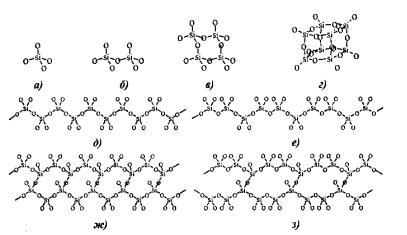
Рис. 2 – Примеры строения силикатов [2]:
а) ортосилика;, б) диортосиликат; в) циклотетрасиликат; г) бициклооктосиликат;
д) пироксеновая цепочк; е) волластонитовая цепочка; ж) амфиболовая лента; з) ксонотлитовая лента
Другой способ перевода кремнезёма в раствор состоит в сплавлении его со щёлочными карбонатами, из которых при высокой температуре выделяется углекислый газ:
SiO2 + Na2CO3 = Na2SiO3 + CO2.
Этот процесс широко используется в промышленности для получения си-
ликатного стекла.
Суммарный процесс образования обычного стекла может быть выражен уравнением:
Na2CO3 + 6SiO2 + CaCO3 = Na2O · CaO · 6SiO2 + 2CO2.
Если бы стекло варилось только из двуокиси кремния, то его производство потребовало бы высоких температур, так как температура плавления двуокиси кремния выше 1700°С. Для понижения температуры плавления в сырьевую смесь вводят соду или сульфат натрия.
Алюмосиликаты – это силикаты, в которых часть атомов кремния в тетраэдрах SiO4 замещена на атомы алюминия. Так как алюминий трёхвалентен, а кремний четырёхвалентен, в их структурах появляются дополнительные катионы металлов: Na+, K+, Mg2+ или Ca2+. С такой заменой в природе образовались полевые шпаты, которые входят в состав многих горных пород.
19
