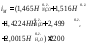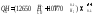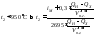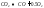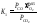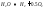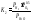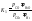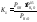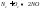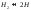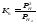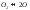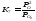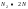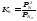- •1.Горючая система. Осн. И доп. Компоненты.
- •2. Процессы, происходящие в гс.
- •3.Агрегатные состояния горючих веществ и окислителя.
- •4. Гетерогенная и гомогенная гс.
- •5. Диффузная и кинетическая гс.
- •6. Организованное и неорганизованное горение.
- •7. Классификация техногенных веществ, участвующих в горении.
- •8. Количественное представление о составе горючих веществ и окислителя.
- •9.Органическиё, сухой и горючий состав горючего вещества
- •10.Пересчет количества компонента от одного состава к другому.
- •11. Теплота сгорания. Высшая и низшая точка. Их соотношение
- •12. Определение теплоты сгорания вещества
- •13. Определение теплоты сгорания газовой смеси
- •14. Определение теплоты сгорания сложного вещества
- •15. Определение расхода окислителя
- •16. Определение состава продуктов горения
- •17. Тепловой баланс
- •18. Адиабатическая температура горения
- •19.Химическое равновесие в реакциях горения
- •20.Диссоциация продуктов горения
- •23.Цепная реакция
- •24.Цепная неразветвлённая реакция
- •25.Цепная разветвлённая реакция
- •26.Самовоспламенение. Термические условия
- •27.Нижний и верхний пределы самовоспламенения
- •28.Адиабатическое самовоспламенение
- •29.Температура самовоспламенения. Зависимость от условий
- •35.Экспериментальная скорость распространения пламени.
- •36. Определение нижнего концентрационного предела распространения пламени
- •37.Классификация горючих газов
19.Химическое равновесие в реакциях горения
В действительности даже в стехеометрической смеси превращение исходных веществ в конечное никогда не может пройти до полного преобразования исходных веществ. По достижении определенных определенных условий становится значимым обратный процесс превращения конечных веществ в исходное, возникает динамическое равновесие прямого и обратного химического превращения.
Любая
хим реакция явл-ся обратимой. Наряду с
прямой реакцией
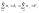 ,
протекающей со скоростью
,
протекающей со скоростью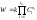
Идет
обратная реакция
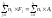 ,
протекающей со скоростью:
,
протекающей со скоростью: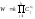 .
.
Если в каком-либо процессе скорости прямой и обратной реакции сравниваются, то дальнейшего изменения состава смеси не происходит и система приходит к состоянию динам рав-сия. Для равновесных концентраций исходных вещ-в и продуктов реакции хар-но след-ее соот-ие:
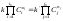
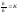 ,
К- константа равновесия. Данное уравнение
представляет собой один из вариантов
записи закона действующих масс.
,
К- константа равновесия. Данное уравнение
представляет собой один из вариантов
записи закона действующих масс.
20.Диссоциация продуктов горения
Если взять за основу понятие динам.равновесия, то состав продуктов равновесного горения в отличии от от стехиометр.полного горения опр-ся процессами диссоциации.
СО2 - СО+0,5О2
k = Р co *Рo20,5/ Рco2
Р- парц.давление в горюч.системе
Химическое превращение конечных веществ в исходные часто называют диссоциацией продуктов горения.
Область применения продуктов горения
Отсутствие диссоциации
Слабая диссоциация
Сильная диссоциация
Область применения продуктов горения.
|
Дав-ие кПа |
Температура, 0С | |||
|
Отсут-ие диссоц-и |
Слабая диссоц-я |
Сильная диссоц-ия | ||
|
10-500 |
< 1300 |
1300-2100 |
> 2100 | |
|
500-2500 |
< 1500 |
150-2300 |
> 2300 | |
|
|
Образ-ся продукты горения |
Пламя состоит из атомов | ||
Определение констант равновесия
Если в каком-либо процессе скорости прямой и обратной реакции сравниваются, то дальнейшего изменения состава смеси не происходит и система приходит к состоянию динам рав-сия. Для равновесных концентраций исходных вещ-в и продуктов реакции хар-но след-ее соот-ие:
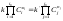
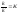 ,
,
К- константа равновесия. Данное уравнение представляет собой один из вариантов записи закона действующих масс.
Константы равновесия для многих реакций определены и приводятся в термодинамических таблицах, описывающих свойства отдельных веществ.
Пример: Ур-ние реакции диссоц. Ф-ла const равновесия
СО2 = СО+0,5О 2 k1= Pco * Po20,5/ Pco2
H2 O = H2 +0,5O2 k2= PH2 * PO20,5 / PH2O
H2 = 2H k3= PH2 / PH2
Состав продуктов равновесного горения
Чтобы рассчитать состав продуктов равновесного горения,нужно решить систему Ур-ний, включ.в себя:
- Ур-ние констант равновес.реакций диссоц.
- Ур-ние баланса хим. Элементов
- Ур-ние общего кол-ва продуктов горения.
|
№ |
Уравнение реакций диссоциации. |
Формула констант равновесия. |
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
|
6 |
|
|
|
7 |
|
|
|
8 |
|
|
Расчёт неполного горения
Расчет сводится к следующему:
проводится расчет стехеометрически полного горения 1 м3 горючего газа при α=1, при этом вычисляются значения О1, L1, H2Oα=1, CO2α=1
удельное количество углекислого газа при α<1 определяется из выражения

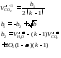
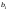 ,
,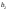 -вспомогательные
величины;k-константа
равновесия реакции водяного газа
-вспомогательные
величины;k-константа
равновесия реакции водяного газа
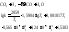
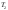 -температура
горения в Кельвинах, может быть
приблизительно определена при помощи
следующего выражения
-температура
горения в Кельвинах, может быть
приблизительно определена при помощи
следующего выражения
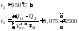
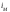 -энтальпия
продуктов горения при 200
-энтальпия
продуктов горения при 200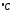 ;
; -тепловая
энтальпия горючих веществ в продуктах
сгорания
-тепловая
энтальпия горючих веществ в продуктах
сгорания