
- •1.Горючая система. Осн. И доп. Компоненты.
- •2. Процессы, происходящие в гс.
- •3.Агрегатные состояния горючих веществ и окислителя.
- •4. Гетерогенная и гомогенная гс.
- •5. Диффузная и кинетическая гс.
- •6. Организованное и неорганизованное горение.
- •7. Классификация техногенных веществ, участвующих в горении.
- •8. Количественное представление о составе горючих веществ и окислителя.
- •9.Органическиё, сухой и горючий состав горючего вещества
- •10.Пересчет количества компонента от одного состава к другому.
- •11. Теплота сгорания. Высшая и низшая точка. Их соотношение
- •12. Определение теплоты сгорания вещества
- •13. Определение теплоты сгорания газовой смеси
- •14. Определение теплоты сгорания сложного вещества
- •15. Определение расхода окислителя
- •16. Определение состава продуктов горения
- •17. Тепловой баланс
- •18. Адиабатическая температура горения
- •19.Химическое равновесие в реакциях горения
- •20.Диссоциация продуктов горения
- •23.Цепная реакция
- •24.Цепная неразветвлённая реакция
- •25.Цепная разветвлённая реакция
- •26.Самовоспламенение. Термические условия
- •27.Нижний и верхний пределы самовоспламенения
- •28.Адиабатическое самовоспламенение
- •29.Температура самовоспламенения. Зависимость от условий
- •35.Экспериментальная скорость распространения пламени.
- •36. Определение нижнего концентрационного предела распространения пламени
- •37.Классификация горючих газов
16. Определение состава продуктов горения
Состав продуктов горения горючего вещества определяется:
Термобарическими условиями в горючей системе (Т, Р)
Соотношением горючего и окислителя
Условиями теплового взаимодействия горючего с окружающей средой
Интенсивностью физико-химических процессов в горючей системе
Для расчета состава продуктов горения составляется система уравнений, в которую входят уравнения материальных балансов химических элементов, участвующих во взаимодействиях при горении, и уравнения констант равновесия или констант скоростей химических реакций.
В общем случае система уравнений отличается повышенной сложностью; решение задачи в указанной постановке получено лишь для частных случаев, например, для стехиометрич. системы горения
Методика расчета стехиометр. полного горения является приближенной, т.к. не учитывает кинетики физико-химических процессов в горюч. системе.
17. Тепловой баланс
Тепловые условия в горючей системе описываются по средствам пространственно-временных температур. бал.
Уравнение теплового баланса адиабатически изолированой Г.С. стехиометрического состава, слагаемые которой отнесены к единичному количеству горючего вещества:
 ,
,
где iг - энтальпия горючего вещества
iB - энтальпия воздуха
L - удельный стехиометрический расход воздуха
i п.г. - энтальпия продуктов горения
Vп.г. - удельное количество продуктов горения
Qн - низшая теплота сгорания.
Энтальпия компонентов Г.С.: i = c(t)t;
t - средняя температура компонентов Г.С., взятая при постоянном давлении
c(t) - теплоемкость компонента горючей системы, как функция средн. температуры
18. Адиабатическая температура горения
Адиабатическая
температура в зависимости от энтальпии:
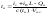
Адиабатическая температура горения - есть средняя температура продуктов стехиометрического полного горения, получаемая из уравнения теплового баланса горючей системы при условии, что вся энергия исходных компонентов преобразована а тепловую энергию продуктов горения.
Если
iг
= 0, iB
= 0; то

Знак “-“ говорит о том, что идет процесс обратный с точки зрения накопления химических связей.
Горючая
система не стехиометрического состава,
обменив-ся тепловой энергией с окружающей
средой средней температурой горения:
 ,
,
Qп - потеря тепловой энергии из горючей системы в окружающую среду.
Qх - химический недожог, вызванный нестехиометричностью горения
Vαп.г.- удельное количество продуктов горения при нестехиометрических условиях горения
Скорость реакции горения
Скорость
химической реакции
горения
определяется числом молекул, реагирующих
веществ в рассматривающем объеме за
единицу времени.
W - скорость химической реакции
Ni - число молекул i -го исходного вещества в момент времени t.
Nj - число молекул j -го конечного вещества в момент времени t.
V - объем г.с. (стехиом. сост. изолир. системы)
Условие
сохранения элементарного состава: ,
,
где miK - число атомов К-го элемента в i -ой молекул
Вк - общее число атомов в горючей системе
 где
где
W - скорость химической реакции
ni, nj - стехиометрический коэффициент
Если объем системы не меняется в ходе реакции, то скорость определяется производной объемной концентрации во времени

сi ,сj - объемные концентрации веществ
Если реакция происходит в результате соударения молекул двух веществ А1 и А2, то такая реакция - бимолекулярная:
 ,
,
где с - концентрация исходного вещ-ва А1, А2
к - константа скорости реакции. Константа скорости реакции зависит от температуры и учитывает то, что не каждое столкновение реакционно-способных молекул веществ А1 и А2 привод. к образованию новых молекул, т.е. хим реакций.
Экспериментальное определение скорости химической реакции состоит в измерении концентрации какого-либо реагирующего вещества и в дифференцир. в зависимости концентр. от времени.
