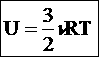- •Основное уравнение динамики вращательного движения
- •Гармоническое колебание
- •Распределение энергии молекул по степеням свободы
- •Теплоемкость газов
- •Цикл Карно
- •Описание цикла Карно
- •Кпд тепловой машины Карно
- •Первая и вторая теоремы Карно
- •Связь между обратимостью цикла и кпд
- •Энтропия
- •Начала термодинамики
- •Смысл энтропии
- •Закон теплопроводности Фурье
Распределение энергии молекул по степеням свободы
|
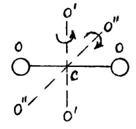
Большинство химических веществ состоит из многоатомных молекул. Если рассматривать газообразное состояние вещества, то при столкновениях молекул тепловая энергия газа случайным образом расходуется на изменение кинетических энергий поступательного и вращательного движений молекул, а также на возбуждение колебаний атомов в молекуле. Естественно предположить, что указанные движения в молекуле могут происходить одновременно. Важнейшим в теории является решение задачи нахождения закона распределения полной энергии газа по этим трем видам движения молекул. Чтобы найти среднюю энергию молекулы, приходящуюся на все виды ее движения, сначала выясняют, каким числом степеней свободы обладает данная молекула, и далее, – какая энергия приходится в среднем на одну степень свободы. Число степеней свободы i молекулы равно количеству независимых координат, определяющих ее положение относительно выбранной системы координат.
Если
рассматривать атомы как бесструктурные
точки, то одноатомные молекулы могут
иметь только энергию поступательного
движения. Число степеней свободы
каждой такой точки iпост =
3 (три декартовы координаты x, y, z или
три сферические
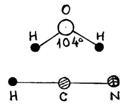
Двухатомную
молекулу представим как систему,
состоящую из двух материальных точек.
Если расстояние r между атомами в
молекуле не изменяется (атомы в молекуле
не колеблются и с увеличением частоты
вращения молекула не растягивается),
то число степеней свободы равно пяти.
В самом деле, если расстояние между
атомами
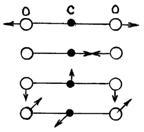
Вращение
молекулы вокруг оси ОО не учитывают,
так как энергия этого вращения
значительно меньше двух других (из-за
малости моментов инерции атомов).
Поэтому у двухатомной молекулы две
вращательные степени свободы, т. е.
Если
число атомов в молекуле
В линейных молекулах, в отличие от нелинейных, атомы расположены вдоль одной прямой. Поэтому жесткая линейная молекула содержит столько же степеней свободы, сколько имеет жесткая двухатомная, т. е. пять. Нелинейная жесткая молекула, очевидно, имеет, как и твердое тело, шесть степеней свободы.
Нелинейные
молекулы имеют 3n – 6 колебательных
степеней свободы, так как из общего
числа 3n степеней свободы три относятся
к поступательному и три к вращательному
движению. У линейной молекулы существуют
две степени свободы вращательного и
три поступательного движения, поэтому
для нее число колебательных степеней
свободы Два нижних колебания вырождены, т. е. имеют одинаковую частоту.
|
Внутренняя энергия. 1-й закон термодинамики.
|
Внутренняя энергия 1-й закон термодинамики. | |
|
Сумма кинетических энергий хаотического движения всех частиц тела относительно центра масс тела (молекул, атомов) и потенциальных энергий их взаимодействия друг с другом называется внутренней энергией. |
|
|
Внимание!
Кинетическая энергия частиц определяется скоростью, а значит - температурой тела. Потенциальная - расстоянием между частицами, а значит - объемом. Следовательно: U=U(T,V) - внутренняя энергия зависит от объема и температуры.
|
U=U(T,V) |
|
Для
идеального газа: U=U(T),
т.к. взаимодействием на расстоянии
пренебрегаем. - внутренняя энергия идеального одноатомного газа. Внутренняя энергия - однозначная функция состояния (с точностью до произвольной постоянной) и в замкнутой системе сохраняется. Обратное неверно(!) - одной и той же энергии могут соответствовать разные состояния. |
Идеальный газ:
|
|
Опыты Джоуля доказали эквивалентность работы и количества теплоты, т.е. и та и другая величины являются мерой изменения энергии, их можно измерять в одинаковых единицах: 1 кал = 4,1868 Дж ≈ 4,2 Дж. Эта величина наз. механическим эквивалентом теплоты. |
|
|
Р.Майер, Д.Джоуль, Г.Гельмгольц - закон сохранения энергии для тепловых процессов - 1-й закон термодинамики. |
|
|
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе: |
|
|
Изменений внутренней энергии не зависит от способа, которым осуществляется этот переход. Т.о. существует два способа изменения внутренней энергии: совершение механической работы и теплопередача (теплообмен). Работа и количество теплоты характеризуют процесс изменения внутренней энергии, но не саму внутреннюю энергию. |
|
|
Если А - работа внешних сил, а А' - работа газа, то А = - А' (в соответствии с 3-м законом Ньютона). Тогда:
- другая форма записи первого закона термодинамики. Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами. |
|
|
Невозможность создания вечного двигателя 1-го рода. Вечный двигатель первого рода - устройство, которое могло бы совершать неограниченное количество работы без затраты энергии. Тогда Q=0. Следовательно: A'= - ΔU. Т.е. такой двигатель должен совершать работу за счет убыли внутренней энергии. Но ее запасы конечны. После того, как запас энергии будет исчерпан, двигатель остановится. |
|