
- •1. Коэффициенты проницаемости горной породы. Единицы измерения и методы их определения.
- •13 Гидраты природных газов и их влияние на процессы разработки месторождений.
- •2. Коэффициенты пористости пород. Единицы измерения и методы их определения.
- •3.Относительные фазовые проницаемости для двухфазных систем.
- •4.Зависимость коэффициентов пористости и проницаемости от давления.
- •5.Состав и св-ва природных газов.
- •6. Состав и св-ва нефтей.
- •7. Понятия упругости насыщенных паров углеводородов.
- •8. Коэффициент сверхсжимаемости реальных газов.
- •9. Уравнения состояния реальных газов
- •10. Критическое давление и температура. Приведенные параметры смеси.
- •11. Растворимость газа в жидкости. Закон Генри.
- •12.Классификация нефтей по структурно – механическим свойствам.
- •14.Движение нефти, газа и воды в пористой среде. Закон фильтрации Дарси.
- •15. Деформационные св-ва г.П. Сжимаемость коллекторов нефти и газа.
- •16. Деформация коллекторов при разработке нефтяных и газовых месторождений
- •17. Поверхностное натяжение на границе раздела фаз. Скачок капиллярного давления. Функция Леверетта.
- •18.Схема фазовых превращений индивидуальных компонентов углеводородов.
- •19. Схема фазовых превращений бинарной смеси углеводородов.
- •20. Особенности фазовых превращений газоконденсатных углеводородных систем.
9. Уравнения состояния реальных газов
Для определения многих физических св-в прир. газов исп-ся ур-ие состояния. Уров-ем состояния наз-ся арифмет-ая завис-ть между параметрами, описывающими поведение простого или сложного вещ-ва. В кач-ве таких пар-ов исп-ся P,V и Т. Для идеальных газов исп-ся след-ее ур-ие состояния Клайперона-Менделеева PV=MRT, где Р – давление, Па; V – объем, м3; М – масса газа,кг; Т – темп-ра, К; R – универсальная газовая постоянная, кДж/(кгК). Для описания поведения реальных газов в последнее вводят корректирующий множитель,называе6мый коэф-ом сверхсжимаемости z – PV=zMRT. Голландский физик Ван-дер-Вальс в 1879г. предложил учитывать собственный объем молекул газа и силы взаимного притятежения посредством введения дополнительных членов в уравнения К-М. (Р+а/V2)(V-b)=RT, где V – удельный объём газа; а/V2 – константа сцепления молекул; b – поправка на объём молекул. Это уравнения состояние удовлетворительно описывает поведение реальных газов лишь при давлениях до 10 МПа и температурах 283-293 К, но оно не может численно описывать поведение природных УВ-ых газов гомологического ряда метана. Дальнейший процесс науки и техники требовал разработки более точного уравнения состояния природных газов, способного правильно описывать поведение их при давлениях до 100 МПа и тем-рах до 573 К в процессах добычи газа и при давлениях до 20 МПа и низких тем-рах до 123-93 К в процессах переработки прир. газов. В решении этой проблемы выявилось два направления: 1) введение коэф. Z в ур-ие сост. идеал. газа учитывающего отклонение реального газа от идеального; 2) добавление в ур-ие сост. идеал. газа большого числа констант. Так появились уравнения состояния:
1)
Редлиха-Квонга:
![]() ,
где
,
где![]() ,
,![]()
2)
Пенга-Робинсона:
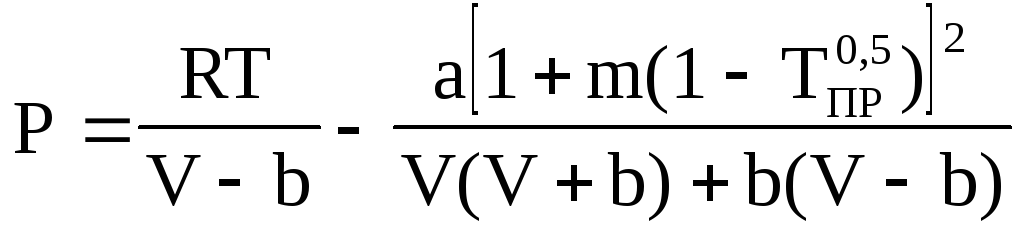 ,
,
где
![]() ,
,![]() .
.
Тпр=Т/Ткр; m=0,37+1,54ω-0,27ω2, ω – ацентрический фактор, учитывающий нецентральность сил взаимодействия м/у сложными молекулами
3) Бритти-Бриджмена (5 констант)
4) Бенедикта-Вебба-Рубина (8 пробел констант)
и т.д.
10. Критическое давление и температура. Приведенные параметры смеси.
Для однокомпонентных систем обе фазы (жидкость и пар) при данном объеме могут присутствовать только в том случае, если давление в паровой области равно ДНП при заданной температуре Т.
В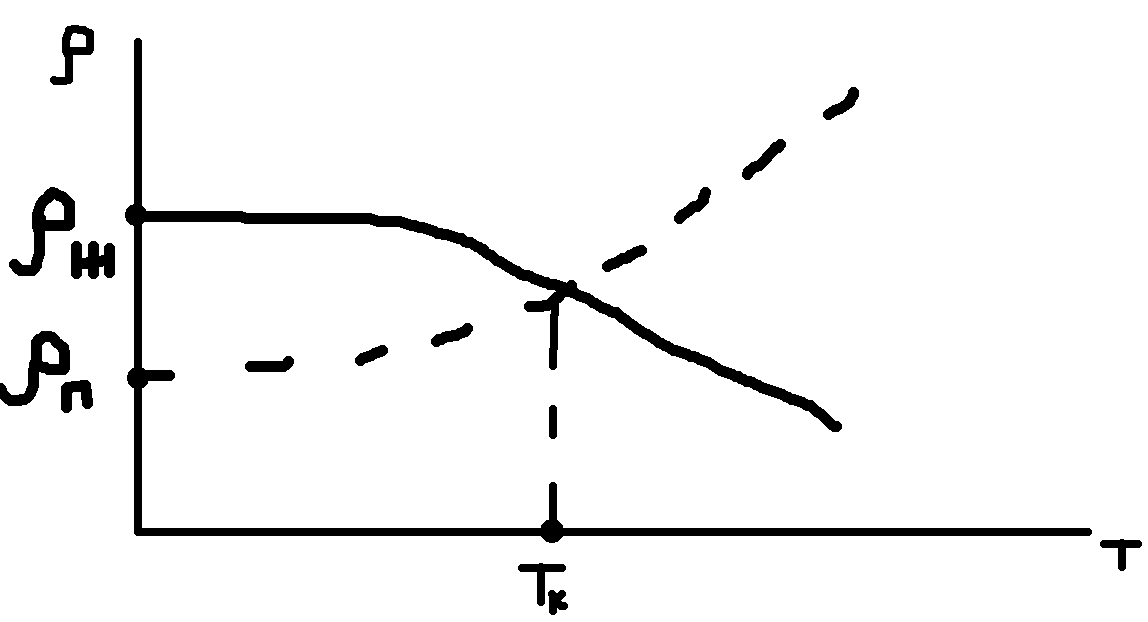 некоторый момент времени свойства
жидкости и пара становятся идентичны,
исчезает понятие фаза, и эта точка
называется критической.
некоторый момент времени свойства
жидкости и пара становятся идентичны,
исчезает понятие фаза, и эта точка
называется критической.
Пространственные диаграммы сложны, поэтому для простоты используются парные диаграммы состояния.
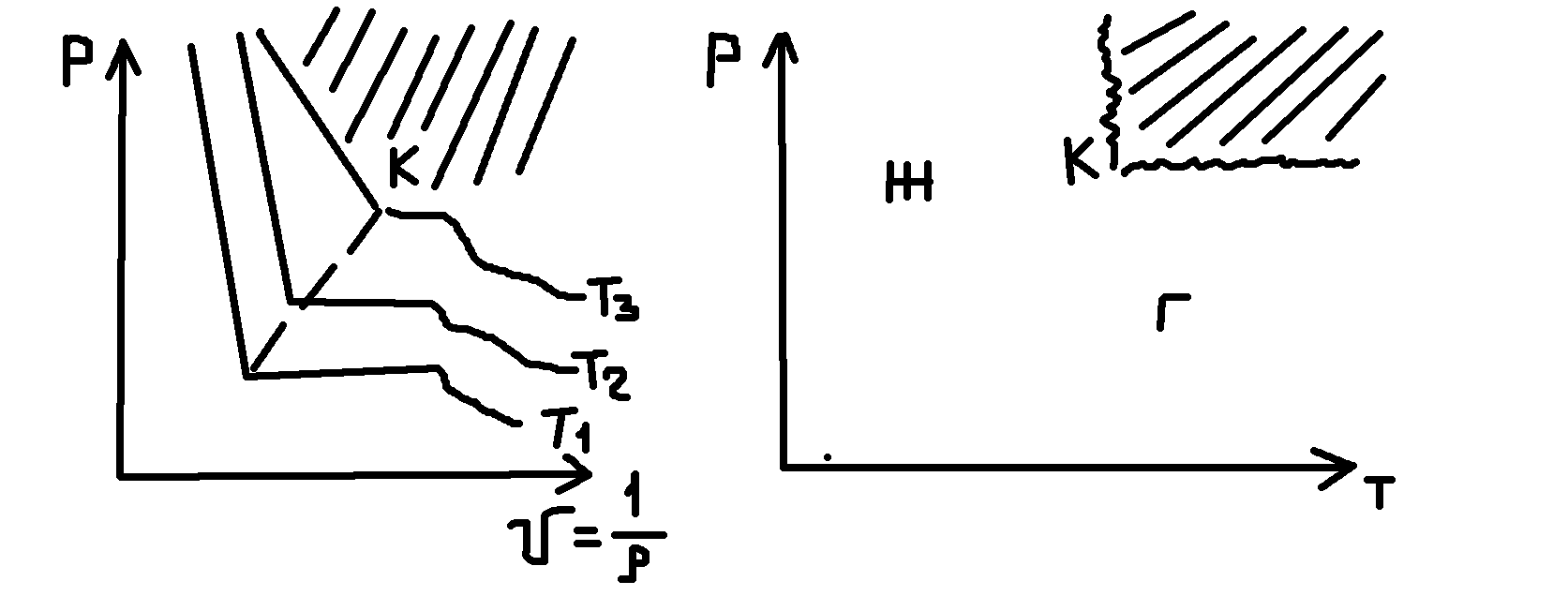
![]() -
закритическая область
-
закритическая область
υ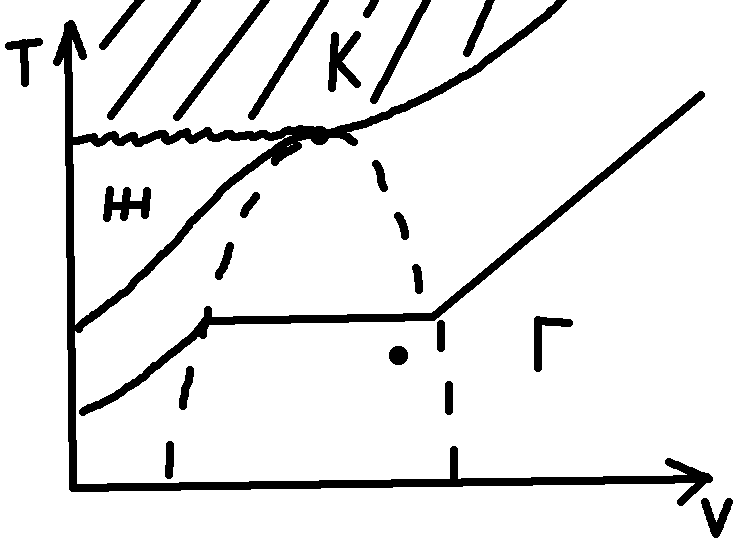 к
– тот максимальный объем, который может
иметь вещество в жидком состоянии.
к
– тот максимальный объем, который может
иметь вещество в жидком состоянии.
До открытия критической точки не понимали, почему из некоторых газов нельзя получить жидкость. Вывод: газ нужно охлаждать ниже Тк. Критическое состояние у всех индивидуальных веществ свои. Кристаллические (твердые) вещества принципиально отличаются от жидкостей и газов анизотропией.
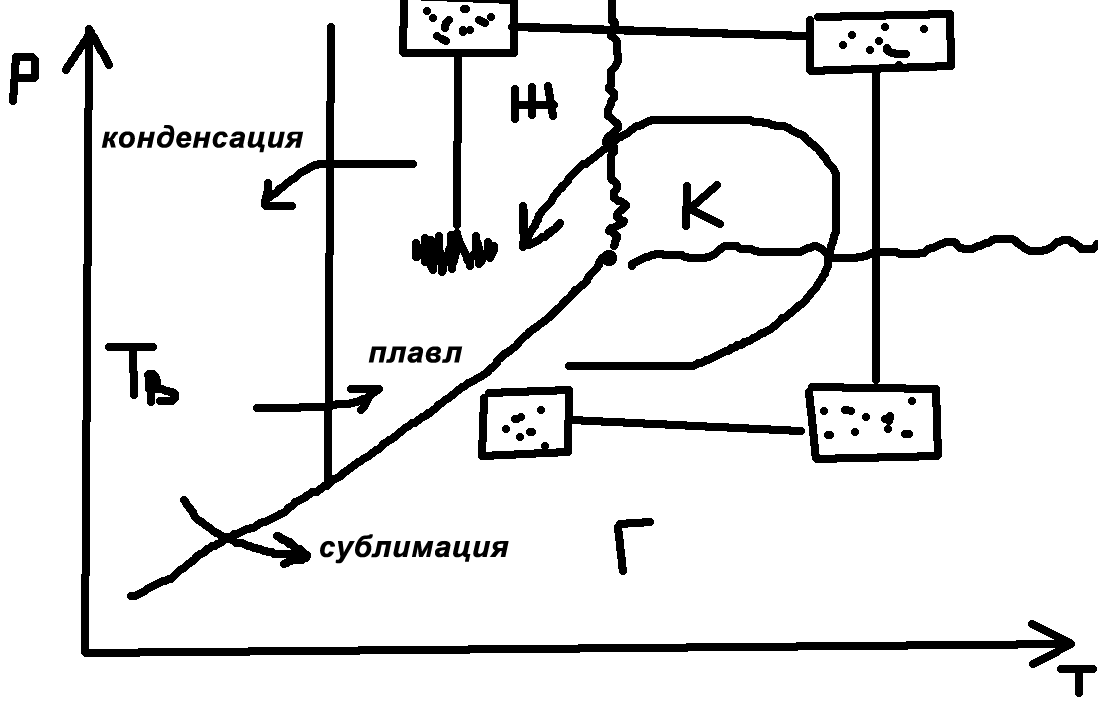
Наличие критической точки говорит, что нет принципиальных различий между газом и жидкостью.
Приведенные параметры смеси. В молекулярной физике описываются взаимодействия молекул иногда очень сложно построенных (особенно в случае многоатомных молекул). При таких сложных взаимодействиях для их описания и обозначения применяются методы термодинамического подобия. В основе метода лежат две идеи: 1)Описание явлений на основе масштабов, свойственных данному явлению или этой системе. Применение тех единиц измерения, которые задаются самой физической природой этой системы; 2)Следует из первой. Переход к использованию безразмерных, т.е. приведенных величин (если много систем, то сравнивать их можно только после обезразмеривания).
![]()
![]()
![]() ;
; ![]()
По смыслу параметр zк – критерий термодинамического подобия. Две углеводородные системы, у которых zк одинаков, будут термодинамически подобны.
Если
2 из 3 приведенных параметров (Тп,
Рп,
Vп)
для разных веществ совпадают, то 3 тоже
совпадает, а состояния этих веществ
будут соответственными. Но поскольку
![]() ,
то для термодинамически подобных
однокомпонентных систем состояние
можно определить только по двум
параметрам.
,
то для термодинамически подобных
однокомпонентных систем состояние
можно определить только по двум
параметрам.
![]()
zк – критерий термодинамического подобия
Для сложно построенных молекул силы взаимодействия этих молекул не действуют строго по линии, соединяющей центр молекул.
![]()
ω – ацентрический фактор
Для многокомпонентных систем закон соответственных состояний выполняется приближенно. Для смесей УВ газов приведенным параметром называется отношение действительного параметра к псевдопараметру.
![]()
В этих формулах любой критический параметр смеси находится чаще всего по правилу аддитивности Кэя. Здесь под аддитивностью понимается то, что суммарное свойство для смеси определяется как сумма произведений молярных долей каждого компонента смеси для данного свойства компонента.
![]() ;
; ![]()
