
- •Карагандинская государственная медицинская академия
- •Функции белков плазмы крови
- •Альбумины
- •Глобулины
- •Функции 1-глобулинов
- •Белки-ферменты плазмы крови.
- •Органические небелковые соединения плазмы
- •I группа - азотсодержащие небелковые компоненты
- •II группа - безазотистые органические вещества
- •Неорганические компоненты плазмы
- •Кислотно-основной баланс
- •Буферные системы плазмы
- •Система свертывания крови и фибринолиза.
- •Начальные стадии внешнего механизма.
- •Начальные стадии внутреннего механизма.
- •Биохимия форменных элементов крови
- •Эффект Бора
- •Патологические варианты гемоглобина
- •Защита эритроцитов от окислительного стресса
- •Гемолиз эритроцитов
- •Обмен железа
- •Медицинское значение
- •Приложение 1. Суперсемейство иммуноглобулинов
- •Приложение 2 Система комплемента
- •Приложение 3.Калликреин - кининовая система
- •Синтез гемоглобина
- •Распад гемоглобина
- •Образование пигментов желчи, кала и мочи.
Медицинское значение
Нормальные величины содержания гемоглобина: у мужчин 130-160 г/л; у женщин; 120-140 г/л.
Повышение концентрации гемоглобина: полицитемия, гемоконцентрация при дегитратации, ожогах, кишечной непроходимости, упорной рвоте; пребывание на больших высотах, чрезмерная физическая нагрузка или возбуждение; сердечно-сосудистая патология, обычно врожденная; некоторые заболевания легких, хроническое химическое воздействие нитритов, сульфонамидов, вызывающих образование мет- и сульфогемоглобина.
Повышение концентрации гемоглобина: - анемия
Приложение 1. Суперсемейство иммуноглобулинов
В работе иммунной системы огромную роль играют белки суперсемейства иммуноглобулинов, которое включает в себя 3 семейства белков: антитела (иммуноглобулины), рецепторы Т-лимфоцитов, белки главного комплекса гистосовместимости.
Все они имеют доменное строение, состоят из гомологичных иммуноподобных доменов и выполняют сходные функции — взаимодействуют с чужеродными структурами, либо растворенными в крови, лимфе или межклеточной жидкости (антитела), либо находящимися на поверхности клеток (собственных или чужеродных).
Антитела— специфические белки, вырабатываемые В-лимфоцитами в ответ на попадание в организм чужеродной структуры, называемой антигеном.
Особенности строения антител
1.Простейшие молекулы антител состоят из 4 полипептидных цепей: 2 идентичных легких — L,содержащих около 220 аминокислот и 2 идентичных тяжелых — Н, состоящих из 440-700 аминокислот. Все 4 цепи антитела соединены множеством нековалентных и 4 дисульфидными связями
2. Легкие цепи антителасостоят из 2 доменов: вариабельного (VC), находящегося на N-концевой области полипептидной цепи, и константного (CL), расположенного на С-конце.
3. Тяжелые цепиобычно имеют 4 домена: один вариабельный (VC), находящийся на N-конце, и 3 константных (CH1, CH2, CH3 ) (рис.7).
4.Каждый домен иммуноглобулина имеет-складчатую суперструктуру, в которой 2 остатка цистеина соединены дисульфидной связью.
5.Между 2 константными доменамиCH1 иCH2 имеется участок, содержащий большое количество остатков пролина, которые препятствуют формированию вторичной структуры и взаимодействию соседних Н-цепей на этом отрезке. Эта шарнирная область придает молекуле антитела гибкость.
6.Между вариабельными доменами тяжелых и легких цепей находятся 2 идентичных антигенсвязывающих участка, поэтому такие антитела часто называют бивалентами.
В связывании антигена с антителом участвует не вся аминокислотная последовательность вариабельных участков обеих цепей, а всего лишь 20—30 аминокислот, расположенных в гипервариабельных областях каждой цепи. Именно эти области определяют уникальную способность каждого вида антитела взаимодействовать с соответствующим комплементарным антигеном.
Антитела — одна из линий защиты организма против внедрившихся чужеродных организмов. Их функционирование можно разделить на два этапа:первый этап — узнавание и связывание антигенана поверхности чужеродных организмов, которые происходят благодаря наличию в структуре антитела антигенсвязывающих участков; второй этап— инициация процесса, благодаря которому антиген инактивируется и разрушается. Специфичность второго этапа зависит от класса антител.
Существует 5 классов тяжелых цепей,отличающихся по строению константных доменов:,,,,,в соответствии с которыми различают 5 классов иммуноглобулинов:A,D, Е,Gи М (рис 8).
Иммуноглобулины М
Иммуноглобулины М имеют две формы:
Мономерная форма— первый класс антител, продуцируемый развивающимся В-лимфоцитом. Впоследствии многие В-клетки переключаются на выработку других классов антител, но с тем же антигенсвязывающим участком.IgMвстраивается в мембрану и выполняет роль антигенраспознающего рецептора. Встраивание IgM в мембрану клеток возможно благодаря наличию в хвостовой части участка 25 гидрофобных аминокислотных остатков.
Секреторная форма IgMсодержит 5 мономерных субъединиц, связанных друг с другом дисульфидными связями и дополнительной полипептидной J-цепью.
Тяжелые цепи мономеров этой формы не содержат гидрофобной хвостовой части. Пентамер имеет 10 центров связывания с антигеном. Секреторная форма IgM — основной класс антител, секретируемых в кровь при первичном иммунном ответе.
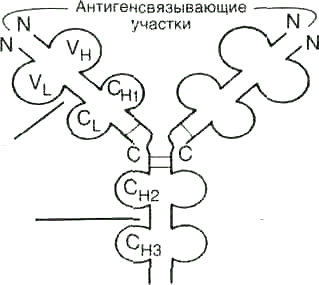
Рисунок 7. Доменное строение IgG
Иммуноглобулины G
В количественном отношении этот класс иммуноглобулинов доминирует в крови (75% от всех Ig).IgG— мономеры, основной класс антител, секретируемый в кровь при вторичном иммунном ответе. После взаимодействияIgGс поверхностными антигенами микроорганизмов комплекс антиген—антитело:
— способен связывать и активировать белки системы комплемента;
— может взаимодействовать со специфическими рецепторами макрофагов и нейтрофилов, что приводит к фагоцитозу комплексов антиген—антитело и разрушению их в фагосомах;
— IgG— единственный классIg, способный проникать через плацентарный барьер и обеспечивать внутриутробную защиту плода от инфекций.
Иммуноглобулины А
Основной класс антител, присутствующий в секретах (молоке, слюне, секретах дыхательных путей и кишечного тракта).IgAсекретируются в основном в димерной форме, где мономеры связаны друг с другом через дополнительную J-цепь.IgAне взаимодействуют с системой комплемента и фагоцитирующими клетками, но, связываясь с микроорганизмами антитела, препятствуют их присоединению к эпителиальным клеткам и проникновению в организм.
Иммуноглобулины Е
Иммуноглобулины Е представлены мономерами, в которых тяжелые -цепи содержат, так же как и- цепи,1 вариабельный и 4 константных домена.IgEпосле секреции связываются своими С-концевыми участками с соответствующими рецепторами на поверхности тучных клеток и базофилов. В результате они становятся рецепторами для антигенов на поверхности данных клеток (рис. 9).
После присоединения антигена к соответствующим антигенсвязывающим участкам IgE клетки получают сигнал к секреции биологически активных веществ (гистамина, серотонина), которые в большой мере ответственны за развитие воспалительной реакции и проявление таких аллергических реакций, как астма, крапивница, сенная лихорадка.
Связывание IgM с антигеном изменяет конформацию IgM и индуцирует связывание его с первым компонентом системы комплемента и активацию этой системы. Если антиген расположен на поверхности микроорганизма, система комплемента вызывает нарушение целостности клеточной мембраны и гибель бактериальной клетки.
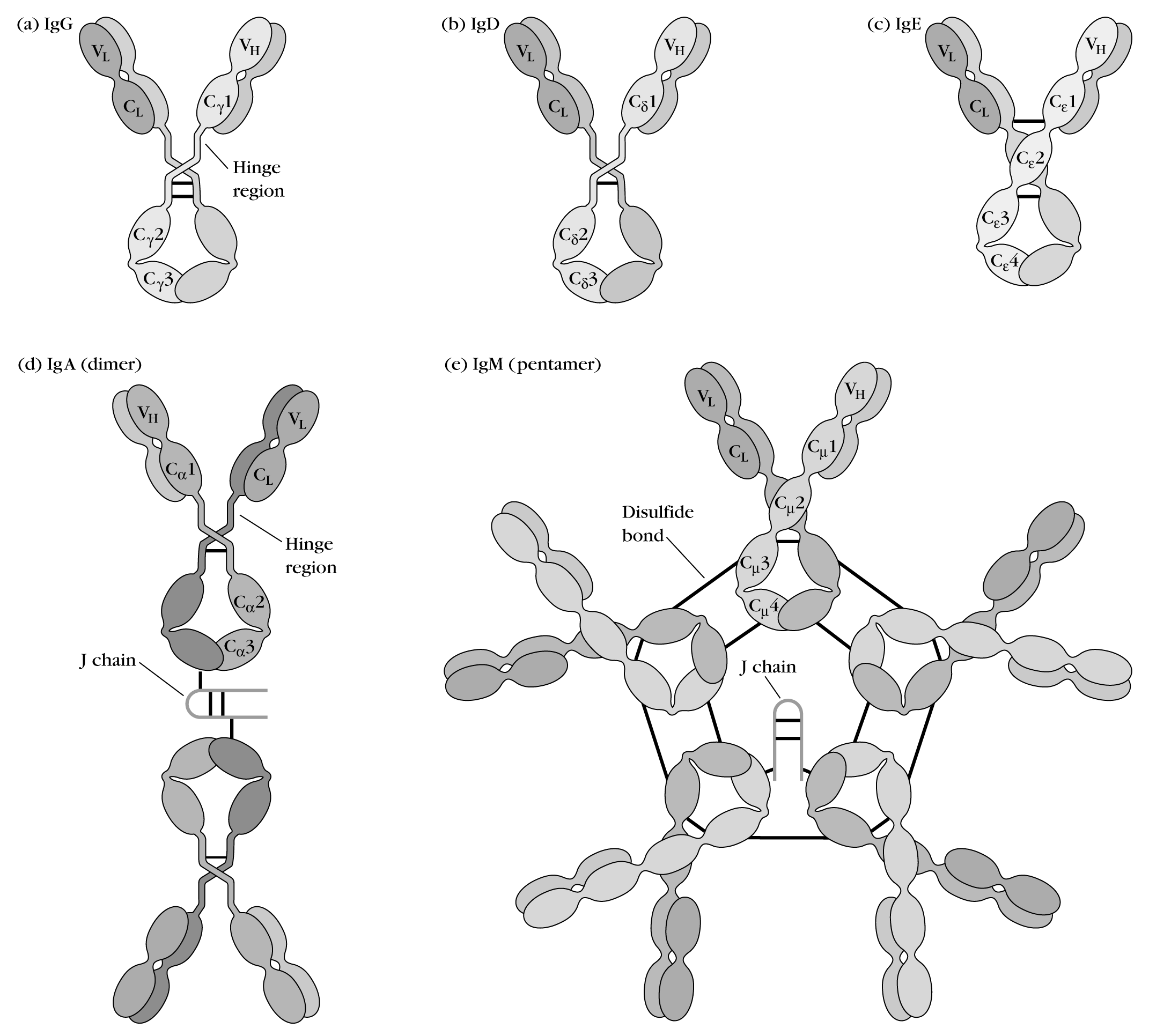
Рисунок 8. Строение иммуноглобулиновA,D,E,G,M
Иммуноглобулины D
Иммуноглобулины D обнаружены в сыворотке в очень небольшом количестве, являются мономерами. В тяжелых 5-цепях имеют 1 вариабельный и 3 константных домена. Выполняют роль рецепторов В-лимфоцитов. Взаимодействие специфических антигенов с рецепторами на поверхности В-лимфоцитов приводит к передаче этих сигналов в клетку и включению механизмов, обеспечивающих размножение данного клона лимфоцитов.
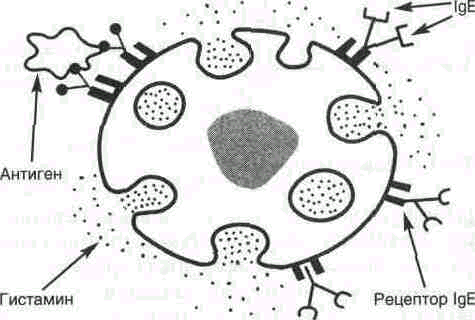
Рисунок 9.Взаимодействие IgE с антигеном на поверхности тучной клетки.
