
- •Карагандинская государственная медицинская академия
- •Функции белков плазмы крови
- •Альбумины
- •Глобулины
- •Функции 1-глобулинов
- •Белки-ферменты плазмы крови.
- •Органические небелковые соединения плазмы
- •I группа - азотсодержащие небелковые компоненты
- •II группа - безазотистые органические вещества
- •Неорганические компоненты плазмы
- •Кислотно-основной баланс
- •Буферные системы плазмы
- •Система свертывания крови и фибринолиза.
- •Начальные стадии внешнего механизма.
- •Начальные стадии внутреннего механизма.
- •Биохимия форменных элементов крови
- •Эффект Бора
- •Патологические варианты гемоглобина
- •Защита эритроцитов от окислительного стресса
- •Гемолиз эритроцитов
- •Обмен железа
- •Медицинское значение
- •Приложение 1. Суперсемейство иммуноглобулинов
- •Приложение 2 Система комплемента
- •Приложение 3.Калликреин - кининовая система
- •Синтез гемоглобина
- •Распад гемоглобина
- •Образование пигментов желчи, кала и мочи.
Эффект Бора
Hb не только переносит кислород от легких к периферическим тканям, но и ускоряет транспорт углекислого газа от тканей к легким. Гемоглобин связывает углекислый газ сразу после высвобождения кислорода. Находящаяся в эритроцитах карбоангидраза катализирует превращение поступающего из тканей углекислого газа в угольную кислоту. Угольная кислота быстро диссоциирует на бикарбонат-ион и протон, причем равновесие вдвинуто в сторону диссоциации.
Для предотвращения опасного повышения кислотности крови должна существовать буферная система, способная поглощать избыток протонов. Гемоглобин связывает два протона на каждые четыре освободившиеся молекулы кислорода и определяет буферную емкость крови.
В легких идет обратный процесс: присоединение кислорода к дезоксигемоглобину сопровождается высвобождением протонов, которые связываются с бикарбонат-ионами, переводя их в угольную кислоту. Далее эффективно действующая карбоангидраза катализирует превращение угольной кислоты в углекислый газ, выдыхаемый из легких. Таким образом, связывание кислорода тесно сопряжено с выдыханием углекислого газа. Это обратимое явление известно как эффект Бора.
Патологические варианты гемоглобина
Кроме нормальных типов гемоглобина в настоящее время известно свыше 50 его патологических вариантов. Заболевания, вызванные появлением патологического типа гемоглобина, называются гемоглобинопатиями или гемоглобинозами. Наследственно обусловленные гемоглобинопатии связаны с изменением глобина.
Вариант 1. Замена целых пар полипептидных цепей в гемоглобиновой молекуле. Пример: таласемия. Вместо нормальной структуры гемоглобина А - альфа-альфа/бета-бета, гемоглобин Н имеет структуру---, что значит, что по обе-полипептидные цепи замещены новыми двумя-полипептидными цепями. В результате развивается болезнь- таласемия. При- таласемии прекращается синтез-цепей, что ведет к прекращению образования НbА, в результате компенсаторно возрастает синтез НbFи НbА2. При талассемии происходят дегенеративные изменения эритроцитов, появлению мишеневидных эритроцитов с центрально расположенным гемоглобином, уменьшением жизни эритроцитов до 30 дней. В результате возникает тяжелая форма анемии.
Вариант 2. замена аминокислот. Пример, серповидно-клеточная анемия. Единственная разница между HbS и HbA состоит в том, что на 6-ом месте в-полипептидной цепи вместо глутамина находится валин. После отдачи кислорода в тканях он превращается в плохо растворимую форму и выкристаллизовывается в эритроцитах, вызывая их деформацию (образование серповидных форм), что и приводит к нарушению функции крови.
Защита эритроцитов от окислительного стресса
Из О2постоянно возникают в небольших количествах токсичные вещества, так называемыеактивные формы кислорода[АФК (от англ. reactive oxygen species)]. Эти соединения являются сильными окислителями или крайне реакционноспособными свободными радикалами, которые разрушают клеточные структуры и функциональные молекулы (рис.5).
Молекула кислорода (О2) содержит два неспаренных электрона и. таким образом, является бирадикалом. Однако неспаренные электроны расположены так, что молекула О2остается относительно стабильной (рис.5). Тем не менее, если молекула присоединяет дополнительный электрон (стадияа), образуется высоко реакционноспособныйсупероксид-радикал(•О2-) Следующая стадия восстановления (стадияб) приводит кпероксид-аниону(•О22-), который легко связывает протоны и вследствие этого переходит впероксид водорода(Н2О2). Присоединение третьего электрона (стадияв) ведет к расщеплению молекулы на ионы О2-и О-. В то время как О2-путем присоединения двух протонов образуетводу, протонирование О-приводит к особо опасномугидроксил-радикалу(•ОН). Присоединение четвертого электрона и заключительное протонирование О-заканчивается образованием воды.
Особенно подвержены АФК-повреждению эритроциты, для которых из-за их транспортной функции характерна высокая концентрация кислорода. Постоянным источником активных форм кислорода в эритроцитах является неферментативное окисление гемоглобина:Hb(Fe2+)+O2 MeтHЬ(Fe3+)+02-
Активные формы кислорода могут вызвать гемолиз эритроцитов. Эритроциты содержат ферментную систему, предотвращающую токсическое действие радикалов кислорода и разрушение мембран эритроцитов.
Для защиты от АФК и других радикалов все клетки содержат антиоксиданты. Последние являются восстановителями, которые легко реагируют с окисляющими веществами и вследствие этого защищают более важные молекулы от окисления. К биологическим антиоксидантам принадлежатвитамины СиΕ,кофермент Qи некоторые каротиноиды. Образующийся при разрушении гемабилирубинтакже служит защитой от окисления.
Особенно важен глутатион, трипептид Glu-Cys-Gly, находящийся почти во всех клетках в высокой концентрации. Восстановителем здесь является тиольная группа цистеинового остатка. Две молекулы восстановленной формы (GSH, на схеме вверху) при окислении образуют дисульфид (GSSG, рис.5).
Эритроциты также обладают системой (супероксиддисмутаза, каталаза, GSH), способной инактивировать АФК и ликвидировать нанесенные ими повреждения.
Для этого необходимы вещества, обеспечивающие поддержание в эритроцитах нормального обменавеществ. Метаболизм в эритроцитах, в сущности, ограниченанаэробным гликолизомипентозофосфатным путем.
Образующийся при гликолизе АТФслужит прежде всего субстратом Na+, К+-АТФ-азы, которая поддерживает мембранный потенциал эритроцитов.. В пентозофосфатном пути образуетсяНАДФН+Н+, который поставляет Н+ для регенерации восстановленного глутатиона (GSH) из глутатион-дисульфида (GSSG) с помощью глутатион-редуктазы [3]. Восстановленный глутатион — самый важный антиоксидант эритроцитов, он служит коферментом при восстановлении метгемоглобина в функционально активный гемоглобин [4]. Важным защитным ферментом является также селенсодержащая глутатион-пероксидаза [5].(рис.5,6)
С помощью восстановленного глутатиона осуществляется детоксикация Н2О2, а также гидропероксидов, которые возникают при реакции АФК с ненасыщенными жирными кислотами мембраны эритроцитов (рис.6).
При генетическом дефекте глюкозо-6-фосфатдегидрогеназы и приеме некоторых лекарств, являющихся сильными окислителями, потенциала глутатионовой защиты может оказаться недостаточно.
Это приводит к увеличению содержания в клетках активных форм кислорода, вызывающих окисление SH-групп молекул гемоглобина. Образование дисульфидных связей между протомерами гемоглобина и метгемоглобина приводит к их агрегации — образованию телец Хайнца (рис.6). Последние способствуют разрушению эритроцитов при попадании их в мелкие капилляры.

Рисунок 5
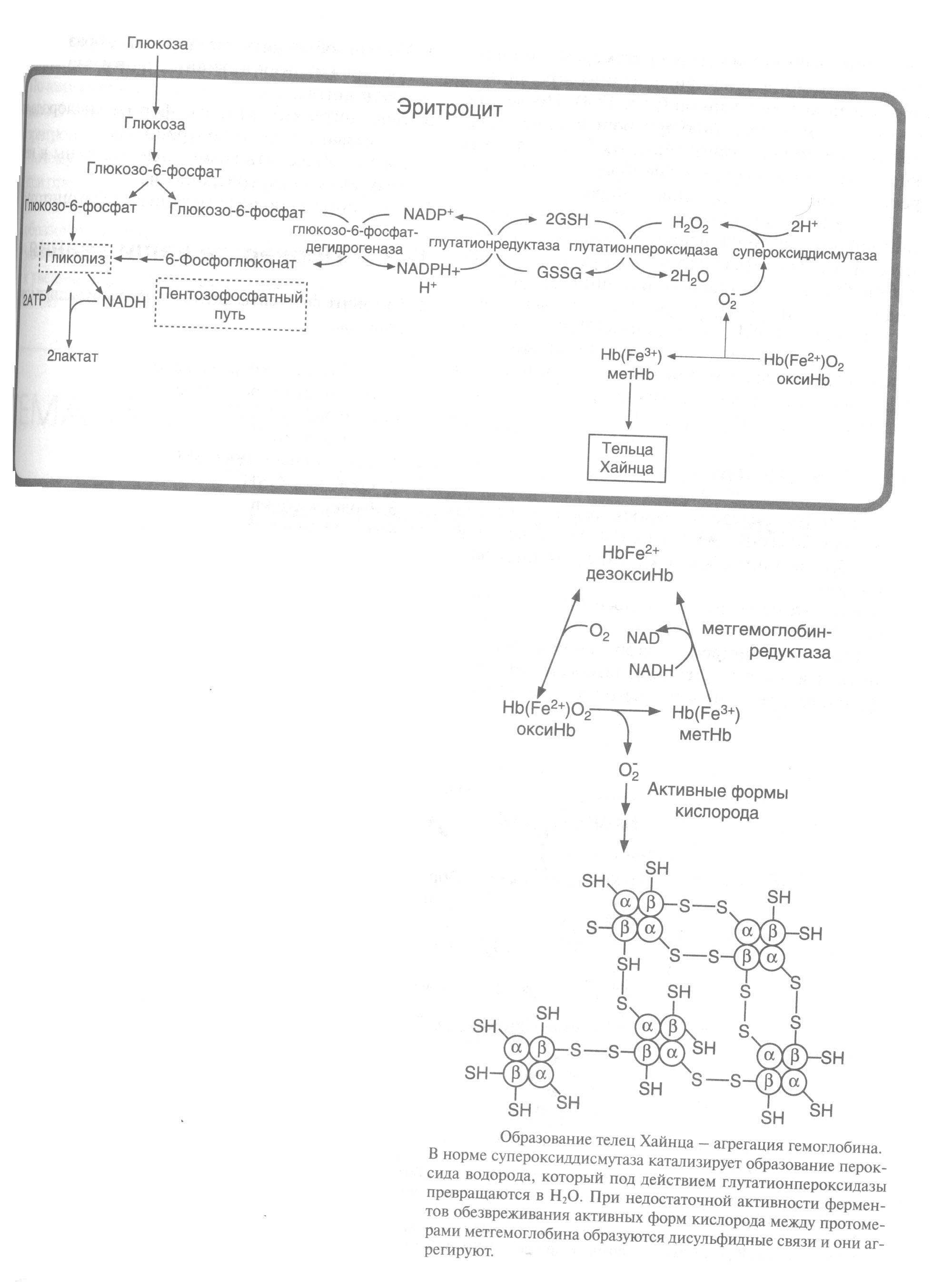
Рисунок 6
