
- •Лабораторна робота № 1 вивчення криволінійного руху
- •Теоретичні відомості
- •Опис методу
- •Порядок виконання роботи
- •Лабораторна робота № 2 визначення моменту інерції системи на прикладі маятника обербека
- •Теоретичні відомості
- •Опис методу
- •Порядок виконання роботи
- •Обчислення похибок прямих вимірювань
- •Обчислення похибок непрямого вимірювання
- •Обчислення похибки непрямого вимірювання
- •То після підстановки формул (5)÷(13) у формулу
- •Порядок виконання роботи.
- •За допомогою формули (21) обчислити відносну похибку вимірювань коефіцієнта тертя кочення.
- •Коефіцієнти тертя кочення
- •Лабораторна робота № 4 визначення відношення питомих теплоємностей газів методом адіабатичного розширення
- •Теоретичні відомості
- •Опис методу
- •Порядок виконання роботи
- •Обчислення похибок прямих вимірювань
- •Обчислення похибки непрямого вимірювання
- •Лабораторна робота № 5 дослідження електростатичного поля
- •Теоретичні відомості
- •Опис методу
- •Порядок виконання роботи.
- •Лабораторна робота № 6 електровимірювальні прилади. Вимірювання електричного струму.
- •Характеристики нешунтованих амперметрів
- •Виміри та розрахунки для еталонного
- •Лабораторна робота № 7 визначення горизонтальної складової вектора магнітної індукції магнітного поля землі
- •Теоретичні відомості
- •Порядок виконання роботи
- •Результати вимірювань та вихідні дані для розрахунку похибок
- •Питання для самоперевірки
Опис методу
Метод, який використовується в цій роботі був запропонований Клеманом і Дезормом. В основі його – використання адіабатичного розширення газу.
Адіабатичним називається процес, який проходить без теплообміну з навколишнім середовищем. І-й принцип термодинаміки для адіабатичного процесу записується так:
A + U = 0, або A = – U,
де U – зміна внутрішньої енергії газу; A – робота, виконана газом.
З цієї формули видно, що робота розширення виконуватиметься за рахунок зміни внутрішньої енергії газу; температура газу при цьому знизиться. Під час же адіабатичного стискання газу його температура підвищиться. Якщо об’єм газу змінюється досить швидко, то внаслідок того, що теплопровідність газу невелика, процес можна розглядати як дуже близький до адіабатичного.
Прослідкуємо за послідовністю процесів, що відбуваються у даному лабораторному експерименті та виведемо формулу для обчислення .
Рис.
1
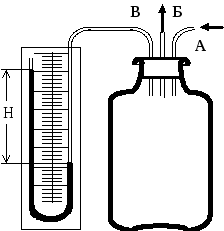
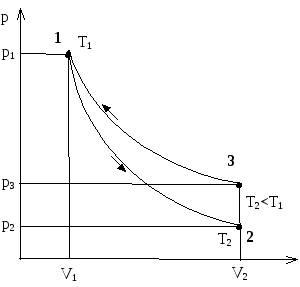
Швидке розширення газу можна вважати з достатнім наближенням адіабатичним Тому, відкриваючи кран на короткий час, протягом якого тиск всередині балону досягне атмосферного, можна вважати, що газ перейшов до нового стану, який характеризується параметрами p2, V2, T2<T1
(рис. 2, точка 2). При цьому температура T2 газу після адіабатичного розширення буде меншою від T1. Параметри станів 1 та 2 зв’язані рівнянням адіабатичного процесу.
Через 2-3 хвилини після перекривання крану газ нагріється до температури навколишнього повітря T1. Але оскільки під час цього нагрівання V2 залишиться незмінним, то тиск у балоні підвищиться до p3. Новий стан газу характеризується параметрами p3, V2, T1
(рис. 2, точка 3).
Порівнявши кінцевий стан газу (точка 3) з початковим
(точка 1), бачимо, що вони знаходяться при однаковій температурі. Отже, за законом Бойля - Маріотта
Рис.
2
p3V2 = p1V1. (2)
Виконаємо деякі перетворення в цьому рівнянні. Піднесемо його до степеня і поділимо почленно на рівняння (1):
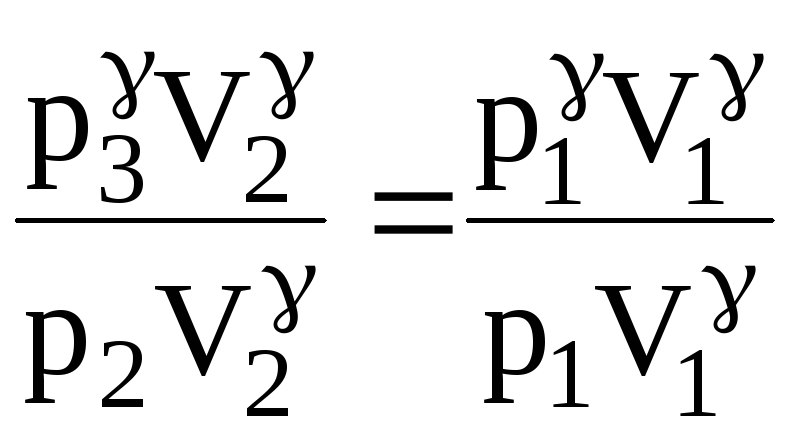
![]()
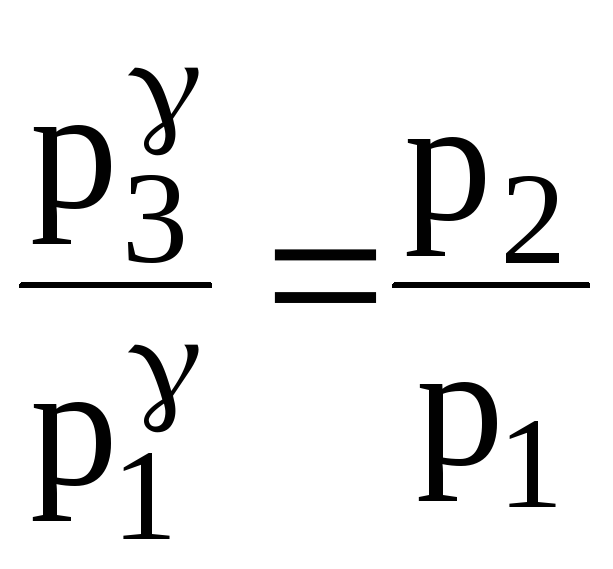
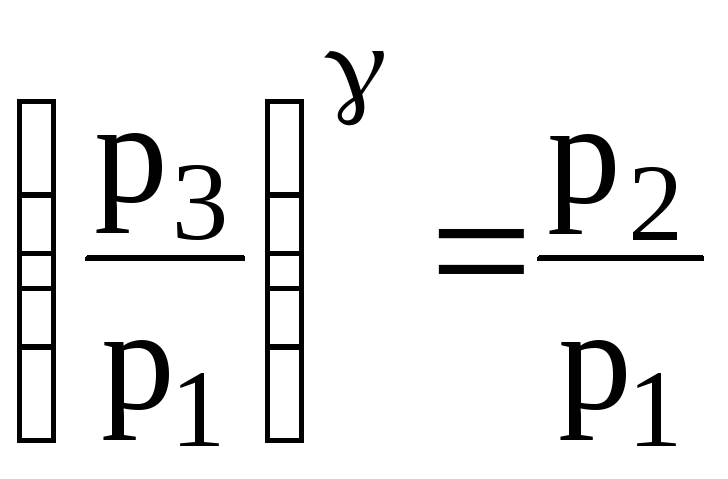 (3)
(3)
Прологарифмуємо рівняння (3):
![]()
![]() .
(4)
.
(4)
Умови експерименту дають змогу спростити розрахункову формулу. А саме, якщо позначити початковий тиск у балоні p1, початкову різницю рівнів рідини в манометрі H, то
p1 = p2 + bH (5)
де p2 – атмосферний тиск; b – коефіцієнт переходу від різниці рівнів рідини до тиску.
Для тиску p3 різницю рівнів позначимо h, тоді
p3 = p2 + bh. (6)
Визначивши
![]() із рівняння (5) і підставивши його в (6),
отримаємо
із рівняння (5) і підставивши його в (6),
отримаємо
p3 = p1 – b(H–h). (7)
Підставивши p2 і p3 у рівняння (4), знайдемо

Величини
![]() та
та![]() набагато менші за одиницю, тому,
використавши наближену формулу ln (1-x)
– x, справедливу для малих x, отримаємо
набагато менші за одиницю, тому,
використавши наближену формулу ln (1-x)
– x, справедливу для малих x, отримаємо
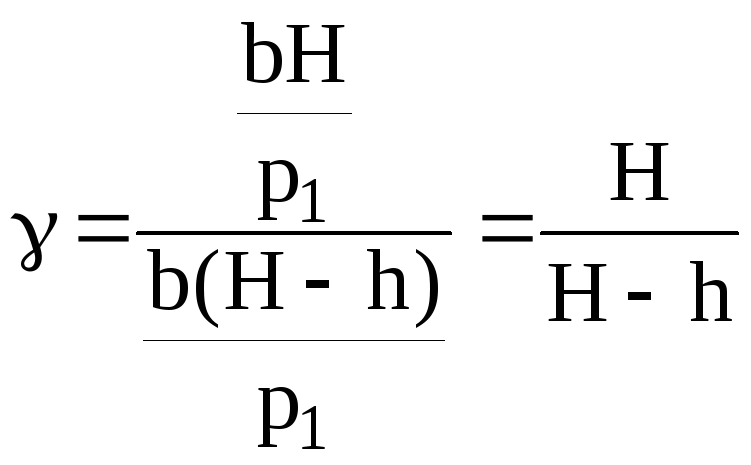 .
(8)
.
(8)
Формула (8) буде розрахунковою для визначення .
