
02_Kinetika_i_kataliz
.pdf
Хімічна кінетика та рівновага
Криськів Олег Степанович
к. фарм. н., доцент

Література
Левитин Е. Я., Бризицкая А. Н., Клюева Р. И.
Общая и неорганическая химия. – Х.: НФАУ;
страницы, 2002. – 534 с.
Неорганічна хімія. Лабораторний
Вид-во НФаУ, 2012. – 148 с.
Ахметов Н. С. Общая и неорганическая химия. Академия, 2001. – 743 с.
Глинка Н.Л. Общая химия. 2000. – 728 с.
Глинка Н.Л. Задачи и упражнения по общей
Интеграл-Пресс. 2005. – 240 с.
10.09.2013 |
2 |

Основні питання
1.Основні поняття.
2.Швидкість хімічних реакцій.
3.Фактори, які впливають на швидкість хімічних реакцій.
4.Каталіз.
5.Хімічні рівновага та її зміщення.
10.09.2013 |
3 |

Основні поняття
Хімічна кінетика - розділ хімії, що вивчає швидкість хімічних процесів (фактори, які впливають на неї, оптимальні умови, за яких можна здійснити дану реакцію) та їх механізми
Гомогенні реакції – в одній фазі і проходять одночасно в усьому об’ємі системи
Гетерогенні реакції – на поверхні поділу фаз
Фаза - гомогенна частина системи, однакова за складом та властивостями і відокремлена від інших фаз поверхнею поділу
Система - множина пов'язаних елементів, відокремлена від середовища і яка взаємодіє з ним, як ціле
10.09.2013 |
4 |

Основні поняття
Тепловий ефект реакції – теплота, яка виділяється або поглинається під час хімічної реакції
Н = H2 – H1
Екзотермічні реакції – теплота виділяється
Н < 0 (H2 < H1)
Ендотермічні реакції – теплота поглинається
Н > 0 (H2 > H1)
Стандартні умови – Т = 298 К (25 0С) і р = 101,3 кПа (1 атм)
Нормальні умови – Т = 273 К (0 0С) і р = 101,3 кПа (1 атм)
10.09.2013 |
5 |

Швидкість хімічних реакцій
Швидкість хімічної реакції - зміна концентрацій реагентів або продуктів реакції за одиницю часу
|
|
|
|
С2 |
С1 |
С |
|
моль |
|
|
v |
||||||||
Середня: |
|
|
|
|
|
|
|||
|
|
|
2 |
1 |
|
л с |
|||
|
|
|
|
|
|
||||
Миттєва (істинна): |
v |
dС |
|
d |
|||
|
|
10.09.2013 |
6 |
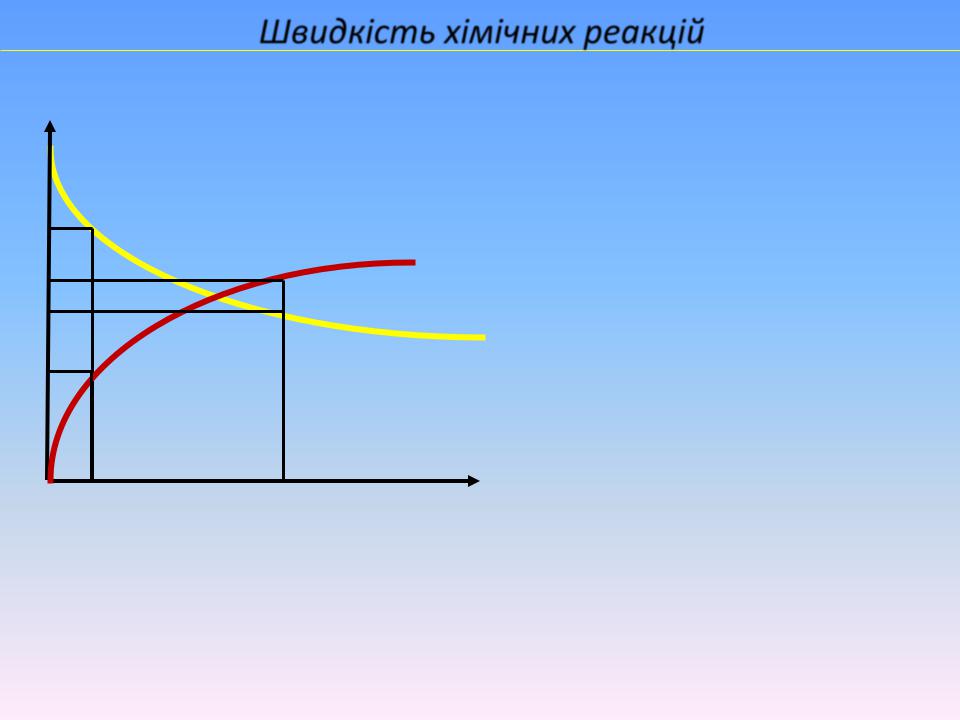
Швидкість хімічних реакцій
C |
А + В С + D |
|
|
|
|
|
|
С2 С1 |
|
С |
||||||
C1 |
|
|
C2 < C1 |
v |
|
||||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
2 1 |
|
|
||
C4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
C2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
C3 |
|
|
|
|
|
|
А + В |
|
С + D |
||||
|
|
|
|
|
|
|
|
||||||
|
|
|
C4 > C3 |
|
|
|
С4 С3 |
|
|
С |
|||
|
|
|
|
v |
|
||||||||
|
2 |
|
|
|
|
|
|||||||
t1 |
t |
|
|
|
|
|
2 1 |
|
|
||||
t |
|
|
|
|
|
|
|
|
|
|
|||
10.09.2013 |
7 |
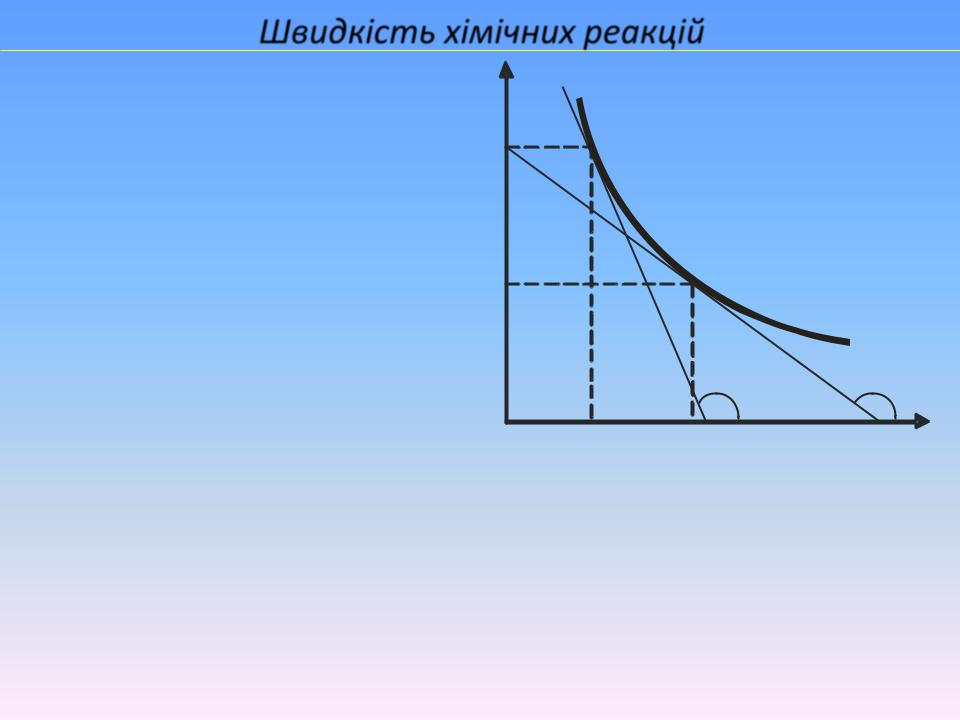
Швидкість хімічних реакцій
C
C1 a
v tgα
Залежить від:
|
природи реагентів |
C2 |
b |
|
|
||
температури |
|
α |
|
|
|
|
|
наявності каталізатора |
1 |
2 |
|
концентрації реагентів (гомогенні реакції)
площі контакту (гетерогенні реакції)
та ін…
α1
10.09.2013 |
8 |

Вплив концентрації реагентів
Закон дії мас (1867 р., Гульдберг, Вааге):
швидкість хімічної реакції прямо пропорційна добутку концентрацій реагентів у степенях стехіометричних коефіцієнтів
aA + bB = cC + dD v = kCAa CBb
Константа швидкості k – швидкість реакції при
|
CA = CB = 1 моль/л |
залежить від: |
не залежить від: |
природи реагентів |
концентрації |
температури |
|
10.09.2013 |
9 |

10.09.2013 Na |
S O + H SO = Na SO + S + SO |
2 |
+ H |
O |
10 |
|||||
2 |
2 |
3 |
2 |
4 |
2 |
4 |
2 |
|
|
|
