
02_Kinetika_i_kataliz
.pdf
Каталіз. Основні поняття
Гомогенний |
Гетерогенний (контактний) |
MnO2 |
V2O5 |
2KClO3(т) = 2KCl(т) + 3O2(г) |
2SO2(г) + О2 (г) = 2SO3 (г) |
Специфічні - прискорюють одну реакцію (ферменти).
Групова специфічність: V2O5 - окиснення NH3, SO2; Ni – гідрування/дегідрування
Універсальні - змінюють швидкість різних реакцій.
Рt - окиснення SO2 SO3; гідрування ненасичених сполук.
10.09.2013 |
21 |
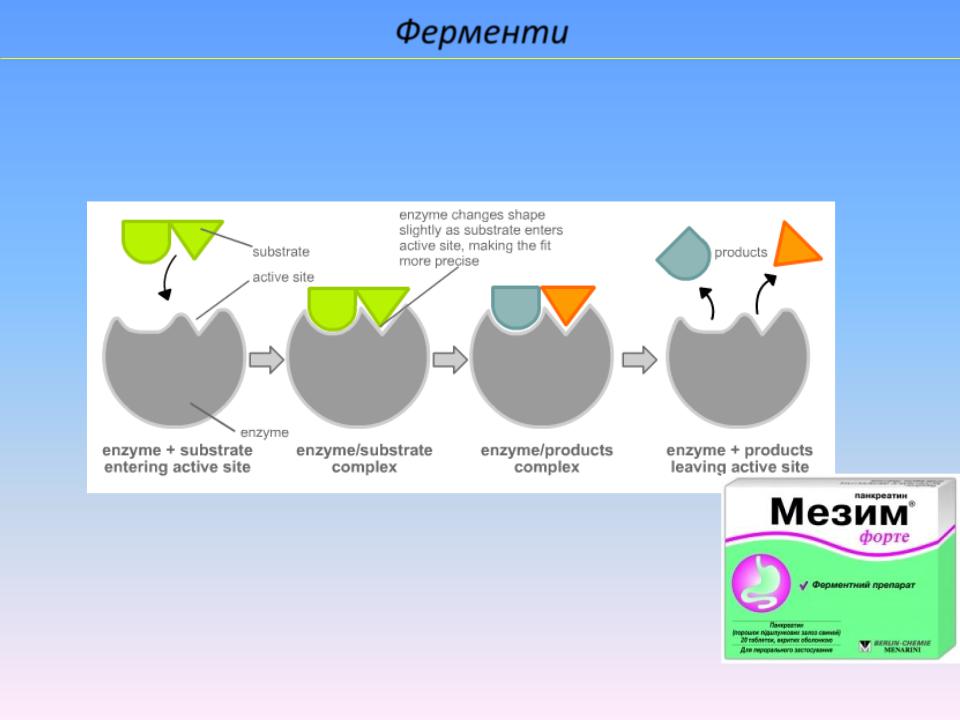
Ферменти
Ферме́нти (ензи́ми) - органічні каталізатори білкової або РНК природи, які утворюються в організмах і прискорюють хімічні реакції у ньому
Е. Фішер – «ключ-замок»
Слина – амілаза, підшлункова – панкреатин (Фестал, Мезим)
10.09.2013 |
22 |

Типи каталізу
Каталізатори іноді змінюють не лише швидкість, а й напрям реакції:
170 °С, H2SO4 |
СН2=СН2 + Н2О |
СН3–СН2–ОН
250 °С, Cu |
СН3СOН + Н2 |
10.09.2013 |
23 |
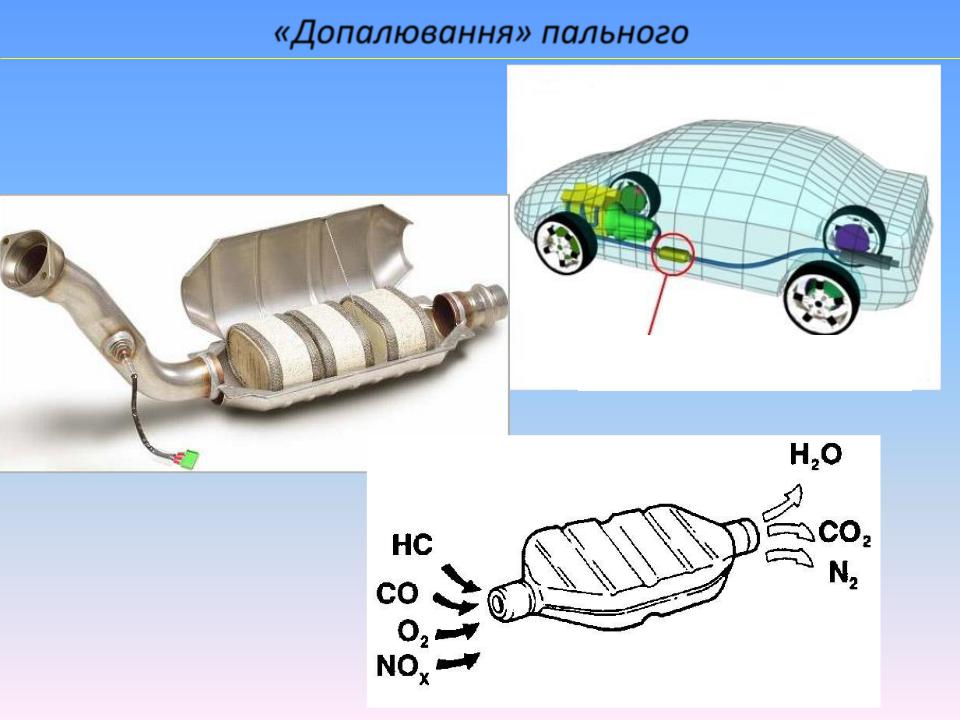
«Допалювання» пального
Каталізатор
10.09.2013 |
24 |
Механізм каталізу
І. Без каталізатора:
A |
A |
A A |
A |
|
|
|
|
A |
|
|
+ |
|
|
+ |
|
|
|
|
|
B |
B |
B B |
B |
B |
|
|
активованийкомплекс
А+B
ІІ. З каталізатором:
A A |
A |
A |
|
AA |
|
|
|
|
A |
A |
|
+ |
|
K |
|
K |
+ K + |
K |
|
+ |
|
B |
B |
|
|
|
B B |
|
|
|
B |
|
B |
|
|
|
|
активованийкомплекс |
|
||
|
|
|
|
|
|
|
|
|
|
А+K+B |
|
Каталізатор знижує Еакт –
10.09.2013 25
утворює з реагентами проміжні сполуки
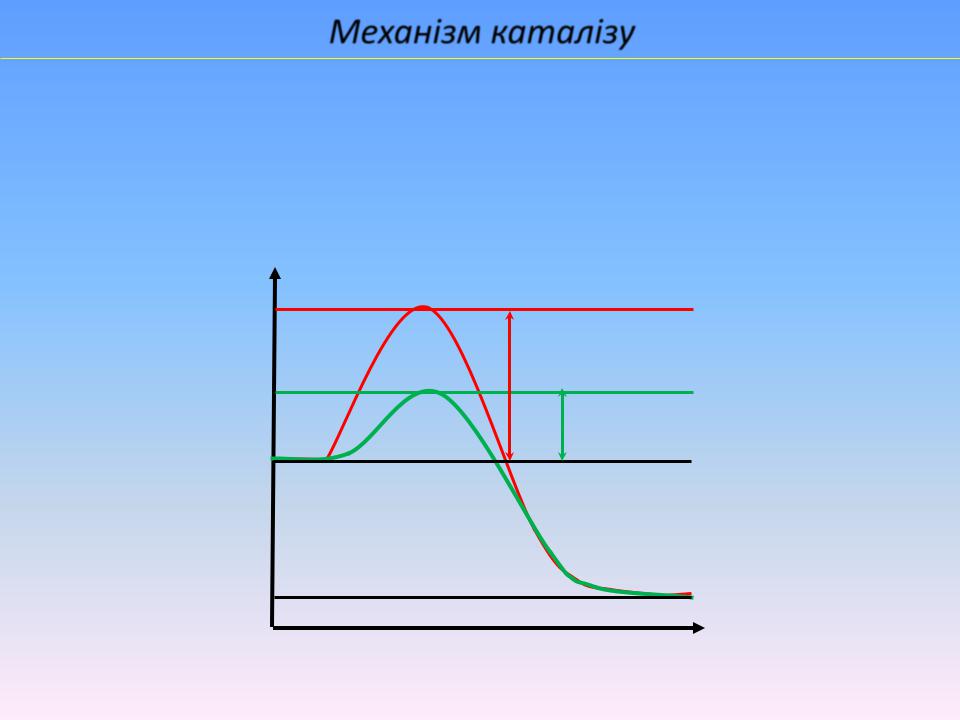
Механізм каталізу
2NH3 = N2 + 3Н2,
некаталітична - Eакт ~ 320 кДж/моль, з Pt - Еакт ~ 150 кДж/моль
Енергія
Енергія активації без каталізатора
Енергія активації з каталізатором
Координата реакції
10.09.2013 |
26 |

10.09.2013 |
2Al + 3I2 |
27 |
|
= 2AlI3 |

Хімічна рівновага
Необоротні – ідуть до кінця, винятково в одному напрямку:
Mg + 2HCl = MgCl2 + H2
Оборотні - ніколи не ідуть до кінця, можуть відбуватись у протилежних напрямках:
1. При 200 °С: H+I |
v |
2HIv = k Н |
І |
|
|||||
1 |
|||||||||
|
2 2 |
|
|
1 |
1 |
2 |
2 |
|
|
Припиняється при вмісті НІ 80% |
|
|
|
|
|
||||
|
2HI |
v |
H +I |
v |
= k НІ 2 |
|
|||
2. При 350 °С: |
2 |
|
|||||||
|
|
2 |
2 |
2 |
|
2 |
|
|
|
Припиниться, коли розкладеться 80% НІ
10.09.2013 |
28 |
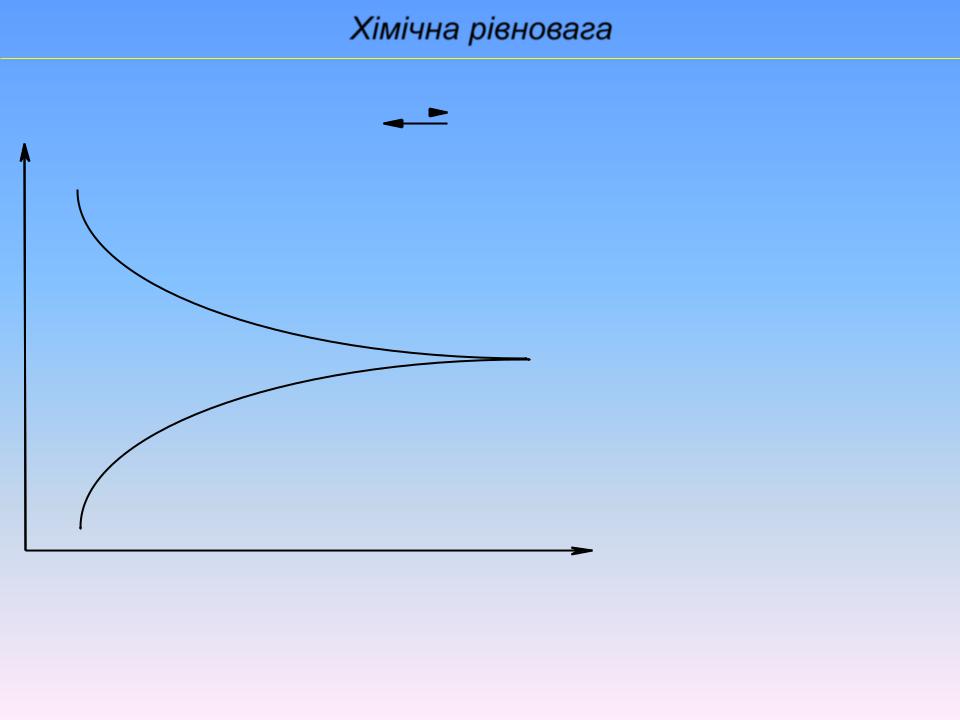
Хімічна рівновага
|
|
v1 |
|
пряма реакція |
||
|
Сумарно:H2 + I2 |
|
|
2HI |
||
v |
v2 |
зворотна реакція |
||||
|
|
|||||
|
|
|
|
|||
v1
v1 = v2 - хімічна рівновага
v2
t
Стан системи, при якому швидкість прямої реакції дорівнює швидкості зворотної - динамічна хімічна рівновага
10.09.2013 |
29 |

Хімічна рівновага
Кількісно описує константа хімічної рівноваги – відношення констант швидкостей прямої k1 і зворотної k2 реакцій
Н2 + І2 2НІ, v1 = v2, k1 Н2 І2 = k2 НІ 2, і
K |
k |
|
HI 2 |
|
|
||
1 |
|
|
|
|
|
||
k |
H |
2 |
I |
2 |
|
||
2 |
|
|
|
|
|||
У загальному випадку для оборотної реакції aA + bB + … pP + qQ + …
K |
P p Q q ... |
|
|
A a B b ... |
|
10.09.2013 |
30 |
|
