
- •ПРОГРАММА
- •ВВЕДЕНИЕ
- •1. Строение атомов и систематика химических элементов
- •2. Химическая связь
- •3. Типы взаимодействия молекул. Конденсированное состояние вещества
- •II. Общие закономерности химических процессов
- •2. Простые соединения химических элементов
- •3. Комплексные соединения
- •4. Органические соединения
- •IV. РАСТВОРЫ И ДРУГИЕ ДИСПЕРСНЫЕ СИСТЕМЫ. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- •2. Водные растворы электролитов
- •3. Твердые растворы
- •4. Гетерогенные дисперсные системы
- •5. Электрохимические процессы
- •6. Коррозия и защита металлов
- •КОНТРОЛЬНЫЕ ЗАДАНИЯ
- •Контрольные вопросы
- •Строение атома
- •Контрольные вопросы
- •Периодическая система элементов Д.И. Менделеева
- •Контрольные вопросы
- •Химическая связь и строение молекул. Конденсированное состояние вещества
- •Контрольные вопросы
- •Энергетика химических процессов (термохимические расчеты)
- •Контрольные вопросы
- •Химическое сродство
- •Контрольные вопросы
- •Химическая кинетика и равновесие
- •Контрольные вопросы
- •Способы выражения концентрации раствора
- •Контрольные вопросы
- •Свойства растворов
- •Контрольные вопросы
- •Ионно-молекулярные (ионные) реакции обмена
- •Контрольные вопросы
- •Гидролиз солей
- •Контрольные вопросы
- •Контрольные вопросы
- •Электронные потенциалы и электродвижущие силы
- •Контрольные вопросы
- •Электролиз
- •Контрольные вопросы
- •Коррозия металлов
- •Контрольные вопросы
- •Комплексные соединения
- •Контрольные вопросы
- •Жесткость воды и методы ее устранения
- •Контрольные вопросы
- •Таблица вариантов контрольных заданий
- •Приложение

ПРИЛОЖЕНИЕ
Таблица 9.
КОНСТАНТЫ И СТЕПЕНИ ДИССОЦИАЦИИ НЕКОТОРЫХ СЛАБЫХ ЭЛЕКТРОЛИТОВ
|
|
ЧИСЛОВЫЕ ЗНА- |
СТЕПЕНЬ ДИССО- |
||
|
|
ЧЕНИЯ |
|||
ЭЛЕКТРОЛИТЫ |
ФОРМУЛА |
ЦИАЦИИ В 0,1 Н. |
|||
КОНСТАНТ |
|||||
|
|
РАСТВОРЕ, % |
|||
|
|
ДИССОЦИАЦИИ |
|||
|
|
|
|||
Азотистая кислота |
HNO2 |
К = 4,0 × |
10-4 |
6,4 |
|
Аммиак (гидроксид) |
NH4OY |
К = 1,8 × |
10-5 |
1,3 |
|
Муравьиная кислота |
HCOOH |
К = 1,76 × |
10-4 |
4,2 |
|
Ортоборная кислота |
H3BO3 |
К1 = 5,8 × |
10-10 |
0,007 |
|
К2 = 1,8 × |
10-13 |
||||
|
|
К3 = 1,6 × |
10-14 |
|
|
Ортофосфорная кислота |
H3PO4 |
К1 = 7,7 × |
10-3 |
27 |
|
К2 = 6,2 × |
10-8 |
||||
|
|
К3 = 2,2 × |
10-13 |
|
|
Сернистая кислота |
H2SO3 |
К1 = 1,7 × |
10-2 |
20,0 |
|
К2 = 6,2 × |
10-8 |
||||
|
|
|
|||
Сероводородная кислота |
H2S |
К1 = 5,7 × |
10-8 |
0,07 |
|
К2 = 1,2 × |
10-15 |
||||
|
|
|
|||
Синильная кислота |
HCN |
К = 7,2 × |
10-10 |
0,009 |
|
Угольная кислота |
H2CO3 |
К1 = 4,3 × |
10-7 |
0,17 |
|
К2 = 5,6 × |
10-11 |
||||
|
|
|
|||
Уксусная кислота |
CH3COOH |
К = 1,75 × |
10-5 |
1,3 |
|
Фтороводородная кислота |
HF |
К = 7,2 × |
10-4 |
8,5 |
|
Хлорноватистая кислота |
HClO |
К = 3,0 × |
10-8 |
0,05 |
|
6
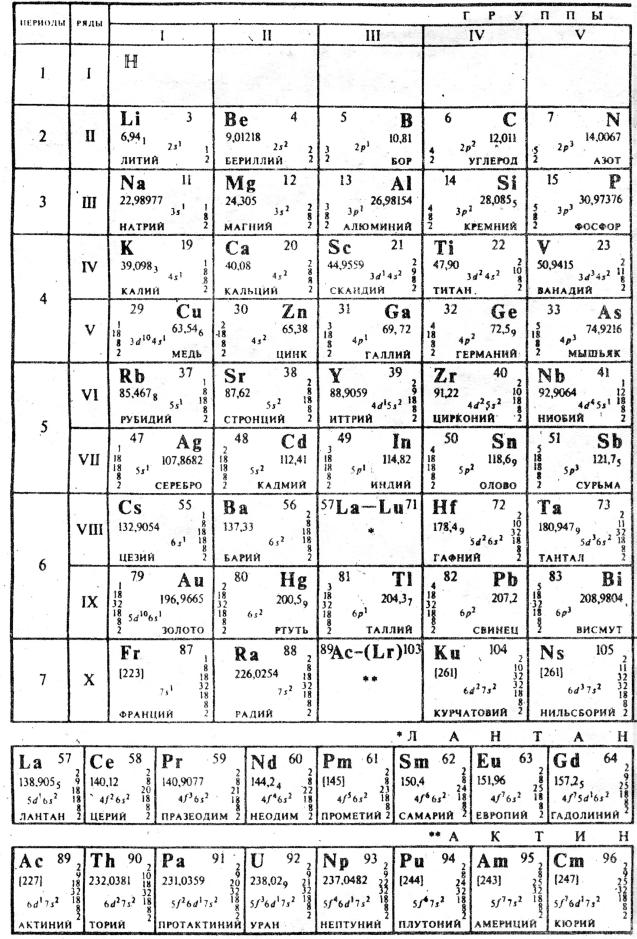
Таблица 10. |
ПЕРИОДИЧЕСКАЯ СИСТЕМА |
6
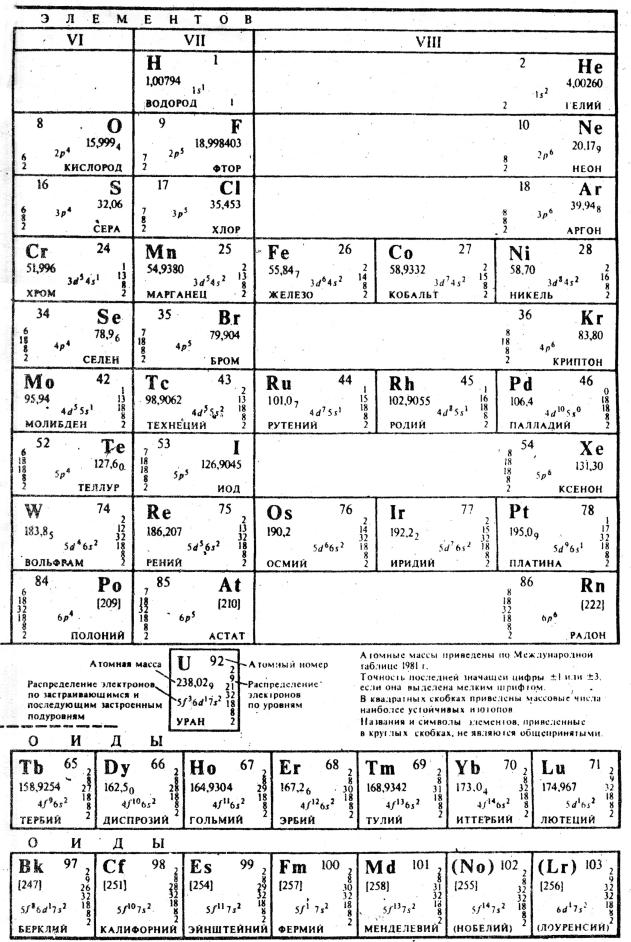
ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
7

|
ПЕРИОДИЧЕСКАЯ СИСТЕМА |
Таблица 11. |
(вариант |
7
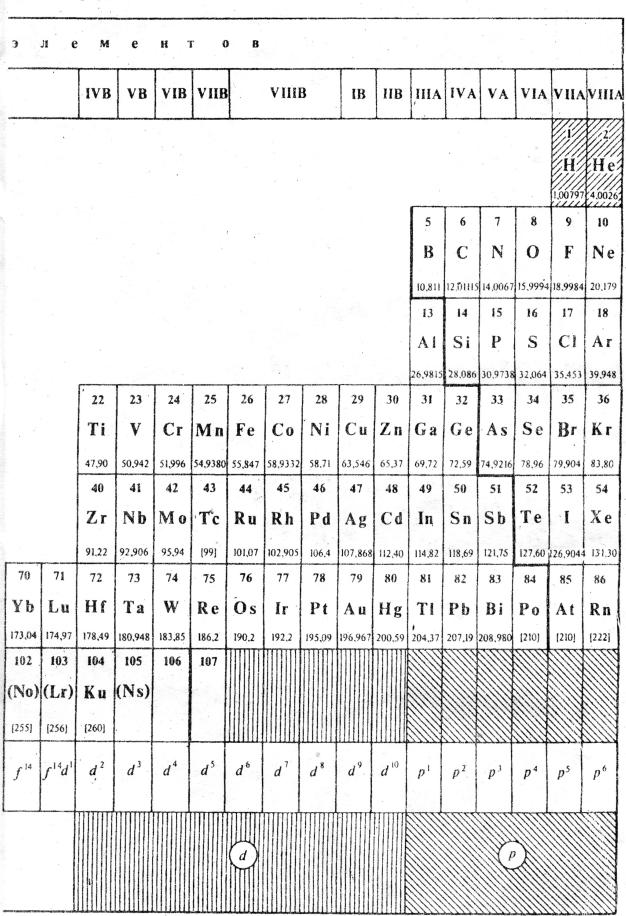
ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА длинной формы)
7
48
Таблица 12.
РАСТВОРИМОСТЬ СОЛЕЙ И ОСНОВАНИЙ В ВОДЕ (Р – РАСТВОРИМОЕ, М – МАЛОРАСТВОРИМОЕ, Н – ПРАКТИЧЕСКИ НЕРАСТВОРИМОЕ ВЕЩЕСТВО, ПРОЧЕРК ОЗНАЧАЕТ, ЧТО ВЕЩЕСТВО
НЕ СУЩЕСТВУЕТ ИЛИ РАЗЛАГАЕТСЯ ВОДОЙ)
|
|
|
|
|
|
|
|
|
КАТИОНЫ |
|
|
|
|
|
|
|
|
||
АНИОНЫ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Li+ |
Na+, |
NH+4 |
Cu2+ |
Ag+ |
Mg2+ |
Ca2+ |
Sr2+ |
Ba2+ |
Zn2+ |
Hg2+ |
Al3+ |
Sn2+ |
Pb2+ |
Bi3+ |
Cr3+ |
Mn2+ |
Fe3+ |
Fe2+ |
|
|
K+ |
||||||||||||||||||
Cl– |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
– |
Р |
Р |
Р |
Р |
Br– |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
М |
– |
Р |
Р |
Р |
Р |
I– |
Р |
Р |
Р |
– |
Н |
Р |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Н |
– |
Р |
Р |
– |
Р |
NO–3 |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
– |
Р |
Р |
Р |
– |
Р |
Р |
CH3COO– |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
– |
Р |
– |
– |
Р |
– |
Р |
S2– |
Р |
Р |
Р |
Н |
Н |
– |
Р |
Р |
Р |
Н |
Н |
– |
Н |
Н |
Н |
– |
Н |
Н |
Н |
SO2–3 |
Р |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
– |
– |
Н |
Н |
– |
Н |
– |
Н |
SO2–4 |
Р |
Р |
Р |
Р |
М |
Р |
М |
Н |
Н |
Р |
– |
Р |
Р |
Н |
– |
Р |
Р |
Р |
Р |
CO2–3 |
Р |
Р |
Р |
– |
Н |
Н |
Н |
Н |
Н |
Н |
– |
– |
– |
Н |
Н |
– |
Н |
– |
Н |
SiO2–3 |
Р |
Р |
– |
– |
– |
Н |
Н |
Н |
Н |
Н |
– |
Н |
– |
Н |
– |
– |
Н |
Н |
Н |
Cr2–4 |
Р |
Р |
Р |
Н |
Н |
Р |
М |
М |
Н |
Н |
Н |
– |
– |
Н |
Н |
Р |
Н |
– |
– |
PO3–4 |
Н |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
OH– |
Р |
Р |
Р |
Н |
– |
Н |
М |
М |
Р |
Н |
– |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
|
|
|
|
Таблица 13. |
|
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ |
|||
|
|
|
|
|
ВЕЩЕ- |
|
КЛАССИФИКАЦИЯ ВЕЩЕСТВ |
П Р И М Е Р Ы |
|
СТВА |
|
|||
|
|
|
|
|
Простые |
|
|
s-элементы |
|
|
|
|
p-элементы |
|
|
|
Металлы |
Al, Ga, In, Ti, Ge, Sn, |
|
|
|
(85 элементов) |
Bi. |
|
|
|
|
d-элементы |
|
|
|
|
f-элементы |
|
|
|
|
s-элементы (Н, Не) |
|
|
|
|
p-элементы |
|
|
|
Неметаллы |
B, C, Si, N, P, O, S, Se, |
|
|
|
(22 элемента) |
Te |
|
|
|
|
галогены |
|
|
|
|
благородные газы |
|
Сложные |
|
|
гидриды |
LiH, NaH, CaH2, BaH2 |
|
|
|
карбиды |
Be2C, CaC2, Al4C3 |
|
|
Бинарные |
нитриды |
Na3N, Mg3N2, Si3N4 |
|
|
оксиды |
Na2O, CaO, Al2O3 |
|
|
|
соединения |
||
|
|
сульфиды |
K2S, ZnS, Fe2S3 |
|
|
|
|
||
|
|
|
галиды |
NaCl, BaCl2, FeCl3 |
|
|
|
Средние |
NaNO3, Al2(SO4)3, K3PO4 |
|
|
Соли |
кислые (гидро-) |
NaHSO4, KH2PO4, Ca(H2PO4)2 |
|
|
основные (гидроксо-) |
MgOHCl, (CuOH)2SO4, |
|
|
|
|
||
|
|
|
|
Fe(OH)2Cl |
|
|
|
кислоты |
HNO3, H2SO4, H3PO4 |
|
|
Гидроксиды |
амфолиты |
Zn(OH)2, Al(OH)3, Be(OH)2 |
|
|
(амфотерные) |
H2ZNO2, H3AlO3, H2BeO2 |
|
|
|
|
||
|
|
|
основания |
KOH, Ba(OH)2, Ni(OH)3 |
8
ВЗАИМОСВЯЗЬ ПРОСТЫХ ВЕЩЕСТВ, ОКСИДОВ, ОСНОВАНИЙ И КИСЛОТ
(РЕАКЦИИ СОЛЕОБРАЗОВАНИЯ)
1. Металл + кислота →соль + водород
Fe + 2HCl = FeCl2 + H2
2. Металл + неметалл →соль бескислородной кислоты 2Fe + 3Cl2 = 2FeCl3
3. Металл (1) + соль (1) →соль (2) + металл (2)
Fe + CuCl2 = FeCl2 + Cu 4. Основной оксид + кислотный оксид →соль
BaO + SO3 = BaSO4 5. Основной оксид + кислота →соль + вода
BaO + 2HCl = BaCl2 + H2O
6. Основание + кислота →соль + вода (реакция нейтрализации) Ba(OH)2 + 2HCl = BaCl2 + 2H2O
7. Основание + кислотный оксид →соль + вода Ba(OH)2 + SO3 = BaSO4 + H2O
8. Основание (1) + соль (1) →соль (2) + основание (2) Ba(OH)2 + K2SO4 = BaSO4 + 2KOH
9. Соль (1) + кислота (1) →соль (2) + кислота (2) BaCl2 + H2SO4 = BaSO4 + 2HCl
10. Соль (1) + соль (2) →соль (3) + соль (4)
BaCl2 + K2SO4 = BaSO4 + 2KCl
8
