
- •1. Материя и ее движение
- •2 Вещества и их изменение. Предмет неорганической химии
- •3. Закон сохранения массы. Основное содержание атомно-молекулярного учения
- •4. Эквивалент. Закон эквивалентности. Важнейшие классы и номенклатура неорганических веществ
- •5. Периодическая система элементов д.И. Менделеева
- •6. Теория химического строения
- •7. Общая характеристика p-, s-, d-элементов
- •8. Ковалентная связь. Метод валентных связей
- •9. Неполярная и полярная ковалентные связи
- •10. Многоцентровые связи
- •11. Ионная связь
- •12. Водородная связь
- •13. Превращение энергии при химических реакциях
- •14. Цепные реакции
- •15. Общие свойства неметаллов
- •16. Водород
- •17. Вода
- •18. Перекись водорода
- •19. Общая характеристика подгруппы галогенов
- •20. Хлор. Хлороводород и соляная кислота
- •21. Краткие сведения о фторе, броме и йоде
- •22. Общая характеристика подгруппы кислорода
- •23. Кислород и его свойства
- •24. Озон и его свойства
- •25. Сера и ее свойства
- •26. Сероводород и сульфиды
- •27. Свойства серной кислоты и ее практическое значение
- •28. Азот. Сигма– и пи-связи
- •29. Общая характеристика подгруппы азота
- •30. Аммиак
- •31. Соли аммония
- •32. Оксиды азота
- •33. Азотная кислота
- •34. Фосфор
- •35. Аллотропные модификации фосфора
- •36. Оксиды фосфора и фосфорные кислоты
- •37. Минеральные удобрения
- •38. Углерод и его свойства
- •39. Аллотропные модификации углерода
- •40. Оксиды углерода. Угольная кислота
- •41. Кремний и его свойства
- •42. Понятие коллоидных растворов
- •43. Соли кремниевой кислоты
- •44. Получение цемента и керамики
- •45. Физические свойства металлов
- •46. Химические свойства металлов
- •47. Металлы и сплавы в технике
- •48. Основные способы получения металлов
- •49. Коррозия металлов
- •50. Защита металлов от коррозии
- •51. Общая характеристика подгруппы лития
- •52. Натрий и калий
- •53. Едкие щелочи
- •54. Соли натрия и калия
- •55. Общая характеристика подгруппы бериллия
- •56. Кальций
- •57. Оксид и гидроксид кальция
- •58. Жесткость воды и способы ее устранения
- •59. Общая характеристика подгруппы бора
- •60. Алюминий. Применение алюминия и его сплавов
- •61. Оксид и гидроксид алюминия
- •62. Общая характеристика подгруппы хрома
- •63. Хром
- •64. Оксиды и гидроксиды хрома
- •65. Хроматы и дихроматы
- •66. Общая характеристика семейства железа
- •67. Железо
- •68. Соединения железа
- •69. Доменный процесс
- •70. Чугун и стали
- •71. Тяжелая вода
- •72. Соли соляной кислоты
29. Общая характеристика подгруппы азота
Подгруппа азота – пятая группа, главная подгруппа периодической системы Д.И. Менделеева. В нее входят элементы: азот (N); фосфор (P); мышьяк (As); сурьма (Sb); висмут (Bi). Общая электронная формула элементов подгруппы азота: ns2np3 – на внешнем энергетическом уровне эти элементы содержат пять валентных электронов, на что указывает номер группы – два электрона на s-подуровне и три не-спаренных электрона на р-подуровне. Это р-эле-менты. У каждого последующего нижестоящего атома нарастает энергетический уровень (N – 2s22p3; P – 3s23p3; As – 4s24p3; Sb – 5s25p3; Bi – 6s26p3), в связи с чем увеличивается радиус атома, уменьшается энергия ионизации, энергия сродства к электрону, электроотрицательность, ослабевают неметаллические свойства – усиливаются металлические.
Характерны следующие степени окисления: N – +1, +2, +3, +4, +5, 0, -1, -3, -5; P – от +1 до +5 (кроме +2), 0, -2, -3; все остальные: +3, +5, -3. Характерные валентности: 3, 4, 5.
Азот пятивалентным быть не может – максимальная его валентность равна четырем, т. к. наивысшая валентность равна числу возможных квантовых ячеек на внешнем уровне – у азота их четыре (одна s– и три р-орбитали), следовательно, число ковалентных связей тоже четыре.
Итак, азот в невозбужденном состоянии имеет валентность три, а в возбужденном (при переходе электронов с s-подуровня) – четыре.
У фосфора и всех последующих элементов подгруппы имеется d-подуровень, куда могут переходить электроны с s– и р-подуровней, и в возбужденном состоянии они имеют валентность пять.
Водородные соединения элементов соответствуют формуле: RН3: NН3 – аммиак; РН3 – фосфин; AsН3 – арсин; SbН – стибин; BiН – висмутин. Все соединения – газы, химическая стойкость каждого последующего ослабевает, что связано с ростом порядкового номера элементов, ослабевания неметаллических свойств и усиления металлических.
Кислородные соединения подгруппы азота отвечают составу: R2О3, R2О5, которые соответствуют кислотам типа: НRО2; НRО3; Н3RO4 – ортокислоты (азот ортокислоты не образует).
Характер оксидов элементов в направлении сверху вниз закономерно изменяется: N2О3, Р2О3 обладают кислотными свойствами; As2О3, Sb2О3 имеют амфотерные свойства; Bi2О3 – основные свойства. R2О5 образуют только кислотные оксиды и соответствуют кислотам: НRО3, Н3RO4 (кроме азота). Сила кислот НRО3 сверху вниз убывает.
Резкие изменения наблюдаются и у простых веществ элементов подгруппы азота: азот, фосфор, мышьяк – неметаллы; сурьма и висмут – металлы.
30. Аммиак
Физические свойства: аммиак (NH3) – бесцветный газ с резким запахом, растворим в воде, в 2 раза легче воздуха; при охлаждении до -33,4 °C и нормальном давлении превращается в прозрачную жидкость, при 77,8 °C затвердевает. Массовая доля аммиака в концентрированном растворе – 25 %. Раствор NH3 в воде – аммиачная вода или нашатырный спирт. Медицинский нашатырный спирт – 10 %. При низкой температуре образует в растворе кристаллогидрат NH3 ? Н2О. Строение молекулы: характерна sp3-гибридизация. В образовании молекулы участвуют 3 неспаренных р-электрона азота и 1s – атомов водорода. Молекула имеет форму правильной пирамиды, в вершине которой стоят атомы азота, а в углах – водорода.
Химические свойства:
1) при растворении NH3 в воде образуются гидратированные молекулы аммиака и частично ионы аммония – NH4+ и ОН-ионы – водный раствор аммиака имеет слабощелочную реакцию.
2) NH3 взаимодействует с кислотами: NH3 + Н2SO4 = NH4НSO4;
3) аммиак – сильный восстановитель. Из СuО при нагревании восстанавливает Сu: 3СuО + 2NH3 = Сu + N2 + 3Н2О;
4) в кислороде NH3 горит желтым пламенем: 4NH3 + 3О2 = 2N2? + 6Н2О;
5) кислородом воздуха NH3 окисляется в присутствии катализаторов: Pt, Cr2O3, Rh: 4NH3 + 5О2 = 4NО? + 6Н2О;
6) при замещении водорода на металлы образуются амиды: Na + NH3 = NaNH2 + 1/2 Н2;
7) водород в NH3 может замещаться на галогены. При действии на раствор хлорида аммония газообразным хлором образуется хлорид азота: NH4Cl + 3Cl2 = 4HCl + NCl3.
Нашатырь (хлорид азота).
Получение: в промышленности до концаХ1Х века аммиак получали как побочный продукт при коксовании каменного угля, который содержит до 1–2 % азота.
В начале XX века были разработаны новые промышленные способы получения аммиака, основанные на связывании или фиксации атмосферного азота.
В 1904 году появился циамидный способ, основанный на способности азота при высокой температуре взаимодействовать с карбидом кальция, образуя циамид кальция CaCN2, который при воздействии с водяным паром при давлении 0,6 МПа легко разлагается на аммиак и карбонат кальция:
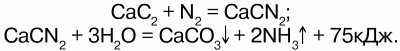
Позднее появился другой способ получения аммиака – прямое взаимодействие азота и кислорода под воздействием электрических разрядов, но эта реакция была обратимой, пока для нее не нашли оптимальные условия. Этими условиями явились высокое давление и низкая температура, использование катализаторов – губчатого железа с добавками активаторов (оксиды алюминия, калия, кальция, кремния, магния).
