
- •10 Дифракция Фраунгофера на дифракционной решетке.
- •11 Понятие о голографии.
- •14. Многолучевая интерференция света.
- •15. Проблемы излучения черного тела. Закон Кирхгофа.
- •16 Закон Стефана - Больцмана.
- •17. Квантовая гипотеза Планка. Энергия и импульс световых квантов.
- •18. Внешний фотоэффект.
- •19 Гипотеза де Бройля.
- •22. Дифракция электронов.
- •23. Волновая функция микрочастицы: её основные свойства и статистический смысл.
- •24. Нестационарное уравнение Шрёдингера.
- •25. Уравнение Шрёдингера для стационарных состояний.
- •26. Волновые функции частицы в одномерной прямоугольной яме.
- •27. Квантование энергии частицы в одномерной прямоугольной яме.
- •28. Волновые функции частицы при туннельном эффекте.
- •29. Коэффициент прозрачности в туннельном эффекте.
- •30. Структура уровней атома водорода.
- •31. Главное, орбитальное, магнитное, спиновые числа для волновых функций частиц
- •32. Принцип Паули. Распределение электронов в атоме по состояниям.
- •33. Понятие о квантовой статистике Бозе-Эйнштейна. Понятие о квантовой статистике Ферми-Дирака.
- •34. Влияние температуры на распределение электронов. Уровень Ферми
- •35. Зависимость сопротивления полупроводника от температуры. Уровень Ферми.
- •36 Строение атомного ядра и его характеристики
- •37 Понятие о свойствах и природе ядерных сил.
- •38 Виды радиоактивных превращений атомных ядер
- •39. Статистический закон распада атомных ядер
- •40 Реакция ядерного деления
30. Структура уровней атома водорода.
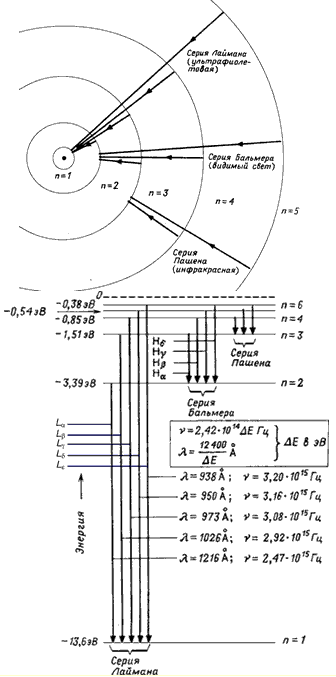
Переходы из состояний n = 2, 3, … ∞ в состояние n = 1 образуют серию Лаймана. Переходы из состояния n = 3, 4, … ∞ в состояние n = 2 – серию Бальмера. Переходы между состояниями с отрицательной энергией (E < 0) приводят к образованию дискретного спектра переходов, в то время как переходы между состояниями с E > 0 и состояниями с E < 0 дают непрерывный спектр переходов.
31. Главное, орбитальное, магнитное, спиновые числа для волновых функций частиц
Квантовые числа
Главное квантовое число n обозначает номер уровня.
n = 1-7 (K-Q). Целое число, характеризует энергию электронов, занимающих данный уровень.
n = 1 - Энергия минимальна
n = 7 - Энергия максимальна, электроны слабо связаны с ядром.
N = 2n2,
где N - максимальное число электронов на уровне, n - номер уровня (главное квантовое число).
Орбитальное = побочное квантовое число l - целое от 0 до n - 1 , определяет форму орбитали.
o l = 0 – s-орбиталь, шарообразная форма
o l = 1 – p-орбиталь, форма объемной восьмерки («гантель»)
o l = 2 – d-орбиталь, более сложная форма
o l = 3 – f-орбиталь, -«-
Электроны с одинаковым l в пределах одного уровня образуют подуровни. Они отличаются энергией связи с ядром. Их число на уровне равно n, но не более 4.
Подуровни обозначают буквами:
o s-подуровень – 1 орбиталь,
o p-подуровень – 3 орбитали,
o d-подуровень – 5 орбиталей,
o f-подуровень – 7 орбиталей.
Элементы, у которых происходит заполнение определенного подуровня, называются соответственно s,p,d,f-элементами.
o s-элементы – элементы главных подгрупп 1 и 2 групп и гелий.
o p-элементы – элементы главных подгрупп 3-8 групп
o d-элементы - элементы вставных декад (переходные элементы)
o f-элементы – лантаноиды и актиноиды.
Магнитное квантовое число m определяет расположение орбитали в пространстве (по осям координат).
m принимает значения от –l до +l, включая 0. Число значений, принимаемых m, определяет число орбиталей на подуровне:
l = 0, m = 0 – 1 s-орбиталь
l = 1, m = -1,0,+1 - 3 p-орбитали
l = 2, m = -2,-1,0, +1,+2 – 5 d-орбиталей
l = 3, m = -3,-2,-1,0,+1,+2,+3 – 7 f-орбиталей
Спиновое квантовое число s характеризует 2 возможных направления вращения электрона вокруг своей оси: s = -½ , s = +½
↑↓ - антипараллельные спины.
32. Принцип Паули. Распределение электронов в атоме по состояниям.
При́нцип Па́ули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона (частиц с полуцелым спином) не могут одновременно находиться в одном квантовом состоянии.
Принцип Паули. В атоме не может быть 2 электронов, все 4 квантовых числа которых были бы одинаковыми. Поэтому на каждой орбитали может находиться не более 2 электронов.
33. Понятие о квантовой статистике Бозе-Эйнштейна. Понятие о квантовой статистике Ферми-Дирака.
Квантовая статистика - раздел статистической физики, исследующий системы, которые состоят из огромного числа частиц, подчиняющихся законам квантовой механики.
Идеальный газ из бозонов - бозе-газ - описывается квантовой статистикой Бозе - Эйнштейна*. Распределение бозонов по энергиям вытекает из так называемого большого канонического распределения Гиббса (с переменным числом частиц) при условии, что число тождественных бозонов в данном квантовом состоянии может быть любым
![]()
Где
![]() , ni — количество частиц в состоянии i,
gi — вырождение уровня i, εi — энергия
состояния i, μ — химпотенциал системы,
k — постоянная Больцмана, T — абсолютное
значение температуры.
, ni — количество частиц в состоянии i,
gi — вырождение уровня i, εi — энергия
состояния i, μ — химпотенциал системы,
k — постоянная Больцмана, T — абсолютное
значение температуры.
Идеальный газ из фермионов - фермн-газ - описывается квантовой статистикой Ферми - Дирака
Статистика Фе́рми — Дира́ка в статистической физике — квантовая статистика, применяемая к системам тождественных фермионов (как правило, частиц с полуцелым спином, подчиняющихся принципу запрета Паули, то есть, одно и то же квантовое состояние не может занимать более одной частицы); определяет статистическое распределение фермионов по энергетическим уровням системы, находящейся в термодинамическом равновесии;
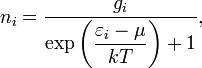
где
ni — среднее число частиц в состоянии i,
Ei — энергия состояния i,
gi — кратность вырождения состояния i (число состояний с энергией ),
μ — химический потенциал (который равен энергии Ферми EF при абсолютном нуле температуры),
k — постоянная Больцмана,
T — абсолютная температура.
