
- •18 Металлические материалы и изделия
- •18.1 Общие сведения
- •18.2 Атомно-кристаллическое строение металлов
- •18.3 Механические свойства и испытания металлов
- •18.4 Производство черных и цветных металлов
- •18.4.1 Получение чугуна
- •18.4.2 Получение стали
- •18.4.3 Получение меди
- •18.4.4 Получение алюминия
- •18.4.5 Получение магния
- •18.5 Производство металлических изделий
- •18.5.1 Получение изделий литьем
- •18.5.2 Обработка металлов давлением
- •18.5.3 Термическая обработка стали
- •18.5.4 Химико-термическая обработка стали
- •18.5.5 Сварка, газовая резка и пайка металлов
- •18.5.6 Металлы, стали и сплавы, применяемые в строительстве:
- •18.5.6.1 Углеродистые и легированные стали
- •18.5.6.2 Чугуны
- •18.5.6.3 Цветные металлы и сплавы
- •18.5.6.4 Сортамент прокатного металла и металлоизделий
- •18.5.6.5 Арматурная сталь
- •18.5.6.6 Рельсы и рельсовые скрепления
- •18.5.6.7 Сталь для мостовых конструкций и водопропускных труб
- •18.6 Коррозия и защита металлов от коррозии
- •Продолжение таблицы 18.9
- •Список литературы
- •Оглавление
18.4.3 Получение меди
Сырьем для выплавки меди служат сульфидные руды – медный колчедан или халькопирит Cu2S и другие с содержанием меди 1–2 %. Медь получают чаще всего пирометаллургическим способом, который включает обогащение руд для получения концентрата, его обжига, плавку на медный штейн, получение черновой меди и ее рафинирование. Обогащение осуществляют флотацией, после чего медный концентрат содержит до 30 % меди. Затем его обжигают для частичного удаления серы (до 50 %) и получают огарок. Плавка на штейн производится в пламенных отражательных или
электропечах при температуре до 1600 °С, затем штейн заливают в конвертор (рисунок 18.18) и перерабатывают в черновую медь. Для шлакования оксидов железа на поверхность штейна загружают кварцевый песок. Затем производят продувку воздухом в два периода.
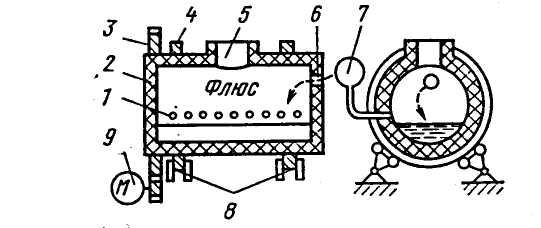
Рисунок 18.18 – Медеплавильный конвертор: 1 – фурмы воздушного дутья;
2 – футеровочный корпус; 3 – зубчатая передача; 4 – обод;
5 – горловина для заливки штейна; 6 – отверстие для загрузки флюса;
7 – воздухопровод; 8–опорные ролики; 9 – электродвигатель с редуктором
В первый период сульфиды железа окисляются кислородом воздуха. FeO, взаимодействуя с SiO2, переходит в шлак, a SO2 направляется на изготовление серной кислоты:
2FeS + ЗО2 = 2FeO + 2SO2 + Q;
2FeO + SiO2 = SiO2 ∙ 2FeO + Q.
Шлак направляют на повторную переработку для извлечения меди. Оставшийся штейн белого цвета продувают вторично воздухом и получают черновую медь:
2Cu2S + ЗО2 = 2Cu2O + 2SO2;
Cu2S + 2Cu2O = 6Cu + SO2.
Она содержит в своем составе до 2 % железа, серы, цинка, никеля, свинца, алюминия и других примесей. Ее рафинируют огневым и электролитическим способами. Огневое рафинирование черновой меди осуществляется в пламенных 400-тонных печах, где ее расплавляют и продувают воздухом. В результате чего образуется 4Сu + О2 = 2Сu2О, который окисляет примеси Al, Si, Mn, Zn, Fe, Ni и др. Не окисляются только золото и серебро. После скачивания шлака медь раскисляют, перемешивая природным газом. Это происходит по реакции
4Сu2О + СН4 = 8Сu + СО2 + 2Н2О.
Расплав с содержанием 99,5–99,7 % меди разливают в слитки или анодные пластины для электролитического рафинирования.
Электролиз осуществляют в ваннах. Электролитом является 15%-ный раствор медного купороса (CuSO4 · 5Н2О) и серной кислоты (H2SO4). В электролит погружают анодные пластины из черновой меди и катоды, изготовленные из чистой электролитической меди. Их подвешивают на анодной и катодной шинах и включают постоянный ток. Металл анодов растворяется и переходит в раствор, а на катодах выделяется металлическая медь чистотой 99,98 %. Ее переплавляют в слитки, из которых получают лист, проволоку, трубы, используют для выплавки латуней и бронз.
18.4.4 Получение алюминия
Алюминий производят из руд, богатых глиноземом. Чаще всего используют бокситы. Состав их следующий, %: AI2O3 – 40–60, Fe2О3 – 15–30, SiO2– 5–15, TiO2 – 2–4 и гидратная вода – 10–15. Процесс получения алюминия включает три этапа: извлечение глинозема из руды, электролиз расплавленного глинозема и получение первичного алюминия, его рафинирование.
Глинозем извлекают мокрым или сухим способами. При мокром – бокситы дробят, измельчают в шаровых мельницах, а затем выдерживают в автоклавах 2–3 часа с концентрированной щелочью при температуре 150–250 °С и давлении до 3 МПа. Происходит взаимодействие между глиноземом и щелочью:
А12О3 + ЗН2О + 2NaOH = Na2O А12О3 + 4 Н2О.
Раствор алюмината натрия в виде пульпы, после фильтрации и разбавления водой, выдерживается в отстойнике, в котором выпадает в осадок гидроксид алюминия,
Na2O ∙ А12О3 + 4 Н2О = 2NaOH + 2А1(ОН)3,
который фильтруют, прокаливают при температуре 1200-1300 °С во вращающихся печах и получают глинозем:
2А1(ОН)3 = А12О3 + 3Н2О.
При сухом способе смесь боксита, соды и известняка спекают во вращающихся печах при температуре 1200 °С. Образуется спек с водорастворимым алюминатом натрия
А12О3 + Na2 CO3 = Na2O · А12О3 + СО2
и нерастворимый в воде силикат кальция CaO · SiO2, в образовании которого участвует известь.
Алюминат натрия извлекают из спека горячей водой и продувают газообразным СО2:
Na2O ∙ А12О3 + 3Н2О + СО2 = 2А1(ОН)3 + Na2 CO3.
Осадок промывают, прокаливают и затем получают глинозем, как при мокром способе.
Глинозем растворяют в расплавленном криолите Na3AlF6, из которого электролизом получают алюминий. Процесс осуществляется в алюминиевой ванне-электролизере (рисунок18.19). Внутренняя поверхность ванны облицована угольными блоками, которые являются катодом. Анодами служат угольные электроды, погруженные в расплав.
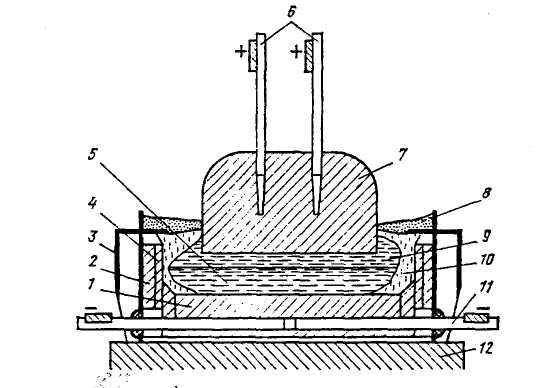
Рисунок 18.19 – Схема электролизера для производства алюминия:
1 – катодные угольные блоки; 2 – огнеупорная футеровка; 3 – стальной кожух;
4 – угольные плиты; 5 – жидкий алюминий; 6 – металлические стержни с шинами;
7 – угольный анод; 8 – глинозем; 9 – жидкий электролит; 10 – корка затвердевшего
электролита; 11 – катодная токоподводящая шина; 12 – фундамент
При температуре 930–950 °С глинозем электролита диссоциирует на ионы:
А12О3 2 А13+ + 3О2-
На поверхности угольной подины, которая служит катодом, ионы восстанавливаются до металла:
2А13+ + 6е = 2А1.
По мере накопления жидкий алюминий периодически удаляется.
Очистка алюминия от примесей А12Оз, Fe, Si, С, Н2 и др. осуществляется чаще всего электролитическим рафинированием, где электролитом являются безводные хлористые и фтористые соли. Получают алюминий чистотой 99,996 %.
