
68
.pdf
22. Вынужденные колебания. Получить уравнение вынужденных колебаний − неоднородное линейное дифференциальное уравнение с постоянными коэффициентами. Записать решение этого уравнения. Получить выражение для амплитуды установившихся вынужденных колебаний. Получить выражение для отставания фазы установившихся вынужденных колебаний от фазы вынуждающей силы.
Вынужденные колебания — колебания, происходящие под воздействием внешних периодических сил.

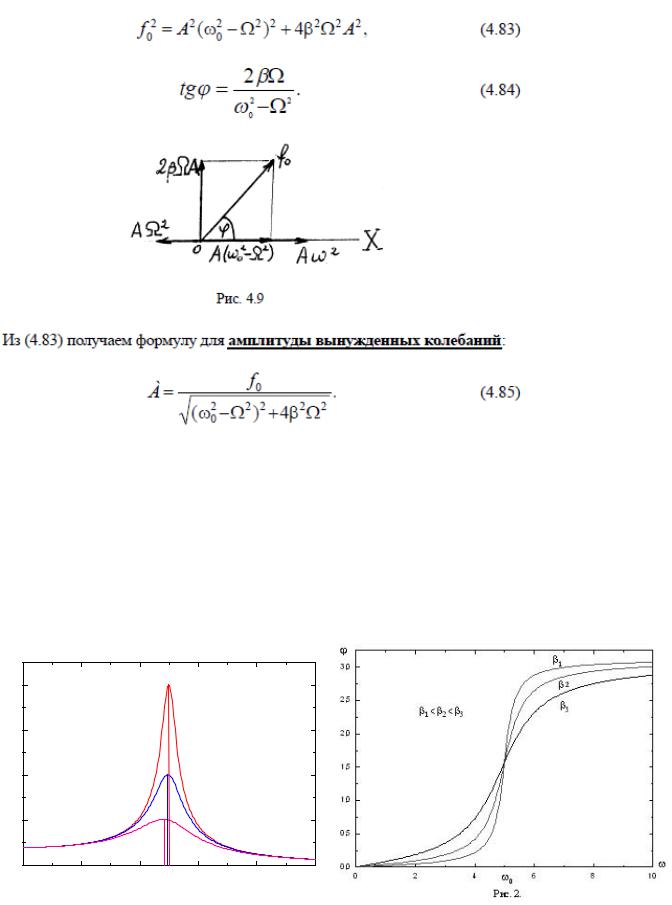
23.Механический резонанс. Резонансные кривые при различных значениях
коэффициента затухания. Фазовые резонансные кривые при различных значениях коэффициента затухания.
Механический резонанс — явление резкого возрастания амплитуды вынужденных колебаний, которое наступает при приближении частоты внешнего воздействия к некоторым значениям (резонансным частотам).
А, отн. ед. |
|
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
|
2,0 |
|
|
|
|
|
|
|
|
1,5 |
|
|
|
|
|
β1>β2>β3 |
|
|
|
|
|
β3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,0 |
|
|
|
|
|
|
|
|
|
|
|
β2 |
|
|
|
|
|
0,5 |
|
|
β1 |
|
|
|
ед. |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
отн. |
||
|
|
|
|
|
|
|
||
0,0 0 |
|
|
|
|
|
|
ω, |
|
2 |
4 |
ω1 |
, ω2 |
6 |
8 |
10 |
ω |
|
|
|
|
, ω3 |
|
|
|
||
|
|
|
|
. 1 |
|
|
|
|
|
|
|
Рис.1. |
|
|
|
||
Резонансные |
|
|
|
|
|
|
фазные |
|
24.Статистический (молекулярно-кинетический) и термодинамический методы исследования. Основные положения молекулярно-кинетической теории газов. Термодинамические системы (открытая, закрытая, изолированная). Состояние системы (равновесное и неравновесное), Процессы (равновесные и неравновесные; обратимые и необратимые). Температура и ее измерение.
Основные положения молекулярно-кинетической теории газов:
-полная хаотичность движения молекул
-средняя скорость молекул пропорциональна корню квадратному из абсолютной температуры
-средне кинетическая энергия молекулы разных газов, находятся при одинаковых температурах, равны между собой.
Система открытая, если возможен энергообмен и обмен веществом.
Система закрытая, если энергообмен возможен, а обмен веществом невозможен. Система изолированная, если невозможен какой-либо обмен системы с окружающей средой.
Обратимым называется процесс, который можно провести в противоположном направлении через все те же самые промежуточные состояния.
Равновесным называется процесс, при котором все состояния, через которые проходит система, являются равновесными состояниями.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния.
Температура -скалярная физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
статистического метода Этот метод основан на том, что свойства
макроскопической системы в конечном счете определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц (скорости, энергии и т. д.)
Термодинамика — раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамика не рассматривает микропроцессы, которые лежат в основе этих превращений. Этим термодинамический метод отличается от статистического.
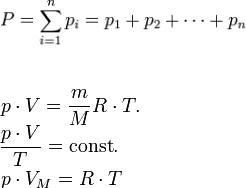
25.Идеальный газ. Эмпирические законы идеального газа. Закон Бойля − Мариотта для изотермических процессов. Закон Дальтона. Уравнение состояния идеального газа − уравнение Клаперона-Менделеева (в трех формах записи).
Идеальный газ - молекулы размерами которых можно пренебречь и которые не взаимодействуют с другими молекулами и со стенками сосуда на расстоянии.
Закон Бойля – Мариотта PV = const- закон Бойля-Мариотта Т= сonst
Закон Дальтона
уравнение Клаперона-Менделеева
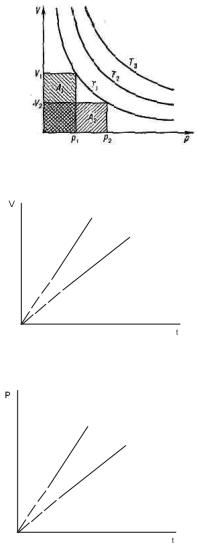
26. Идеальный газэто газ размерами молекул которого можно пренебречь и который не взаимодействует друг с другом и со стенками сосуда на
расстоянии..
Закон Бойля – Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная: pV=const при
T=const, m=const,
Закон Гей-Люссака: объем данной массы газа при постоянном давлении изменяется с температурой линейно:
V=V0(1+αt) при p=const, m=const
Закон Шарля: давление данной массы газа при постоянном объеме изменяется линейно с температурой:
p=p0(1+αt) при v=const, m=const
если t в кельвинах то начало как на графике, а если в цельсиях то начало графика переносится влево по оси иксов до точки (-1/α)
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений p1,p2,...,pnвходящих в нее газов:
p=p1+p2+....+pn
Формулировка закона Шарля следующая: для данной массы газа отношение давления газа к его температуре постоянно, если объем газа не меняется. Эту зависимость математически записывают так:P/Т=const, если V=const и m=const
αu-термический объемный коэффициент. αu=(Р-Р0)/(Р0(t-t0)) – относительное изменение давления при изменении температура на 1 градус. αu=1/273 [K-1]-для любого газа.
Уравнение менделеева-клайперона: PV=(m/M)RT, k=R/Na-постоянная Больцмана, ρ=m/V, P= ρ(RT/M), PV=NkT, p=nkT, n=N/V
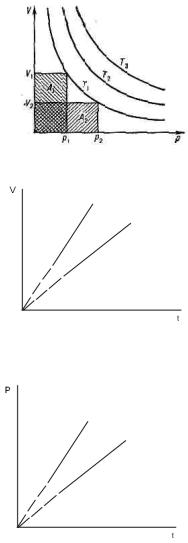
27. Идеальный газ. Эмпирические законы идеального газа. Закон ГейЛюссака для изобарных процессов; термический коэффициент давления (температурный коэффициент давления). Закон Дальтона. Уравнение состояния идеального газа − уравнение Клайперона-Менделеева (в трех формах записи).
Закон Бойля – Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная: pV=const при
T=const, m=const,
Закон Гей-Люссака: объем данной массы газа при постоянном давлении изменяется с температурой линейно:
V=V0(1+αt) при p=const, m=const
Закон Шарля: давление данной массы газа при постоянном объеме изменяется линейно с температурой:
p=p0(1+αt) при v=const, m=const
если t в кельвинах то начало как на графике, а если в цельсиях то начало графика переносится влево по оси иксов до точки (-1/α)
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений p1,p2,...,pnвходящих в нее газов:
p=p1+p2+....+pn
V /Т=const, если P =const и m=const
αp-термический объемный коэффициент. αp=(V-V0)/(V0(t-t0)) – относительное изменение давления при изменении температура на 1 градус.
Уравнение менделеева-клайперона: PV=(m/M)RT, k=R/Na-постоянная Больцмана, ρ=m/V, P= ρ(RT/M), PV=NkT, p=nkT, n=N/V
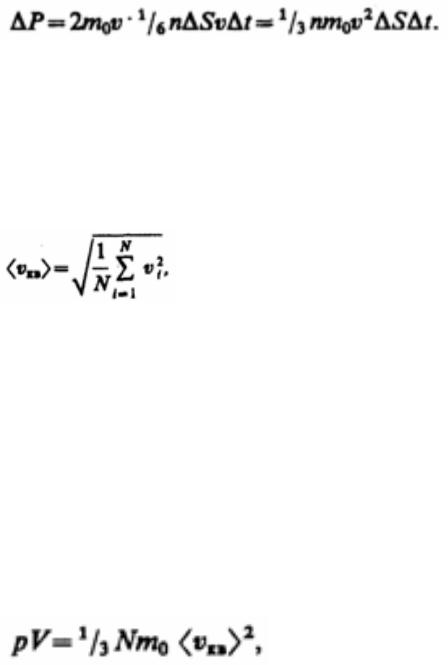
28. Вывод основного уравнения молекулярно кинетической теории идеального газа (в трех формах записи). Молекулярно-кинетическое толкование температуры.
Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных направлений, так что в любой момент времени вдоль каждого из них движется 1/3 молекул, причем половина молекул 1/6 движется вдоль данного направления в одну сторону, половина — в противоположную. Тогда число ударов молекул, движущихся в заданном направлении, о площадку S будет1/6n столкновенииSv t. Прис площадкой эти молекулы передадут ей импульс
Тогда давление газа, оказываемое им на стенку сосуда,
 (43.1)
(43.1)
Если газ в объеме V содержит N молекул, движущихся со скоростями v1, v2, ..., vN, то целесообразно рассматривать среднюю квадратную скорость
(43.2)
характеризующую всю совокупность молекул газа.
Уравнение (43.1) с учетом (43.2) примет вид
 (43.3)
(43.3)
Выражение (43.3) называется основным уравнением молекулярно-кинетической теории идеальных газов. Точный расчет с учетом движения молекул по всевозможным направлениям дает ту же формулу.
Учитывая, что n =N / V, получим
(43.4)
или
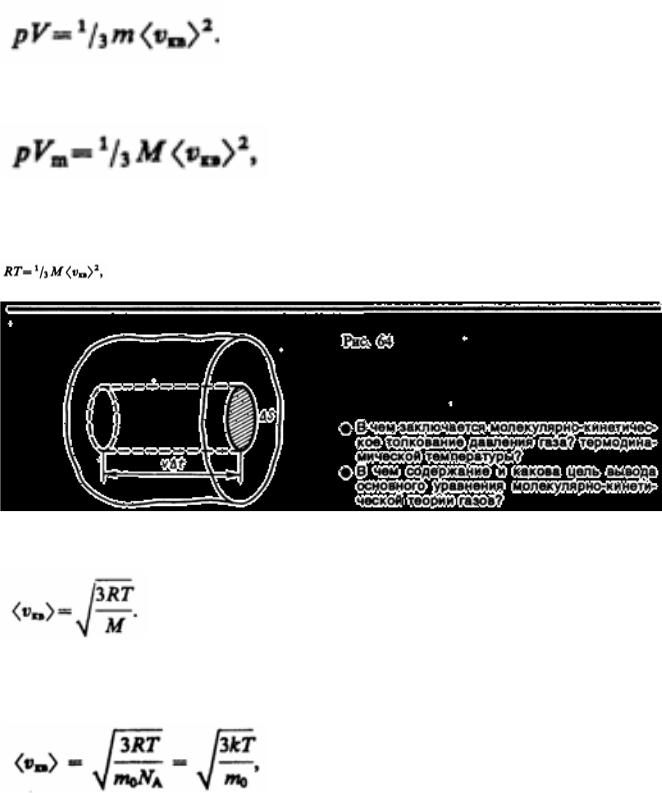
 (43.5)
(43.5)
где Е — суммарная кинетическая энергия поступательного движения всех молекул газа.
Так как масса газа m=Nm0, то уравнение (43.4) можно переписать в виде
Для одного моля газа т=М (М — молярная масса), поэтому
где Vm — молярный объем. С другой стороны, по уравнению Клапейрона — Менделеева, pVm=RT. Таким образом,
откуда
(43.6)
Так как M=m0NА, где т0 — масса одной молекулы, a NА — постоянная Авогадро, то из уравнения (43.6) следует, что
(43.7)
