
- •1. Предмет і мета дисципліни, її місце і роль в навчальному процесі
- •2. Задачі навчальної дисципліни
- •3. Тематичний план та зміст лекційного курсу
- •5. Лабораторні заняття
- •6. Індивідуальні та домашні завдання для самостійної роботи студентів
- •7. Зміст модулів навчальної дисципліни, їх оцінювання в балах, форми і терміни поточного і модульного контролю
- •8. Використання інформаційних технологій або елементів дистанційного навчання
- •9. Критерії контролю успішності навчальної роботи студентів
- •10. Питання для контрольних робіт студентів-заочників
- •11. Питання до екзаменаційних білетів Перший принцип термодинаміки
- •Другий принцип термодинаміки
- •Хімічна рівновага
- •Фазова рівновага і основи фізико-хімічного аналізу
- •Розчини електролітів
- •Електрохімія
- •Хімічна кінетика
- •Поверхневі явища та властивості дисперсних систем
- •12. Список рекомендованої літератури Основна
- •Таблиця відповідності рейтингових балів за національною та європейською шкалами
Хімічна рівновага
Напишіть вирази для константи рівноваги (Кр, Кс, Кn, Кx, K°) хімічних реакцій а)2С2Н5ОН(г.) = (С2Н5)О(г.) + Н2О(г.); б) С2Н5ОН(р.) = С2Н4 + Н2О(р.); в) SnS2 + 2H2 = Sn + 2H2S.
Які фактори впливають на константу рівноваги Кр та Кс, якщо реагуючу систему розглядати як ідеальну?
Чи може константа рівноваги бути від’ємною, додатною, рівній нулю чи нескінченності?
Чи може рівноважний вихід продукту дорівнювати нулеві або бути більшим за одиницю?
Проаналізуйте рівняння ізобари та ізохори хімічної реакції.
Виразіть в загальному вигляді Кр та Кс для реакції СО + Н2 = Н2СО(г.), якщо при даній температурі Т і загальному тиску в системі Р рівноважна кількість формальдегіду дорівнює y, а початкові кількості реагентів складають 1 моль СО та 3 моль Н2.
Виразіть в загальному вигляді Кс для реакції 2НІ = Н2 + І2, якщо дисоціює n моль НІ. Загальний об’єм рівноважної суміші складає V, а ступінь дисоціації НІ – α..
Дисоціація N2O4 перебігає за рівннням N2O4 = 2NO2. При 298 К та Р = 1,0 · 105 Па N2O4 дисоційована на 18,5 %. Визначіть ступінь дисоціації при цій же температурі, якщо Р = 0,5 · 105 Па.
Як зміниться рівноважний вихід ацетону за рівнянням реакції С2Н6 + СО = (СН3)2СО при підвищенні температури, при збільшенні тиску або введенні інертного компонента (при сталому загальному тиску)?
Дисоціація N2O4 перебігає за рівннням N2O4 = 2NO2. При 298 К та Р = 1,0 · 105 Па N2O4 дисоційована на 18,5 %. До якого тиску необхідно стиснути суміш, щоб ступінь дисоціації знизився до 5 %?
Для яких реакцій константа рівноваги Кр дорівнює рівноважному тиску в системі при даній температурі?
Залежність lgKp = f(1/T) є лінійною з позитивним тангенсом кута нахилу. Визначити, ендо- чи екзотермічною є реакція у даному інтервалі температур?
Залежність константи рівноваги деякої реакції від температури описується рівнянням:
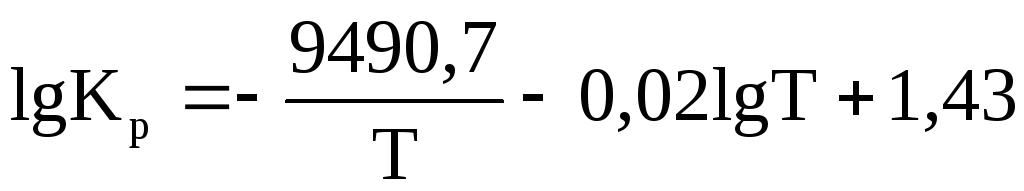 .
Як зміниться вихід продуктів цієї
реакції при підвищенні температури?
Виділяється чи поглинається тепло в
цій реакції?
.
Як зміниться вихід продуктів цієї
реакції при підвищенні температури?
Виділяється чи поглинається тепло в
цій реакції?Виразіть константу рівноваги для реакції (NH4)2CО3(тв) = 2NH3 + СО2 + Н2О(г.) через загальний тиск в системі Р.
При деякій температурі загальний тиск в системі NH4Cl(тв) = NH3 + HCl дорівнює 0,5.103 Па. Обчислити константу рівноваги Кр при даній температурі.
Знайти розчинність PbSO4, якщо розчинення відбувається за схемою:
 при Т = 298 К. (Добуток розчинності є
константа рівноваги зазначеного
процесу).
при Т = 298 К. (Добуток розчинності є
константа рівноваги зазначеного
процесу). Для реакції С + 2Н2 = СН4
 .
Чи можливо утворення метану при Т = 400
К і р = 1,013.105
Па , якщо газ, що вступає в стикання з
вуглецем, складається з 10% мол. СН4,
80% мол. Н2
і 10% мол. N2?
.
Чи можливо утворення метану при Т = 400
К і р = 1,013.105
Па , якщо газ, що вступає в стикання з
вуглецем, складається з 10% мол. СН4,
80% мол. Н2
і 10% мол. N2?
Розрахуйте число молей PCl5 у рівноважній суміші при температурі Т і загальному тиску 2.105 Па, якщо 4 моля PCl3(газ) змішані з 2 молями Cl2(газ), а константа рівноваги реакції PCl3(г) + Cl2 = PCl5(г) дорівнює Кр = 1.10-5 Па-1 при тій самій температурі.
Добуток розчинності AgCl при 25оС дорівнює 1,55.10-10 і 13,2.10-10 при 50оС. Визначте теплоту розчинення.
Тиск дисоціації магній карбонату при 813 К дорівнює 0,996.105 Па, а при 843 К – 1,786.105 Па. Обчисліть, за якої температури тиск дисоціації буде дорівнювати 1,5.105 Па.
Обчисліть тепловий ефект реакції при 800 К N2 + O2 = 2NO, якщо
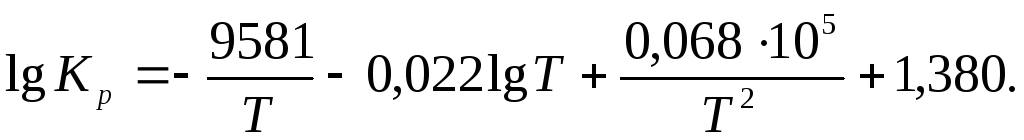
Напишіть математичне співвідношення між величинами Кр і Кс для хімічної реакції CH4 + 3Cl2 = CHCl3 + 3HCl.
Константа рівноваги реакції А(г) + В(г) = 4С(г) дорівнює 4. Розрахувати рівноважну кількість молей продукту С, якщо для реакції були взяті 2 моля А і 1 моль В.
Газоподібні речовини реагують за рівнянням 2А(г) + В(г) = С(г). Обчисліть константи рівноваги Кр і Кс, якщо при взаємодії 2 моль речовини А і 1 моля речовини В утворюється 0,5 моля компонента С.
Константа рівноваги реакції 2HI = H2 + I2(г) при Т = 693 К дорівнює 0,02. Обчислити вихід продукту реакції, якщо вихідні речовини були взяті в стехіометричному співвідношенні.
Стандартна спорідненість
 хімічної реакціїCl2
+ H2
= 2HCl(г)
дорівнює -190,6 кДж/моль. Розрахувати
константу рівноваги цієї реакції.
хімічної реакціїCl2
+ H2
= 2HCl(г)
дорівнює -190,6 кДж/моль. Розрахувати
константу рівноваги цієї реакції. Використовуючи таблиці стандартних величин, обчислити константу рівноваги реакції 2С6Н5СН3 = м-С6Н4(СН3)2 + С6Н6 і склад рівноважної суміші у молярних долях при стандартних умовах.
Використовуючи таблиці стандартних величин, обчислити за методом Тьомкіна-Шварцмана константу рівноваги реакції 1/2S2 + 3/2O2 = SO3 при 1000 К.
Обчислити тиск термічної дисоціації СаCO3 при Т = 800 К. Термічна дисоціація СаCO3 відбувається за рівнянням СаCO3 = СаO + CO2.
Обчисліть константу рівноваги К° реакції, яка проводиться у газовій фазі CH4 + 2H2O = CO2 + 4H2 при 1000 К.
Для реакції N2O4 = 2NO2 при 328 К константа рівноваги Кс = 50,6·10-3 моль/л. Скільки молей N2O4 необхідно помістити у посудину ємністю 5 л для того, щоб при рівновазі концентрація NO2 у ній стала дорівнювати 0,1 моль/л?
При певній температурі загальний тиск в рівноважній системі 4Fe + 3O2 = 2Fe2O3 дорівнює р. Виразіть константи рівноваги Кр і Ко цієї реакції через загальний тиск.
Константа рівноваги реакції H2O + Cl2 = 2HCl + 0,5O2 дорівнює
 ´,
а
´,
а ´´
– константа рівноваги реакції2H2O
+ 2Cl2
=
4HCl + O2.
Чи будуть відрізнятися численні значення
´´
– константа рівноваги реакції2H2O
+ 2Cl2
=
4HCl + O2.
Чи будуть відрізнятися численні значення
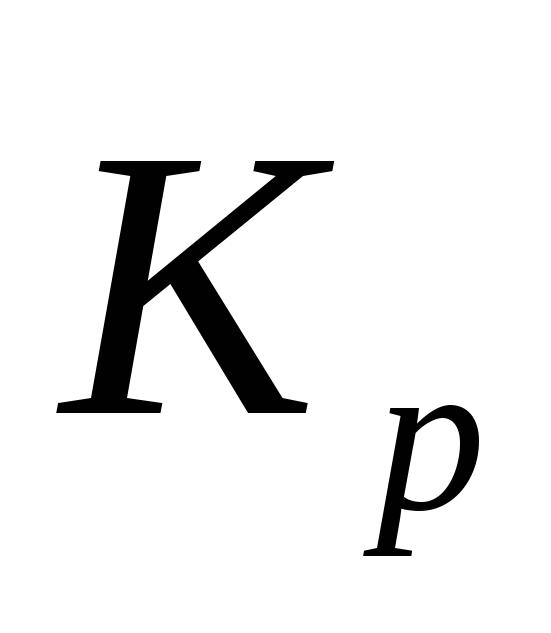 ´
і
´
і ´´
при однаковій температурі? Напишіть,
як зв’язані між собою
´´
при однаковій температурі? Напишіть,
як зв’язані між собою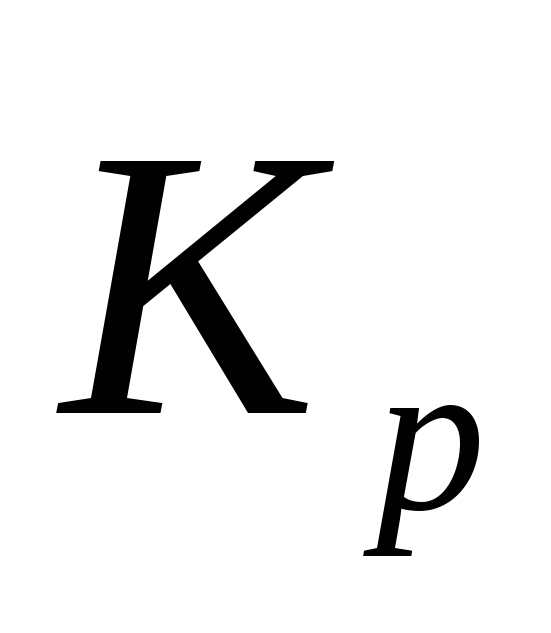 ´
і
´
і ´´.
´´.Константа рівноваги конверсії метану з водяною парою СН4 + Н2О(г) = СО + 3Н2 при температурі Т = 1000 К дорівнює К° = 24,0. Розрахувати склад рівноважної суміші при заданій температурі і тиску 1,013.105 Па, якщо вихідна суміш взята в стехіометричному співвідношенні.
При підвищенні температури рівноважний тиск водяної пари над Са(ОН)2 зростає. З поглинанням чи виділенням тепла відбувається дисоціація Са(ОН)2?
Зобразіть схематично графік залежності константи рівноваги Кр від температури Т, якщо у даному інтервалі температур тепловий ефект реакції ΔН > 0.
Розрахуйте константу рівноваги Кр реакції Cu2O + 1/2O2 = 2CuO при температурі Т = 500 К.
Визначте стандартну спорідненість реакції C2Н4 + Н2 = С2Н6, якщо при 873 К Кр = 2,86 · 10-4.
Деяка кількість SO3 нагріта в замкненому реакторі до 727 К. Внаслідок термічної дисоціації утворилися SO2 та О2. Розрахуйте загальний тиск реакційної суміші, якщо Кр реакції SO3 = SO2 + 0,5О2 дорівнює 0,539, а рівноважний тиск SO2 – 4,05 · 104 Па.
Виразіть константу рівноваги Кр та К° реакції між ідеальними газами А і В, взятими в стехіометричному співвідношенні 4А + В = 2С(г) + D(г.), якщо х – число молей утвореної сполуки С (газ), р – рівноважний тиск.
