
- •1. Предмет і мета дисципліни, її місце і роль в навчальному процесі
- •2. Задачі навчальної дисципліни
- •3. Тематичний план та зміст лекційного курсу
- •5. Лабораторні заняття
- •6. Індивідуальні та домашні завдання для самостійної роботи студентів
- •7. Зміст модулів навчальної дисципліни, їх оцінювання в балах, форми і терміни поточного і модульного контролю
- •8. Використання інформаційних технологій або елементів дистанційного навчання
- •9. Критерії контролю успішності навчальної роботи студентів
- •10. Питання для контрольних робіт студентів-заочників
- •11. Питання до екзаменаційних білетів Перший принцип термодинаміки
- •Другий принцип термодинаміки
- •Хімічна рівновага
- •Фазова рівновага і основи фізико-хімічного аналізу
- •Розчини електролітів
- •Електрохімія
- •Хімічна кінетика
- •Поверхневі явища та властивості дисперсних систем
- •12. Список рекомендованої літератури Основна
- •Таблиця відповідності рейтингових балів за національною та європейською шкалами
11. Питання до екзаменаційних білетів Перший принцип термодинаміки
Роботу розширення від V1 до V2 можна обчислити за формулою:
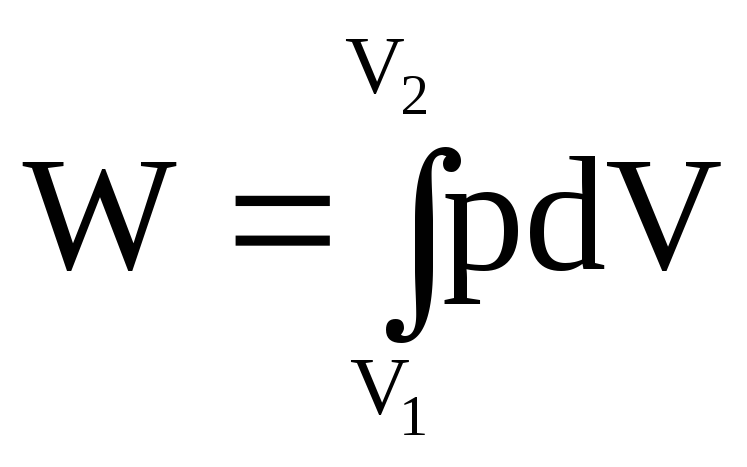 .
.
Для газоподібного, рідкого чи твердого стану речовини застосовується це рівняння?
Робота ізотермічного розширення обчислюється за рівнянням:
![]() .
.
Як можна розрахувати роботу стиснення при цієї ж температурі від V2 до V1? Чому це рівняння не застосовується для реальних газів?
При переході системи із стану 1 в стан 2 оборотним шляхом роботу розширення можна обчислити за рівняннями:
 ,
W = p(V2
– V1)
і
W = RΔT.
,
W = p(V2
– V1)
і
W = RΔT.
У чому відмінність цих рівнянь?
Для яких процесів робота розширення обчислюється за рівняннями: W = -ΔU і W = Cv(T1 – T2)?
Для яких процесів робота розширення обчислюється за рівняннями: W = R і W = RT?
Виведіть рівняння для розрахунку роботи розширення 1 моля ідеального газу при підвищенні його температури на ΔТ при сталому тиску.
Виведіть рівняння для розрахунку роботи, необхідної для ізотермічного стиснення 1 моля ідеального газу від тиску р1 до тиску р2 при температурі Т.
Виведіть формулу для розрахунку роботи адіабатного розширення 1 моля ідеального газу при зниженні температури від Т2 до Т1. Врахувати залежність теплоємності від температури.
У якому з процесів розширення ідеального газу від об’єму V1 до об’єму V2 робота буде більша: в ізотермічному чи ізобаричному? Чому?
0,45 кг повітря під тиском 26.105 Па займають об’єм 0,11 м3. Визначити роботу, виконану повітрям, якщо об’єм його при сталому тиску збільшується в 4 рази.
Розрахуйте температуру суміші в процесі змішування 4 кг води при 363 К з 2 кг води при 285 К. Прийняти, що теплоємність води Ср дорівнює 76,0 Дж/моль·К і не залежить від температури.
Розрахуйте середню теплоємність Ср FeS2 в інтервалі температур від 298 до 348 К, якщо його істинна теплоємність виражається рівнянням: Ср = 74,81 + 5,52.10-3Т – 12,76.105/Т2 Дж/моль·К.
Сформулюйте перший принцип термодинаміки та запишіть його математичний вираз для різних фізико-хімічних процесів (ізотермічного, ізобарного, ізохорного, адіабатного). Які величини у цих рівняннях є функціями стану?
Що таке функція стану? Наведіть приклади.
Яку кількість теплоти необхідно витратити, щоб 4 кг натрію розплавити при температурі його плавлення 97,9°С? (ΔНпл. = 2600 Дж/моль).
Як залежить внутрішня енергія індивідуальної речовини від температури? Напишіть в диференційному і інтегральному вигляді математичний вираз цієї залежності.
Як залежить від температури ентальпія індивідуальної речовини? Напишіть математичний вираз цієї залежності в диференційній і інтегральній формі.
Наскільки відрізняються ізобарний і ізохорний теплові ефекти реакції Sn(р) + 2S(г) = SnS2(тв.) при 450 К?
Стандартна теплота утворення рідкого етанолу С2Н6О дорівнює -276,98 кДж/моль. Напишіть рівняння реакції, до якої відноситься цей тепловий ефект. Екзо- чи ендотермічна ця реакція?
Напишіть рівняння реакції, тепловий ефект якої дорівнює стандартній теплоті згоряння фенолу.
Якщо для прямої реакції ізобарний тепловий ефект ΔH менш ізохорного ΔU, то чи збережеться це співвідношення між ΔH i ΔU для зворотної реакції?
Розрахувати зміну ентальпії при 298 К для реакції розбавлених водних розчинів MnCl2 та Na2S.
Розрахуйте теплові ефекти при сталому тиску та сталому об’ємі при 298 К для реакции:
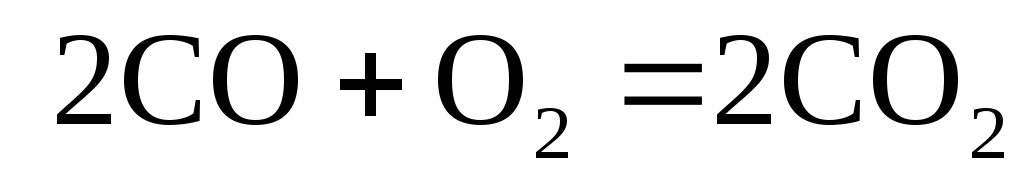
Яке співвідношення між ізохорною і ізобарною теплотами випаровування
 і
і чистих
рідин, якщо їхня пара підкоряється
законам ідеальних газів?
чистих
рідин, якщо їхня пара підкоряється
законам ідеальних газів?Яке співвідношення між ізохорною і ізобарною теплотами сублімації
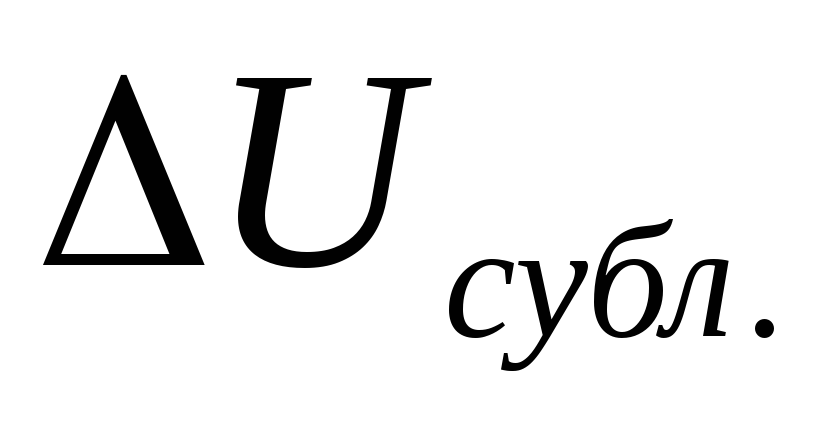 і
і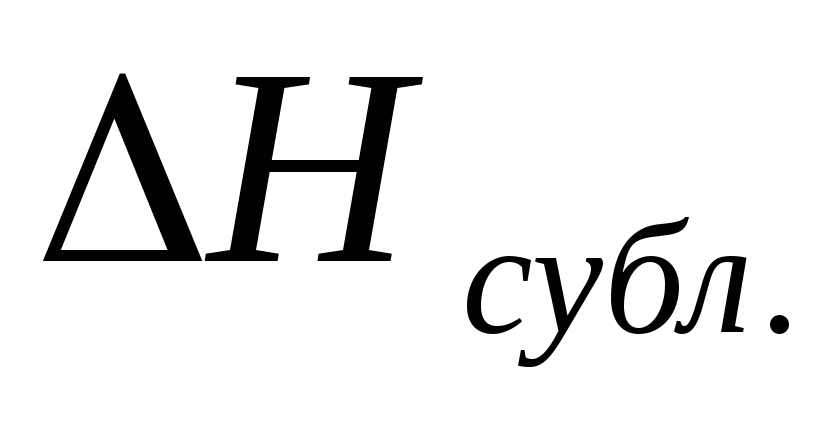 чистих
рідин, якщо їхня пара підкоряється
законам ідеальних газів?
чистих
рідин, якщо їхня пара підкоряється
законам ідеальних газів? Поясніть, як розраховується тепловий ефект хімічної реакції за теплотами утворення вихідних речовин і продуктів реакції.
Поясніть, як розраховується тепловий ефект хімічної реакції за теплотами згоряння вихідних речовин і продуктів реакції.
Сформулюйте закон Гесса та наслідки з нього. Як закон Гесcа використовується для розрахунків теплових ефектів?
Стандартна теплота згоряння циклопентану при 25оС дорівнює -3290,73 кДж/моль. Знайти тепловий ефект реакції 5С + 5Н2 = С5Н10, якщо теплоти утворення
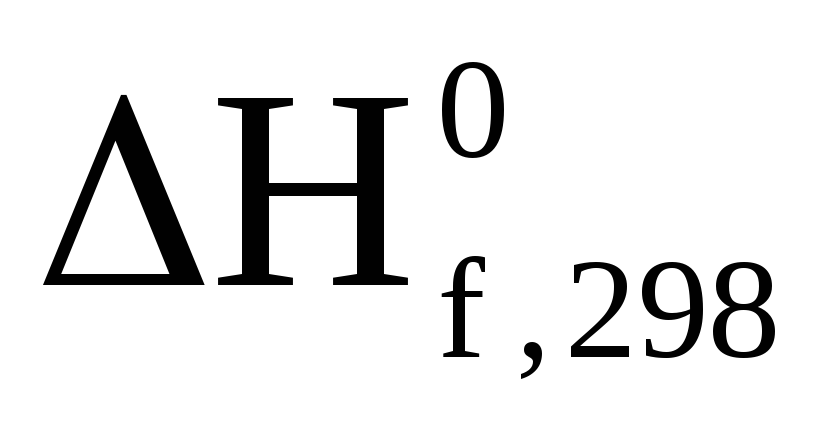 СО2
і рідкої води дорівнюють –394,1 і –286,2
кДж/моль відповідно.
СО2
і рідкої води дорівнюють –394,1 і –286,2
кДж/моль відповідно.Розрахуйте тепловий ефект хімічної реакції С2Н2 + 2Н2 = С2Н6, якщо теплоти згоряння ацетилену, водню та етану складають -1299,63, -286,2 та -1559,88 кДж/моль відповідно.
Розрахуйте тепловий ефект реакції SnCl2 + Cl2 = SnCl4, якщо теплові ефекти реакцій утворення SnCl2 і SnCl4 дорівнюють -330,95 та -528,86 кДж/моль відповідно.
Виділяється чи поглинається тепло і в якій кількості в процесі фазового переходу Рбел → Ркрасн. при 298 К?
Виведіть і проаналізуйте рівняння Кірхгоффа залежності теплового ефекту хімічної реакції від температури.
Закінчіть рівності і поясніть смисл одержаних рівнянь:
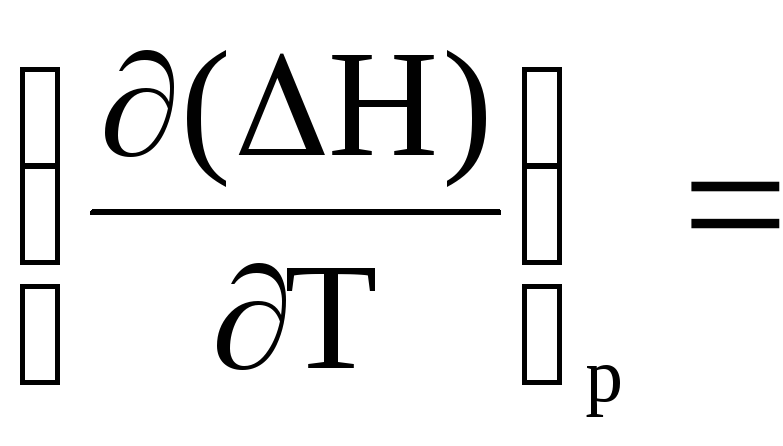 і
і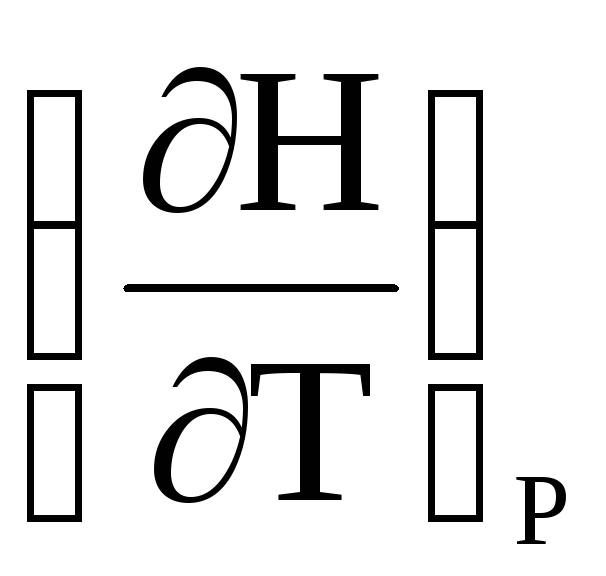 =
=Закінчіть рівності і поясніть смисл одержаних рівнянь:
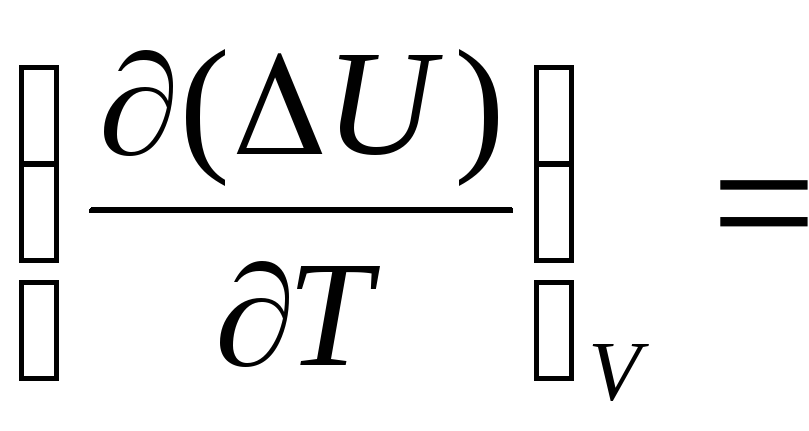 і
і =
=Наведіть приклади реакцій, для яких ΔН = ΔU.
Покажіть, що для ізотермічного розширення ідеального газу ΔН = 0.
Обчислити тепловий ефект утворення Fe2O3 при 500 К і стандартному тиску.
Що більше: теплота випаровування води ΔНвип. при 25оС чи при 90оС і чому? Теплоємність рідкої води і пари вважати сталими в цьому температурному інтервалі.
Теплота випаровування метанолу при 298 К дорівнює 37,5 кДж/моль. Визначте теплоту випаровування метанолу при 330 К. Теплоємності рідкого і газоподібного метанолу візьміть з довідника і вважайте їх незалежними від температури.
Визначте тепловий ефект реакції 2SO2 + О2 = 2SO3 при 330 К, якщо прийняти, що теплоємності всіх реагуючих речовин не залежать від температури і дорівнюють теплоємностям при 298 К.
