
- •1. Предмет і мета дисципліни, її місце і роль в навчальному процесі
- •2. Задачі навчальної дисципліни
- •3. Тематичний план та зміст лекційного курсу
- •5. Лабораторні заняття
- •6. Індивідуальні та домашні завдання для самостійної роботи студентів
- •7. Зміст модулів навчальної дисципліни, їх оцінювання в балах, форми і терміни поточного і модульного контролю
- •8. Використання інформаційних технологій або елементів дистанційного навчання
- •9. Критерії контролю успішності навчальної роботи студентів
- •10. Питання для контрольних робіт студентів-заочників
- •11. Питання до екзаменаційних білетів Перший принцип термодинаміки
- •Другий принцип термодинаміки
- •Хімічна рівновага
- •Фазова рівновага і основи фізико-хімічного аналізу
- •Розчини електролітів
- •Електрохімія
- •Хімічна кінетика
- •Поверхневі явища та властивості дисперсних систем
- •12. Список рекомендованої літератури Основна
- •Таблиця відповідності рейтингових балів за національною та європейською шкалами
Фазова рівновага і основи фізико-хімічного аналізу
Що називають фазою, компонентом та ступенем свободи?
Що показує число ступенів свободи? Як його розрахувати?
Скільки фаз та ступенів свободи на площині, лініях та в потрійній точці на діаграмі стану води? За яких умов система має мінімум стпенів свободи та чому він дорівнює?
Як вивести рівняння Клапейрона – Клаузіуса, виходячи з рівності питомих або молярних значень енергії Гіббса речовини в фазах, що співіснують?
Як і чому залежить теплота випаровування від температури? Якого значення вона набуває при критичній температурі?
Як графічно визначити температуру випаровування рідини при заданій температурі? Схематично нарисуйте графік, яким необхідно користуватися, та ввиведіть відповідну розрахункову формулу.
Як залежить тиск насиченої пари над твердим тілом від температури? Як графічно визначити температуру сублімації речовини при заданій температурі?
До якого значення потрібно знизити тиск, щоб температура кипіння води знизилась до 355 К, якщо в нормальних умовах вона кипіть при 373 К, а середня теплота її випаровування складає 40,66 к Дж/моль?
Розрахуйте зміну ентропії при ізотермічному випаровуванні 2 кг тетрабромметану при нормальному тиску, якщо залежність тиску насиченої пари від температури виражає рівняння: lgP = 10,89 -2665·Т-1.
Розрахуйте теплоту випаровування фреону при 310 К, якщо залежність тиску насиченої пари ССl2F2 від температури виражається рівнянням lgP = 34,5 - 2406,1·T-1 – 9,26·lgT + 0,037·T.
Визначіть, наскільки треба підвищити тиск, щод ртуть плавилась при 237,5 К, якщо при температурі потрійної точки (234,3 К) теплота плавління ΔНпл. = 2266 Дж/моль, а густини твердої та рідкої фаз відповідно складають 14,19 та 13,69 г/см3.
Маємо розбавлений розчин леткої речовини в рідкому леткому розчиннику. За яким значеням змінюється тиск насиченої пари розчиненорї речовини, як функція його концентрації у розчині?
Як залежить тиск насиченої пари розчину від концентрації нелеткої речовини при даній температурі? Як визначити відносне пониження тиску пари над розчином при довільній температурі? Виведіть рівняння закону Рауля.
Виведіть рівняння залежності температури кипіння розчину нелеткої речовини від концентрації. Наведіть рівняння, яке дозволяє розрахувати ебуліоскопічну сталу.
Виведіть рівняння залежності температури замерзання розчину нелеткої речовини від концентрації. Наведіть рівняння, яке дозволяє розрахувати кріоскопічну сталу.
Вкажіть, якими властивостями розчинника або розчиненої речовини визначається величина ебуліоскопичної та кріоскопічної сталих.
Як залежить розчинність газів від тиску? При яких умовах розчинність газів підлягає закону Генрі?
Температура кипіння трихлорметану 61,3°С. Його молярна теплота випаровування 31,42 кДж/моль. Розрахуйте ебуліоскопічну сталу трихлорметану.
В 2 кг води розчинено 0,05 кг сахара (М = 342). Розрахуйте тиск пари цього розчину при 373 К.
При 293 К тиск пари сірчастого етеру складає 58,9 кПа, а тиск пари розчину, що містить 6,1 г бензойної кислоти в 50 г етеру, дорівнює 54,8 кПа. Розрахуйте молекулярну масу кислоти в етері та відносну помилку опита у відсотках порівняльно зі значенням, яке наведено у довідникових таблицях.
Теплота випаровування толуола 37,99 кДж/моль. Розрахуйте підвищення температури кипіння розчину, який містить 0,0025 моль розчиненої нелеткої речовини в 0,250 кг толуола, якщо температура кипіння толуола складає 110,6°С.
Сформулюйте закони Коновалова. Поясніть ці закони на діаграмах склад – температура кипіння.
Накреслити та пояснити діаграми склад – температура кипіння для розчинів зі значним негативним або позитивним відхиленням від закона Рауля.
Що називають азеотропною сумішшю?
При 370 К тиск пари води 9,094 · 104 Па, а нафталіна – 0,221 · 104 Па. Обчислити, яка кількість води потрібна для перегонки 500 г нафталіна, якщо нафталін практично нерозчинний у воді.
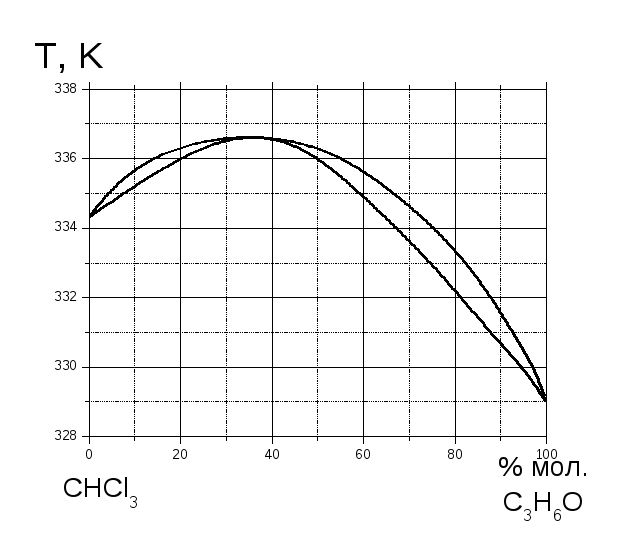
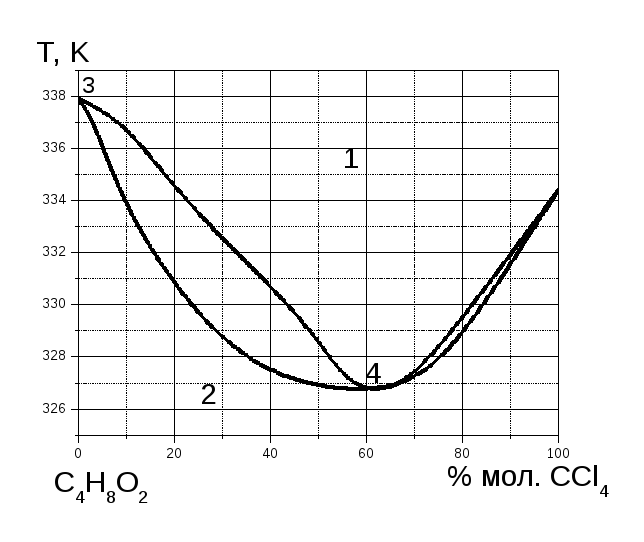
Рис. 1.
Рис. 2
Використовуючи діаграму “температура кипіння – склад” для бінарної системи CНCl3 – C3H6O (рис. 1), визначити, при якій температурі розпочинається кипіння рідини, котра містить 20 мол. % трихлорметану, який склад першої бульбашки пару, при якій температурі зникне остання крапля рідини та її склад.
За допомогою діаграми “температура кипіння – склад” для бінарної системи CCl4 – C4H8O2 (рис. 2), визначити, кількість та склад рівноважних фаз, а також число ступенів свободи у фігуративних точках.
Використовуючи діаграму “температура кипіння – склад” для бінарної системи CCl4 – C4H8O2 (рис. 2), визначити, який компонент і в якій кількості можна виділити з системи, що містить 500 г CCl4 та 600г C4H8O2.
Використовуючи діаграму “температура кипіння – склад” для бінарної системи CНCl3 – C3H6O (рис. 1), визначити, який компонент і в якій кількості треба додати до системи, котра містить 8 моль CНCl3 та 10 моль C3H6O, щоб отримати азеотропну суміш.
За допомогою діаграми “температура кипіння – склад” (рис. 1) визначте скільки (кг) трихлорметану та ацетону знаходиться в парах та рідкій фазі, якщо 2 кг системи, котра містить 15 мол. % ацетону нагріти до 336 К.
