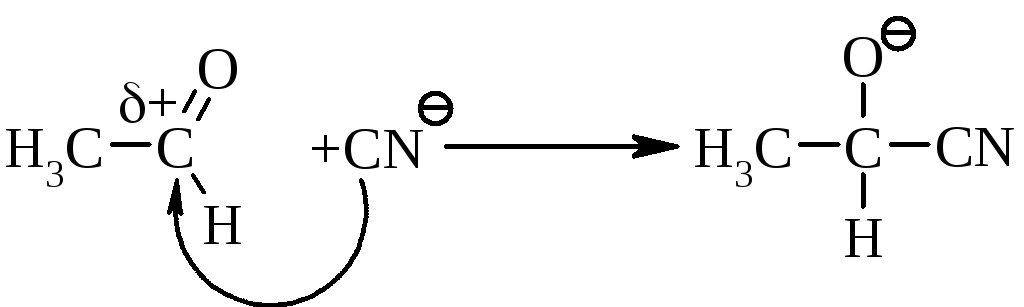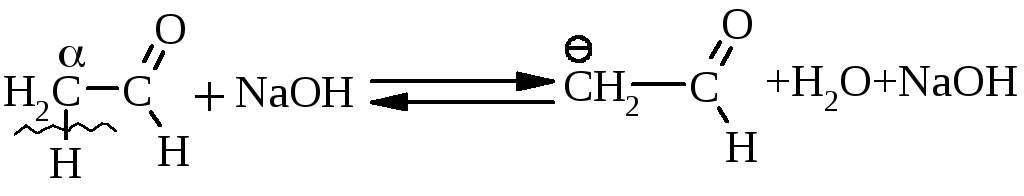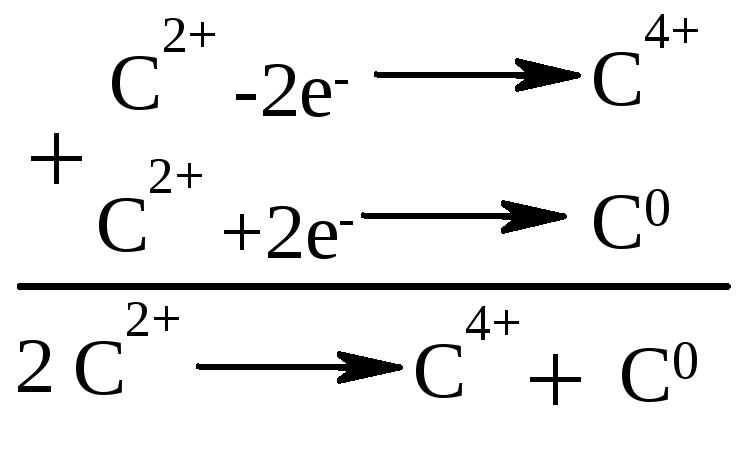- •16. Альдегіди та кетони
- •1. Класифікація. Номенклатура.
- •2. Методи отримання.
- •2.5. При піролізі солей карбонових кислот із двохвалентними металами (m: Ca, Ba, Mn, Th) утворюються альдегіди або кетони за загальною схемою:
- •3. Будова карбонільної групи.
- •4. Фізичні властивості.
- •5. Хімічні властивості.
- •6. Екологічні питання
4. Фізичні властивості.
Альдегіди та кетони, на відміну від спиртів, не утворюють асоційованих міжмолекулярних водневих зв’язків, тому їх температури кипіння значно нижче, ніж у спиртів. Деякі фізичні константи альдегідів та кетонів наведені, відповідно, у табл. 15.1 та 15.2. Нижчі альдегіди та кетони (ацетон, формальдегід, ацетальдегід) – розчинні у воді, а вищі добре розчинні у більшості органічних розчинниках (спирти, етери, естери тощо). Альдегіди С1-С4 мають різкий та неприємний запах, вищі – запах квітів (використовуються у парфюмерії).
5. Хімічні властивості.
5.1. Реакція нуклеофільного приєднання.
При дії полярних реагентів (А-–В+) сильно поляризований карбонільний зв’язок >C+=O-легко переходить в простий зв’язок за наступною схемою:

Субстрат:алкіл- та арилальдегіди і кетони.
Реагент:
H+–OH-,
H+–OR-,
H+–CN-,
H+–SO3Na-,
R-–MgBr+,
PCl5
(![]() ).
).
Загальна схема перетворень:

Механізм нуклеофільного приєднання (AN):
|
1. |
Каталізатор: |
|
утворення нуклеофіла | ||
|
2. |
Перша стадія, йде повільно (лімітуюча): |
| |||
|
3. |
Друга стадія, йде швидко: |
| |||
|
4. |
Регенерація каталізатора: |
| |||
Сіль може утворюватись і при
обробці HCN
лугом: ![]() ,
тому можна стверджувати, що реакція
каталізується лугом, що призводить до
реального збільшення концентрації
нуклеофільного реагента
,
тому можна стверджувати, що реакція
каталізується лугом, що призводить до
реального збільшення концентрації
нуклеофільного реагента ![]() .
.
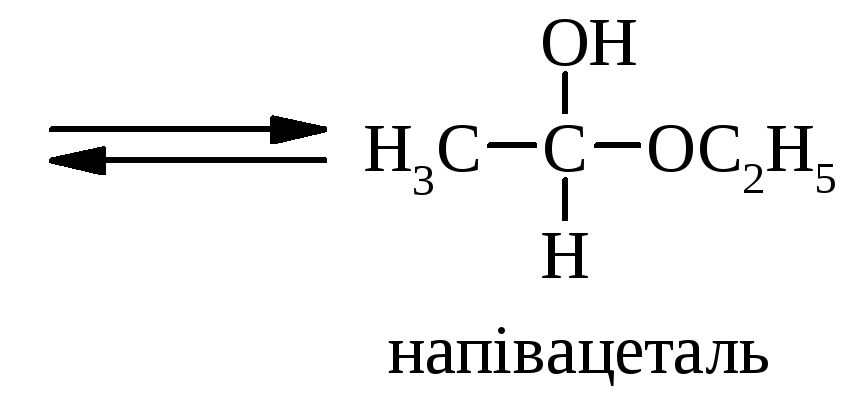
Приєднання спиртів ROH, наприклад, може проходити при кислотному каталізі:

Механізм реакції утворення диетилацеталя оцтового альдегіда:
|
1. |
| ||
|
|
|
далі реакція іде обов’язково у присутності безводної сильної кислоти. | |
|
2. |
| ||
|
|
|
диетилацеталь ацетальдегіда (повний ацеталь) | |
5.2. Реакції за участю атома гідрогена, що знаходиться в -положенні відносно карбонільної групи.
5.2.1. Карбонільні сполуки легко галогенуються (Cl2 або Br2) заміщенням атома гідрогена, що знаходиться у -положенні по схемі:
|
|
-бромпропіоновий альдегід | |
|
|
2-хлорпентанон-3 | |
У випадку ацетальдегіда або ацетона із надлишком хлора в лужному середовищі реакція проходить із повним хлоруванням метильної групи:

а далі сильно поляризований С-С зв’язок розривається під впливом лугу з утворенням хлороформа та форміата натрія.
5.2.2. Реакція конденсації кетонів і особливо альдегідів проходить на холоду при дії лужних або кислотних каталізаторів.
5.2.2.1. Альдольна конденсація ацетальдегідапід дією лужних розчинів при охолодженні проходить за схемою:

Механізм реакції (AN):
|
1. |
Дія лугу визначається утворенням нуклеофільного реагента (карбаніона):
| |
|
2. |
Взаємодія із другою молекулою ацетальдегіда:
| |
|
3. |
Регенерація каталізатора: |
|
5.2.2.2. Кротонова конденсація пропіонового альдегіда проходить аналогічно альдольній, лише у цьому випадку малостійкий альдоль відщеплює молекулу води, утворюючі похідні кротонового альдегіда:

Таким чином, якщо конденсація альдегідів супроводжується відщепленням води, то вона називається кротоновою.
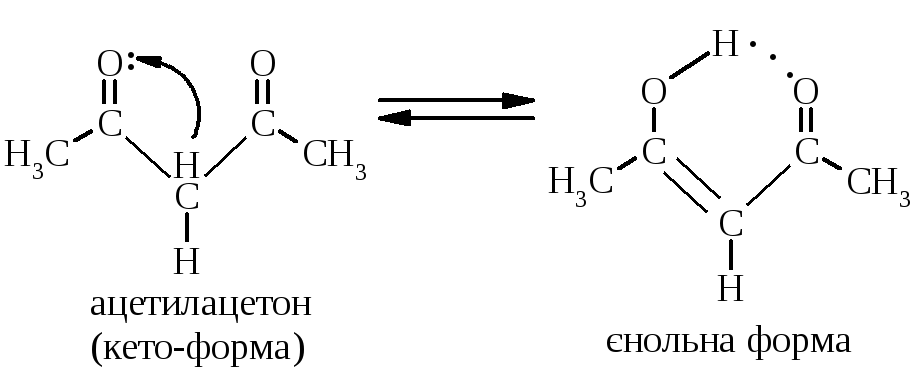
5.2.3. Кето-єнольна таутомерія визначається наявністю рухливих атомів гідрогену в -положенні відносно карбонільної групи:

За звичайних умов рівновага практично націло зміщується у бік кето-форми. Лише в окремих випадках єнольна форма може існувати за рахунок, наприклад, внутрішньомолекулярного водневого зв’язку:
|
|
стабілізація єнольної форми відбувається за рахунок утворення водневого зв’язку |
5.3. Реакції заміщення карбонільного оксигена при взаємодії з аміаком або його похідними проходять за загальною схемою:

Карбонільна складова: альдегіди та кетони аліфатичного та ароматичного рядів.
Аміноскладова:
R=H
(NH3
– аміак); R=
NH2H2O
(N2H4H2O
– гідразингідрат); R=OH
(NH2OH
– гідроксиламін); R=NHC6H5
(NH2–NH–C6H5
– фенілгідразин); 
5.3.1. При взаємодії альдегідів із аміакомутворюються малостабільні альдіміни, які стабілізуються тримеризацією з утворенням гексагідро-1,3,5-триазинів:
|
|
2,4,6-тризаміщенний гексагідро-1,3,5-триазин |
Реакція із кетонами проходить більш складно.
5.3.2. Первинні аміни взаємодіють із альдегідами, утворюючи азометини (основи Шифа):
|
|
кристалічні речовини жовтого або оранжевого кольору |
5.3.3. Взаємодія альдегідів та кетонів із гідразином та його похідними має велике значення і проходить з утворенням гідразонів:

Гідразони – кристалічні речовини, які використовуються для ідентифікації альдегідів і кетонів, наприклад, реакцією із 2,4-динітрофенілгідразином.
5.3.4. Взаємодією альдегідів і кетонів з гідроксиламіном, що відбувається наступним чином, використовують також для їх ідентифікації:

5.4. Альдегіди та кетони по-різному відносяться до реакції окиснення.
Альдегіди легко окиснюються до карбонових кислот з тим же вуглецевим скелетом такими слабкими окисниками, як кисень повітря, солі Cu2+та Ag+:

Реакція із аміачним розчином гідроксида срібла є якісною реакцією на альдегіди (реакція „срібного дзеркала”):

при цьому вихідний аміачний розчин гідроксида срібла утворюється при взаємодії нітрата срібла та гідроксида амонія:

Кетони окиснюються
лише під дією сильних окисників (![]() )
з розщепленням зв’язку С–С вуглецевого
скелета та утворенням відповідних
кислот:
)
з розщепленням зв’язку С–С вуглецевого
скелета та утворенням відповідних
кислот:

5.5. Реакції відновлення альдегідів та кетонів широко використовують для отримання, відповідно, первинних та вторинних спиртів:

В інших умовах спирти відновлюються до алканів.
5.6. Деякі реакції ароматичних альдегідів.
5.6.1. В реакцію Канніцарро (1853 р.) вступають альдегіди, що не мають рухливих атомів гідрогену у -положенні відносно карбонільної групи:

|
|
Це реакція диспропорціонування, що проходить у лужному середовищі. V=K0[C6H5COH][OH–]. |
Можливий і змішаний варіант реакції:

Механизм реакції:

Після нуклеофільного приєднання гідроксид-іона по зв’язку >C=O, реакція формально зводиться до перенесення гідрид-іона однієї молекули альдегіда по зв’язку >C=O до іншої. Вважається, що механізм цієї реакції до кінця не досліджений.
5.6.2. Реакція Вільгеродта-Кіндлера (1887, 1923 рр.) представляє собою взаємодію ароматичних альдегідів або кетонів алкіл-, аріламінів та елементної сірки у присутності нуклеофільних каталізаторів:

Нуклеофільні каталізатори використовують для активації елементної сірки:
![]()
Подальший механізм реакції дуже складний, до кінця не досліджений, але вважають (проф. Бурмістров С.І.), що реакція йде з перенесенням гідрид-іона по іонно-радикальному механізму подібно до реакції Канніцарро.
5.6.3. В реакцію Перкіна (1877 р.) вступають ароматичні альдегіди та ангідриди карбонових кислот (по типу альдольної конденсації) в присутності відповідних до ангідриду солей (K+, Na+) карбонових кислот з утворенням ,-ненасичених кислот:

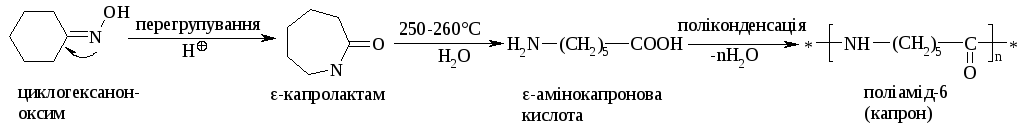
5.6.4. Перегрупування Бекмана (1886 р.) відбувається із оксимами кислот (син- та анти-ізомерів) в кислому середовищі у відповідні аміди кислот:

Кетоксими існують у вигляді двох геометричних ізомерів: син- та анти-форм:
|
| |
|
анти-ізомер цис(Z)-ізомер, більш стійкий |
син-ізомер транс(Е)-ізомер менш стійкий |
Наявність геометричних ізомерів обумовлена несиметричною будовою кетоксимів та неможливістю вільного обертання молекули навколо подвійного C=N зв’язку.
Формально подальше перегрупування геометричних ізомерів полягає в тому, що гідроксильна група міняється місцями з радикалом, що знаходиться відносно неї в транс-положенні:

Перегрупування Бекмана використовують у промисловості для отримання поліаміда-6 (капрона):
5.7. Полімеризація альдегідів,як більш активних сполук у порівнянні з кетонами, проходить в звичайних умовах і прискорюється мінеральними кислотами:

Промислове значення має іонна полімеризація формальдегіда або 1,3,5-триоксана: