- •16. Альдегіди та кетони
- •1. Класифікація. Номенклатура.
- •2. Методи отримання.
- •2.5. При піролізі солей карбонових кислот із двохвалентними металами (m: Ca, Ba, Mn, Th) утворюються альдегіди або кетони за загальною схемою:
- •3. Будова карбонільної групи.
- •4. Фізичні властивості.
- •5. Хімічні властивості.
- •6. Екологічні питання
2. Методи отримання.
2.1. Окиснення первинних і вторинних спиртів з утворенням, відповідно, альдегідів та кетонів:
|
|
етаналь (ацетальдегід) |
|
|
пропанон (ацетон) |
При окисненні первинних і вторинних спиртів ароматичного ряду також утворюються, відповідно, ароматичні альдегіди та кетони:
|
|
бензальдегід |
|
первинний спирт |
|
|
|
метилфенілкетон (ацетофенон) |
|
вторинний спирт |
|
При високих температурах і каталітичній дії металевої міді первинні спирти і без окисника (О2) утворюють альдегіди і кетони:
|
|
|
(реакція дегідрування) |
|
|
R=Alk,Ar–універсальний метод.
2.2. Оксосинтез (гідроформілювання алкенів, О. Ройлен, 1938 р.):

Особливості промислового метода:
вуглеводневий ланцюг альдегіда збільшується на один атом карбону;
головним чином утворюється альдегід нормальної будови (І).
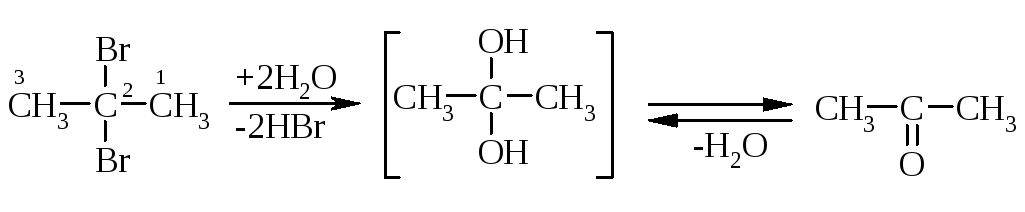
2.3. Гідроліз гемінальних дигалогенпохідних:
|
| |||
|
|
1,1-дибромпропан |
нестійкий діол |
пропаналь |
|
| |||
|
|
2,2-дибромпропан |
нестійкий діол |
пропанон |
Особливість метода: нестійкі діоли (дві гідроксигрупи біля одного атома карбону), згідно до правила Ейленмейера, відщеплюють молекулу води і утворюють кінцевий альдегід або кетон; метод є універсальним і поширюється на ароматичні гемінальні дигалогенпохідні.
2.4. При дії реактивів Гриньяра, наприклад, на похідні мурашиної кислоти (етилформіати) або інші біполярні сполуки отримують альдегіди або кетони:

2.5. При піролізі солей карбонових кислот із двохвалентними металами (m: Ca, Ba, Mn, Th) утворюються альдегіди або кетони за загальною схемою:
|
|
якщо R=R – утворюються симетричні кетони; якщоRR – утворюються несиметричні кетони; якщо R=H – утворюються альдегіди |
Каталізатори процесу MnO–для альдегідів;CdO,ThO–для кетонів.
2.5. Ацилюванням аренів по Фриделю-Крафтсу у присутності кислот Льюїса отримують кетони:
|
|
ацетофенон |
|
дифенилкетон (бензофенон) |
2.6. Формілювання аренів по реакції Гаттермана-Коха, 1887 р.:
|
|
За механізмом – це реакція електрофільного заміщення (SE): |
утворення ацилієвого комплекса (електрофіла):
![]()
утворення -комплекса -комплекса та кінцевого альдегіда:

відновлення каталізатора:

3. Будова карбонільної групи.
|
|
В карбонільній групі >C=O атоми карбону та оксигену знаходяться у sp2-гібридному стані, утворюючи при цьому - та -зв’язки. Вважають,
що дві залишкові пари n-електронів 2s2
та
| |
|
|
При цьому вклад резонансної біполярної форми складає ~40%. Атом оксигену, як більш електронегативний елемент, притягує до себе і -електрони подвійного зв’язку. Завдяки цьому, зв’язок >C=Oстає сильно поляризованим: на атомі карбона виникає позитивний заряд (електрофільний центр, +), а на атомі оксигену – негативний заряд (нуклеофільний центр, -). | |
Альдегіди більш реакційноздатні сполуки, ніж кетони. Тому як, по-перше, наявність у кетонах ще однієї алкільної групи за рахунок +І-ефекту зменшує позитивний заряд на атомі карбону карбонільної групи, а по-друге, при цьому виникають додатково стеричні перешкоди.
Сильно поляризована карбонільна група впливає також і на рухомість атомів гідрогену, що знаходиться в -положенні відносно групи >C=O; у разі пониження електронної густини на атомі -карбона (Х-донор електронів) маємо зворотній ефект. Враховуючи впив індукційного ефекту, а також стеричні перешкоди, реакційну здатність для карбонільних сполук можна навести наступний ряд активності:
|
| |||||
|
хлораль |
формальдегід |
ацетальдегід |
ацетон |
бензальдегід |
дифенілкетон |
В такій же послідовності зменшується заряд на атомі карбона групи >C=O:
>1>2>3>4>5.
Хлораль і формальдегід приєднують навіть такий слабкий нуклеофіл, як воду, а дифенілкетон не взаємодіє з таким полярним реагентом, як гідросульфіт натрію.
Можна констатувати, що практично всі хімічні реакції альдегідів та кетонів обумовлені розглянутим розподілом електронної густини в молекулі і для них є найбільш характерними:
реакції нуклеофільного приєднання (AN);
реакції за участю атома гідрогена, що знаходиться в -положенні відносно карбонільної групи;
реакції заміщення карбонільного оксигена;
реакції окиснення та відновлення;
реакції полімеризації.