
- •Розділ 5. Структура, функції та метаболізм ліпідів
- •5.1. Біологічні функції та класифікація ліпідів
- •5.2. Структурна організація біомембран
- •5.3. Циркуляторний транспорт і депонування ліпідів у жировій тканині
- •5.4. Катаболізм тріацилгліцеролів і його регуляція
- •5.5. Біосинтез тріацилгліцеролів
- •5.6. Біосинтез фосфоліпідів
- •5.7. Метаболізм сфінголіпідів. Сфінголіпідози
- •5.8. Окиснення жирних кислот
- •5.9. Окиснення гліцеролу
- •5.10. Синтез жирних кислот
- •5.11. Метаболізм кетонових тіл
- •5.12. Метаболізм холестерину
- •5.13. Гіперліпемії
- •5.14. Стеатоз
- •5.15. Ожиріння
5.12. Метаболізм холестерину
5.12.1. Біосинтез холестерину. У дослідах з радіоактивною міткою ацетатної кислоти, яка добавлялася до харчового раціону тварин було встановлено, що вуглецевий скелет холестерину повністю складається з вуглецю ацетатної кислоти. Біосинтез холестерину з ацетил-КоА протікає з участю ферментів ендоплазматичної сітки і гіалоплазми багатьох тканин і органів. Найбільш інтенсивно цей процес проходить в печінці, тонкій кишці і корі надниркових залоз та значно слабше в м’язах і головному мозку. Біосинтез холестерину – багатостадійний процес, який можна розбити на три етапи:
1) утворення мевалонової кислоти із ацетил-КоА ;
2) синтез із мевалонової кислоти „активного ізопрену” з конденсацією останнього в сквален ;
3) перетворення сквалену в холестерин.
П
кислоти Рис.5.26.
Схема синтезу мевалонової
Рис.5.26.
Схема синтезу мевалонової
Одним із проміжних продуктів є β-гідрокси-β-метилглутарил-КоА (ГМГ-КоА), що утворюється і при синтезі кетонових тіл. Перша специфічна для біосинтезу холестерину реакція - відновлення ГМГ-КоА в мевалонову кислоту при дії ГМГ-КоА-редуктази.
Ця реакція незворотна і лімітує швидкість біосинтезу холестерину в цілому. β-Гідроксиметилглутарил-КоА–редуктаза є регуляторним ферментом, активність якого гальмується кінцевим продуктом цього біосинтезу – холестерином (ендогенного чи екзогенного).
На другому етапі мевалонова кислота в процесі декількох ферментативних реакцій з затратою АТФ перетворюється в „активний ізопрен” (ізопентенілпірофосфат) та його ізомерну форму – 3,3 –диметилалілпірофосфат (рис. 5.27).
К
Рис.
5.27. Схема синтезу диметилалілпірофосфату
Сквален перетворюється на ланостерин, що вже містить тетрациклічну групу, характерну для холестерину (рис. 5.29). З ланостерину в кілька стадій утворюється холестерин.
Н
Рис.
5.28. Схема синтезу сквалену
Сквален перетворюється на ланостерин, що вже містить тетрациклічну групу, характерну для холестерину (рис. 5.29). З ланостерину в кілька стадій утворюється холестерин.
Н
Рис.
5.29. Схема синтезу
холестерину
зі сквалену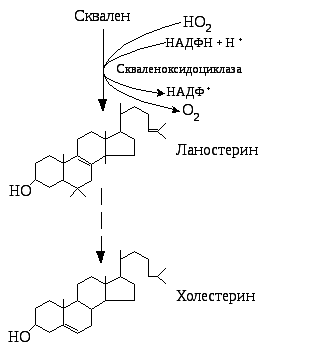
За добу в організмі людини синтезується 0,5- 1,0 г холестерину (з них приблизно 80 % в печінці). Інтенсивність синтезу холестерину в печінці залежить від кількості його всмоктування в кишечнику, а також надходження з позапечінкових тканин у складі ліпопротеїнів. Кількість холестерину, яка всмоктується в кишечнику, обмежена (до 0,5 г на день, 10 %). Близько 5 % холестерину синтезується в клітинах шкіри. При наявності в добовому харчовому раціоні людини 2 – 3 г холестерину синтез власного холестерину майже цілком припиняється. Ферменти, необхідні для синтезу холестерину, є у всіх клітинах, крім зрілих еритроцитів.
5.12.2. Регуляція біосинтезу холестерину. Синтез холестерину регулюється декількома механізмами. Зокрема, за принципом негативного зворотного зв’язку холестерин, як кінцевий продукт, гальмує активність регуляторного ферменту β- гідрокси- β-метилглутарил-КоА-редуктази. Активність редуктази гальмує також продукт її реакції- мевалонова кислота та ліпопротеїни низької щільності. Крім того, цей регуляторний фермент може знаходитися у фосфорильованій (неактивній) та дефосфорильованій (активній) формах. Глюкагон і глюкокортикоїди знижують активність редуктази, а інсулін та гормони щитоподібної залози, навпаки, підвищують. При голодуванні, коли секреція глюкагону підвищується, синтез холестерину загальмовується, а при споживанні значної кількості вуглеводів і жирів під дією інсуліну - стимулюється. жовчні кислоти прямо впливають на швидкість синтезу холестерину в клітинах слизової кишечника за рахунок гальмування регуляторного ферменту. Утворення жовчних кислот також регулюється за принципом негативного зворотного зв’язку. Тому порушення ентерогепатичної циркуляції й екскреції жовчних кислот впливає на перетворення холестерину в ці кислоти.
5.12.3. Екскреція холестерину з організму. Холестерин виділяється з організму з жовчю і через стінки кишечника (переважно у вигляді холестеридів). У товстій кишці холестерин (0,5-1,0 г) під впливом мікроорганізмів відновлюється до копростерину (копростанолу) і холестанолу та невелика кількість незміненого холестерину виводяться з калом. Холестерин виводиться також у вигляді жовчних кислот. В організмі постійно циркулює 3-5 г жовчних кислот: певна частина (до 500 мг/ добу) не всмоктується і виводиться з організму; виведення холестерину в формі нейтральних стероїдів – кінцевих метаболітів стероїдних гормонів.
У клітинах слизової кишечника холестерин естерифікується і в складі хіломікронів транспортується до тканин. Загальна кількість холестерину в організмі людини складає 100 - 150 г. Хіломікрони віддають жири жировій тканині, а залишки хіломікронів захоплюються печінкою. У гепатоцитах також синтезується холестерин, крім того, сюди потрапляє холестерин із позапечінкових органів і тканин.
Так утворюється фонд холестерину в печінці, який може використовуватися на синтез жовчних кислот, включатися в мембрани гепатоцитів, секретуватися в жовч, а далі в кишечник, попадати в кров у складі ліпопротеїнів і переноситися до позапечінкових органів. Дуже мала кількість холестерину перетворюється у стероїдні гормони і вітамін D3.
Таким чином, в організмі людини спостерігається динамічна рівновага: сумарна кількість холестерину, який надходить з їжею і синтезується в тканинах, дорівнює сумарній кількості, що виводиться з організму.
5.12.4. Біотрансформація холестерину. Унаслідок метаболічних перетворень холестерин, що синтезувався в організмі або надійшов з продуктами харчування, підлягає метаболічним перетворенням - біотрансформації, в результаті чого утворюються біологічно активні сполуки стероїдної природи – жовчні кислоти, стероїдні гормони, вітамін D3 (рис. 5.30).

Рис. 5.30. Шляхи біотрансформації холестерину
Естерифікація холестерину. Синтез ефірів холестерину в плазмі крові та в клітинах відбувається кількома шляхами, а саме:
1. Зовнішньоклітинна естерифікація холестерину здійснюється з участі ферменту лецитин-холестерин-ацилтрансферази (ЛХАТ) крові (рис. 5.31).
ЛХАТ каталізує реакцію перенесення ацильного залишку з 2-го (β-) положення фосфатидилхоліну на гідроксильну групу холестерину:
Д
Рис.
5.31. Зовнішньоклітинна естерифікація
холестерину
Внутрішньоклітинна естерифікація холестерину перебігає за участі ацил-КоА-холестерин-ацил-трансферази (АХАТ):
Холестерин + ацил-КоА → холестерин-ефір + КоА- SН
АХАТ використовує для естерифікації холестерину ацил -КоА різної природи, найчастіше залишки олеїнової кислоти. Фермент локалізований у мікросомах печінки та інших органів - надниркових залозах, кишечнику, шкірі.
Завдяки цьому створюються внутрішньоклітинні резерви холестерину, який використовується для синтезу жовчних кислот, стероїдних гормонів надниркових залоз, статевих гормонів, вітаміну D3 та його похідних.
Обмін холестерину, як і обмін жирів, починається з розщеплення його ефірів – холестеридів – під впливом ферментів (холінестераз) на холестерин і жирні кислоти. Обмін холестерину має ряд особливостей, пов’язаних з хімічною будовою його молекули. Циклопентанпергідрофенантренове кільце, що лежить в основі молекули холестерину, стійке до дії ферментів і тому в організмі людини майже не розщеплюється. Основні перетворення холестерину пов’язані переважно з окисненням бічного ланцюга.
Якщо при окисненні цього ланцюга (в печінці) відбудеться відщеплення фрагменту з трьох атомів карбону, то утвориться сполука, яка використовується для синтезу жовчних кислот. У наднирникових і статевих залозах при окисненні бічного ланцюга холестерину від нього відщеплюється шість атомів карбону або він руйнується зовсім. Так утворюються сполуки, з яких синтезуються гормони кори надниркових залоз і статеві гормони.
Реакції окисного гідроксилювання стероїдів каталізується ферментами монооксигеназами (оксигеназами змішаної дії). Сумарне рівняння процесу окисного гідроксилювання холестерину має вигляд:
RH + O2+ HAДФН +Н+ → ROH +H2O + НАДФ+
Процес протікає з участю цитохрому Р -450 у мембранах ендоплазматичного ретикулуму („мікросомальне окиснення”) або в мітохондріях надниркових залоз та клітин статевих залоз.
Біосинтез жовчних кислот. У клітинах печінки синтезуються жовчні кислоти – важливі компоненти жовчі, що беруть участь у перетравленні харчових жирів у кишечнику.
Жовчні кислоти є гідроксильованими похідними холанової кислоти. До жовчних кислот належать холева (3,7,12–триоксихоланова), дезоксихолева (3,12- діоксихоланова), хенодезоксихолева (3,7- діоксихоланова) та літохолева (3-оксихоланова) кислоти.
Першим етапом біосинтезу жовчних кислот є 7-α-гідроксилювання холестерину під дією 7-α-гідроксилази (рис.5.32), яка є однією з ізоформ цитохрому Р-450, коферментом якої є НАДФН, необхідний для цієї реакції кисень і аскорбінова кислота.
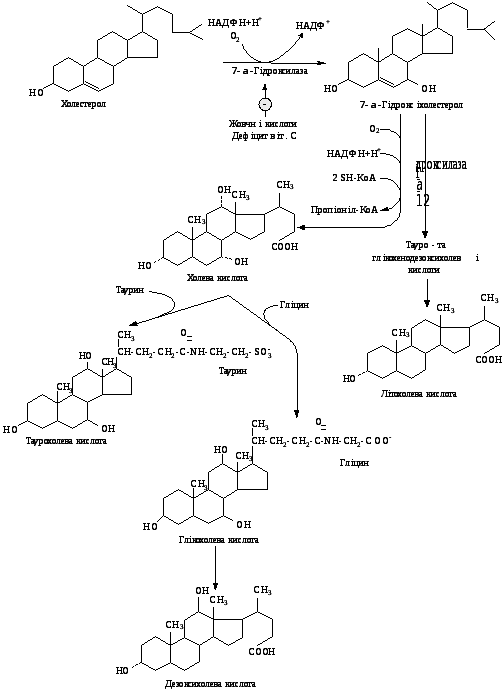
Рис. 5.32. Схема синтезу жовчних кислот з холестерину
Утворені жовчні кислоти гальмують активність цього ферменту за принципом негативного зворотного зв’язку. Після утворення 7-α- гідроксихолестеролу шлях синтезу жовчних кислот розгалужується: утворюється холева кислота і хенодезоксихолева. Ці кислоти із гепатоцитів надходять у жовчні капіляри і депонуються в жовчному міхурі й поступають у 12-палу кишку. в Під пливом мікроорганізмів кишечника утворюються вторинні жовчні кислоти – дезоксихолева та літохолева
О
Рис.
5.33 Схема синтезу стероїдних гормонів
з холестерину
Б
Рис.
5.34. Схема синтезу
вітаміну
D3
Гормони чоловічих та жіночих статевих залоз також утворюються з холестерину через стадію прегненолону та прогестерону, який перетворюється на 17-α-гідроксипрогестерон – попередник андрогену (С19) – тестостерону та естрогенів (С18) – естрону та естрадіолу.
Біосинтез вітаміну D3. Перетворення холестерину на вітамін D3 – холекальциферол – відбувається внаслідок розкриття кільця циклопентанопергідрофенантрену з утворенням провітаміну D3, який підлягає окисному гідроксилюванню з утворенням біологічно активної форми вітаміну -1,25-дигідроксихолекальциферолу (кальцитріолу) (рис. 5.34).
5.12.5. Порушення обміну холестерину. Порушення обміну холестерину супроводжується підвищенням (гіперхолестеринемія) або зниженням (гіпохолестеринемія) його концентрації у крові. Гіперхолестеринемія може бути викликана надлишковим вмістом холестерину в харчовому раціоні; емоційним напруженням (як короткочасним, так і тривалим; недостатнім виділенням холестерину з жовчю при дискінезіях жовчного міхура і жовчних шляхів, а також при сповільненні перистальтики тонкої і товстої кишок; недостатнім розпадом холестерину в результаті кисневого голодування (різні види гіпоксій). Вона може виникати при цукровому діабеті та голодуванні, якщо надлишок ацетооцтової кислоти призводить до інтенсивного утворення холестерину ідіопатичних гіперхолестеринеміях і нефротичному синдромі.
Гіперхолестеринемія посилює відкладання холестерину в печінці та спричинює тим самим холестериновий цироз. Унаслідок порушення обміну холестерину відбувається його випадання із жовчі і утворення жовчних каменів у жовчному міхурі та жовчовивідних протоках, що спричинює порушення перетравлення жирів і жиророзчинних вітамінів.
Гіпохолестеринемія є, насамперед, результатом недостатнього поступлення холестерину з їжею і зниження його ендогенного утворення при недостатньому надходженні білків, жирів і вуглеводів. Блокада синтезу холестерину спостерігається при деяких інтоксикаціях та інфекціях, наприклад, хворобі Боткіна. Ураження печінки спричиняє зниження утворення естерифікованого холестерину. Переважання розпаду холестерину над його синтезом і посилене виділення з організму спостерігається при тиреотоксикозах, проносах.
Атеросклероз (ather- кашка, scleros- твердий, грец) - це поширена патологія, яка характеризується переважним відкладанням холестерину в стінках судин. Ліпідні бляшки - це своєрідне чужорідне тіло, навколо якого розростається сполучна тканина (склероз). Відбувається кальцифікація ураженої ділянки судини. Останні стають нееластичними, щільними, погіршується кровопостачання тканин, а на місці бляшок можуть виникати тромби.
Розвиток атеросклерозу відбувається в декілька стадій (рис. 5.35). Процес починається із пошкодження ендотелію судин, при цьому пошкодження відбуваються за різними механізмами. Важливий механізм пошкодження ендотелію за рахунок зміни структури ЛПНЩ, наприклад у результаті ПОЛ у складі ЛПНЩ; змінюється не тільки структура ліпідів, але й порушується структура апопротеїнів. Окиснені ЛПНЩ захоплюються макрофагами за допомогою певних рецепторів. Цей процес не регулюється кількістю поглинутого холестеролу,
Макрофаги
перетворюються у „пінисті клітини”,
які проникають у субендотеліальний
простір. Це призводить до утворення
жирових смужок у стінці кровоносних
судин. На цій стадії ендотелій зберігає
свою структуру. При збільшенні кількості
„пінистих клітин” відбувається
пошкодження ендотелію судин. У нормі
клітини ендотелію секретують простагландин
І2
(
 рис.
5.35. Розвиток атеросклеротичної бляшки
в клітинах
рис.
5.35. Розвиток атеросклеротичної бляшки
в клітинах 
При пошкодженні клітин ендотелію тромбоцити активуються і секретують тромбоксан А2 (ТХА2), який стимулює їх агрегацію, що може призвести до утворення тромбу в місці атеросклеротичної бляшки; одночасно тромбоцити починають продукувати пептид – тромбоцитарний фактор росту, який стимулює проліферацію ГМК, а він мігрує з медіального у внутрішній шар артеріальної стінки і сприяє таким чином росту бляшки. Далі проходить проростання бляшки фіброзною тканиною (колагеном, еластином); клітини під фіброзною оболонкою некротизуються, а холестерол відкладається у міжклітинному просторі. На цій стадії в центрі бляшки утворюються холестеринові кристали.
На останній стадії розвитку бляшка просочується солями кальцію і стає дуже щільною. У ділянці бляшки часто утворюються тромби, які перекривають просвіт судин, що призводить до гострого порушення кровоплину в відповідній ділянці та розвитку інфаркту. Часто атеросклеротичні бляшки утворюються в артеріях міокарду, тому найбільш поширеним захворюванням, що розвивається при атеросклерозі є інфаркт міокарда.
Атеросклероз розвивається в результаті гіперліпопротеїнемії. У стінку судини проникають всі ліпопротеїни, крім хіломікронів. Однак α-ліпопротеїни, які містять багато білка і фосфоліпідів, можуть швидко розпадатися у стінці судини. Атерогенними є β-ліпопротеїни і частково пре-β-ліпопротеїни, які містять багато холестерину. При підвищенні вмісту цих класів ліпопротеїнів у крові і збільшенні проникливості судинної стінки проходить просочування судин атерогенними ліпопротеїнами з наступним розвитком атеросклерозу.
За останні роки висунута, поряд з іншими, пероксидна теорія атеросклерозу. Суть її зводиться до того, що при атеросклерозі порушується гомеостаз між швидкістю утворення активних форм кисню, розвитком вільнорадикальних процесів, з одного боку, й антиоксидантною системою — з другого.
При атеросклерозі в стінках судин відкладаються ліпіди – в основному ефіри холестерину і в меншій кількості сфінголіпіди. Відкладання холестерину та інших ліпідів, а також солей в інтимі судин призводить до їх переродження, до зменшення еластичності і міцності стінок кровоносних судин, також звуження діаметра.
Для розвитку атеросклеротичного процесу необхідні, крім порушень концентрації ліпідів крові, хоч незначні пошкодження ендотелію судин, які виникають внаслідок підвищеного тиску крові, запальних процесів,стресів, порушення згортання крові, дії токсичних агентів (нікотину, ендотоксинів тощо). ЛПНЩ проникають в інтиму, поглинаються гладком’язовими клітинами та клітинами крові й накопичуються під ендотелієм судин. Крім цього, вони можуть утворювати комплекси з кислими глікозаміногліканами і глікопротеїнами, яким властиві автоімунні властивості. Припускається можливість утворення аутоантитіл і розвиток патологічного процесу за типом автоімунного. Фагоцитовані ліпопротеїни піддаються розщепленню під дією ферментів лізосом.
Білки, фосфоліпіди, тріацилгліцероли утилізуються, а молекули холестерину утворюють ефіри з масляною кислотою і накопичуються у великих кількостях. Внаслідок значних структурних і функціональних змін мембран клітини гинуть. Атерогенні бляшки із продуктів лізису клітин і холестерину покриваються капсулою із сполучної тканини, йде інтенсивна проліферація фібробластів. Стінки судин деформуються, стають жорсткими, на поверхні бляшки розвивається тромб, просвіт судин звужується аж до закупорення.
Для лікування атеросклерозу використовують дієтотерапію (обмеження холестерину, жирів з насиченими жирними кислотами, підвищене споживання поліненасичених жирних кислот). Антисклеротичні препарати, що застосовують з метою профілактики та лікування атеросклерозу, спрямовані на зниження рівня гіперхолестеринемії шляхом впливу на різні напрямки метаболізму стеролу: сповільнення всмоктування холестерину в кишечнику (рослинні стерини); гальмування реакцій біосинтезу холестерину (інгібітори β –ГОМК- редуктази: препарати гемфіброзил, фенфібрат, ловастатин): активація метаболізму холестерину оксигеназами змішаної дії (фенобарбітал, зиксорин); стимулювання секреції холестерину з організму (ентеросорбенти- препарати квестран, гуарем).
Ефективним є застосування ліпотропних факторів. Так, холін, як ліпотропний фактор, затримує підвищення рівня холестерину в печінці. Однією з причин цього є те, що холін входить до складу фосфоліпідів, які в комплексі з білками утворюють ліпопротеїнові сполуки крові, а в такій формі транспортується приблизно 2/3 всього холестерину. Холін гальмує транспортування і окиснення жирних кислот, а холестерин, навпаки, гальмує цей процес, зокрема, пригнічує утворення фосфоліпідів в печінці і посилює її жирове переродження.
Таким чином, виникає можливість направленої регуляції обміну ліпідів при тих чи інших захворюваннях за рахунок зменшення в дієті холестерину і збільшення холіну або фосфоліпідів. Це треба мати на увазі при складанні дієти для людей старших 40 років, схильних до ожиріння.
