
- •Биологическое значение реакций трансаминирования
- •Клиническое значение определения активности трансаминаз
- •Принцип метода
- •Контрольные вопросы
- •Литература
- •ХОД РАБОТЫ
- •Таблица 1
- •Таблица 2
- •Таблица 3
- •Оформление работы
- •К занятию:
- •Во время занятия:
- •Реакции аммиака
- •Цикл мочевины
- •Альтернативные реакции выведения избытка азота
- •Регуляция цикла мочевины
- •Наследственные дефекты ферментов цикла мочевины
- •Карбамоилфосфат-синтетаза
- •Орнитин-транскарбамоилаза
- •Аргининосукцинат-синтетаза
- •Аргининосукцинат-лиаза
- •Аргиназа
- •Принцип метода
- •Контрольные вопросы
- •Литература
- •ХОД РАБОТЫ
- •Во время занятия:
- •Глутатион и аномалии эритроцитов
- •Принцип метода
- •Контрольные вопросы
- •Литература
- •ХОД РАБОТЫ
- •Оформление работы
- •Во время занятия:
- •Регуляторная роль пируваткиназы
- •Гипоксические повреждения тканей
- •Утилизация молочной кислоты
- •Принципы методов
- •Контрольные вопросы
- •Литература
- •Субстратные циклы
- •Обмен фруктозы
- •Синтез глюкозы из других сахаров
- •Фруктоза
- •Манноза
- •Галактоза
- •Принципы методов
- •Контрольные вопросы
- •Литература
- •ХОД РАБОТЫ
- •Оформление работы
- •Во время занятия:
- •Образование ЛПОНП и ЛПНП
- •Б. Гиперлипопротеинемия
- •Принцип метода
- •Контрольные вопросы
- •Литература
- •ХОД РАБОТЫ
- •Оформление работы
- •Во время занятия:
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Реакции аммиака
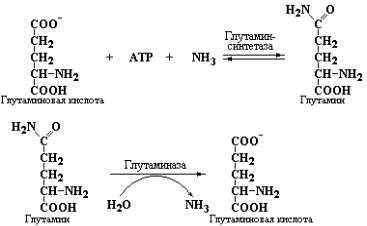
Конечными продуктами распада аминокислот в организме при высоком содержании белка в пищевом рационе являются аммиак, мочевина, углекислый газ и вода. Один из продуктов распада – аммиак представляет собой высокотоксичное соединение, накопление которого в больших количествах представляло бы серьезную опасность для организма. Бόльшая часть образующегося аммиака инактивируется в ходе ряда специфических реакций, в результате которых NH4+ превращается в нетоксические соединения. В некоторых случаях связывание аммиака сопровождается синтезом важнейших метаболитов. Например, в организме постоянно протекают реакции синтеза пуриновых колец, присоединения аминогрупп к пиримидинам с образованием цитозина, а также реакции синтеза аминосахаров. Все эти процессы зависят от промежуточного накопления глутамина – амида глутаминовой кислоты, который синтезируется с участием глутамин-синтетазы:
С одной стороны, это соединение представляет собой одну из 20 протеиногенных аминокислот, необходимых для синтеза белков. С другой стороны, глутамин является одной из форм экскретируемого аммиака в почках. Таким образом, аммиак переносится в кровь в виде нетоксичного, неионизованного амида, который играет важную роль в регуляции рН мочи благодаря нейтрализации кислых продуктов обмена аммиаком, высвобождаемым при простом гидролизе амидной группы под действием глутаминазы (см. реакцию, приведенную выше). Именно по этой причине уровень глутамина в крови обычно превосходит содержание любой другой аминокислоты. Итак, аммиак – NH4+, образующийся при деградации аминокислот (см. лабораторную работу №1), становится доступным в виде глутамина для других органов, отвечающих за синтез пуринов, пиримидинов и ряда азот-содержащих соединений.
16
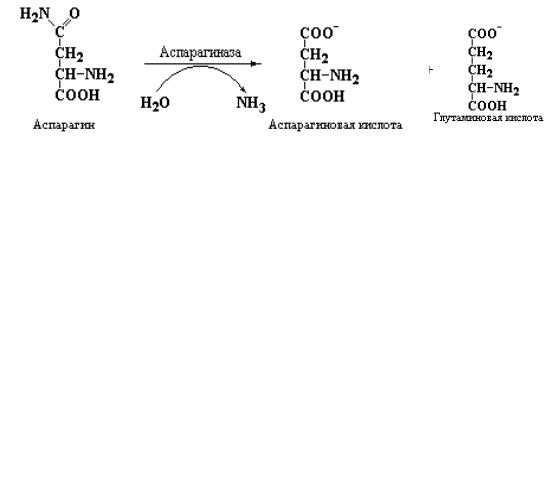
Глутамин также поставляет амидные группы для синтеза другого гомолога – аспарагина. Данная реакция является энергозависимой, поскольку для активации β-карбоксильной группы аспартата, также как и для активации γ- карбоксильной группы глутамата, необходим АТР.
В настоящее время неизвестно имеет ли аспарагин какое-либо другое назначение у млекопитающих и человека кроме, как одна из аминокислот, необходимых для синтеза белка. Вместе с тем в ряде работ установленно, что некоторые быстро делящиеся лейкемические клетки утрачивают способность синтезировать аспарагин и начинают зависеть от уровня данного амида в крови. Это наблюдение может послужить молекулярной основой возможного терапевтического использования аспарагиназы, катализирующей реакцию удаления амидной группы из аспарагина:
Применение аспарагиназы, теоретически, может позволить лишить неопластические клетки необходимых количеств аспарагина, за счет резкого снижения уровня этого соединения в сыворотке крови.
Цикл мочевины
Как упоминалась выше, часть NH4+, образующегося при расщеплении аминокислот, расходуется на биосинтез азотистых соединений. У большинства наземных животных и у человека около 80% азота экскретируется в виде мочевины, которая синтезируется в печени в ходе циклической последовательности реакций. Эту последовательность реакций впервые в 1932 году описали Ганс Кребс и Курт Хензеляйт (по этой причине цикл мочевины носит название цикла Кребса-Хензеляйта или орнитинового цикла). Цикл мочеви-
ны является, в сущности, первым обнаруженным циклическим метаболическим путем. Один из двух атомов азота мочевины происходит из NH4+, дру-
17
гой – из аспарагиновой кислоты. Источником углеродного атома мочевины служит СО2. Переносчиком этих атомов в цикле служит аминокислота орни-
тин.
Расщепление аминокислот интенсивно происходит во всех органах и тканях человека, однако основная часть мочевины синтезируется в печени. Значение этого органа в обмене азота можно проиллюстрировать на примере явлений гипераммониемии и гепатической комы.
Увеличение концентрации NH4+ в крови (гипераммониемия) до значений, превышающих уровень, составляющий в норме 30-60μМ, может вызвать кому. При этом потеря сознания связана с резкой нехваткой АТР в мозге. Аммиак способен проникать через гематоэнцефалический барьер и сдвигать равновесие реакции, катализируемой глутамат-дегидрогеназой, что в свою очередь вызывает снижение концентрации α-кетоглутарата, необходимого для нормального функционирования цикла трикарбоновых кислот. Накопление глутаминовой кислоты приводит к избыточному синтезу глутамина, что также способствует снижению уровня АТР.
Гипераммониемия, как правило, связана с неспособностью ферментных систем пациентов обеспечивать образование мочевины с необходимой скоростью для поддержания физиологической концентрации аммиака в крови. Во многих случаях к возникновению данного состояния причастны нарушения структуры ферментов цикла мочевины. Иногда преходящая гипераммониемия отмечается у новорожденных в случае задержки синтеза ферментов цикла мочевины.
Проявления гипераммониемии могут также наблюдаться в тех случаях, когда происходит нарушение нормального кровотока через печень. Переключение циркуляции крови от портальной системы на довольно интенсивный второстепенный кровоток через нижнюю полостную вену в обход печени может иметь место в случае цирроза данного органа. Иногда такой тип нарушения кровотока в печени устраняется хирургическим путем посредством шунтирования.
Альтернативные реакции, обеспечивающие выведение избытка азота, могут некоторым образом компенсировать описанные выше нарушения. При этом удаление азота осуществляется за счет образования экскретирующихся аминокислот глицина и глутамина.
Поскольку анаплеротические (запасные) реакции могут поставлять α- кетоглутарат, связывающий два эквивалента аммиака при образовании глутамина, а глицин способен образовываться из NH4+ под действием глицинсинтазы, осторожное введение бензоата и/или фенилацетата может компенсировать нарушения цикла мочевины и предотвращать токсичное действие аммиака.
Альтернативные реакции выведения избытка азота
18

Многие органические кислоты экскретируются в виде конъюгатов с аминокислотами. Это явление было использовано для разработки теста на функциональное состояние печени, который заключается в превращении бензойной кислоты в гиппуровую кислоту. В ходе данной реакции происходит активация карбоксильной группы бензойной кислоты при ее взаимодействии с HS–CoA c образованием бензоил–СоА. Впоследствие активированная карбоксильная группа переносится на глицин, синтезирующийся из СО2 и NH4+ под действием глицин-синтазы:
В результате переноса бензоил-СоА на глицин происходит образование коэнзима А и гиппуровой кислоты, которая выводится с мочой.
Сходная реакция имеет место между гомологом бензойной кислоты – фенилуксусной кислотой и глутамином. Отличие этой реакции от описанной выше заключается в том, что в этом случае не происходит накопления интермедиата, представляющего собой тиоэфир с CoA. Тем не менее данная реакция также зависит от присутствия CoA, но карбоксильная группа фенилуксусной кислоты непосредственно взаимодействует с α-аминогруппой глутамина. Другое важное отличие реакции состоит в выведении двух эквивалентов NH4+, а не одного, поскольку для синтеза глутамина из α-кетоглутарата требуются две молекулы аммиака.
19
