
Семенихина и др. (2007)_Современ. методы микробиол. исследований
.pdfДанное исследование проводят с использованием планшет из полистирола (поливинилхлорида) на поверхности лунок которых адсорбируют специфический антиген. Фиксированный на пластине антиген инкубируют с испытуемыми человеческими сыворотками. После отмывания от несвязавшихся белков связанные иммобилизованными антигенами иммуноглобулины выявляют с помощью антивидовой (античеловеческой) антииммуноглобулиновой сыворотки, к антителам которой ковалентно прикреплен фермент – пероксидаза. После инкубации с субстратом (пероксидом водорода) и индикатором (диаминобензидином) оценивают ферментативную активность по интенсивности окраски. Интенсивность окраски, пропорциональную количеству сорбированных на антигене антител, можно оценить визуально или с помощью спектрофотометра. В данной модификации удобна универсальность меченого реагента, который позволяет выявлять антитела к разным антигенам.
Использование фермента в качестве индикатора дает ряд преимуществ, однако имеет ряд ограничений. Необходимо подобрать такой фермент, который длительно сохраняет свою активность, не теряет ее при операции связывания с антигеном или антителом, обладает высокой специфичностью к субстрату. Широко используются пероксидаза хрена, щелочная фосфатаза и β-галактозидаза Escherichia coli. Перспективны люциферазы светлячков и светящихся бактерий. Активность ферментов детектируют по изменению оптической плотности, флуориметрически и электрохимически. Люциферазные реакции сопровождаются высвечиванием фотонов, поэтому их регистрируют по биолюминесценции. Приведем несколько примеров.
Пероксидаза катализирует реакцию
AH2 + H2O2  A + 2H2O.
A + 2H2O.
Вкачестве AH2 могут быть разные соединения. Так, восстановленный бесцветный о-фенилендиамин в пероксидазной реакции превращается в окисленную окрашенную форму с максимумом оптического поглощения при 435 нм, регистрируемую фотометрически.
Щелочная фосфатаза катализирует гидролиз фосфорных эфиров: 4-нитрофенилфосфат превращается в 4-нитрофенол, регистрируемый по оптической плотности при 405 нм; 4-метилумбеллиферилфосфат превращается в 4-метилумбеллиферон, флуоресцирующий с высоким квантовым выходом при 450 нм (флуоресценцию возбуждают при 365 нм).
β-Галактозидаза катализирует гидролиз лактозы с образованием глюкозы и галактозы. Если вместо природного субстрата взять 4-метилумбеллиферил-β-D-галактозид, при гидролизе образуются галактоза и 4-метилумбеллиферон, регистрируемый флуориметрически.
Влюциферазных реакциях детектируют биолюминесценцию:
АТФ + люциферин + O2,
11

АМФ + Фн + оксилюциферин + hn560 нм,
ФМНН2 + О2 + R-CHO, ФМН + R-COOH + H2O + hn490 нм,
где АТФ – аденозинтрифосфат, АМФ – аденозинмонофосфат, Фн – ортофосфат, ФМН и ФМНН2 – окисленный и восстановленный флавинмононуклеотид, R-CHO и R-COOH – жирный альдегид и соответствующая кислота.
Для связывания ферментной метки с антителом или антигеном без потери активности фермента и нарушения свойств антитела и антигена существуют три группы методов: биохимические, иммунологические и генно-инженерные.
В биохимических методах используется сшивка фермента (E) с антителом или антигеном при участии свободных реакционноспособных групп: -NH2 , -COOH, -SH, -OH. Например:
E-NH2 + HOOC-Аг |
E-NH-CO-Аг + H2O. |
Если прямое взаимодействие реализовать не удается, в ход идут |
|
бифункциональные сшивающие |
агенты: глутаровый диальдегид, |
n-бензохинон. Функциональные группы реагентов могут быть активированы. Так, гидроксигруппы в углеводном компоненте пероксидазы хрена можно окислить с помощью периодата натрия до альдегидных, через которые затем пришиваются антиген или антитело при участии аминогрупп с образованием основания Шиффа:
E-CHO + H2N-Аг |
E-CH = N-Аг. |
Витамин биотин исключительно |
прочно связывается с яичным |
белком авидином – ингибитором биотинсодержащих ферментов. Если приготовить комплексы Аг-биотин и авидин-E и затем смешать их, то образуется комплекс Аг-биотин-авидин-E.
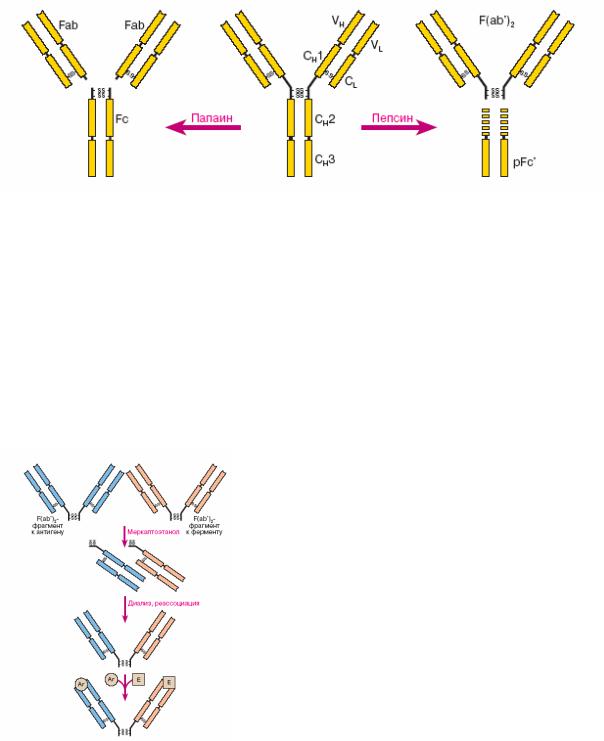
Иммунологические методы получения антигенов или антител, меченных ферментами, основаны на применении антител или их составляющих в качестве сшивающих звеньев. Антитела всех пяти классов построены по единому плану. Антитело построено из четырех полипептидных цепей: двух тяжелых (H от англ. heavy – тяжелый) и двух легких (L от англ. light – легкий) с молекулярными массами соответственно 50 и 25 кДа. Тяжелые цепи связаны друг с другом двумя дисульфидными связями через остатки цистеина. Легкие цепи образуют с тяжелыми по одной дисульфидной связи. Обе цепи состоят из доменов, по ~ 110 аминокислотных остатков в каждом: в тяжелой цепи – четыре, в легкой – два домена. N-концевые домены H- и L-цепей, обозначаемые VH
иVL (V от англ. variable – вариабельный), определяют специфичность антител, их первичная структура вариабельна. Остальные домены характеризуются постоянством структуры и обозначаются CH1, CH2, CH3
иCL (C от constant – константный). По форме молекула антитела напоминает букву Y, ножка которой связана с отростками шарнирным
12
участком.
Рис 1. Антитело класса G: действие папаина и пепсина
В исследовании структуры антител применяются протеолитические ферменты. Папаин расщепляет молекулу на три фрагмента. Два из них идентичны, одновалентны в реакции связывания антигена и названы Fabфрагментами (Fab от Fragment antigen binding – фрагмент, связывающий антиген). Третий фрагмент не связывает антиген, легко кристаллизуется и поэтому назван Fc-фрагментом (Fc от Fragment crystallizable –
кристаллизуемый фрагмент). Пепсин расщепляет молекулу антитела подругому. При этом образуются двухвалентный F(ab')2-фрагмент и несколько осколков Fc-фрагмента, из которых наиболее крупный назван pFc'-фрагментом (рис. 1).
Метод гибридных антител для сшивки антигена с ферментом включает несколько этапов (рис. 2): получение F(ab')2- фрагментов к антигену и ферменту путем обработки соответствующих антител пепсином, их разъединение путем восстановления дисульфидных связей меркаптоэтанолом, смешивание полученных Fab-фрагментов, удаление меркаптоэтанола диализом, ведущее к реассоциации с образованием гибридных F(ab')2- фрагментов, связывающих антиген и фермент в единый комплекс.
Рис 2. Получение комплекса антигена Ar
и фермента Е методом гибридных антител
Fc-фрагменты антител образуют прочный комплекс с белком A стафилококка. При наличии антител к ферменту и конъюгата белок А- антиген можно получить комплекс E-Ат-белок А-Аг.
Генно-инженерный метод получения меченого антигена основан на синтезе гибридных белков с помощью микроорганизмов. Таким методом, используя трансгенную E. coli, в лаборатории Е.С. Северина получены
13
гибридные белки, содержащие полную аминокислотную последовательность бактериальной b-галактозидазы и специфическую последовательность белка от вируса иммунодефицита человека или вируса гепатита B. Сохранение нативной структуры и функции сшиваемых реагентов зависит от их индивидуальных особенностей, поэтому здесь не может быть применен какой-либо стандартный прием. Конкретный метод сшивки подбирается в индивидуальном порядке.
Таким образом, нами рассмотрено получение необходимых компонентов диагностикума для проведения иммуноферментного анализа. В основе данного анализа лежит иммунохимическая реакция
взаимодействия АГ-АТ: |
|
aАг + bАт* →a(Аг-Ат*) + (b – a)Ат* |
(1) |
или
аАг* + bАт + cАг → d(Аг*-Ат) + e(Аг-Ат) + (a – d)Аг* + (c – e)Aг. (2)
В первом варианте (1) из антигена Аг, находящегося в тестируемом образце, и меченого антитела Ат*, добавленного в концентрации, превышающей концентрацию Аг, образуется комплекс Аг-Ат*. Количественный анализ реакции (1) может быть проведен по образованию комплекса Аг-Ат*, детектируемого с помощью ферментной метки, или по Ат*, оставшемуся в свободном состоянии. Это неконкурентный вариант ИФА. Во втором варианте (2) лимитирующим субстратом является антитело Ат. Меченый антиген Аг*, будучи добавленным в анализируемый образец в известной концентрации, связывается с антителом, образуя комплекс Аг*-Ат. В этой реакции Аг* будет конкурировать с немеченым антигеном Аг, содержащимся в образце. Концентрация Аг*-Ат будет обратно пропорциональна концентрации Аг. Таким способом по заранее известной концентрации Аг* можно определить неизвестную концентрацию Аг. Это конкурентный вариант ИФА. В обоих вариантах ИФА надо решить важную задачу – разделить связанную фракцию меченого реагента (Аг-Ат* или Аг*-Ат) от несвязавшегося, свободного реагента (Ат* или Аг*), чтобы определить долю специфического связывания.
Количественный анализ иммунохимических реакций (см. уравнения
(1) и (2)) может быть проведен по продуктам (Аг-Ат* и Аг*-Ат) или по субстратам реакций, оставшимся в свободном состоянии (Ат* и Аг*). Для этого используют два основных подхода.
Первый подход – направленное воздействие на ферментативную активность комплекса Аг-E посредством связанного Ат, ведущее к торможению или, напротив, к возрастанию скорости ферментативной реакции. Такой ИФА может быть реализован в однофазной системе – в растворе – и поэтому называется гомогенным, или жидкофазным. Это ИФА без предварительного физического разделения меченых лигандов (Ат* или Аг*) от их иммунохимических комплексов – продуктов реакций
(1) и (2).
14
Второй подход – физическое разделение с помощью твердой фазы, связывающей меченый реагент. Это гетерогенный или твердофазный ИФА. В качестве твердой фазы используются стенки сосудов, в которых проводится анализ. Эти сосуды изготавливаются в виде специальных планшетов из непористых прозрачных полимерных материалов: полистирола, поливинилхлорида, полиметакрилата. Белки (антигены или антитела) адсорбируются на поверхности пластика – и в этом основа твердофазного ИФА. Для увеличения прочности связывания белков пластик подвергается модификации (проводится обработка глутаровым альдегидом, поли-L-лизином, толуол-2,4-диизоцианатом; способ модификации – ноу-хау фирмы-производителя) таким образом, что активированная поверхность приобретает способность к ковалентному связыванию белков. К режиму модификации предъявляются жесткие требования: однородность связывающих свойств поверхности пластика, его оптическая прозрачность (результаты ИФА регистрируются фотометрически). По окончании процедуры связывания с поверхностью пластика несвязанный меченый реагент просто смывается с поверхности планшета. В англоязычной литературе твердофазный ИФА именуется
ELISA (enzyme-linked immunosorbent assay) – определение фермента,
связанного с иммуносорбентом.
Общие принципы метода гетеротенного ИФА Определение антител
Рассмотрим принцип определения специфических Aт методом тИФА. На рис. 3а показана общая схема метода, состоящего из трех стадий, соединенных на рисунке знаком плюс. Во время каждой стадии в систему добавляется очередной компонент, инкубируется некоторое время, необходимое для образования иммунного комплекса. Затем ячейка промывается для удаления не связавшихся компонентов. После этого переходят к следующей стадии реакции, которая обозначена следующим знаком плюс на схеме. Рассмотрим подробнее процесс образования иммунного комплекса, который представлен на рис. 3. На твердой поверхности пластиковой лунки, изображенной на рисунке слева, сорбирован Аг любого инфекционного агента (фрагмент вируса, бактерии, простейшего и т. п.). В эту лунку вносится исследуемый биологический материал, чаще всего сыворотка крови больного. Если в ней содержатся Aт к инфекционному агенту (на рисунке обведены), то они закрепляются на соответствующих Aг и остаются связанными при промывке. На этом первая стадия заканчивается. Это основная – «специфическая» стадия процесса. Последующие стадии нужны лишь для выявления образовавшегося иммунного комплекса.
На второй стадии анализа в лунку вносят Aт с заранее прикрепленным к ним ферментом, способные связаться с Aт человека,
15

закрепившимися на инфекционном агенте. Это так называемый конъюгат. Если в ячейке имеются образовавшиеся на первой стадии процесса иммунные комплексы, то возникает «молекулярная цепочка», на конце которой находится фермент. На следующей стадии в лунку добавляется раствор бесцветного вещества — хромогена. Это вещество приобретает окраску после расщепления его присутствующим в ячейке ферментом. То есть, если все элементы цепочки присутствуют, в лунке образуется окрашенный комплекс (рис. 3б). Если на первой стадии анализа иммунных комплексов не образовалось (рис. 3в), то отсутствует и вся последующая часть «молекулярной цепочки», вследствие чего хромоген не окрашивает раствор. В нашем случае ключевым элементом является специфическое Aт из сыворотки крови больного к инфекционному агенту. По сути, мы анализируем способность некоторых из Aт в исследуемом материале связаться с интересующим нас Aг.
Хотелось бы особо отметить, что положительный результат теста показывает только наличие в исследуемом образце (обычно сыворотке крови больного) Aт, способных связываться с поверхностными Aг, сорбированными на твердой фазе. Результат анализа может существенно зависеть от свойств самой тест-системы и от особенностей иммунного ответа больного. Тест-системы на основе моноклональных Aт позволяют достигать более высокой чувствительности и избирательности. Однако чрезмерно узкая избирательность может приводить к ложноотрицательным результатам при некоторых особенностях иммунного ответа организма больного. Многое зависит от того, какого рода Aг используется для сорбции на твердой фазе. Важна и степень очистки, и количество различных Aг, доступных для образования иммунных комплексов, и многое другое. Разумеется, все отмеченное относится к полностью пригодным для использования тест-системам и безошибочному проведению процесса анализа.
Рис. 3а. Последовательность анализа
Рис. 3б. Положительный результат теста
16

Рис. 3в. Отрицательный результат теста
Рис.3. Определение антител методом твердофазного иммуноферментного анализа
Определение антигенов
Для обнаружения самих инфекционных агентов, а точнее их Aг, применяется другая модификация метода тИФА, которая представлена на рис. 4а. В этом случае на поверхности планшета (твердой фазе) сорбируются Aт к искомому агенту. Образующаяся в ходе анализа цепочка выглядит так: Aт, инфекционный агент, далее, как и в предыдущем случае, следует комплекс Aт-Аг. То есть, если в исследуемом образце присутствует искомый Aг, то образуется иммунный комплекс. В ячейке присутствует фермент, который способен расщеплять хромоген с образованием окрашенного продукта. Это возможно только при наличии полной цепочки. Если в исследуемом образце искомый Aг (обведен на рис. 4а) отсутствует, то цепочка не образуется и окрашивания не происходит
(рис. 4в).
Ключевым элементом, от которого зависит, сформируется цепочка или нет, является искомый агент, точнее, его Aг, способные связываться с соответствующими Aт диагностической тест-системы. Так же, как и в предыдущем случае, не следует забывать, что мы определяем только наличие Aг, которые могут быть связаны в такой системе. Например, целую (неразрушенную) бактерию, Aг которой мы ищем, нельзя обнаружить в подобном тесте. Она слишком велика для того, чтобы ее можно было бы удержать в подобной молекулярной системе. Все особенности, о которых говорилось применительно к предыдущему варианту анализа, сохраняют свою актуальность и в этом случае. Кроме того, имеются дополнительные особенности, обусловленные необходимостью связывания диагностических Aт c различными поверхностными Aг исследуемого объекта. Все эти особенности необходимо учитывать при анализе результатов, получаемых с помощью ИФА. Только понимание того, что именно на самом деле определяет тест, позволяет правильно трактовать результат. Кроме того, необходимо учитывать динамику изменений этих показателей. В общем, они адекватно отражают течение инфекционного процесса, но не всегда синхронны с ним и не во всех деталях совпадают.
17

Рис. 4а. Последовательность иммуноферментного анализа
Рис. 4б. Положительный результат теста
Рис. 4в. Отрицательный результат теста
Рис. 4. Определение Aг методом твердофазного иммуноферментного анализа
Динамика изменений показателей ИФА-тестов при инфицировании
В связи с тем, что различные тест-системы дают возможность получить информацию о различных сторонах взаимодействия инфекционного агента и организма человека, возникает вопрос: каким образом значения отдельных показателей связаны с развитием исследуемых процессов.
В случае острого инфекционного процесса, характеризующегося быстрым развитием инфекции и полным уничтожением инфекционного агента, выявлено несоответствие по времени в изменении числа бактерий и уровне поверхностных Аг, определяемых методом ИФА (рис. 5).
Рис. 5. Динамика изменения уровня антигена при развитии острого инфекционного процесса, определяемого методом ИФА:
кривая 1 соответствует изменению числа бактерий; кривая 2 — уровню поверхностных Aг, определяемых методом ИФА
18

Увеличение уровня поверхностных Aг может существенно отставать от роста числа бактерий. Некоторое запаздывание этой кривой может объясняться и тем, что чувствительность методов не бесконечно высокая, и ограниченной доступностью инфекционного агента в исследуемом материале, и рядом других причин. Возможно, сказывается то, что тестсистемы, как правило, лучше реагируют на антигенно-активные фрагменты, в то время как Aг непосредственно на поверхности живой клетки могут оставаться недоступными для тест-системы. Даже при адекватном заборе материала для лабораторного исследования с соблюдением всех предосторожностей, как правило, отмечается подобного рода несовпадение. Таким образом, далеко не всегда результат лабораторного теста по определению поверхностного Aг инфекционного агента полностью соответствует содержанию биологически активного инфекционного материала. Результат теста зависит от многих составляющих инфекционного процесса и от конкретной реализации тестсистем. Имеют значение технология получения диагностических Aг и некоторые другие факторы, в том числе описанные выше.
Еще более неоднозначной может быть трактовка результатов теста на наличие Aт к антигенам инфекционного патогена. Часто результаты такого теста могут, в общем, достаточно хорошо описываться известной кривой иммунного ответа на иммунизацию чужеродными Aг (рис. 6).
Рис. 6. Динамика изменения уровня антител специфичных к инфекционному агенту:
кривая 1 отражает содержание инфекционного агента; кривая 2 — иммунный ответ на иммунизацию чужеродными Aг, определенный методом ИФА
Необходимо отметить, что кривая 2, которая, по сути, является кривой иммунного ответа, запаздывает по отношению к кривой, отражающей содержание инфекционного агента. Иногда это бывает очень существенно. Уровень специфичных иммуноглобулинов (Ig), который собственно и определяется в нашем тесте, может сохраняться высоким и после подавления инфекции, хотя это и не является абсолютным правилом. Кроме того, при анализе результатов такого теста необходимо помнить о том, какого класса Ig определялись в применявшемся тесте, поскольку при развитии иммунного ответа происходит закономерная смена классов Ig. В типичных случаях Ig класса М (первичный иммунный ответ) сменяются на Ig класса G (вторичный иммунный ответ). Вместе с тем, при реактивации
19

хронической инфекции, «серологический профиль» пациента может имитировать первичный иммунный ответ (рис. 7).
Рис. 7. Динамика образования антител
Таким образом, тесты, определяющие непосредственно уровень Ag в исследуемом материале, более адекватно отражают уровень содержания инфекционного патогена или другого агента, однако результаты анализа сильно зависят от выбора материала для исследования, условий его забора и др. Причем невозможность забора необходимого материала может поставить под вопрос и применимость теста вообще. Особенно важно, что во многих случаях при исследовании наиболее доступного биологического материала, которым является сыворотка крови, такие тесты закономерно дают отрицательные результаты.
Вторая группа тестов, достоинство которых заключено в возможности определения инфекции или опухоли вне зависимости от локализации патологического процесса, основана на выявлении Aт различного класса, а также их субпопуляций к антигенам инфекционного агента, раковой клетки, гормона и т. п. В клиническом понимании эта информация дает сведения о стадии иммунного ответа.
Рассмотрим возможные варианты результатов определения Aг и Aт методом тИФА на примере успешного лечения бактериальной инфекции. Через некоторое время после начала лечения содержание поверхностных антигенов начинает увеличиваться, иногда значительно. Затем уровень медленно падает до низких значений. Показатели тестов, определяющих содержание Ig, вообще не имеют на начальном этапе лечения четких тенденций. Может наблюдаться как снижение, так и увеличение уровня. Причем это зависит не только от применявшегося препарата, но и от ряда других факторов. Хотя можно отметить, что при использовании некоторых препаратов имеется тенденция к снижению данного показателя, в то время как при назначении других эта тенденция отсутствует.
Необходимо подчеркнуть, что в указанном случае речь идет только об изменении отдельных показателей, полученных определенным методом. Изменение содержания Ag инфекционного агента в исследуемом
20
