
- •Механизм действия ферментов. Этапы ферментативного катализа.
- •Повышение температуры неоднозначно влияет на активность фермента
- •Ферменты характеризуются высокой специфичностью
- •Изостерическая и аллостерическая регуляция.
- •Аллостерическая регуляция.
- •У аллостерических ферментов особые свойства
- •Две модели объясняют механизмы аллостерии.
- •В основе связывания субстрата - индуцированное взаимодействие.
- •Изменение конформации одной субъединицы индуцирует изменения структуры другой
- •Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
- •Принципы конкурентного торможения находят применение в медицинской практике.
- •Смешанные неконкурентные ингибиторы
- •Кинетика смешанных неконкурентных ингибиторов
- •Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
- •Торможение продуктом реакции- пример конкурентного торможения.
- •Субстрат может быть ингибитором фермента
- •Регуляция активности с помощью гормонов.
Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
Д![]() ля
связывания неконкурентного ингибитора,
фермент должен сначала связаться с
субстратом:
ля
связывания неконкурентного ингибитора,
фермент должен сначала связаться с
субстратом:
![]() и
только затем происходит связывание с
ингибитором:
и
только затем происходит связывание с
ингибитором:
К![]() омбинация
ингибитора со свободным ферментом:
омбинация
ингибитора со свободным ферментом:
невозможна.
Это означает, что неконкурентные ингибиторы неактивны при очень низких концентрациях субстрата, когда почти весь фермент присутствует в свободной форме. При высоких концентрациях субстрата, когда большая часть молекул фермента присутствует в форме комплекса с субстратом, ингибитор эффективен.
Влияние на Km Неконкурентные ингибиторы оказывают довольно неожиданный эффект на Км. Поскольку ингибитор связывается с комплексом субстрата и фермента, он эффективно уменьшает концентрацию этого комплекса, превращая часть его в тройной EIS. По закону действующих масс это способствует смещению равновесия субстрат связывающей реакции вправо и тем самым ингибитор увеличивает количество субстрата, который связывается с ферментом, давая очевидное увеличение сродства фермента к субстрату и уменьшение Км.
Эффект на Vmax Поскольку ингибитор не вытесняется большими количествами субстрата, а наоборот, при больших количествах субстрата быстрее идет образования его комплекса с ферментом, необходимого для проявления действия ингибитора и поэтому уменьшается Vmax.
Влияние на Vmax/Km Так как эти ингибиторы не работают при низких концентрациях субстрата, Vmax/Km не меняется.
Типичный график Лаинуивера - Берка для неконкурентного ингибитора представлен на рис. 2-12.
Вывод. Неконкурентные ингибиторы могут связываться только с комплексом субстрат-фермент, но не со свободным ферментом. В результате они не действуют при очень низких концентрациях субстрата. Они способствуют явному увеличению сродства фермента к субстрату, поскольку большее количество субстрата связывается с ферментом для образования, правда, неактивного тройного комплекса
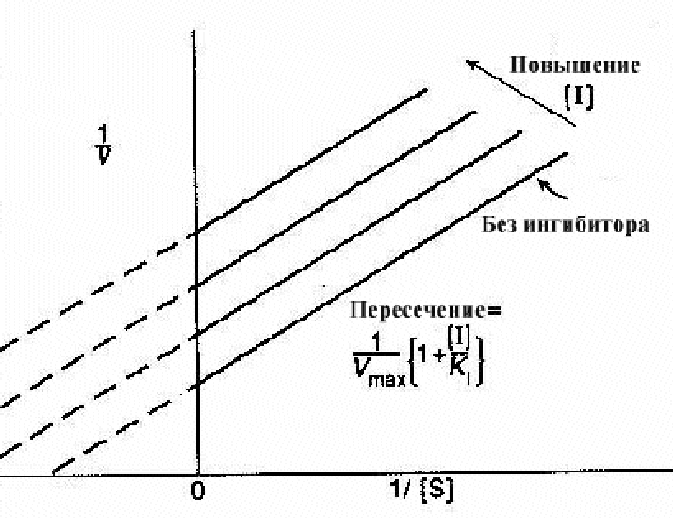
Рис 2-12. График Лаинуивера-Берка для неконкурентных ингибиторов
Торможение продуктом реакции- пример конкурентного торможения.
Заключительный этап в действии любого фермента -выделение продукта. Это важный этап в работе фермента. Продукт связан с активным центром теми же связями, которые связывали и субстрат. Это взаимодействие похоже на субстрат связывающую реакцию, и подобно этой реакции, чаще всего является очень быстрой и легко обратимой. В результате этого, молекулы продукта способны к связыванию со свободным ферментом, образуя комплекс продукта и фермента. Как и в случае действия конкурентного ингибитора, продукт и субстрат пытаются занять активный центр, но не могут связываться одновременно. Поэтому предшествующее связывание продукта предохраняет фермент от связывания с субстратом , и продукт эффективно действует как ингибитор. В ферменте, катализирующем реакцию первого порядка это специализированная форма конкурентного торможения, поскольку субстрат и продукт конкурируют друг с другом. В ферментах с больше чем одним субстратом это выглядит более сложно.
В ферментных кинетических исследованиях мы почти всегда изучаем начальные скорости, которые является скоростью реакции, начинающейся немедленно после добавления фермента к субстрату. В это период времени, конечно, продукта нет, поскольку он еще не успел возникнуть, так что мы обычно игнорируем торможение продуктом в наших кинетических исследованиях.
