
- •Механизм действия ферментов. Этапы ферментативного катализа.
- •Повышение температуры неоднозначно влияет на активность фермента
- •Ферменты характеризуются высокой специфичностью
- •Изостерическая и аллостерическая регуляция.
- •Аллостерическая регуляция.
- •У аллостерических ферментов особые свойства
- •Две модели объясняют механизмы аллостерии.
- •В основе связывания субстрата - индуцированное взаимодействие.
- •Изменение конформации одной субъединицы индуцирует изменения структуры другой
- •Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
- •Принципы конкурентного торможения находят применение в медицинской практике.
- •Смешанные неконкурентные ингибиторы
- •Кинетика смешанных неконкурентных ингибиторов
- •Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
- •Торможение продуктом реакции- пример конкурентного торможения.
- •Субстрат может быть ингибитором фермента
- •Регуляция активности с помощью гормонов.
-
Механизм действия ферментов. Этапы ферментативного катализа.
После установления химической природы фермента было подтверждено представление Михаэлиса и Ментен о том, что при энзиматическом катализе фермент соединяется с субстратом (они подходят как ключ к замку), образуя нестойкий промежуточный фермент-субстратный комплекс, который в конце реакции распадается с освобождением фермента и продукта реакции.
Даниэль Кошланд предложил теорию «индуцированного» соответствия: т. е. что субстрат навязывает активному центру свою форму, а активный центр в свою очередь подгоняет форму субстрата под свою собственную.
Выдвинутая в 1913 году Л. Михаэлисом и М. Ментен общая теория ферментативного катализа постулировала, что фермент Е сначала обратимо и относительно быстро связывается с со своим субстратом S в реакции:
E + S == ES
Образовавшийся при этом фермент-субстратный комплекс ES, не имеющий аналогий в органической химии и химическом катализе, затем распадается в второй более медленной (лимитирующей) стадии реакции:
ES == Е + Р
1 этап: происходит сближение и ориентация субстрата относительно субстратного центра фермента и его постепенное «причаливание» к «якорной» площадке.
2 этап: напряжение и деформация: индуцированное соответствие - происходит присоединение субстрата, которое вызывает конформационные изменения в молекуле фермента приводящие к напряжению структуры активного центра и деформации связанного субстрата.
3 этап: непосредственный катализ.
-
Факторы, определяющие активность ферментов [E], [S], [P], Km. Влияние pH, [P], tº, ионной силы на активность ферментов.
У каждого фермента существует свой pH-оптимум. Существенное влияние на активность ферментов оказывает реакция среды. Для проявления их оптимального действия чаще всего существует узкий диапазон измерения pH среды (pH-оптимум). В некоторых случаях сдвиг pH на единицу снижает активность на 80%. Поэтому в экспериментальных условиях работы с ферментом очень важно поддерживать pH на постоянном уровне.
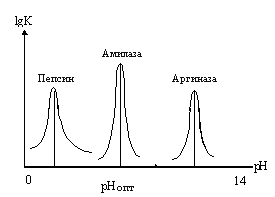 Слева приведены
кривые зависимости активности фермента
от изменения pH среды. Пепсин желудочного
сока, который катализирует гидролиз
белков, имеет pH-оптимум при pH=2. При pH=3
он теряет половину активности, а при
pH=4 активность пепсина не измеряется.
pH-оптимум амилазы, фермента, катализирующего
расщепление крахмала, составляет 7,0. И
в этом случае изменения pH на единицу
приводит к снижению активности на 50%, а
- на 2 единицы отмечается полная потеря
активности. Относительно редко встречаются
случаи, когда pH-оптимум активности
ферментов находится в сильно кислой
или щелочной среде. Это характерно для
таких ферментов как пепсин и аргиназа
(катализирует расщепление аргинина).
Большинство белков при экстремальных
значениях pH неустойчивы. рH-оптимум
является важной характеристикой
фермента, но ни как не исключительной,
присущей только данному ферменту.
Слева приведены
кривые зависимости активности фермента
от изменения pH среды. Пепсин желудочного
сока, который катализирует гидролиз
белков, имеет pH-оптимум при pH=2. При pH=3
он теряет половину активности, а при
pH=4 активность пепсина не измеряется.
pH-оптимум амилазы, фермента, катализирующего
расщепление крахмала, составляет 7,0. И
в этом случае изменения pH на единицу
приводит к снижению активности на 50%, а
- на 2 единицы отмечается полная потеря
активности. Относительно редко встречаются
случаи, когда pH-оптимум активности
ферментов находится в сильно кислой
или щелочной среде. Это характерно для
таких ферментов как пепсин и аргиназа
(катализирует расщепление аргинина).
Большинство белков при экстремальных
значениях pH неустойчивы. рH-оптимум
является важной характеристикой
фермента, но ни как не исключительной,
присущей только данному ферменту.
|
Табл 2-2.Значения pH опт. некоторых ферментов |
|
|
Фермент |
pH опт. |
|
Липаза (подж.железа) |
8.0 |
|
Липаза (желудок) |
4.0 - 5.0 |
|
Липаза(касторовое масло) |
4.7 |
|
Пепсин |
1.5 - 1.6 |
|
Трипсин |
7.8 - 8.7 |
|
Уреаза |
7.0 |
|
Инвертаза |
4.5 |
|
Мальтаза |
6.1 - 6.8 |
|
Амилаза (подж.железа) |
6.7 - 7.0 |
|
Амилаза (солод) |
4.6 - 5.2 |
|
Каталаза |
7.0 |
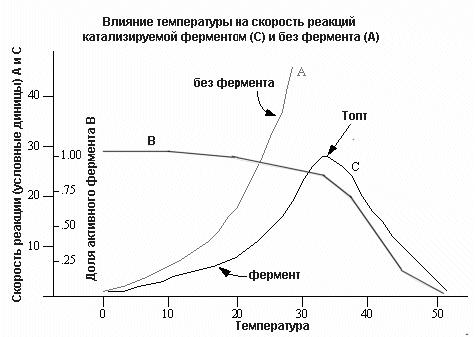
Влияние температуры на активность фермента
Дело в том, что многие ферменты имеют схожие значения pH-оптимумов. Механизм влияния pH среды на активность ферментов заключается в том, что изменение этого показателя приводит к изменению степени ионизации амино- (NH3) и карбосильных (СОО-) групп в молекуле фермента. В результате белковая молекула фермента подвергается конформационным перестройкам, что сказывается на взаимоотношения между ферментом и субстратом.
