
- •Механизм действия ферментов. Этапы ферментативного катализа.
- •Повышение температуры неоднозначно влияет на активность фермента
- •Ферменты характеризуются высокой специфичностью
- •Изостерическая и аллостерическая регуляция.
- •Аллостерическая регуляция.
- •У аллостерических ферментов особые свойства
- •Две модели объясняют механизмы аллостерии.
- •В основе связывания субстрата - индуцированное взаимодействие.
- •Изменение конформации одной субъединицы индуцирует изменения структуры другой
- •Конкурентные ингибиторы не влияют на Vmax, они понижают Км.
- •Принципы конкурентного торможения находят применение в медицинской практике.
- •Смешанные неконкурентные ингибиторы
- •Кинетика смешанных неконкурентных ингибиторов
- •Неконкурентных ингибиторы неактивны при низких концентрациях субстрата.
- •Торможение продуктом реакции- пример конкурентного торможения.
- •Субстрат может быть ингибитором фермента
- •Регуляция активности с помощью гормонов.
В основе связывания субстрата - индуцированное взаимодействие.
Последовательная модель принимает, что субстрат оказывает более прямое влияние на форму фермента. В отсутствии субстрата фермент существовал бы более или менее полностью в T-форме, которая имеет очень низкое сродство к субстрату. Так как субстрат входит в активный центр, как обычно путем случайного столкновения, отдельные части молекулы белка фермента самостоятельно обхватывают субстрат, обеспечивая хорошее взаимодействие. Это известно как индуцированное взаимодействие. Процесс индуцированного взаимодействия способствует переходу субъединицы, с которой связался субстрат в R-конформацию.
Изменение конформации одной субъединицы индуцирует изменения структуры другой
Одна субъединица теперь была преобразована в R-форму, но другие - все еще в T-состоянии. Отметим, что эти субъединицы связаны друг с другом и взаимодействуют друг с другом. Если мы принимаем, что переход одной субъединицы из T состояния в R оказывает влияние на переход в состояние R других субъединиц, мы говорим о положительной кооперативности в действии субстрата, поскольку большее количество субъединиц, вероятно, перейдет в состояние с более высоким сродством к субстрату. Это изменение для других субъединиц может происходить до связывания субстрата или просто облегчать индуцированное взаимодействие при приближении молекулы субстрата.
Ингибиторы и активаторы. Влияние аллостерических эффекторов можно также легко объяснить. Активатор подобен в своем действию субстрату только уже при связывании с другим центром на субъединице, в то время как ингибитор будет делать фермент более жестким, и затрудняет индуцированое взаимодействие при переходе от Т до R.
Отрицательная субстратная кооперативность. Отрицательная субстратная кооперативность встречается не часто, но это происходит у некоторых ферментов. Симметричная модель не может объяснить отрицательную субстратную кооперативность, так как на основе закона действующих масс трудно объяснить перемещение R T равновесия в сторону высокого сродства. Последовательная модель объясняет это совершенно легко. Нужно только принять, что взаимодействие между субъединицами - таково, что преобразование одной из них в R-форму вызванную индуцированным взаимодействием делает это более трудным для других субъединиц.
Какая гипотеза является правильной?
Существование отрицательной кооперативности дает право предположить, что последовательная гипотеза более реальна. С другой стороны существование смесей Т и R субъединиц ведет к намного более сложному равновесию. Некоторые исследования, используя быстрые методы измерения скорости реакции, предполагают, что функция некоторых ферментов лучше объясняется с позиций симметричной модели. В некоторой мере гипотеза симметрии может быть рассмотрена как частный случай последовательной, в котором T/R комбинации могут существовать лишь на протяжении очень короткого времени.
Ингибиторы бывают разные: обратимые и необратимые
Вещества со свойствами ингибиторов ферментов можно грубо разделить на обратимые и необратимые. Обратимые ингибиторы связываются с ферментом, используя слабые связи, подобные тем, которые используются ферментом в связывании субстрата. Эти связи формируются быстро, но также быстро и легко разрушаются. Следствием такого связывания обратимого ингибитора является эффективное мгновенное действие, но после удаления ингибитора фермент сохраняет свою активность. Ингибитор находится в равновесии с ферментом, формируя комплекс ингибитора фермента:
С![]() тепень
торможения зависит от количества
фермента, связавшегося с ингибитором,
т.е. от позиции равновесия.
тепень
торможения зависит от количества
фермента, связавшегося с ингибитором,
т.е. от позиции равновесия.
Н
![]() еобратимые
ингибиторы известны также как инактиваторы
фермента. Они связываются с ферментом,
формируя прочные, обычно ковалентные
связи:
еобратимые
ингибиторы известны также как инактиваторы
фермента. Они связываются с ферментом,
формируя прочные, обычно ковалентные
связи:
Реакция практически необратима и фермент теряет свою активность. Учитывая, что ковалентные связи образуются медленнее, для проявления действия необратимого ингибитора требуется некоторое время для взаимодействия с ферментом. Следовательно, действие необратимого ингибитора обычно зависит от времени и степень торможения увеличивается со временем контакта его с ферментом.
Многие необратимые ингибиторы нашли применение в исследовании ферментов и медицине.
Среди примеров необратимо действующих ингибиторов можно назвать диизопропилфторфосфат (ДИПФФ). Это соединение вошло в историю энзимологии как соединение использовавшееся для исследования роли химических групп в в структуре активного центра. ДИПФФ ковалентно связывается с гидроксильной группой серина и если эта группа важна в катализе реакции, фермент терял свою активность. Эти исследования позволило выявить группу ферментов, в активном центре которых активную роль играет серин (сериновые протеазы)
Другое соединение
иодацетамид, образует ковалентную связь
с SH –группами цистеина
и если эта аминокислота важна для
активности фермента, такой фермент
утрачивает активность.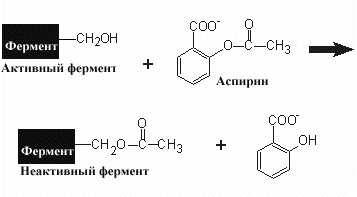
Ацетилсалициловая кислота (известный всем аспирин) является необратимым ингибитором циклооксигеназы- фермента участвующего в синтезе простагландинов. Ингибитором синтеза протеогликанов стенки бактерий является пенилиллин, структура которого напоминает D-аланин, встраиваемый в структуру протеогликанов. Связываясь с активным центром фермента бактерии благодаря своей схожести с переходным состоянием промежуточного продукта в активном центре, пенициллин образует ковалентную связь и тормозит работу фермента.
Обратимые ингибиторы могут быть конкурентными и неконкурентными
Различия между этими типами обратимых ингибиторов касаются их взаимоотношений с субстратом. Если ингибитор конкурирует с субстратом за место связывания на ферменте и действие одного может быть отменено избытком другого, говорят о конкурентном торможении, в противном случае речь идет о неконкурентных ингибиторах.
Конкурентные ингибиторы не всегда структурно подобны субстрату.
Различают два механизма конкурентного торможения.
А.Конкурентное торможение путем связывания активного центра. Классический конкурентный ингибитор - вещество, которое имеет структурное сходство с субстратом фермента. Благодаря этому подобию ингибитор может связываться с активным центром вместо субстрата. Это своеобразная молекулярная ошибка. Однако, поскольку субстрат и ингибитор не идентичны полностью, фермент не способен катализировать превращение ингибитора в продукт. Ингибитор просто блокирует активный центр фермента. Если субстрат свяжется с активным центром раньше, чем ингибитор, ингибитор не может связаться с ферментом. Нельзя одновременно обоим связаться с активным центром. Такой способ конкурентного торможения получил название изостерического из-за схожести (изос) структур субстрата и ингибитора. Наиболее часто в клетке в роли классического конкурентного ингибитора выступает продукт данной реакции, что имеет глубокий практический смысл.
 Б. Конкурентное
торможение путем изменения конформации
фермента. В отличие от классического
варианта, ингибитор связывается не с
активным центром, а со специальным
центром, связывающим ингибитор, который
расположен вдали от активного центра.
Связывание ингибитора вызывает изменение
пространственной структуры (изменение
конформации) в области активного центра,
которое не позволяет присоединиться
субстрату. Предшествующее связывание
субстрата к активному центру в свою
очередь, вызывает изменения конформации
центра связывания ингибитора, которое
предотвращает связывание ингибитора.
И субстрат и ингибитор не могут
одновременно связаться с ферментом. В
этом виде конкурентного торможения
ингибитор может иметь любую химическую
структуру, поскольку они связываются
с различными участками фермента.
Б. Конкурентное
торможение путем изменения конформации
фермента. В отличие от классического
варианта, ингибитор связывается не с
активным центром, а со специальным
центром, связывающим ингибитор, который
расположен вдали от активного центра.
Связывание ингибитора вызывает изменение
пространственной структуры (изменение
конформации) в области активного центра,
которое не позволяет присоединиться
субстрату. Предшествующее связывание
субстрата к активному центру в свою
очередь, вызывает изменения конформации
центра связывания ингибитора, которое
предотвращает связывание ингибитора.
И субстрат и ингибитор не могут
одновременно связаться с ферментом. В
этом виде конкурентного торможения
ингибитор может иметь любую химическую
структуру, поскольку они связываются
с различными участками фермента.
