
- •28. Особенности строения и роль различных видов рнк - информационной, рибосомальной, транспортной, вирусной.
- •29. Механизмы хранения и передачи наследственной информации - репарация, репликация (строение репликативной вилки), транскрипция, трансляция, характеристика основных ферментов и кофакторов.
- •31Процессинг и сплайсинг рнк Кэпирование и полиаденилирование иРнк называется процессингом (посттранскрип-ционной модификацией).
- •33 . Общая схема биосинтеза белка - необходимые предпосылки:
- •34 Пластический поток - механизм активации аминокислот, строение тРнк, характеристика арс-аз - кодаз.
- •35Рибосомы - принципы организации, строение, состав. Механизм трансляции - этапы рибосомального цикла:
- •36. Виды и механизмы посттрансляционной модификации (процессинга) пробелков:
- •38. Строение иммуноглобулинов (Ig). Характеристика основных классов Ig - (IgA, IgD, IgE, IgG, IgM). Регуляция экспрессии генов Ig и причины их разнообразия.
36. Виды и механизмы посттрансляционной модификации (процессинга) пробелков:
. химическая модификация (виды, примеры);
ограниченный протеолиз;
самосборка белка.
Многие белки синтезируются в неактивном виде (в виде предшественников) и после схождения с рибосом подвергаются постсинтетической модификации. Виды модификации белков:
частичный (ограниченный) протеолиз (удаление N-концевого метионина и сигнального пептида, образование активных форм ферментов и гормонов, смотри ниже в вопросе 3.2)
ацетилирование: в большинстве случаев инициирующий метионин удаляется путем гидролиза, и к новой N – концевой аминокислоте добавляется ацетильная группа. Ацетил-КoA – донор ацетильной группы для этих реакций. Ацетилированию подвергаются гистоновые белки.
метилирование происходит по остаткам лизина в некоторых белках типа калмодулина и цитохрома c. S-аденозилметионин - донор активной метильной группы
фосфорилирование - одна из наиболее популярных модификаций белков, которые происходят в животных клетках. Реакции фосфорилирования белков составляют часть механизмов регуляции биологической активности белка и являются обратимыми. Реакции фосфорилирования (АТФ + белок фосфопротеин +АДФ) катализируются протеинкиназами, а реакции отщепления остатков фосфата (фосфопротеин протеин + фосфат) протеинфосфатазами. Примером такого рода реакций могут быть реакции фосфорилирования гликоген синтазы и гликоген фосфорилазы в гепатоцитах в ответ на действие глюкагона – гормона поджелудочной железы. Фосфорилирование синтазы ингибирует ее активность, в то время как активность фосфорилазы повышается. Эти два синхронные события ведут к повышению поступления печеночной глюкозы в кровь. Наоборот, дефосфорилирование вызывает обратное соотношение активностей и клетки печени активно синтезируют гликоген.
остатки тирозина в некоторых белках могут сульфатироваться. Примерами таких белков могут быть фибриноген или гастрин. Донором сульфата для белков, как и при сульфатировании других молекул является 3 '-фосфоаденозил-5 '-фосфосульфат (ФАФС). Присоединение сульфата к остаткам тирозина необходимо для проявления функции белков и является необратимым процессом в отличие от фосфорилирования тирозина, используемого в регуляторных механизмах клетки.
Пренилирование - присоединение 15 углеродной фарнезильной или 20 углеродной геранилгеранильной групп к акцепторным белкам. Фарнезил и геранилгеранил - изопреноиды, получаемые на пути синтеза холестерина. Изопреноидные группы присоединяются к остаткам цистеина на С конце белков тиоэфирной связью (C-S-C). Последовательность на C - конце белков, подвергающихся пренилированию: CAAX, где C – цистеин, А – любая алифатическая аминокислота (кроме аланина) и X - C-концевая аминокислота. Для проведения реакции присоединения пренильных групп, три С- концевые аминокислоты молекулы предшественника (AAX) удаляются, а цистеин активируется метилированием при участии S-аденозилметионина как донора метильной группы. Примерами пренлированных белков могут служить белки, связывающие и гидролизуюшие ГТФ. Многочисленные G-белки участвующие в передаче сигналов имеют гамма субъединицу, модифицированную геранил-геранилом.
Модификации белков, которые зависят от витамина C как кофактора, включают гидроксилирование пролина и лизина. Гидроксилирующие ферменты - пролилгидроксилазы и лизилгидроксилазы. (см. тему «Белки-2» вопрос 1.1.)
Витамин К – кофактор в карбоксилировании остатков ГЛУ. Результатом этой реакции является -карбоксиглутаминовая кислота.

Это соединение важно для функции ряда белков, участвующих в свертывании крови. Образование глутамата позволяет белкам формировать комплексы с ионами кальция и таким образом способствовать изменению конформации и биологической активности белков. Антикоагулянты производные кумарина, варфарин и дикумарин, ингибируют реакцию
Ограниченный протеолиз;Большинство белков подвергается действию протеаз. Самая простая форма такого протеолиза - удаление инициирующего метионина. Многие белки синтезируются в форме неактивных предшественников, активирование которых происходит порой далеко от места их синтеза при помощи так называемого ограниченного протеолиза. Примерами могут служить секретируемые ферменты поджелудочной железы или ферменты системы свертывания крови. Неактивные предшественники таких белков, активируемых удалением дополнительных пептидов, названы пропротеинами. Термин препротеины используется для обозначения белков, содержащих сигнальные последовательности, которые также удаляются специфическими протеазами. Многие секретируемые белки (пропротеины) также имеют сигнальные последовательности. Для обозначения таких белков используют термин препропротеины. Посттрансляционный протеолиз в в ряде случаев может принимать сложный характер. Например, препроопиомеланотропин, синтезируемый гипофизом, или препроинсулин.
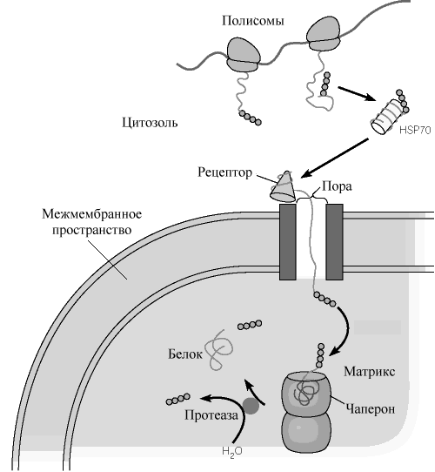
Самосборка белка.Через какое-то время после начала трансляции N-концевая часть растущего полипептида оказывается вне рибосомы и затем по мере роста полипептида все большая часть его свешивается с рибосомы в окружающую среду. В ней полипептидная цепь не может оставаться в виде развернутой цепи: ее гидрофобные боковые группы взаимодействуют друг с другом, а гидрофильные - с окружающей водой и ионами. Это создает условия для сворачивания, компактизации и самоорганизации внерибосомной части растущего полипептида в пространственную (вторичную и третичную) структуру.
Такое постепенное полярное сворачивание растущей полипептидной цепи на рибосоме обозначается как котрансляционное формирование структуры белка. В других случаях белок, синтезируемый рибосомой и используемый в других компартментах клетки необходимо перенести через мембрану либо вне клетки, либо в одну из внутриклеточных органелл. Транспорт такого белка через мембрану требует несвернутого состояния его полипептидной цепи. В этом случае могут быть использованы две альтернативные возможности:
1) рибосомы, синтезирующие белок, предназначенный для транспорта через мембрану, сами сидят на мембране (мембраносвязанные рибосомы), и растущий полипептид в развернутом виде поступает из них непосредственно в мембрану;
2)
свободные (не прикрепленные к мембране)
рибосомы цитоплазмы синтезируют
полипептидную цепь, которая по мере
выхода из рибосомы взаимодействует со
специальными белками - молекулярными
шаперонами. Шапероны препятствуют
полному сворачиванию белка в компактную
структуру и поддерживают его недосвернутое
состояние в растворе. После освобождения
из рибосомы эти недосвернутые белки
взаимодействуют с мембраной и
транспортируются через нее.
37 Регуляция биосинтеза белка у прокариот. Особенности регуляции биосинтеза белка у эукариот: избирательная транскрипция. альтернативный сплайсинг иРНК. модификация гистоновых и негистоновых белков.
Регуляция биосинтеза белка у прокариот.
Значительная часть белков одинакова для всех типов клеток. Они обеспечивают основные функции клеток (ферменты гликолиза, цикла Кребса, структурные белки). Скорость их образования и содержание в клетке обычно меняется незначительно. Такие белки получили название конститутивных белков. Существуют белки, потребность в которых возникает только в специальных условиях. Такие белки обычно синтезируются с очень низкой скоростью, но синтез их может быть значительно ускорен. Например, при голодании или усиленных физических упражнениях клетки печени начинают активно превращать аминокислоты в глюкозу. Это становится возможным благодаря усилению синтеза ферментов, катализирующих образование глюкозы из аминокислот. Такие белки получили название индуцируемых белков. Индукция – свойство клеток синтезировать определенные ферменты только при наличии соответствующих субстратов
Молекулярный механизм индукции ферментов был разработан Жакобом и Моно и известен как гипотеза оперона. У прокариот регуляция инициации транскрипции – основное место действия регуляторов.
Оперон - участок ДНК, кодирующий строение белков, содержит регуляторную зону, контролирующую синтез этих белков. Структурные гены располагаются на молекуле ДНК рядом с последовательностями нуклеотидов, называемых промотором и оператором. Для регуляции транскрипции необходим еще один участок ДНК - регуляторный ген, не всегда располагающийся вблизи вышеописанной группы. Во время транскрипции РНК-полимераза связывается с промотором и продвигается вдоль ДНК, образуя транскрипт генов оперона. Белки-репрессоры - продукты трансляции регуляторных генов, связываются с соответствующими операторными участками и блокируют продвижение РНК-полимеразы, и, следовательно, препятствуют транскрипции.
В самом простом варианте этот механизм можно рассмотреть на примере триптофанового оперона кишечной палочки. Оператор триптофанового оперона представляет собой последовательность нуклеотидов, которую узнает репрессор этого оперона. Присоединение репрессора блокирует присоединение РНК-полимеразы к промотору, предотвращая экспрессию триптофанового оперона. Присоединение репрессора к оператору становится возможным лишь в том случае, если к репрессору присоединятся 2 молекулы триптофана. Результатом данного взаимодействия оператора и репрессора является остановка синтеза. Такое влияние продукта гена регулятора получило название негативного контроля, гены, кодирующие такие регуляторы, названы генами репрессоров, а молекулы, способствующие такой реакции репрессора, получили название корепрессоры (в нашем случае это молекулы триптофана). Роль корепрессоров в клетке часто выполняют конечные продукты метаболических путей.
Особенности регуляции биосинтеза белка у эукариот. Избирательная транскрипция.
У эукариот, регуляция экспрессии генов происходит на разных участках механизма синтеза белков, начиная от синтеза иРНК и до формирования пространственной структуры белков. Можно выделить несколько уровней такой регуляции:
1 Регуляция механизмов траскрипции;
2. Регуляция процессинга иРНК;
3. Регуляция транспорта РНК из ядра в цитозоль;
4.Регуляция трансляции;
5.Регуляция стабильности (продолжительности жизни) иРНК;
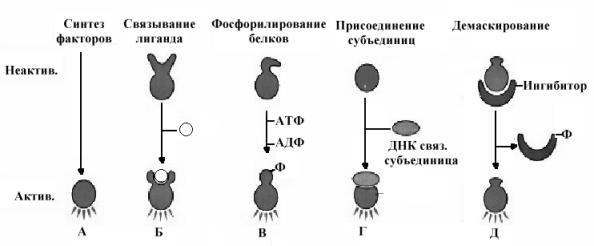
Основным объектом регулирующего влияния на синтез белка и нуклеиновых кислот является транскрипция, она регулируется специальными регуляторными белками, которые присоединяются к специфическим последовательностям, как правило, расположенным на больших расстояниях от промотора. Влияние на процесс формирования комплекса инициирующих белков может быть ускоряющим (энхансеры) или замедляющим (сайленсеры).

Важным элементом в механизмах регуляции экспрессии генов на уровне транскрипции является доступность участков ДНК к действию регуляторов транскрипции.
Многие гены, используемые для синтеза белков, собраны в молекулах ДНК в форме кластеров и доступность к такому кластеру может быть в свою очередь регулируема. Предполагается несколько механизмов, позволяющих вызвать изменения хроматина. Включение или выключение отдельных кластеров генов в определенные сроки жизни клетки или организма обеспечивают процессы дифференцировки клеток, адаптации к определенным условиям жизни.
Альтернативный сплайсинг иРНК.
См. тему «Белки-4», вопрос №11
Модификация гистоновых и негистоновых белков.
В ядре отрицательно заряженная ДНК находится в комплексе с положительно заряженными белками гистонами. Чтобы начались матричные синтезы, нужно «снять» гистоны с ДНК. Это достигается путем ведения отрицательно заряженных структур (под действием гормонального сигнала посредством ферментов аденилатциклазы (превращает АТФ в цАМФ) и протеинкиназ (катализирует процесс протеин---фосфопротеин) происходит фосфорилирование негистоновых белков, которые при этом приобретают отрицательный заряд и притягивают к себе положительно заряженные гистоны. В результате чего ДНК обретает способность к транскрипции и дальнейшей трансляции.
