- •28. Особенности строения и роль различных видов рнк - информационной, рибосомальной, транспортной, вирусной.
- •29. Механизмы хранения и передачи наследственной информации - репарация, репликация (строение репликативной вилки), транскрипция, трансляция, характеристика основных ферментов и кофакторов.
- •31Процессинг и сплайсинг рнк Кэпирование и полиаденилирование иРнк называется процессингом (посттранскрип-ционной модификацией).
- •33 . Общая схема биосинтеза белка - необходимые предпосылки:
- •34 Пластический поток - механизм активации аминокислот, строение тРнк, характеристика арс-аз - кодаз.
- •35Рибосомы - принципы организации, строение, состав. Механизм трансляции - этапы рибосомального цикла:
- •36. Виды и механизмы посттрансляционной модификации (процессинга) пробелков:
- •38. Строение иммуноглобулинов (Ig). Характеристика основных классов Ig - (IgA, IgD, IgE, IgG, IgM). Регуляция экспрессии генов Ig и причины их разнообразия.
34 Пластический поток - механизм активации аминокислот, строение тРнк, характеристика арс-аз - кодаз.
Этап активирования аминокислот:
Процесс трансляции начинается с активирования аминокислот, в котором участвуют тРНК, аминокислоты и специфические ферменты аминоацил-т-РНК синтетазы (АРСазы).

На первом этапе аминокислота взаимодействует с АТФ, образуя промежуточное соединение аминоацил-аденилат. АТФ распадается при этом с образованием пирофосфата, гидролиз которого делает этот этап необратимым. На втором этапе аминокислота в активном центре АРСазы переносится на тРНК с образованием связи между СООН группой аминокислоты и 2’или 3’ ОН группами рибозы концевого аденилового нуклеотида акцепторного участка тРНК. Узнавание соответствующей тРНК связано с особенностями нуклеотидного состава всей молекулы тРНК (не только структуры антикодона).
. энергетический поток. Роль макроэргов АТФ, ГТФ и др. в биосинтезе белка.
Роль АТФ:
Используется в стадии активации аминокислот
Аминокислота+АТФ+тРНК+Н2О = аминоацил-тРНК+АМФ+ФФн
используется для раскручивания вторичной структуры иРНК в процессе трансляции;
Роль ГТФ:
смыкание субъединиц рибосом (в стадии инициации)
присоединение аминоацил тРНК к аминоацильному центру рибосомы (в стадии элонгации)
механизм транслокации, т.е. перемещения рибосомы на три нуклеотида вдоль иРНК (в стадии элонгации)
??? размыкание субъединиц рибосомы (в стадии терминации)
35Рибосомы - принципы организации, строение, состав. Механизм трансляции - этапы рибосомального цикла:
инициация, факторы инициации. Образование инициаторного комплекса.
элонгация, факторы элонгации.
терминация.
Рибосомы - принципы организации, строение, состав.
Рибосомы, внутриклеточные частицы, осуществляющие биосинтез белка, состоят из двух различных субчастиц, каждая из которых построена из рибосомной РНК [рРНК (rRNA)] и многих белков. Рибосомы и их субчастицы обычно классифицируют не по массам, а в соответствии с коэффициентами седиментации. Коэффициент седиментации полной эукариотической рибосомы составляет около 80 единиц Сведберга (80S), а коэффициент седиментации ее субчастиц составляет 40S и 60S.
Меньшая 40S-субчастица состоит из одной молекулы 18S-рРНК и 30-40 белковых молекул. Большая 60S-субчастица содержит три типа рРНК с коэффициентами седиментации 5S, 5,8S и 28S и 40-50 белков. В присутствии мРНК (mRNA) субчастицы объединяются с образованием полной рибосомы, молекула мРНК проходит через щель на малой субчастице, причем эта щель ориентирована как раз в промежуток между двумя субчастицами. тРНК также связываются вблизи этого участка.
Рибосомы прокариот имеют аналогичную структуру, но они несколько мельче, чем эукариотические (коэффициенты седиментации полной рибосомы 70S, а субчастиц — 30S и 50S).
В процессе функционирования (т. е. синтеза белка) рибосома осуществляет несколько функций:
1) специфическое связывание и удержание компонентов белоксинтезирующей системы [информационная, или матричная, РНК (иРНК); аминоацил-тРНК; пептидил-тРНК; гуанозинтрифосфат (ГТФ); белковые факторы трансляции еEF;
2) каталитические функции (образование пептидной связи, гидролиз ГТФ):
3) функции механического перемещения субстратов (иРНК, тРНК), или транслокации. Функции связывания (удержания) компонентов и катализа распределены между двумя рибосомными субчастицами:
малая рибосомная субъединица:
связывая мРНК, служит первичным акцептором генетической информации для белоксинтезирующего аппарата;
с участием факторов инициации обеспечивает узнавание инициирующего участка на иРНК путем сканирования цепи мРНК [у эукариот];
обеспечивает кодон-антикодоновое взаимодействие инициирующего кодона иРНК с антикодоном инициирующей тРНК;
Малая рибосомная субъединица таким образом, является главным " действующим лицом " всего сценария инициации и, по-видимому, не несёт каталитических функций.
большая субчастица исполняет биохимическую часть функций: содержит каталитический участок для синтеза пептидной связи, а также центр, участвующий в гидролизе ГТФ; кроме того, в процессе биосинтеза белка она удерживает на себе растущую цепь белка в виде пептидил-тРНК.
Рибосома имеет 2 центра связывания: Р-центр (пептидильный) и А-центр (аминоацильный)
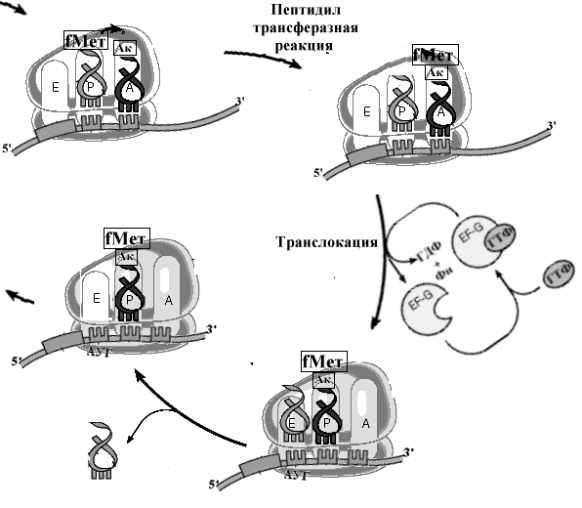
Механизм трансляции - этапы рибосомального цикла:
Собственно трансляция проходит в три этапа: инициация, элонгация и терминация.
Инициация: (на рисунке шаг 2) молекула иРНК поступает на малую рибосомную субъединицу, рибосома точно присоединяется к модифицированному (кэп) 5’-концу иРНК и перемещается по ней до тех пор, пока не обнаружит инициирующий кодон, к инициирующему кодону (АУГ) присоединяется первая аминоацил-тРНК (метионил-тРНК), и комплекс «закрывается» большой субъединицей рибосомы. В образовании инициирующего комплекса участвуют белковые факторы инициации (еIF-1,2,3) [Initiation Factors] и используется энергия ГТФ.
Элонгация: (на рисунке шаг 3) в аминоацильный участок поступает следующая аминоацил-тРНК. Фермент пептидилтрансфераза образует пептидную связь между активированной карбоксильной группой первой аминокислоты и аминогруппой второй аминокислоты. Образованный при этом дипептид «зависает» в аминоацильном центре. Затем с помощью транслоказы и энергии ГТФ рибосома перемещается по иРНК на один кодон, аминоацильный участок освобождается, туда поступает новая аминокислота. В стадии элонгации принимают участие белковые факторы элонгации (еEF). Таким образом, при элонгации рибосома работает как лентопротяжный механизм, перемещая с помощью тРНК цепь мРНК относительно себя с шагом по три нуклеотида от 5'- к 3'-концу цепи.
Терминация (на рисунке шаг 4) наступает тогда, когда в аминоацильном участке оказывается один из терминирующих кодонов УАА, УГА, УАГ. К таким кодонам присоединяются специальные белки факторы терминации (рилизинг-факторы, release factors) еRF, которые высвобождают синтезированный пептид и вызывают диссоциацию субъединиц рибосомы.
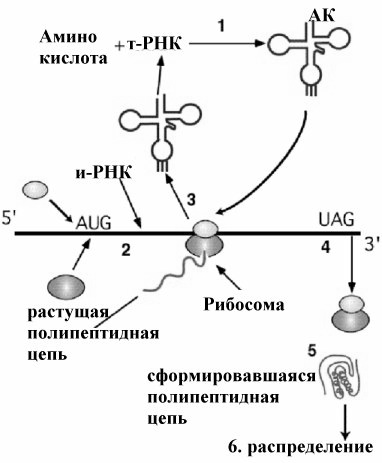
На рисунке шаг 4 - посттрансляционная модификация белка: формирование пространственной структуры и процессинг белковой молекулы с целенаправленным перемещением молекул к местам их функционирования.