
- •Міністерство освіти і науки україни
- •С.М. Котікова
- •Опис установки
- •Порядок виконання роботи
- •Опрацювання результатів
- •Опис приладу
- •Порядок виконання роботи
- •Опрацювання результатів
- •Контрольні запитання
- •Визначення коефіцієнта поверхневого натягу рідини Завдання 1
- •Основні теоретичні відомості
- •Порядок виконання роботи
- •Опрацювання результатів
- •Контрольні запитання
- •Завдання 2
- •Основні теоретичні відомості
- •Порядок виконання роботи
- •Опрацювання результатів
- •Контрольні запитання
- •Визначення абсолютної і відносної вологості повітря за допомогою гігрометра і психрометра
- •Основні теоретичні відомості
- •Опис установки
- •Порядок виконання роботи
- •Опрацювання результатів
- •Контрольні запитання
- •Визначення показника адіабати для повітря
- •Основні теоретичні відомості
- •Опис установки
- •Порядок виконання роботи
- •Опрацювання результатів
- •Контрольні запитання
- •Вимірювання деяких термодинамічних характеристик процесу плавлення олова
- •Основні теоретичні відомості
- •Опис установки
- •Порядок виконання роботи
- •Опрацювання результатів
- •Контрольні запитання
- •Визначення коефіцієнта температуропровідності харчових продуктів методом регулярного режиму
- •Основні теоретичні відомості та опис установки
- •Порядок виконання роботи
- •Опрацювання результатів
- •Контрольні запитання
- •Міністерство освіти і науки україни
- •Київ нухт 2004
Опис установки
Лабораторна установка (рисунок ) складається із: скляної посудини 7, на горловині якої закріплений великий кран 4; водяного манометра 3; гумової груші 6.
У корпусі крана 4 є штуцер з краном 5, до якого приєднана гумова груша 6, а до другого штуцера − гумова трубка, що з’єднує посудину 7 з манометром 3.
Якщо ручка крана 4 у вертикальному положенні, то завдяки отворам в його корпусі посудина 7 з’єднується з атмосферою, якщо у горизонтальному - посудина герметично закрита.
Ручка крана 4 може прокручуватись на 180° (фіксовані крайні його положення). Діаметр отворів у корпусі крана 4 великий (15 мм), тому тиск повітря в посудині 7 вирівнюється з атмосферним миттєво. Достатньо плавно перевести ручку крана від одного крайнього положення в інше.
Манометр змонтований на штативі і складається із бачка 3, що залитий дистильованою водою, вертикальної вимірювальної скляної трубки 1 з метричною шкалою, нижній кінець якої з’єднаний з манометричним бачком 3. Верхній кінець вимірювальної трубки 1 відкритий, тому стовп води в ній зрівноважує надлишковий тиск у посудині 7.
За відсутності надлишкового тиску у посудині 7 рівень води у вимірювальній трубці має збігатись з нулем шкали.
Відношення ср/сV вимірюється на експериментальній установці, що показана на рисунку. Метод вимірювання передбачає проведення двох процесів з повітрям: ізохоричного нагрівання та адіабатного розширення.
Розглянемо послідовність процесів і виведемо робочу формулу для визначення показника адіабати .
Посудину (скляний балон), що містить повітря при температурі Т1 і за атмосферного тиску ра, герметично закривають краном 4. Потім грушею 6 нагнітають у нього повітря. В результаті нагнітання в балоні встановиться тиск р1, а повітря в ньому матиме молярний об’єм V1= V/1. Тут V − об’єм посудини, 1=m1/ − кількість молів речовини. Одночасно при цьому повітря нагрівається, тому слід почекати 3−4 хв., поки температура в балоні зрівняється з температурою навколишнього середовища Т1. Тоді тиск у ньому дорівнюватиме р1=ра+gh1, де gh1 − надлишковий тиск у балоні (відповідна висота стовпчика води h1 у вимірювальній трубці 1 рідинного манометра 3). Отже, параметри першого стану (І) повітря в балоні мають значення Т1, V1, р1.
Після
вирівнювання температур (коли висота
h1
стовпчика води у трубці 1
досягне певної сталої величини) швидко
відкривають і закривають кран 4.
При цьому молярний об’єм повітря, що
міститься в балоні 7,
швидко збільшується до значення V2=![]() ,
а тиск спадає до атмосферного (р2=ра).
Цей процес вважають адіабатним, тому
що проходить він швидко, і помітного
теплообміну між стінками балона та
навколишнім середовищем не відбувається.
Температура повітря в балоні знижується
до Т2
(ІІ стан − Т2,
V2,
р2).
,
а тиск спадає до атмосферного (р2=ра).
Цей процес вважають адіабатним, тому
що проходить він швидко, і помітного
теплообміну між стінками балона та
навколишнім середовищем не відбувається.
Температура повітря в балоні знижується
до Т2
(ІІ стан − Т2,
V2,
р2).
Через 3-4 хв температура повітря в балоні 7 досягне кімнатної температури Т1. Молярний об’єм повітря залишається незмінним V2, а тиск у процесі нагрівання повітря зросте до р3, при цьому висота водяного стовпа в манометричній трубці 1 досягне рівня h2. Тоді тиск р3=ра+gh2 (ІІІ стан − Т1, V2, р3).
Перехід повітря із І стану в ІІ − адіабатний. Тому згідно з рівнянням Пуассона, запишемо:
р1![]() .
(7)
.
(7)
Враховуючи, що в станах І і ІІІ температура повітря однакова, згідно із законом Бойля−Маріотта можна записати:
р1V1=р3V2. (8)
Розв’язуючи рівняння (7) та (8) відносно , отримаємо:
![]() .
(9)
.
(9)
Оскільки р1=ра+gh1; р2=ра; р3=ра+gh2, співвідношення (9) набуде вигляду:
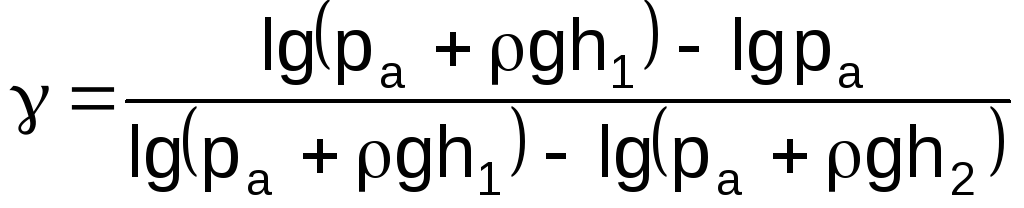 .
(10)
.
(10)
Розкладемо lgp1 і lgp3 в ряд Тейлора і обмежимось першими членами цього ряду:
![]() ;
;
(11)
![]() .
.
Підставляючи вираз (11) у рівняння (10), отримаємо формулу для обчислення показника адіабати:
![]() .
(12)
.
(12)
Співвідношення (12) є робочою формулою для визначення показника адіабати ідеального газу в даній роботі.
