
- •Часть I. Общая микробиология 17
- •Глава 1. Введение в микробиологию
- •Глава 2. Морфология и классификация
- •Глава 3. Физиология микробов 50
- •Глава 4. Экология микробов — микроэкология...82
- •Глава 5. Генетика микробов (м.Н. Бойченко).. 104
- •Глава 6. Биотехнология.
- •Глава 7. Противомикробные препараты
- •Глава 8. Учение об инфекции (а.Ю. Миронов, ю.В. Несвижский, д. Н. Нечаев) 136
- •Часть II. Общая иммунология 183
- •Глава 9. Учение об иммунитете и факторы неспецифической резистентности
- •Глава 10. Антигены и иммунная система
- •Глава 11. Основные формы иммунного реагирования
- •Глава 12. Особенности иммунитета
- •Глава 13. Иммунодиагностические реакции и их применение
- •Глава 14. Иммунопрофилактика
- •Часть III. Частная микробиология.. 310
- •Глава 15 Микробиологическая и иммунологи ческая диагностика (а.Ю Миронов) 310
- •Глава 16. Частная бактериология 327
- •Глава 17. Частная вирусология520
- •Глава 18. Частная микология 616
- •Глава 19. Частная протозоология
- •Глава 20. Клиническая микробиология
- •Часть I.
- •Глава 1. Введение в микробиологию и иммунологию
- •1.2. Представители мира микробов
- •1.3. Распространенность микробов
- •1.4. Роль микробов в патологии человека
- •1.5. Микробиология — наука о микробах
- •1.6. Иммунология — сущность и задачи
- •1.7. Связь микробиологии с иммунологией
- •1.8. История развития микробиологии и иммунологии
- •1.9. Вклад отечественных ученых в развитие микробиологии и иммунологии
- •1.10. Зачем нужны знания микробиологии и иммунологии врачу
- •Глава 2. Морфология и классификация микробов
- •2.1. Систематика и номенклатура микробов
- •2.2. Классификация и морфология бактерий
- •2.3. Строение и классификация грибов
- •2.4. Строение и классификация простейших
- •2.5. Строение и классификация вирусов
- •Глава 3. Физиология микробов
- •3.2. Особенности физиологии грибов и простейших
- •3.3. Физиология вирусов
- •3.4. Культивирование вирусов
- •3.5. Бактериофаги (вирусы бактерий)
- •Глава 4. Экология микробов - микроэкология
- •4.1. Распространение микробов в окружающей среде
- •4.3. Влияние факторов окружающей среды на микробы
- •4.4 Уничтожение микробов в окружающей среде
- •4.5. Санитарная микробиология
- •Глава 5. Генетика микробов
- •5.1. Строение генома бактерий
- •5.2. Мутации у бактерий
- •5.3. Рекомбинация у бактерий
- •5.4. Передача генетической информации у бактерий
- •5.5. Особенности генетики вирусов
- •Глава 6. Биотехнология. Генетическая инженерия
- •6.1. Сущность биотехнологии. Цели и задачи
- •6.2. Краткая история развития биотехнологии
- •6.3. Микроорганизмы и процессы, применяемые в биотехнологии
- •6.4. Генетическая инженерия и область ее применения в биотехнологии
- •Глава 7. Противомикробные препараты
- •7.1. Химиотерапевтические препараты
- •7.2. Механизмы действия противомикроб-ных химиопрепаратов
- •7.3. Осложнения при антимикробной химиотерапии
- •7.4. Лекарственная устойчивость бактерий
- •7.5. Основы рациональной антибиотикотерапии
- •7.6. Противовирусные средства
- •7.7. Антисептические и дезинфицирующие вещества
- •Глава 8. Учение об инфекции
- •8.1. Инфекционный процесс и инфекционная болезнь
- •8.2. Свойства микробов — возбудителей инфекционного процесса
- •8.3. Свойства патогенных микробов
- •8.4. Влияние факторов окружающей среды на реактивность организма
- •8.5. Характерные особенности инфекционных болезней
- •8.6. Формы инфекционного процесса
- •8.7. Особенности формирования патоген-ности у вирусов. Формы взаимодействия вирусов с клеткой. Особенности вирусных инфекций
- •8.8. Понятие об эпидемическом процессе
- •ЧаСть II.
- •Глава 9. Учение об иммунитете и факторы неспецифической резистентности
- •9.1. Введение в иммунологию
- •9.2. Факторы неспецифической резистентности организма
- •Глава 10. Антигены и иммунная система человека
- •10.2. Иммунная система человека
- •Глава 11. Основные формы иммунного реагирования
- •11.1. Антитела и антителообразование
- •11.2. Иммунный фагоцитоз
- •11.4. Реакции гиперчувствительности
- •11.5. Иммунологическая память
- •Глава 12. Особенности иммунитета
- •12.1. Особенности местного иммунитета
- •12.2. Особенности иммунитета при различных состояниях
- •12.3. Иммунный статус и его оценка
- •12.4. Патология иммунной системы
- •12.5. Иммунокоррекция
- •Глава 13. Иммунодиагностические реакции и их применение
- •13.1. Реакции антиген—антитело
- •13.2. Реакции агглютинации
- •13.3. Реакции преципитации
- •13.4. Реакции с участием комплемента
- •13.5. Реакция нейтрализации
- •13.6. Реакции с использованием меченых антител или антигенов
- •13.6.2. Иммуноферментный метод, или анализ (ифа)
- •Глава 14. Иммунопрофилактика и иммунотерапия
- •14.1. Сущность и место иммунопрофилактики и иммунотерапии в медицинской практике
- •14.2. Иммунобиологические препараты
- •Часть III
- •Глава 15. Микробиологическая и иммунологическая диагностика
- •15.1. Организация микробиологической и иммунологической лабораторий
- •15.2. Оснащение микробиологической и иммунологической лабораторий
- •15.3. Правила работы
- •15.4. Принципы микробиологической диагностики инфекционных болезней
- •15.5. Методы микробиологической диагностики бактериальных инфекций
- •15.6. Методы микробиологической диагностики вирусных инфекций
- •15.7. Особенности микробиологической диагностики микозов
- •15.9. Принципы иммунологической диагностики болезней человека
- •Глава 16. Частная бактериология
- •16.1. Кокки
- •16.2. Палочки грамотрицательные факультативно-анаэробные
- •16.3.6.5. Ацинетобактер (род Acinetobacter)
- •16.4. Палочки грамотрицательные анаэробные
- •16.5. Палочки спорообразующие грамположительные
- •16.6. Палочки грамположительные правильной формы
- •16.7. Палочки грамположительные неправильной формы, ветвящиеся бактерии
- •16.8. Спирохеты и другие спиральные, изогнутые бактерии
- •16.12. Микоплазмы
- •16.13. Общая характеристика бактериальных зоонозных инфекций
- •Глава 17. Частная вирусология
- •17.3. Медленные вирусные инфекции и прионные болезни
- •17.5. Возбудители вирусных острых кишечных инфекций
- •17.6. Возбудители парентеральных вирусных гепатитов в, d, с, g
- •17.7. Онкогенные вирусы
- •Глава 18. Частная микология
- •18.1. Возбудители поверхностных микозов
- •18.2. Возбудители эпидермофитии
- •18.3. Возбудители подкожных, или субкутанных, микозов
- •18.4. Возбудители системных, или глубоких, микозов
- •18.5. Возбудители оппортунистических микозов
- •18.6. Возбудители микотоксикозов
- •18.7. Неклассифицированные патогенные грибы
- •Глава 19. Частная протозоология
- •19.1. Саркодовые (амебы)
- •19.2. Жгутиконосцы
- •19.3. Споровики
- •19.4. Ресничные
- •19.5. Микроспоридии (тип Microspora)
- •19.6. Бластоцисты (род Blastocystis)
- •Глава 20. Клиническая микробиология
- •20.1. Понятие о внутрибольничной инфекции
- •20.2. Понятие о клинической микробиологии
- •20.3. Этиология вби
- •20.4. Эпидемиология вби
- •20.7. Микробиологическая диагностика вби
- •20.8. Лечение
- •20.9. Профилактика
- •20.10. Диагностика бактериемии и сепсиса
- •20.11. Диагностика инфекций мочевыводящих путей
- •20.12. Диагностика инфекций нижних дыхательных путей
- •20.13. Диагностика инфекций верхних дыхательных путей
- •20.14. Диагностика менингитов
- •20.15. Диагностика воспалительных заболеваний женских половых органов
- •20.16. Диагностика острых кишечных инфекций и пищевых отравлений
- •20.17. Диагностика раневой инфекции
- •20.18. Диагностика воспалений глаз и ушей
- •20.19. Микрофлора полости рта и ее роль в патологии человека
- •20.19.1. Роль микроорганизмов при заболеваниях челюстно-лицевой области
16.2. Палочки грамотрицательные факультативно-анаэробные
16.2.1. Энтеробактерии (семейство Enterobacteriaceae)
Общая характеристика. Семейство Enterobacteriaceae является самым многочисленным семейством патогенных и условно-патогенных бактерий. Объединяет более 20 родов. Семейство обладает большой степенью гетерогенности. Процент ГЦ-пар в ДНК, определяющих степень гетерогенности, варьирует от 38—42 % (роды Proteus, Providencia) до 52—60 % (роды Klebsiella, Enterobacter). Центральное положение занимает род Escherichia (50—52 % ГЦ-пар), который является типовым родом семейства. Близкородственное к нему положение занимают роды Shigella (50-52 % ГЦ-пар) и Salmonella (50-53 % ГЦ-пар).
16.2.1.1. Эшерихии (род Escherichia)
Морфология и физиология. Семейство энтеробактерии представлено грамотрицательными палочками, размером 1/5х0,4/0,8 мкм. Могут
быть подвижными за счет перитрихиальных жгутиков. Некоторые образуют капсулу. Спор не образуют. Растут на простых питательных средах, большинство хорошо культивируется при 37 "С, некоторые (род Yersinia) наибольшей метаболической активностью обладают при 25—30 "С. Факультативные анаэробы. Обладают дыхательным и бродильным метаболизмами. Оксидазаотрицательны. Катал азаположительны. Способны восстанавливать нитраты за счет наличия нитратредуктазы.
Энтеробактериям присущи два типа ферментации глюкозы муравьино-кислым брожением. При смешанном типе, выявляемом реакцией с метил красным, образуется большое количество кислот, в некоторых случаях — газ. При бутандиоловом типе основными продуктами являются 2,3-бутандиол и этанол, выявляемые реакцией Фогеса—Проскауэра.
Энтеробактерии обладают широким спектром биохимической активности, который служит основой подразделения внутри семейства на роды, а внутри некоторых родов — на виды. Ключевыми тестами при идентификации энтеробактерии являются тесты на определение продуктов ферментации глюкозы (газообразование, реакции с метил красным и Фогеса— Проскауэра), способности продуцировать серо-
водород, индол, утилизировать цитрат на агаре Симмонса, расщеплять мочевину, продуцировать ферменты, превращающие аминокислоты: декарбоксилазы лизина и орнитина, дезаминазу фенилаланина; а также способность использовать различные моно-, олиго- и полисахариды и спирты в качестве энергетического материала. Биохимическая характеристика некоторых представителей семейства Enterobacteriaceae представлена в табл. 16.9.
Распространение в природе. Патогенность. Энтеробактерии разнообразны по экологии и кругу хозяев. Они распространены повсеместно: в почве, воде, в составе микрофлоры различных животных, человека. Могут вызывать заболевания у человека, животных, птиц, насекомых, растений.
Представители родов Escherichia, Shigella, Salmonella вызывают у человека ОКИ, энтеро-патогенные иерсинии, Y. pseudotuberculosis и Y. enterocolitica — псевдотубкулез и кишечный иерсиниоз соответственно, a Y. pestis — чуму. Представители родов Klebsiella, Proteus, Providencia, Serretia являются возбудителями внутрибольничных (нозокамиальных) инфекций, а некоторые из них вызывают пищевые токсикоинфекции, заболевания органов респираторного и мочевыделительного трактов.
Таблица 16.10. Механизмы взаимодействия возбудителей ОКИ с поверхностным кишечным эпителием
|
Тип взаимодействия |
Возбудитель |
Механизм патогенного действия |
|
1-й тип |
ЭТК.П |
Размножение на поверхности эпителия без повреждения эпителия тонкой кишки |
|
2-й тип |
ЭПКП ЭГКП |
Размножение на поверхности эпителия тонкой и толстой кишок с разрушением микроворсинок, повреждением апикальной поверхности эпителия |
|
3-й тип
|
эикп род Shigella |
Внедрение и размножение в эпителиальных клетках слизистой толстой кишки, цитотоксическое повреждение и гибель эпителиоцитов |
|
4-й тип |
Род Salmonella, род Yersinia |
Трансцитоз эпителия тонкой кишки через М-клетки с инфицированием пейеровых бляшек, с последующим размножением в макрофагах |
Факторы патогенности разнообразны и в различных комбинациях присутствуют в определенных видах. Все энтеробактерии содержат эндотоксин, который освобождается после разрушения микробных клеток. Некоторые представители семейства продуцируют белковые токсины, обладающие цитотоксическим и энтеротоксическим эффектами, могут выделять гемолизины. Антифагоцитарная активность обеспечивается факторами, присущими определенным видам. К ним относятся капсула, ферменты супероксиддисмутаза и адени-латциклаза, поверхностные белки и специфические антигены. Начальные этапы инфекции опосредуются структурами, обеспечивающими взаимодействие с поверхностным эпителием. К ним относятся поверхностные структуры 3-го типа: фимбрии 3-го типа, фибриллярные белки, белки наружной мембраны, О-антиген. Установлено 4 типа механизмов взаимодействия возбудителей ОКИ с поверхностным эпителием кишечника (табл. 16.10).
Антигенная структура энтеробактерии представлена соматическим О-антигеном. Могут также встречаться жгутиковый Н-антиген и поверхностный (капсульный) К-антиген. Антигенной активностью обладают также фимбрии 3-го типа. Представители некоторых родов, в частности рода Yersinia, имеют дополнительные видоспецифические антигены.
Основу микробиологической диагностики инфекционных процессов, вызванных представителями семейства Enterobacteriaceae, составляет бактериологический метод исследования. Используются также серологический метод и ПЦР.
16.2.1.1. Эшерихии (род Escherichia)
Род Escherichia включает несколько видов, из которых в патологии человека и животных имеет значение только вид Е. coli, впервые описанный в 1885 г. Т. Эшерихом.
Морфология. Е. coli представлены прямыми грамотрицательными палочками, размером 0,4/0,6х2,0/6,0 мкм, подвижные за счет пе-ритрихиально расположенных жгутиков. Для некоторых характерно наличие микрокапсулы, построенной из гомополимера сиаловой кислоты; такие штаммы обозначаются как К+.
Культуральные свойства. На плотных средах образуют колонии в S- и R-формах. Колонии в S-форме гладкие, блестящие, полупрозрачные. На жидких средах образуют диффузное помутнение и придонный осадок.
Биохимические свойства. Обладает выраженной биохимической активностью (см. табл. 16.9). Биохимические свойства, составляющие основу дифференциальной диагностики при проведении бактериологического исследования, следующие:
продукция кислоты и газа при ферментации глюкозы,
ферментация лактозы,
неспособность образовывать сероводород,
продукция индола.
Антигенная структура. Е. coli обладает сложной антигенной структурой:
а) имеет соматический О-антиген, опре деляющий серогруппу. Известно около 171 разновидностей О-антигена;
б) поверхностный К-антиген может быть представлен 3 антигенами: А, В и L, отлича ющимися по чувствительности к температуре
и химическим веществам. У эшерихий встречается более 97 разновидностей К-антигена, преимущественно В типа. К-антиген обладает способностью маскировать О-антиген, вызывая феномен О-инагглютинабельности. В этом случае О-антиген можно выявить только после разрушения К-антигена кипячением;
в) типоспецифическим антигеном является Н-антиген, определяющий серовар, которых насчитывается более 57.
Антигенная структура обозначается формулами серогруппы как 0:К, серовара — 0:К:Н, например: 012:В6:Н2.
Резистентность. В течение нескольких месяцев сохраняется в воде и почве. Погибает при нагревании до 55 °С в течение 60 мин, при 60 °С — в течение 15 мин. Эшерихий в окружающей среде способны переходить в некультивируемую форму.
Экология, особенности распространения и патогенеза. Вид Е. coli не является однородным, а подразделяется на подвиды. Различают условно-патогенные эшерихий и диареегенные.
Условно-патогенные эшерихий входят у человека в состав микрофлоры кишечника и влагалища. Е. coli также составляют микрофлору кишечника млекопитающих, птиц, рептилий, рыб. С испражнениями микроб выделяется в окружающую среду. Присутствие кишечной палочки в воде, почве, продуктах, предметах обихода является показателем фекального загрязнения.
Условно-патогенные Е. coli способны вызывать эндогенные гнойно-воспалительные процессы различной локализации, называемые парентеральными эшерихиозами. Парентеральный эшерихиоз может протекать в виде сепсиса, нагноения ран, вторичной пневмонии, инфекции моче вы водящих путей. Часто возникает на фоне иммуноде-фицита.
Штаммы Е. coli, вовлеченные в инфекционный процесс нижних отделов мочевыводящих путей, обладают специфическим О-антигеном, позволяющим им адгезироваться на поверхности эпителия мочевого пузыря. Те штаммы Е. coli, которые вызывают инфекцию верхних отделов мочевыводящих путей (пиелонефрит), имеют особые Р-фимбрии, обладающие антигенными свойствами. Эти Р-фимбрии поз-
воляют микробу адгезироваться на эпителии собирательных канальцев. Е. coli, вызывающие инфекцию мочевыводящих путей, чаще относятся к серогруппам 02, Об, 09. Некоторые из них обладают гемолитической активностью за счет наличия Н1у-плазмиды.
Подавляющее число (около 80 %) менингитов новорожденных вызваны Е. coli, которой новорожденный заражается через родовые пути. Е. coli, вызывающая неонатальный менингит, часто обладает микрокапсулой, состоящей из гомополимера сиаловой кислоты. Наличие микрокапсулы придает возбудителю антифагоцитарные свойства, так как микроб перестает опсонизироваться из-за потери способности активировать комплемент.
Из условно-патогенных Е. coli могут формироваться полирезистентные к антибиотикам штаммы за счет приобретения R-плазмид, которые становятся возбудителями ВБИ.
Патогенные Е. coli, которые являются воз будителями кишечного эшерихиоза, ОКИ, получили название диареегенных.
Диареегенные Е. соli не являются однородной группой. Они подразделяются на 4 основные категории, исходя из наличия у них определенных факторов патогенности, их генетической детерминации, особенностей эпидемиологии, патогенеза и клинических проявлений вызываемого ими заболевания. В пределах каждой категории имеется определенный состав О-серогрупп или 0:Н-се-роваров. Именно по составу О-серогрупп и проводится первичная дифференциация диареегенных Е. со/ют условно-патогенных.
Четыре основных категории Е. coli составляют:
энтеротоксигенные кишечные палочки (ЭТКП), энтероинвазивные кишечные палочки (ЭИКП), энтеропатогенные кишечные палочки (ЭПКП), энтерогеморрагические кишечные палочки (ЭГКП).
Кроме них, имеется еще 5 (пока недостаточно изученная) категория энтероагрегатив-ных кишечных палочек.
ЭТКП являются возбудителями холеропо-добных заболеваний у детей и взрослых.
Патогенность определяется выработкой термолабильного (LT), структурно и функцио-
нально связанного с холерным токсином, и термостабильного (ST) энтеротоксинов, детерминированных Ent-плазмидой, и факторами колонизации CF (colonization factor, англ.), синтез которых также детерминируется плаз-мидами. Благодаря CF, ЭТКП размножаются на поверхности эпителия тонкой кишки (см. табл. 16.10). Колонизация ЭТКП поверхности слизистой тонкого кишечника обеспечивает массивный выброс энтеротоксинов, которые нарушают водно-солевой обмен в кишечнике, приводя к развитию водянистой диареи. Механизм развития диарейного синдрома связан с активацией LT аденилатциклазы кишечника, a ST — гуанилатциклазы. С ЭТКП связано 17 серогрупп, среди них серовары О6:H16, 08:Н9, O78:Н11, O148:Н28. Заражение ЭТКП происходит водным и алиментарным путями.
ЭИКП способны внедряться и размножаться в эпителиальных клетках слизистой стенки толстого кишечника, вызывая их деструкцию. Это обусловлено наличием у ЭИКП плазмиды размером 140 мДа, идентичной таковой у шигелл, кодирующей синтез поверхностных белков, опосредующих процесс инвазии в клетки слизистой толстого кишечника. Следствием этого является развитие дизентериеподобного заболевания. Заражение ЭИКП происходит водным и алиментарным путями, возможны вспышки ВБИ, вызванных ЭИКП. С ЭИКП связаны серогруп-пы 0124, 0144, 0152 (более 9 серогрупп).
ЭПКП вызывают диарею у детей первого года жизни. Заболевание передается в основном контактно-бытовым путем, часто протекает как ВБИ в отделениях для новорожденных и грудных детей, находящихся на искусственном вскармливании. ЭПКП обладают способностью размножаться на поверхности эпителия тонкого кишечника с разрушением микроворсинок и повреждением апикальной поверхности эпителия (см. табл. 16.10). Процесс обеспечивается белком наружной мембраны, детерминированным хромосомным геном, который получил название ИНТИМИНА, и белком, синтез которого детерминирован плазмидой размером 60 мДа. С ЭПКП связаны серогруппы 055, 0111, 026, 018 (всего 13), некоторые серовары которых, например О55.Н10, 0111 :Н2, 026:HNM, продуцируют шигаподобные токсины.
ЭГКП способны вызывать у людей кровавый понос (геморрагический колит) с последующим осложнением в виде гемолитического уремического синдрома, тромботической тромбоцитопе-нической пурпуры. Наибольшее эпидемическое значение имеет ЭГКП серовара 0157:Н7 и 0157:HNM. Источником инфекции являются крупный рогатый скот и овцы. Основной путь передачи — алиментарный через мясо, прошедшее недостаточную термическую обработку. Поражаются слепая, восходящая и поперечная толстые кишки. Механизм взаимодействия ЭГКП с поверхностным эпителием кишки происходит так же, как и у ЭПКП, по 2-му типу (см. табл. 16.10). В этом взаимодействии участвует белок наружной мембраны интимин, синтез которого детерминирован хромосомным геном, и, возможно, фимбрии, детерминированные плазмидой размером 60 мДа, которую называют плазми-да 0157. Плазмида 0157 детерминирует также синтез гемолизина, который способствует нарушению барьерной функции кишечника. Развитие геморрагического колита связано со способностью ЭГКП продуцировать шигаподобные токсины (см. гл. 16.2.1.3), синтез которых обеспечивается конвертирующими фагами. У ЭГКП встречается 2 типа шигапо-добных токсина. Серовар ЭГКП O157 может продуцировать как один тип шигаподобного токсина, так и оба сразу. Серовар ЭГКП 0157: Н7 не обладает способностью утилизировать сорбит, что используется при проведении бактериологического исследования.
Иммунитет. Парентеральные эшерихиозы чаще возникают на фоне иммунодефицитных состояний. Надежный иммунитет к ним не вырабатывается.
При кишечных эшерихиозах наблюдается выработка местного иммунитета, опосредованного секреторным IgA. После кишечного эшерихиоза, вызванного ЭТКП, происходит выработка антител к субъединице В LT, им-мунологически родственной субъединице В холерного токсина.
У детей первого года жизни пассивный трансплацентарный иммунитет к ЭИКП обеспечивается проходящими через плаценту IgG. Естественный иммунитет детей первого года жизни обеспечивается колонизацией кишечни-
ка к 5-му дню жизни бифидобактериями и антителами, находящимися в материнском молоке.
Специфическая профилактика. Не разработана.
Неспецифическая профилактика. Сводится к соблюдению санитарно-гигиенических правил, санитарному контролю за источниками водоснабжения, пищевыми предприятиями, продуктами питания.
Микробилогическаядиагаостика. Осуществля -ется проведением бактериологического исследования. Материалом для исследования при кишечных эшерихиозах служат испражнения, при парентеральных — материал из соответствующего инфекционного очага (моча, отделяемое раны, кровь). Исследуемый материал (кроме крови) засевается на дифференциальные лактозосодержащие среды; после инкубации при 37 "С в течение 18 ч отбираются колонии, агглютинирующиеся поливалентной ОВ-агглютинирующей сывороткой, которые подвергаются идентификации до вида по биохимическим тестам, с последующим определением их серологического варианта.
16.2.1.2. Клебсиеллы (род Klebsiella)
Получил название в честь Э. Клебса, который впервые описал микроб в 1875 г. Род Klebsiella включает в себя 4 вида: К. pneumoniae, К. oxytoca, К. planticola, К terrigena, которые различаются по биохимическим свойствам. В патологии человека наибольшее значение имеют виды К. oxytoca и К. pneumoniae, состоящий из 3 подвидов: K. subsp. pneumonia, К. subsp. ozaenae, К. subsp. rhinoscleromatis, которые дифференцируют по биохимическим свойствам.
Морфология. Клебсиеллы — не образующие спор неподвижные палочки, размером 0,3/1,5х0,6/6,0мкм, располагающиеся единично, парами или короткой цепочкой. Обычно они локализованы в капсуле, которая является характерным морфологическим признаком.
Культуральные свойства. Клебсиеллы хорошо растут на простых питательных средах. На поверхности плотных питательных сред образуют куполообразные крупные слизистые колонии. В жидких средах вызывают интенсивное помутнение.
Физиология. Клебсиеллы обладаютвыраженной биохимической активностью. Дифференциация между видами внутри рода и подвидами внутри
вида К. pneumoniae осуществляется по биохимическим свойствам (табл. 16.11).
Антигенная структуралебсиеллы имеют соматические О-антигены (более 10 серогрупп) и более 80 вариантов капсульных К-антиге-нов. Некоторые варианты К-антигена клеб-сиелл родственны термостабильному А-вари-анту К-антигена Е. coli.
Факторы патогенности. К факторам патоген-ности относятся: капсула полисахаридной природы, обладающая антифагоцитарной активностью; маннозорезистентные фимбрии 3-го типа; термостабильный и термолабильный эн-теротоксины, а также встречающиеся у некоторых вирулентных штаммов ферменты патоген-ности: ДНКаза, нейраминидаза, фосфатаза.
Экология и распространение. К pneumoniae входит в состав факультативной микрофлоры кишечника, верхних дыхательных путей, влагалища; также обнаруживается на коже и слизистых оболочках. Клебсиеллы устойчивы к факторам окружающей среды благодаря наличию капсулы и могут в течение длительного времени сохраняться в почве, воде, помещениях. Клебсиеллы погибают при температуре 65 °С через 60 мин, в растворах обычных дезинфицирующих веществ.
Патогенез и заболевание у человека. К. pneumoniae подвид pneumoniae является возбудителем неспецифических инфекций дыхательных путей (бронхитов, пневмоний), органов мочевыводящей системы, пищевой токсикоинфекции.
Этот микроб может также вызывать гнойные послеродовые осложнения, неонатальную инфекцию, которая проявляется в виде пневмоний у новорожденных, кишечной инфекции и токсико-септических состояний, заканчивающихся летальным исходом. К. subsp. pneumonia, обладающая фактором множественной лекарственной устойчивости, в настоящее время занимает ведущее место среди возбудителей ВБИ, которые протекают с поражением дыхательных и мочевыводящих путей.
Возбудитель подвида ozaenae вызывает поражение слизистой оболочки носа и придаточных пазух, сопровождающееся выделением зловонного секрета.
Klebsiella subsp. rhinoscleromatis вызывает ри-носклерому, при которой поражается слизис-
тая оболочка верхних дыхательных путей, с образованием гранулем, в которых микроб находится как вне-, так и внутриклеточно. Болезнь может протекать хронически и заканчиваться склеротическими изменениями на месте гранулем.
К. oxytoca вызывает ВБИ в урологической клинике.
Иммунитет. Гуморальный иммунный ответ защитной активностью не обладает. В защите от инфекции главная роль принадлежит фагоцитозу, опсонизированному специфическими антителами клебсиелл. При хронических формах клебсиеллезов, при которых микроб расположен внутриклеточно, развивается ГЗТ.
Микробиологическая диагностика.
Применяется бактериологический метод исследования, который предусматривает выделение чистой культуры возбудителя из мокроты, мочи, испражнений, крови, гноя, в зависимости от локализации процесса, путем посева исследуемого материала на лактозосо-держащие дифференциальные питательные среды с последующим выделением чистой культуры возбудителя и его идентификации до вида и подвида. Серодиагностика проводится путем постановки РСК с О-антигеном.
Профилактика и лечение. Средств специфической профилактики не существует. Для лечения используют клебсиеллезный бактериофаг и антибиотики, чему предшествует определение антибиотикограммы.
16.2.1.3. Шигеллы (род Shigella)
Род получил название по имени К. Шига, который в 1898 г. детально изучил микроб,
известный в настоящее время под названием S. dysenteriae 1 серовара.
Род Shigella включает 4 вида, которые различаются по биохимическим свойствам и антигенной структуре:
S. dysenteriae — 12 сероваров,
S.flexneri — 9 сероваров,
S. boydii— 18 сероваров,
S. sonnei — 1 серовар.
Морфология. Шигеллы представлены неподвижными палочками, размером 0,5/0,7х2/З мкм. Спор и капсул не образуют.
Культуральные свойства. Хорошо культивируются на простых питательных средах. На плотных средах образуют мелкие гладкие, блестящие, полупрозрачные колонии; на жидких — диффузное помутнение. Жидкой средой обогащения является селенитовый бульон. У S. sonnei отмечена при росте на плотных средах S R-диссоциация.
Физиология. Обладают слабой биохимической активностью по сравнению с представителями родов Esherichia и Salmonella.
Основные биохимические признаки, необходимые для идентификации при выделении чистой культуры:
отсутствие газообразования при ферментации глюкозы,
отсутствие продукции сероводорода,
отсутствие ферментации лактозы в течение 48 ч.
S. sonnei способен ферментировать лактозу медленно, в течение 72 ч. Является наиболее биохимически активным видом; по биохимической активности подразделяется на хе-мовары.
Резистентность. В зависимости от температуры, влажности, рН и вида возбудителей выживаемость шигелл во внешней среде, на предметах обихода колеблется от нескольких дней до нескольких месяцев. Наиболее неустойчив во внешней среде вид S. dysenteriae. Шигеллы хорошо переносят высушивание, низкие температуры, но быстро погибают под воздействием прямых солнечных лучей и нагревании (при 60 °С — через 30 мин; при 100 °С — мгновенно). Благоприятный средой для шигелл являются пищевые продукты. S. sonnei в молоке и молочных продуктах способны не только длительно переживать, но и размножаться. Дезинфицирующие средства (гипохлориты, хлорамин, лизол и др.) в обычных концентрациях убивают шигеллы. У некоторых видов, в частности у S. dysenteriae, отмечен переход в некультивируемую форму.
Антигенная структура. Все шигеллы обладают соматическим О-антигеном, в зависимости от строения которого происходит их подразделение на серовары, a S.flexneri внутри сероваров подразделяется на подсеровары. S. sonnei обладает антигеном 1-й фазы, который является К-антигеном.
Факторы патогенности. Все виды шигелл обладают способностью вызывать инвазию с последующим межклеточным распространением и размножением в эпителии слизистой толстого кишечника. Эта способность связана с функционированием крупной плазмиды инвазии, которая имеется у всех 4 видов шигелл. У S. sonnei эта плазмида имеет молекулярную массу 120 мДа и, в отличие от аналогичных плазмид других видов, детерминирует добавочно синтез антигена 1-й фазы. У остальных трех видов плазмида инвазии имеет молекулярную массу 140 мДа.
Плазмида инвазии детерминирует синтез ipa BCD-инвазинов (invasion plasmide antigen, англ.), белков, входящих в состав наружной мембраны, которые обеспечивают процесс инвазии слизистой, ipa BCD-инвазины чувствительны к трипсину, поэтому патологический процесс ограничивается толстым кишечником.
Помимо ipa BCD-инвазинов, в патогенезе играют роль белки внутриклеточного распространения, которые вызывают лизис мембран эукариотических клеток, обеспечивая внутриклеточное и межклеточное распространение шигелл.
Плазмидные гены начинают экспрессиро-ваться при 37 °С и в условиях осмотического давления в кишечнике.
Шигеллы продуцируют шига и шигаподоб-ные белковые токсины. Шига-токсин продуцируется S. dysenteriae 1 серовара, остальные шигеллы продуцируют шигаподобные токсины. Это белковые токсины, состоящие из 1 эн-зиматической субъединицы А и 5 рецепторных субъединиц В, имеющих сродство к рецептору Gb3 (globotriaosylceramide), который локализуется на мембранах эндотелия капилляров. Субъединица А, проникнув в клетку, взаимодействует с 60S-субъединицей рибосом, необратимо блокируя синтез белка. Эти токсины не имеют гомологии с холерным токсином и LT-токсином ЭТКП. Шига и шигаподобные токсины накапливаются после гибели шигелл. У шигелл, отличных от S. dysenteriae 1 серовара, количество шигаподобных токсинов вырабатывается в 1000 раз меньше, поэтому ареал действия токсина ограничивается стенкой кишечника. У S. dysenteriae 1 серовара токсин попадает в кровь и наряду с эндотелием подслизистой поражает также гломерулы почки, вследствие чего помимо кровавого поноса развивается гемолитический уремический синдром с развитием почечной недостаточности.
Эндотоксин защищает шигеллы от действия низких значений рН и желчи.
Эпидемиология и патогенез.
Шигеллы вызывают заболевания, называемые шигеллезами (старое название — бактериальная дизентерия), которые являются антропонозными инфекциями с фокально-оральным механизмом передачи. Заболевание, вызываемое S. dysenteriae, имеет контактно-бытовой путь передачи, S. flexneri — водный, a S. sonnei — алиментар-ный. Естественная восприимчивость людей высокая, поэтому шигеллезы распространены повсеместно, чаще всего возникают в виде вспышек алиментарного и водного характера. Ежегодно шигеллезами болеют более 200 млн человек. Чаше болеют дети и жители городов, характерна летне-осенняя сезонность.
Патогенез и клиника заболевания
Шигеллезы — это инфекционные заболевания, характеризующиеся поражением толстого кишечника, с развитием колита и интоксикацией организма.
Заболевание характеризуется сложными начальными этапами патогенеза. Шигеллы взаимодействуют с эпителием слизистой толстой кишки по 3-му типу (см. табл. 16.10). Прикрепляясь ipa-инвазинами к М-клеткам, которые покрывают регионарные лимфатические образования подслизистой кишечника, шигеллы пенетрируют через М-клетки в подслизистую, где поглощаются макрофагами. Взаимодействие шигелл с макрофагами приводит к их гибели, следствием чего является выделение ИЛ-1, который инициирует воспаление в подслизистой. Апоптоз фагоцитов позволяет шигеллам сохраниться и проникнуть в эпителиальные клетки слизистой через базаль-ную мембрану. Внутри энтероцитов происходит размножение шигелл и их межклеточное распространение, следствием чего является развитие эрозий. При гибели шигелл происходит выделение шига и шигаподобных токсинов, действие которых приводит к появлению крови в испражнениях. Патологический процесс ограничивается кишечником. Бактериемии при шигеллезах не наблюдается. Наиболее тяжело протекает шигеллез, вызванный S. dysenteriae 1 серовара. S. sonnei вызывает развитие заболевания в легкой форме, часто в виде бактерионосительства. Осложнением шигеллезов может быть развитие кишечного дисбактериоза. Летальность при шигеллезах достигает 0,3 %.
Иммунитет. В защите от инфекции основная роль принадлежит секреторным IgA, предотвращающим адгезию, и цитотоксической антителозависимой активности интраэпите-лиальных лимфоцитов, которые вместе с секреторными IgA уничтожают шигеллы.
Микробиологическая диагностика. Основным методом диагностики является бактериологический, материалом для исследования служат испражнения. Для посева отбираются гной-но-слизисто-кровяные образования из средней порции кала, которые при диагностике заболевания непосредственно высеваются на лактозосодержащие дифференциальные питательные плотные среды. В случае выявления
бактерионосителей посев испражнений обязательно проводится в селенитовый бульон с последующим выделением возбудителя на плотных лактозосодержащих дифференциальных питательных средах. Среди выросших на этих средах отбирают лактозонегативные колонии, которые идентифицируют до вида и серовара, а выделенные культуры S. flexneri — до подсероваров, S. sonnei — до хемоваров. В качестве вспомогательного используют серологический метод с постановкой РНГА.
Профилактика и Лечение. Для лечения по эпидемиологическим показаниям используют бактериофаг орального применения, антибиотики после определения антибиотиког-раммы; в случае возникновения дисбактериоза — препараты пробиотиков для коррекции микрофлоры. Не специфическая профилактика сводится к соблюдению санитарно-гигиенических правил приготовления, хранения и реализации пищевых продуктов, при водоснабжении, соблюдению правил личной гигиены и других мероприятий аналогичных таковым при кишечном эшерихиозе.
Многочисленная практика разработки и применения вакцинопрофилактики свидетельствует о неэффективности метода специфической профилактики шигеллезов.
16.2.1.4. Сальмонеллы (род Salmonella)
Род получил название в честь Д. Сальмона, который в 1885 г описал микроб, выделенный из свиньи и известный в настоящее время под названием S. Choleraesuis.
Морфологические и Кулыуральные свойства. Подвижные грамотрицательные палочки, размером 0,7x1,5x2—5 мкм. Капсулу не образуют. Хорошо растут на простых питательных и желчесодержащих средах. На плотных средах могут образовывать колонии в R- и S-формах, на жидких — диффузное помутнение. Колонии в S-форме средних размеров (некоторые се-ровары, например S. Abortus ovis, формируют мелкие колонии), гладкие, блестящие, полупрозрачные, с голубоватым оттенком. Серовар S. Schottmuelleri (S. Paratyphi В) при росте на плотных средах образует слизистые валики. Жидкими средами обогащения при посеве крови является желчный бульон, при посеве содержащих дополнительную флору материалов (фе-
калий, желчи, мочи) — селенитовый бульон. На лактозосодержащих дифференциальных средах образуют бесцветные колонии, на висмут-сульфитном агаре — колонии черного цвета.
Физиология. Обладают выраженной биохимической активностью. По биохимическим свойствам род однороден. Основные биохимические свойства, необходимые для идентификации:
ферментация глюкозы до кислоты и газа (за исключением S. Typhi),
отсутствие ферментации лактозы,
продукция сероводорода,
— отсутствие индолообразования. Антигенная структура и классификация.
СальмонеллыобладаютсоматическимО-анти-геном, жгутиковым Н-антигеном. Некоторые сальмонеллы обладают К-антигеном.
В связи с тем, что по основным биохимическим свойствам представители рода Salmonella однотипны, дифференциация внутри рода проводится по антигенной структуре.
Имеется несколько классификаций сальмонелл. Наиболее старой является классификация по Кауфману—Уайту. В основе этой классификации лежит подразделение сальмонелл на серогруппы по общности строения О-антигена, а внутри серогруппы — на серовары, в соответствии с различиями в строении Н-антигена.
О-антиген состоит из R-ядра и боковой S-цепи. К S-цепи присоединяются сахара, которые называют рецепторами и обозначают цифрами. Критерием для объединения в се-рогруппу является общность конечного сахара, который по химической природе является 3,6-дидезоксигексозой.
Н-антиген является двухфазным. Это связано с тем, что его синтез кодируется двумя независимыми генами, работа одного из которых исключает работу другого. Поэтому в каждой клетке может быть синтезирован только один белок (фаза). Первая фаза обозначается буквами, она считается специфической, вторая фаза — цифрами, ее принято считать неспецифической.
В таблице Кауфмана—Уайта (табл. 16.12) внутри серогруппы серовары расположены в алфавитном порядке. В прежних классификациях каждый серовар соответствовал виду, которых насчитывалось более 2500.
Согласно последней классификации, род Salmonella состоит из двух видов — вида S. enterica, в который включены все сальмонеллы, являющиеся возбудителями человека и теплокровных животных, и вида S. bongori. который подразделяется на 10 сероваров и включает в себя сальмонеллы, изолированные от холоднокровных животных.
Вид S. enterica разделен на 6 подвидов, которые в свою очередь подразделены на серовары. Все серовары подвида enterica имеют названия, которые соответствуют прежним видовым названиям. Например: S. typhi — S. Typhi.
Некоторые серовары сальмонелл, в частности S. Typhi, имеют полисахаридный Vi-антиген, являющийся разновидностью К-ан-тигена. Vi-антиген по химической структуре является полимером N-ацетилгалактозоами-ноуроновой кислоты. Этот антиген является рецептором для бактериофагов. По спектру чувствительности к набору Vi-фагов устанавливается фаговар S. Typhi, который необходим для эпидемического анализа вспышек брюшного тифа с целью определения источника инфекции. Vi-антиген может придавать бактерии явление О-инагглютинабельности.
Патогенность и патогенез. Сальмонеллы обладают множественностью факторов патогенное™, многие из которых еще недостаточно изучены. Совокупность действия факторов патогенности обеспечивает сальмонеллам трансцитоз, т. е. инвазию слизистой через М-клетки, а также резистентность к фагоцитозу, позволяющую сальмонеллам сохраняться и размножаться внутри фагоцитов. Трансцитоз обеспечивается белками секреторной системы 3 типа, синтез которых детерминируется «островком патогенности 1», среди которых имеется белок наружной мембраны инвазии. Особенность синтеза этих белков заключается в том, что он индуцируется в среде с высоким осмотическим давлением, соответствующим таковому в тонком кишечнике.
Резистентность к фагоцитозу обеспечивается многими факторами. В этом процессе принимают участие продукты генов, расположенных на «островке патогенности 2», синтез которых индуцируется внутрифагоцитарным окружением. Установлено, что в формирова-
нии антифагоцитарной активности сальмонелл принимает также участие фермент су-пероксиддисмутаза, инактивируюшая O2-радикалы.
Все сальмонеллы обладают эндотоксином, который вызывает развитие лихорадки в случае бактериемии, вызванной сальмонеллами. При достижении критической концентрации эндотоксин активирует каскад арахидоновой кислоты в тканях. Некоторые сальмонеллы образуют белковый энтеротоксин, который обладает гомологией с холерным энтероток-сином и LT-токсином ЭТКП.
Попав после перорального заражения в тонкий кишечник, сальмонеллы инвазиру-ют трансцитозом слизистую кишечника через М-клетки без повреждения слизистой. Из М-клеток сальмонеллы транспортируются в субэпителиальное пространство, где захватываются макрофагами и привносятся в прилегающие к М-клеткам пейеровы бляшки, где, размножаясь в макрофагах, формируют первичный очаг инфекции
Резистентность. Сальмонеллы устойчивы к воздействию факторов внешней среды. Выдерживают рН в диапазоне 4—9; в водоемах, сточных водах, почве сохраняют жизнеспособность до 3 месяцев, в комнатной пыли — от 80 до 550 дней. Хорошо переносят низкие температуры. В зараженных продуктах сохраняются:
в колбасе — 3 месяца, в замороженном мясе и яйцах — до 1 года, на овощах и фруктах — 5-10 дней. При нагревании до 56 °С сальмонеллы гибнут в течение 45—60 мин, температура 100 °С убивает их мгновенно. Растворы дезинфицирующих веществ (5% фенол, 3% хлорамин, 3% лизол) убивают сальмонеллы в течение 2—3 мин. При неблагоприятных условиях сальмонеллы могут переходить в некультиви-руемую форму.
Вызываемые заболевания. В зависимости от источника инфекции, путей передачи и особенностей патогенеза и форм проявления инфекционного процесса, среди заболеваний, вызываемых сальмонеллами, различают: брюшной тиф и паратифы, сальмонеллезы, госпитальный (нозокомиальный) сальмонел-лез.
Возбудители брюшного тифа и паратифов (S. Typhi, S. Paratyphi В, S. Paratyphi A)
Брюшной тиф представляет собой острую антропонозную системную инфекцию, характеризующуюся циклическим течением, поражением лимфатического аппарата тонкого кишечника, бактериемией, лихорадкой, сыпью и интоксикацией организма.
Возбудителем брюшного тифа является S. Typhi, впервые обнаруженный К. Эбертом
в 1880 г. в срезах селезенки, лимфатических узлов и пейеровых бляшек людей, умерших от брюшного тифа. В 1884 г. Т. Гаффки выделил возбудитель в чистой культуре. S. Paratyphi А, описанный А. Брионом и X. Кайзером, и S. Paratyphi В, описанный Г. Шоттмюллером, являются возбудителями паратифов, которые схожи с брюшным тифом по патогенезу, клиническим проявлениям и эпидемиологии заболевания. Брюшной тиф и паратифы являются антропонозами, т. е. S. Typhi, S. Paratyphi A, S. Paratyphi В вызывают заболевание только у человека. Источником инфекции является больной или бактерионоситель, которые выделяют возбудитель во внешнюю среду с испражнениями, мочой, слюной. Возбудители этих инфекций, как и другие сальмонеллы, устойчивы во внешней среде, сохраняются в почве, воде. Благоприятной для них средой являются пищевые продукты (молоко, сметана, творог, мясной фарш, студень), в которых сальмонеллы способны размножаться. Передача возбудителей осуществляется водным путем, играющим в настоящее время существенную роль, а также алиментарным и контактно-бытовым путями. Заражающая доза равняется приблизительно 1000 клеток. Естественная восприимчивость людей к возбудителям тифа и паратифа высокая.
Патогенез и клиника. Сформировав первичный очаг инфекции в пейеровых бляшках, после инвазии трансцитиозом слизистой тонкого кишечника, возбудители тифа и паратифов вызывают их воспаление с развитием лимфаденита. В результате воспаления нарушается их барьерная функция, и сальмонеллы попадают в кровь, вызывая бактериемию. Это совпадает с концом инкубационного периода, который длится 10—14 суток. Во время бактериемии, которая сопровождает весь лихорадочный период, возбудители тифа и паратифов с током крови разносятся по организму, оседая в ретикулоэндотелиальных элементах паренхиматозных органов: печени, селезенке, легких, а также в костном мозге, где размножаются в макрофагах, а также в желчном пузыре, куда они попадают по желчным протокам, диффундируя из Купферовских клеток печени. К концу 2-й недели заболевания возбудитель начинает выделяться из организ-
ма с мочой, путом, материнским молоком, слюной. Накапливаясь в желчном пузыре, сальмонеллы вызывают его воспаление и с током желчи реинфицируют тонкий кишечник. Повторное внедрение сальмонелл в сенсибилизированные пейеровы бляшки приводит к развитию в них гиперергического воспаления по типу феномена Артюса, их некрозу и изъязвлению, что может привести к кишечному кровотечению и прободению кишечной стенки. Выделяются сальмонеллы из организма с испражнениями и мочой.
Клиника брюшного тифа и паратифов характеризуется циклическим течением и проявляется лихорадкой (повышение температуры до 39—40°), интоксикацией, появлением розеолезной сыпи, нарушениями со стороны нервной системы (бред, галлюцинации) и сердечно-сосудистой системы (падение кровяного давления, коллапс и др.). Паратифы протекают в основном так же, как брюшной тиф.
Иммунитет. Иммунитет после перенесенного заболевания напряженный и длительный. Протективный иммунный ответ обеспечивается синергичным действием клеточного иммунного ответа, в котором ведущая роль принадлежит активированным макрофагам.
Гуморальный иммунитет самостоятельно не обладает протективной активностью, а является свидетелем инфекционного процесса. Причем первыми к концу 1-й недели заболевания появляются антитела к О-антигену, которые максимальных титров достигают к разгару заболевания, а затем исчезают. Антитела к Н-антигену появляются в период реконва-лесценции и у привитых лиц и длительно сохраняются. У бактерионосителей брюшного тифа обнаруживаются антитела к Vi-анти-гену. Возникновение бактерионосительства связано с функциональной недостаточностью макрофагов.
Микробиологическая диагностика. Учитывая цикличность течения заболеваний, материал для исследования и метод исследования определяются стадией течения болезни.
В первые дни заболевания наблюдается бактериемия, поэтому на 1-й неделе заболевания и в течение всего лихорадочного периода используют метод гемокультуры: посев крови в желчный бульон с последующим пересе-
вом на дифференциально-элективные среды (Эндо, Плоскирева, висмут-сульфитный агар). Выделенную культуру идентифицируют по биохимическим свойствам и антигенной структуре, а выделенную культуру S. Typhi ти-пируют Vi-фагами для определения источника инфекции. С конца 2-й недели заболевания производят выделение копро-, урино- и би-ликультур, т. е. материалом для исследования являются моча, испражнения, желчь.
Начиная со 2-й недели заболевания проводят серологическое исследование с целью определения наличия и типа антител. Исследование проводится постановкой РНГА. РНГА ставят с О-, Н- и Vi-диагностикумами. Положительным считают диагностический титр не менее 1:200. Ранее для серологической диагностики применяли развернутую реакцию агглютинации Видаля. В настоящее время серологическое исследование проводят также постановкой ИФА.
Профилактика и Лечение. Для специфической профилактики брюшного тифа используют брюшнотифозную сорбированную и брюшнотифозную спиртовую, обогащенную Vi-ан-тигеном, вакцины. Для профилактики, по эпидемическим показаниям, лицам, которые проживают совместно с больным и которые употребляли продукты и воду, зараженные или подозрительные на заражение S. Typhi, назначают сухой брюшнотифозный бактериофаг.
Лечение — этиотропная антибиотикотерапия.
Не специфическая профилактика включает: санитарно-бактериологический контроль за системами водоснабжения, соблюдение санитарно-гигиенических правил при приготовлении пищи, выявление бактерионосителей среди работников пищеблоков, торговли, своевременное выявление и изоляцию больных.
Сальмонеллез (S. Typhimurium, S. Enteritidis, S. Choleraesuis)
Сальмонеллез — острая кишечная зооноз-ная инфекция, вызываемая многочисленными сероварами сальмонелл, характеризующаяся преимущественным поражением ЖКТ и протекающая чаше в виде локальной, в форме гастроэнтерита, инфекции, реже — генерализованных форм: тифопо-добной или септико-пиемичеекой.
Этиология и Эпидемиология. Возбудителями сальмонеллеза является большая группа сальмонелл, входящая, согласно современной классификации, в подвид enterica, которые вызывают заболевание как у животных, так и у человека. Наиболее часто возбудителями сальмонеллезов у человека являются серова-ры S. Typhimurium, S. Dublin, S. Choleraesuis. В настоящее время на территории России доминирует в качестве возбудителя сальмонеллеза серовар S. Enteritidis. Основным резервуаром возбудителей в природе являются сельскохозяйственные животные. Развитие промышленного животноводства способствует распространению сальмонелл среди животных (крупного рогатого скота, свиней), у которых сальмонеллез протекает как в форме клинически выраженной системной инфекции, так и в форме бактерионосительства, при этом животные выделяют возбудителя с мочой, испражнениями, слюной и молоком. Резервуаром сальмонелл являются также птицы (водоплавающие) и куры, у которых происходит трансовариальная передача возбудителя. Основные факторы передачи — мясо, молоко, яйца, субпродукты, особенно печень крупного рогатого скота и свиней, а также вода. Естественная восприимчивость людей к сальмонеллам высокая. Заражение происходит алиментарным и водным путями. Заражающая доза — от одного миллиона до ста миллионов микробных клеток. Больной сальмонеллезом человек выделяет сальмонеллы в период от 3 дней до 3 недель, иногда до 1 года.
Патогенез и клиника. Заболевание чаще протекает в локальной форме гастроэнтерита, ведущим синдромом которого является диарейный. Инвазировав слизистую тонкого кишечника трансцитозом через М-клетки и проникнув в подслизистую, сальмонеллы частично захватываются макрофагами, переносясь ими в пейеровы бляшки, где, размножаясь в макрофагах, формируют первичный очаг инфекции. Частично размножаются в подслизистой. При этом выделяются эндотоксин и белковый энтеротоксин, который у сальмонелл накапливается в периплазмати-ческом пространстве клетки.
Энтеротоксин активирует Са-зависимую аденилатциклазу эпителиальных клеток крипт
тонкого кишечника, результатом чего является повышение уровня цАМФ, что влечет за собой поступление в просвет кишечника большого количества жидкости, К, Na и хлоридов. У больных возникают понос и рвота, приводящие к обезвоживанию организма.
Добавочным источником накопления цАМФ является активация аденилатцикла-зы клеток lamina propria простагландинами. Накопившийся в результате гибели сальмонелл эндотоксин усиливает синтез простаглан-динов из арахидоновой кислоты, входящей в состав фосфолипидов клеточных мембран.
При нарушении барьерной функции лимфатического аппарата кишечника происходит генерализация процесса, и возникает бактериемия, в результате которой сальмонеллы заносятся в различные внутренние органы и костный мозг, формируя вторичные гнойные очаги (септико-пиемическая форма). Патогенез возникающей при этом тифопо-добной формы аналогичен патогенезу брюшного тифа и паратифов.
Иммунитет. Ненапряженный, серовароспе-цифический, опосредован секреторным IgA, который предотвращает процесс пенетрации сальмонеллами слизистой тонкого кишечника. В крови могут определяться антитела, которые являются свидетелями инфекционного процесса.
Микробиологическаядиагностика. Проводится бактериологическим и серологическим методами. Бактериологическому исследованию подвергают рвотные массы, промывные воды желудка, испражнения, желчь, мочу, кровь (при генерализованных формах заболевания).
Для серологического исследования применяют РНГА, ИФА. Важное диагностическое значение имеет нарастание титра антител в динамике заболевания.
Профилактика. Основную роль играет Специфическая профилактика сальмонелле-за у сельскохозяйственных животных и птицы. Большое значение имеет не специфическая профилактика, включающая проведение ветеринарно-санитарных мероприятий, направленных на предупреждение распространения возбудителей среди сельскохозяйственных животных и птицы, а также соблюдение санитарно-гигиенических правил при убое на
мясоперерабатывающих предприятиях, при хранении мяса и мясных продуктов, приготовления пищи, правильная кулинарная и достаточная термическая обработка пишевых продуктов.
Лечение. Применяется патогенетическая терапия, направленная на нормализацию водно-солевого обмена. При генерализованных формах — этиотропная антибиотикотерапия.
Внутрибольничный (нозокомиальный) саль-монеллез
Этиология. Возбудителями внутрибольнич-ного сальмонеллеза являются полиантибио-тикорезистентные штаммы S. Typhimurium, S. Enteritidis, S. Virchov, S. Infants, S. Haife и некоторые другие.
Госпитальные штаммы сальмонелл представляют собой особую биологическую разновидность. Для них характерно: наличие криптичной плазмиды с характерной для определенного вида молекулярной массой; отсутствие типируемости типовыми бактериофагами; изменение биохимических свойств.
Эпидемиология. Источником инфекции и основным резервуаром возбудителей являются дети и взрослые (больные и бактерионосители), находящиеся или поступающие в стационар. В эпидемический процесс вовлекаются прежде всего дети в возрасте до 1 года, особенно новорожденные, а также взрослые, пациенты хирургических и реанимационных отделений, перенесшие обширные оперативные вмешательства, лица пожилого и старческого возраста, больные с тяжелой соматической патологией, сопровождающейся иммунодефицитами.
Передача возбудителя при внутрибольнич-ном сальмонеллезе осуществляется: воздушно-пылевым путем (при вдыхании воздуха, содержащего пылевые частицы с адсорбированными на них сальмонеллами); контактно-бытовым путем (через предметы обихода, посуду, грязные руки персонала); алиментарным путем. Заражающая доза — порядка от одной тысячи до десяти тысяч клеток.
Клиническое течение. Характеризуется длительным инкубационным периодом от 8 до 43 суток Проявление болезни варьирует от бессимптомного носительства до выраженных кишечных расстройств с развитием генера-
лизованных форм инфекции с септическими осложнениями.
Иммунитет не формируется. Профилактика осуществляется поливалентным бактериофагом. Для лечения применяют этиотропную антибиотикотерапию.
16.2.1.5. Протеи (род Proteus)
Протеи относятся к условно-патогенным микроорганизмам. Вызывают инфекцию мо-чевыводящих путей и гнойную раневую инфекцию, в том числе сепсис. Заболевания могут протекать как зндоинфекция, а также быть результатом внутрибольничной инфекции.
Род Proteus состоит из четырех видов: В патологии человека наибольшее значение имеют два вида: P. vulgaris и P. mirabilis. Впервые были выделены Г. Хаузером в 1885 г.
Морфология. Палочки, размером 0,4/0,6х1/З мкм, располагающиеся попарно или цепочками. Капсулу не образуют, подвижны.
Культуральные свойства. Хорошо растет на обычных питательных средах. На плотных средах образует два типа колоний. В Н-форме (нем. hauch — дыхание) колонии имеют вид «роения», с образованием дочерних отростков. Это типичная форма роста. При неблагоприятных условиях, в частности на средах с добавлением желчи, образуют О-формы (нем. ohne hauch — без дыхания) колоний: крупные, с ровными краями.
Физиология. Обладает выраженной биохимической активностью. Подразделение на виды производится по биохимическим свойствам (табл. 16.13). Основные биохимические признаки, дифференцирующие от других представителей семейства Enterobacteriaceae:
— продукция фенилаланиндезаминазы, уреазы,сероводорода,
отсутствие расщепления лактозы,
разжижение желатины.
Антигенная структура. Обладает О- и Н-ан-тигенами.
Резистентность. Устойчив к воздействию факторов окружающей среды. Переносит нагревание до 60 °С в течение 1 ч. Сохраняет длительную жизнеспособность в слабых растворах фенола и других дезинфицирующих веществ.
Экология. Протеи входят в состав факультативной флоры толстого кишечника и влагалища женщин, их можно обнаружить в сточных водах.
Патогенез. В патогенезе инфекции мочевы-водящих путей, вызванных протеем, важную роль играет продуцируемая им уреаза, которая, расщепляя мочевину, вызывает освобождение аммиака, что ведет к повышению рН. Защелачивание мочи снижает растворимость кальция и магния, создавая благоприятные условия для отложения кальциевых и магниевых солей и образования почечных камней.
Профилактика и лечение. Специфическая профилактика не разработана. Для лечения используют коли-протейный бактериофаг и антибиотики после определения антибиоти-кограммы.
Иммунитет. Протективный иммунитет не формируется
Микробиологическаядиагностика. Используют бактериологический метод исследования. Посев материала проводится на лактозосо-держащие дифференциальные среды и на скошенный агар по Щукевичу (в конденсационную воду в месте скоса агара). Выделенная культура идентифицируется по биохимическим свойствам.
16.2.1.6. Иерсинии (род Yersinia)
Род Yersinia включает 11 видов, из которых в патологии человека основное значение имеют 3 вида: возбудитель чумы Y. pestis и энтеропа-тогенные иерсинии, возбудитель псевдотуберкулеза Y. pseudotuberculosis и возбудитель кишечного иерсиниоза Y. enterocolitica.
Род назван в честь А. Иерсена, который в 1894 г. совместно с С. Китасато открыл возбудителя чумы. Подразделение внутри рода на виды производится на основе биохимических свойств и подвижности (табл. 16.14).
16.2.1.6.1. Возбудитель чумы (Y. pestis)
Чума — острая инфекционная природно-очаговая болели., относящаяся к группе карантинных (конвенционных) инфекций, характеризующаяся тяжелой интоксикацией,лихорадкой, поражением кожи, лимфатических узлов, легких, сепсисом и высокой летальностью.
Морфология. Y. pestis, представляет собой неподвижную палочку овоидной формы, размером 1,5x0,7 мкм, с биполярным окрашиванием анилиновыми красителями. Образует нежную капсулу.
Культуральные свойства. Факультативный анаэроб. Растет на простых питательных средах. Оптимальная температура роста 28 "С, но может расти в широком диапазоне температур от 2 до 40 °С. Для ускорения роста в питательные среды добавляют стимуляторы, сульфит натрия и гемолизированную кровь. При росте на плотных питательных средах через 8— 12 ч появляются колонии в виде «битого стекла». Через 18—20 ч инкубации вирулентные бактерии образуют колонии в R-форме, которые имеют форму «кружевных платочков»: со светлым центром и фестончатыми краями. Менее вирулентные бактерии образуют колонии в S-форме. На жидких средах бактерии растут в виде пленки, от которой спускаются нити, напоминающие пещерные сталактиты; на дне образуется хлопьевидный осадок.
Биохимическая актвиность достаточно высокая. Синтезирует плазмокоагулазу, фиб-ринолизин, гемолизин, лецитиназу, РНКазу. Основные Биохимические свойства, необходимые для идентификации:
не разжижает желатину, не расщепляет мочевину,
не ферментирует рамнозу и сахарозу,
ферментирует декстрин.
По отношению к утилизации глицерина подразделяется на хемовары.
Антигенная структура. Обладает комплексом антигенов, многие из которых относятся к факторам патогенности. Имеет термостабильные О-антигены и термолабильные кап-сульные антигены. Протективной активностью обладает Fl-антиген. Имеет антигены, общие с антигенами эритроцитов 0-группы крови человека.
Резистентность. Микроб обладает психро-фильностью. При понижении температуры увеличиваются сроки выживания бактерий. При температуре —22 "С бактерии сохраняют жизнеспособность 4 месяца, в замороженных трупах и блохах — до 1 года. При нагревании до 50 °С гибнет в течение 10 мин, до 100 °С — в течение 1 мин. Чувствителен к сулеме в концентрации 0,1 %, к 3-5% растворам лизола и фенола, ультрафиолетовому облучению.
Патогенность. У. pestis обладает многочисленными факторами патогенности, генетическая детерминация которых осуществляется как хромосомой, так и тремя плазмидами: pPst (6 мДа), pCad, (45 мДа), pFra (60 мДа).
Синтез ферментов патогенности: фибрино-лизина и плазмокоагулазы, а также пестицина детерминирует pPst плазмида; синтез F1-антигена — гликопротеидной природы, который продуцируется при температуре 37 °С и препятствует поглощению микроба фагоцитами, детерминируется pFra плазмидой; этой же плазмидой детерминируется синтез F2-фракции, «мышиного токсина», функция которого окончательно не ясна. Известно, что он обладает способностью блокировать адренергические рецепторы и ингибировать дыхательную активность митохондрий, понижая активность НАДФ-редуктазы.
Синтез V- и W-антигенов (V-антиген является пептидом, а W-антиген — внеклеточным липопротеином), обеспечивающих способность бактерий сохраняться в фагоцитах, детерминирует pCad плазмида. К факторам патогенности, обеспечивающим антифагоцитарную активность микроба, относят также внеклеточную аденилатциклазу и цитохро-моксидазу, а также пигмент, связывающий гемин и способность к синтезу эндогенных пуринов.
Эпидемиология. Резервуаром возбудителя природной чумы являются дикие, синант-
ропные и домашние животные (всего около 300 видов). Основными носителями являются грызуны (сурки, суслики, полевки, песчанки, крысы, зайцы и др.). У грызунов, впадающих зимой в спячку, чума протекает в хронической латентной форме. Эти животные являются источником инфекции в межэпидемический период.
Вторичные очаги, связанные с деятельностью человека, обнаруживаются в географических зонах между 35° северной широты и 35° южной широты. В них источниками и хранителями возбудителя служат домовые виды крыс и мышей, от них заражаются некоторые виды домашних животных, в частности верблюды и, возможно, кошки.
Специфическими переносчиками возбудителя в обоих типах очагов служат блохи. В инфицированной блохе возбудитель размножается в преджелудке, а при кровососании человека попадает в ток его крови. Человек заражается в очаге трансмиссивно — через укусы инфицированных блох, контактным путем при контакте с инфицированными животными (разделка шкур и мяса зараженных животных) и алиментарным путем — при употреблении в пищу продуктов, обсемененных чумными микробами. От больных легочной формой чумы происходит аэрогенное заражение.
Восприимчивость людей к чуме очень высокая. Индекс контагиозности приближается к единице. Эпидемии чумы обычно следуют за эпизоотиями. В истории человечества извест-
ны три пандемии чумы. Первая, «юстиниано-ва чума» свирепствовала в странах Ближнего Востока, Европы в VI в. и вызвала гибель около 100 млн человек. Вторая пандемия, известная под названием «черная смерть», была занесена из Азии в Европу в 1348 г.; она унесла жизни более 50 млн человек, т. е. четверти населения Европы. Третья пандемия началась в 1894 г. в Кантоне и Гонконге; особенностью этой пандемии явилось то, что она охватывала только портовые города, не распространяясь за их пределы. Природные очаги чумы существуют и сейчас на всех континентах, кроме Австралии и Антарктиды. В настоящее время ежегодно регистрируется несколько сот случаев чумы человека. В России такими очагами являются регионы Закавказья, Поволжья.
Патогенез и клиника заболевания. Зависят от пути заражения. При контактном пути, проникая через неповрежденную кожу, и трансмиссивном пути заражения возбудитель с током лимфы заносится в регионарные лимфатические узлы, где происходит его размножение. Вследствие незавершенности фагоцитоза в лимфатических узлах развивается серозно-геморрагическое воспаление, с развитием бубона, т. е. увеличенного лимфатического узла, иногда достигающего размеров куриного яйца. Так возникает первичная бубонная форма. Утрата лимфатическим узлом барьерной функции приводит к генерализации процесса. Возбудитель разносится гематогенно в отдаленные лимфатические узлы, где формируются вторичные бубоны,
а также в органы, где развиваются септико-пиемические очаги. Гематогенный занос чумных микробов в легкие приводит к развитию вторично-легочной формы заболевания, которая характеризуется развитием пневмонии с обильным серозно-геморрагическим экссудатом, содержащим большое число микробов. При воздушно-капельном заражении возникает первично-легочная форма, а при контактном и алиментарном путях заражения развиваются соответственно кожная и, в редких случаях, кишечная формы заболевания.
Инкубационный период — от нескольких часов до 2—6 дней, у привитых — до 10 дней. Заболевание начинается остро: температура тела повышается до 39 °С и выше, возникает озноб, наблюдаются явления интоксикации, которая проявляется резкой головной болью, разбитостью, мышечными болями, помрачением сознания. Больной возбужден. При бубонной форме на 1—2-й день болезни появляется лимфаденит (чумной бубон). Различают несколько клинических форм чумы: кожную, бубонную, первично- и вторично-септическую, первично- и вторично-легочную формы. Летальность до применения антибиотиков при диссеминированных формах чумы достигла 100 %, при локальных формах — до 70 %; при антибиотикотерапии достигает 10 %.
Иммунитет. Различной длительности и напряженности. Отмечены случаи повторных заболеваний. Протективная активность обеспечивается главным образом клеточным иммунным ответом, реализующимся через иммунные макрофаги.
Микробиологическаядиагаостика. Используют бактериоскопический, бактериологический, биологический и серологический методы исследования, которые проводят в специальных лабораториях, работающих в соответствии с инструкциями о режиме работы противочумных учреждений. Материалами для исследования являются: пунктаты бубонов мокрота, отделяемое карбункулов и язв, кровь, моча, рвотные массы, трупный материал. Материал засевают на питательные среды (мясопептон-ный агар — МПА, бульон Хоттингера, элективные среды), и ставят биопробу на морских свинках и белых мышах. В качестве экспресс-диагностики используют РИФ, позволяющую
поставить предварительный диагноз уже через 2 ч. Серологическое исследование проводится постановкой РИГА, ИФА, РН антител.
Профилактика и лечение. Больные чумой подлежат строгой изоляции и обязательной госпитализации. Для лечения используют этиотропную антибиотикотерапию. Прогноз неблагоприятный, так как при генерализованных формах болезни летальность может достигать 100 %.
Специфическая профилактика осуществляется живой вакциной из штамма EV. После вакцинации развивается иммунитет продолжительностью до 6 месяцев. Вакцина вводится однократно накожно или подкожно с помощью безыгольного инъектора; разработана таблетированная живая вакцина из штамма EV для перорального применения (А. А. Воробьев, Е. М. Земсков), а также аэрозольная вакцина (В. А. Лебединский и соавт.).
Большое значение имеет не специфическая профилактика, которая включает: предупреждение заболевания людей и возникновения эпизоотии в природных очагах, предупреждение завоза чумы на территорию страны, которое осуществляется согласно специальным «Международным санитарным правилам»; предупреждение заражения лиц, работающих с заразным Y. pestis материалом, осуществляемое регламентом работы противочумных учреждений. Вся работа с заразным Y. pestis материалом и в госпиталях для больных чумой должна проводиться в специальных защитных противочумных костюмах с соблюдением строгого порядка их надевания и снятия. В случае появления больного чумой проводятся карантинные мероприятия.
16.2.1.6.2. Энтеропатогенные иерсинии
К энтеропатогенным иерсиниям относят возбудителей псевдотуберкулеза и кишечного иерсиниоза: У. pseudotuberculosis и Y. enterocolitica соответственно. Дифференциация между видами осуществляется по биохимическим свойствам и антигенной структуре. Особенность экологии. Энтеропатогенные иерсинии являются сапронозами. Способны существовать в окружающей среде. Обладают свойствами, которые определяют особенности эпидемиологии вызываемых ими заболеваний:
способностью к сапрофитическому существованию в окружающей среде;
психрофильностью.
Оптимум роста +22...-25 "С. Сохраняют жизнеспособность при температурах —15...— 25 "С. Размножаются при температуре +4°С. Энтеропатогенные иерсинии способны размножаться в воде, почве, растениях, в которые они через корневую систему попадают из почвы. Размножение при низких температурах сопровождается многомесячной (до полугода) продолжительностью стационарной фазы, что способствует накоплению большой биомассы бактерий. Популяция иерсинии во внешней среде поддерживается свободноживущими инфузориями вида Tetrahymena pyriformis. При этом происходит селекция устойчивых к фагоцитозу бактерий.
Генетическая детерминация синтеза факторов патогенности и их температурная регуляция обеспечивают возможность перехода эн-теропатогенных иерсинии из внешней среды к существованию внутри организма.
Начальные этапы инфекции, а именно транс-цитоз слизистой кишечника через М-клетки (IV тип), осуществляется за счет функционирования inv-гена хромосомной локализации, который функционирует при температурах ниже 37 "С, вырабатывая белок наружной мембраны клеточной стенки, необходимый для взаимодействия с М-клетками. Распространение микробов по организму связано с функционированием генов плазмиды (молекулярная масса 45 мДа), которые активны при температуре 37 °С. Эти гены детерминируют синтез цитотоксина, повреждающего клетки стенки кишечника, и V- и W-антигенов, обеспечивающих размножение микробов в фагоцитах, что вызывает незавершенный фагоцитоз.
16.2.1.6.2. Возбудитель псевдотуберкулеза (Y. pseudotuberculosis)
Псевдотуберкулез — инфекционное заболевание, характеризующееся полиморф-ностью клинической картины, затяжным
течением, аллергизацией организма.
Возбудитель псевдотуберкулеза
У. pseudotuberculosis впервые был описан в 1883 г. Л. Маляссе и В. Виньялем.
Морфология. Палочка, с биполярным окрашиванием, размером 0,8/2х0,4/0,6 мкм, подвижная, т. е. имеет жгутики, при температурах ниже 37 "С. Образует капсулу.
Культуральные свойства. Хорошо растет на простых питательных средах. Оптимум размножения 22—28 °С. При температурах ниже 37 °С на плотных средах образует колонии в S-форме. При температуре 37 °С — колонии в R-форме. На жидких средах образует пленку.
Физиология. Биохимически активен. Основные биохимические признаки, необходимые для идентифиации:
продукция уреазы,
ферментация рамнозы,
отсутствие ферментации сахарозы,
отсутствие продукции индола, —отрицательная реакция Фогеса—
Проскауэра.
Биохимически внутри рода однороден.
Возбудитель устойчив во внешней среде: в воде при комнатной температуре выживает до 1,5 месяцев, при +4 "С — до полугода; в овощах (капуста, морковь, лук) и фруктах выживает несколько месяцев. Малоустойчив к нагреванию при 60°, при кипячении, к УФ-свету к дезинфектантам.
Антигенная структура. Обладает О-антигеном. на основании строения которого подразделяется на 8 сероваров, а также Н-антигеном.
Эпидемиология. Резервуаром возбудителя в природе являются многие виды млекопитающих (рогатый скот, кошки) и птиц, грызуны (мыши, крысы), выделяющие микроб с испражнениями, а также вода, почва, в которых происходит накапливание микроба. Человек заражается водным и алиментарным путями. Основными факторами передачи являются вода и овощи. Овощи заражаются Y. pseudotuberculosis в результате их загрязнения в хранилищах испражнениями инфицированных возбудителем мышей, а также непосредственно из почвы и воды. Заражение человека от больного или носителя не происходит. Естественная восприимчивость людей к возбудителю высокая. Болезнь распространена повсеместно, возникает в виде спорадических и эпидемических вспышек, имеет сезонность (февраль-март). В районе Дальнего Востока РФ заболевание протекает в виде эпидемических вспышек в генерализо-
ванной форме под названием Дальневосточная скарлатиноподобная лихорадка.
Патогенез и клиника заболевания. Инкубационный период 3—10 дней. Заболевание протекает в виде локальной и генерализованной форм. Начало острое или под острое, сопровождается лихорадкой. Инвазировав слизистую кишечника трансцитозом через М-клетки, выделяя при этом цитотоксин, Y. pseudotuberculosis вследствие незавершенности фагоцитоза попадает в мезентериальные лимфатические узлы, вызывая мезентериальный лимфаденит. Следствием развития мезенте-риального лимфаденита являются боли в эпи-гастральной области, симптомы раздражения брюшины, которые имитируют симптомы острого аппендицита.
В случае прорыва лимфатического барьера наступает бактериемия, в результате которой микроб разносится по организму, вызывая образование гранулем и микроабсцессов в макрофагальных элементах печени, селезенки, легких, суставов. При этом происходит аллергизация организма. На 1—6-й день появляется розеолезная сыпь. Возможен летальный исход.
Иммунитет. Непрочный, нестерильный. Антитела не обладают протективной активностью. В организме происходит развитие ГЗТ.
Микробиологическаядиагностика. Применяют бактериологический и серологический методы исследования. Материалами для исследования при бактериологическом методе являются испражнения, кровь, желчь, суставная жидкость, бронхиальная жидкость. Материал помещают в фосфатный буфер и подвергают холодовому обогащению при температуре 4°С в течение 21 дня, периодически делая высев на плотные среды (Эндо, Серова).
Серологическое исследование проводят на 2-й неделе и 3—5-й неделе постановкой РНГА и ИФА.
Профилактика и лечение. Специфическая профилактика не разработана. Лечение — этиотропная антибиотикотерапия.
Не специфическая профилактика включает: постоянный санитарный контроль за водоснабжением, технологическим режимом обработки и хранения пищевых продуктов, борьбу с грызунами.
16.2.1.6.2.2. Возбудитель кишечного иерсиниоза (Y. enterocolitica)
Кишечный иерсиниоз — инфекционное заболевание с поражением тонкого и толстого кишечника и развитием мезентериального
лимфаденита.
Этиология. Возбудителем кишечного иерсиниоза является Y. enterocolitica, который впервые был описан Дж. Шлейфстейном и М. Калеманом в 1939 г. Заболевание стало широко распространяться с конца 1960 годов.
Морфология. Грамотрицательные палочки, размером 1,8/2,7x0,7/0,9 мкм, подвижные, капсулу не образуют.
Физиология. Хорошо растут на обычных питательных средах. Оптимум роста 22-28 "С. Обладают выраженной биохимической активностью. Внутри вида по спектру биохимической активности — индолообразованию, утилизации эскулина, реакции Фогеса— Проскауэра — подразделяется на 5 хемоваров. Заболевание чаще вызывают биовары 2.3.4. Основные биохимические признаки, необходимые для идентификации:
расщепление мочевины,
ферментация сахарозы,
отсутствие ферментации рамнозы,
продукция орнитиндекарбоксилазы. Антигенная структура. Обладает О- и Н-ан-
тигенами. По строению О-антигена подразделяется более чем на 30 сероваров. Наиболее часто заболевание у человека вызывают серо-вары 03, 05, 09, 08.
Патогенность. Помимо общих для энтеро-патогенных иерсиний факторов патогеннос-ти, Y. enterocolitica обладает термостабильным энтеротоксином, гомологичным термостабильному энтеротоксину ЭТКП.
Эпидемиология. Кишечный иерсиниоз выявляется во всех странах, возникает в виде групповых, семейных, внутрибольничных вспышек. Резервуаром возбудителя в природе являются почва, вода, инфицированные через них растения. Инфицированные вода и растения способствуют распространению инфекции среди сельскохозяйственных животных. Резервуаром и источником инфекции могут быть крупный рогатый скот, свиньи,
собаки, кошки, птицы. Основные пути передачи — водный и алиментарный, через воду, молоко, овощи. В отличие от У. pseudotuberculosis, Y. enterocolitica может передаваться от человека к человеку, являясь даже причиной внутрибольничной инфекции.
Патогенез и клиническая картина. Начальные этапы патогенеза аналогичны таковым при псевдотуберкулезе. Инвазировав трансцито-зом через М-клетки слизистую подвздошной кишки, Y. enterocolitica внедряется в ее лимфо-идные образования, из которых микроб попадает в мезентериальные лимфоузлы, вызывая в них развитие аденита. Действие цитотоксина и энтеротоксина вызывает воспалительный процесс в стенке кишечника и развитие диареи.
При прорыве лимфатического барьера кишечника развивается бактериемия, следствием которой является развитие генерализованной формы инфекции, которая протекает с поражением селезенки, развитием полиаденита, полиартрита, менингита, с аллергиза-цией организма. У иммунодефицитных лиц может развиться сепсис.
Инкубационный период составляет в среднем 3—7 суток. Начало острое: с лихорадкой, интоксикацией, болями в животе, расстройствами стула, появлением сыпи на коже. Различают гастроинтестинальную, абдоминальную, генерализованную и вторично-очаговую формы болезни. Болезнь может протекать хронически до 1,5—2 лет.
Микробиологическаядиагностика. Используют бактериологический и серологический методы исследования. Материалом для бактериологического метода исследования служат испражнения, ликвор, кровь, моча, иногда червеобразный отросток. Как и при диагностике псевдотуберкулеза, материал для исследования помещают в фосфатный буфер и подвергают холодовому обогащению. Серологическая диагностика проводится постановкой РНГА, с диагностическим титром 1:160. Важное диагностическое значение имеет наблюдение за нарастанием титра антител в динамике.
Профилактика и лечение. Специфическая профилактика не разработана. Лечение — этиотропная антибиотикотерапия. Не специфическая профилактика аналогична таковой при псевдотуберкулезе.
16.2.2. Вибрионы (семейство Vibrionaceae)
Семейство Vibrionaceae включает в себя патогенные для человека роды Vibrio, Aeromonas, Plesiomonas. Все они являются изогнутыми подвижными палочками размером 1,4/5,0х0,3/1,3 мкм. Подвижность их обеспечивается жгутиками, расположенными полярно. Хемоорганотрофы. Метаболизм — окислительный и бродильный. Температурный оптимум для большинства видов 37 "С, для некоторых морских видов — 25 °С. Оксидазаположительны (большинство видов). Глюкозу и другие углеводы детерминируют до кислоты и газа. Могут расти на средах, содержащих 2—3% NaCl. Распространены повсеместно в морской, пресной воде, в гидробионтах.
16.2.2.1. Вибрионы холеры (род Vibrio)
В род Vibrio входят прямые или изогнутые палочки 1,4/2,6x0,5/0,8 мкм. Их подвижность обеспечивается одним или несколькими жгутиками. Хемоорганотрофы. Окислительный и бродильный метаболизм. Температурный оптимум для разных видов — от 20 до 30 °С. Большинство видов оксидазаположительны. Углеводы ферментируют только до кислоты (мальтозу, маннозу, трегалозу). Вибрионы распространены в пресных и соленых водоемах, покрывают дно, растительность, а также в гидробионтах. Часть вибрионов патогенны для человека. Наибольшее медицинское значение имеют V. cholerae, V. parahaemoliticus, V. vulnificus. Типовой вид рода — V. cholerae.
16.2.2.1.1. Возбудитель холеры (Vibrio cholerae)
Холера — особо опасная карантинная болезнь, вызываемая Vibrio cholerae, серогрупп 01 и 0139, характеризующаяся токсическим поражением тонкого кишечника, нарушением водно-солевого баланса и высокой летальностью.
Заболеваемость холерой с древнейших времен регистрируется на полуострове Индостан, особенно в период военных действий. В Европу и в Россию холера проникла через Ближний Восток, Египет. В середине XIX в. Р Кох открыл холерный вибрион («запятая Коха»), благо-
даря применению питательных плотных сред (желатин на стеклах). После открытия холерного вибриона было выделено большое количество гемолитических штаммов вибрионов, которые считались непатогенными. В 1906 г. в Египте F. Gotschlich выделил на карантинной станции Эль-Тор из трупов паломников — мусульман, умерших при явлении диареи, гемолитический вибрион, названный затем eltor. Поскольку в то время эпидемии холеры не было, роль вибриона eltor в патологии человека осталась сомнительной. В 1939 г. S. de Moor описал сезонные диареи на о. Сулавеси (Индонезия), при которых постоянно выделялся вибрион eltor. В 1961 г. на о. Сулавеси диареи потеряли сезонный характер, и разразилась жестокая эпидемия, которая переросла в VII пандемию. В 1962 г. состоялось внеочередное заседание экспертного комитета ВОЗ, на котором впервые было принято решение считать вибрионы (eltor) такими же возбудителями холеры, как и классический (Коховский) вибрион. В начале 1993 г. появились сообщения о случаях холеры в Юго-Восточной Азии, вызванных вибрионами ранее неизвестной серогруппы «0139»; отдельные случаи «новой» холеры уже появились и на территории нашей страны. Холерные вибрионы 0139 серогруппы «Бенгал» принято считать возбудителями эпидемической холеры.
В мировой литературе подробно описано шесть пандемий холеры, а в 1961 г. началась VII пандемия холеры, где в качестве основного этиологического агента выступает биовар Эль-Тор. Эта пандемия продолжается до настоящего времени.
Морфологические и культура л ьные свойства. Холерный вибрион размером 1,5/4,0x0,2/0,4 мкм имеет один полярно расположенный жгутик. В мазках из клинического материала и колоний, выросших на плотных средах наблюдаются типичные вибрионы. В висячей или раздавленной капле можно наблюдать подвижность вибрионов. В старых культурах наблюдаются инволюционные нитевидные, кокковидные формы. Под действием пенициллина образуются фильтрующиеся L-фор-мы. Тинкториальные свойства такие же, как у энтеробактерий. Грамотрицательны, спор не образуют. Факультативный анаэроб с преобладанием аэробных свойств. Не требователен к питательным средам. Температурный оптимум 37 "С, оптимум рН — 7,6-8,0.
На плотных средах вибрионы образуют мелкие круглые прозрачные S-колонии с ровными
краями, маслянистые, голубоватые в проходящем свете. Колонии старых культур желтеют, грубеют. На скошенном агаре образуется желтоватый налет. На агаре TCBS образует желтые колонии. На желатиновом столбике вызывают воронкообразное разжижение. В непрозрачных R-колониях бактерии становятся устойчивыми к действию бактериофагов, антибиотиков и не агглютинируются О-сыворотками.
На жидких средах вибрионы вызывают помутнение поверхностной пленки, которая разрушается при встряхивании. На 1% пептонной воде (рН 9,0) опережают рост энтеробактерий.
Биохимические свойства. Холерные вибрионы биохимически активны: сбраживают до кислоты глюкозу, мальтозу, сахарозу, ман-нит, лактозу (медленно), левулезу, гликоген и крахмал. Не сбраживают арабинозу, рамнозу, дульцит, инулин, инозит. По Хейбергу, все вибрионы делятся на шесть групп по отношению к трем сахарам (манноза, сахароза, ара-биноза). Первую группу, к которой относятся истинные возбудители холеры, составляют вибрионы, разлагающие маннозу и сахарозу и не разлагающие арабинозу: они разжижают также желатин с образованием «воронки», гидролизуют казеин, свертывают плазму кролика, разжижают свернутую сыворотку, молоко, разлагают белки до аммиака и индола. H2S не образуют. Остальные пять групп Хейберга объединяют нехолерные вибрионы (табл. 16.15).
Антигенная структура. Холерные вибрионы обладают термостабильными О-антигенами и термолабильными Н-антигенами.
Н-АГ являются общими для большой группы вибрионов.
По структуре О-АГ выделяют > 150 серго-групп, определяемых в реакциях агглютинации.
Возбудители классической холеры и холеры Эль-Тор объединяются в серогруппу 01.
Антигены серогруппы 01 включают в различных сочетаниях А-, В- и С-субъедини-цы. Сочетание субъединиц АВ называется сероваром Огава, сочетание АС — сероваром Инаба, сочетание ABC — Гикошима. R-фор-мы (шероховатые) колоний утрачивают О-АГ, М-формы (слизистые) изменяют структуру О-АГ; обе эти формы не агглютинируются стандартными О-сыворотками. Вибрионы се-
рогруппы 0139 агглютинируются только сывороткой 0139.
Холерные вибрионы дифференцируют также с помощью бактериофагов. V. cholerae, cholerae лизируются бактериофагами IV группы (по Mukerjee); V. cholerae, eltor лизируется бактериофагами V группы. Бактериофаги применяются для диагностики и лечения холеры.
Резистентность. Вибрионы плохо переносят солнечную радиацию, высушивание, конку-реницию со стороны другой микрофлоры. В водоемах холерные вибрионы могут сохраняться до 2—3 недель, в выгребных ямах — до 3—4 месяцев, длительно сохраняются в пищевых продуктах с щелочным рН, в одежде и постельном белье, испачканных испражнениями и рвотными массами больных. Биовар Эль-Тор более устойчив в окружающей среде, чем классический вибрион, и с этим биоваром связано большинство описанных случаев носительства. Все вибрионы высокочувствительны к действию дезинфектантов, особенно с кислым рН, а также к кислотам.
Эпидемиология. Холера- это острая кишечная инфекция с фекально-оральным механизмом передачи. Наиболее распространенным путем передачи является водный, пищевой, реже — контактно-бытовой. Определенную роль в распространении холеры играют мухи. Эпидемии могут протекать в виде острых вспышек заболеваний и в виде вялотекущих эпидемий с постоянно регистрируемой заболеваемостью, но не с такой высокой интенсивностью.
Источник инфекции — больной человек или вибрионоситель. Резервуаром инфекции является также водная среда. Животные к возбудителю холеры нечувствительны.
Факторами передачи могут служить пресная и морская вода, пищевые продукты (молоч-
ные, овощи, фрукты, гидробионты), объекты окружающей среды. Большую роль играет несоблюдение правил личной и коммунальной гигиены. Подъем заболеваемости обычно отмечается в теплый, влажный сезон, что связано с лучшей сохраняемостью возбудителя в окружающей среде, обилием мух, скученностью населения.
Факторы патогенности. Большая часть вибрионов, попавших в организм через рот, погибает в кислой среде желудка; лишь небольшая часть вибрионов достигает кишечника. К факторам патогенности, обеспечивающим колонизацию кишечника, относятся: пили адгезии; фермент муциназа, разжижающий слизь и обеспечивающий им доступ к эпителию. Эпителиальные клетки выделяют щелочной секрет, который в сочетании с желчью является прекрасной питательной средой для размножения вибрионов. Клиническая картина холеры связана с токсинообразованием вибрионов, которые вырабатывают эндо- и экзотоксины.
Экзотоксин (энтеротоксин) холероген — термолабильный белок, инактивируется фенолом и формалином, чувствителен к протеоли-тическим ферментам. Холероген содержит 2 субъединицы: А и В. Субъединица В образована пятью пептидами, которые взаимодействуют с ганглиозидами — клетками эпителия и обуславливает проникновение в них компонента А. С компонентом В связана антигенная специфичность токсина. Компонент А состоит из субъединиц А1 (активный центр) — пептид, реализующий энтеротокси-генное действие, и пептид А2, связывающий оба компонента. Компонент А1 активизирует внутриклеточную аденилатциклазу, что, в свою очередь, приводит к повышению содер-
жания цАМФ и к выходу экстрацеллюлярно электролитов и других жидкостей в просвет кишечника. Переполнение кишечника жидкостью приводит к профузной диарее и рвоте. Бактерии серогруппы 0139 также продуцируют энтеротоксин с такими же свойствами, но в меньших количествах. Фермент нейрамини-даза усиливает связывание холерного экзотоксина с эпителием слизистой кишечника. Синтез факторов патогенности опосредован двумя лизогенизирующими бактериофагами.
Эндотоксин запускает каскад арахидоновой кислоты, которая входит в состав фосфолипи-дов клеточных мембран. Арахидоновая кислота запускает синтез простагландинсинтета-зы, которая синтезирует простагландин (Е, F). Простагландины вызывают сокращение гладкой мускулатуры тонкого кишечника и подавляют иммунный ответ, чем обусловлены тенез-мы, диарея.
Клинические проявления. Инкубационный период варьирует от нескольких часов до 5 дней (в среднем 2—3 дня). Клинически холера проявляется в виде боли в животе, тенезмы, рвоты, диареи. Тяжелый больной в сутки выделяет до 30 л жидкости. Стул носит характер «рисового отвара», т. е. бесцветные обильные испражнения со сладковатым запахом (не фекальный). Помимо клинической картины энтерита (или гастроэнтерита) в тяжелых случаях может развиваться почечная недостаточность, афония, гипотензия, сердечная недостаточность, гипотермия («холерный алгид»). При неправильном лечении летальность при алгиде достигает 60 %.
Иммунитет. Гуморально-клеточный. При выздоровлении возникает напряженный непродолжительный иммунитет. Существует индивидуальная предрасположенность к холере.
Микробиологическая диагностика. В основе диагностики лежат выделение и идентификация возбудителя. Материалом для исследования могут быть выделения от больных и носителей (испражнения, рвотные массы, желчь), объекты окружающей среды (вода, пищевые продукты, белье, сточные воды, гидробионты, смывы с объектов окружающей среды и др.).
Для экспресс-диагностики используют РИФ, ПЦР. Бактериоскопический метод в настоящее время не используется.
Лечение проводится в двух направлениях:
а) регидратация (восполнение потерь жид кости и электролитов введением изотоничес ких, апирогенных солевых растворов, а также плазмозаменяющих жидкостей внутривенно или per as);
б) антибактериальная терапия (антибиотики широкого спектра действия: тетрациклины, хлорамфеникол, а также фторхинолоны).
Профилактика. Учитывая фекально-ораль-ный мехайизм передачи инфекции, основу профилактики составляют мероприятия, направленные на разрыв путей передачи (предупреждение заноса инфекции на территорию страны, санитарно-просветительная работа с населением, обеспечение населения доброкачественной питьевой водой, канализацией, пищевыми продуктами, дезинфекцией и т. п.). Важно обеспечение населения современной и полноценной медицинской помощью (выявление, диагностика, госпитализация, Лечение, карантин). Менее важным является экстренная профилактика антибиотиками широкого спектра действия, а также вакцинопрофилактика. Современная вакцина представляет собой комплексный препарат, состоящий из холероген-анатоксина (70 %) и химического О-антигена (30 %) обоих био-варов и сероваров Огава и Инаба. Прививка обеспечивает выработку вибриоцидных антител и антитоксинов в высоких титрах.
Вакцинация населения проводится по эпидемическим показаниям.
16.2.2.2. Вибрионы парагемолитические (род Vibrio)
Патогенные свойства других бактерий, относящихся к этому роду, недостаточно изучены. В табл. 16.16 приведены основные свойства представителей рода Vibrio, имеющие медицинское значение. Однако наибольший интерес представляют V. parahaemolyticus и V. vulnificus.
Vibrio parahaemolyticus. Галофильный вибрион, часто (до 20 % всех диарей) вызывает острые диареи в Японии, других странах Юго-Восточной Азии, в Латинской Америке. Заражение происходит при употреблении в пищу гидробионтов (устрицы, крабы, рыбы и т.д.), приготовленных с нарушением технологии (недостаточная термическая обработка).
Возбудитель вырабатывает энтеротоксин, похожий на холерный экзотоксин (холероген).
У половины заразившихся наблюдаются клинические проявления болезни: сильные боли в животе, водянистая обильная диарея. У детей и пожилых людей (с сопутствующей патологией) могут быть летальные исходы. Диагностика такая же, как при холере. На TCBS-aгape возбудитель образует зеленоватые колонии, так как не ферментируют сахарозу и способен утилизировать орнитин.
Vibrio vulnificus часто встречается в морской воде и в устьях рек Тихоокеанского и Атлантического побережий. Особенно часто обнаруживается в гидробионтах («природных фильтрах») — устрицах, мидиях, гребешках и др. После употребления в пищу моллюсков у лиц с заболеваниями печени, почек, с сахарным диабетом могут развиваться буллезные поражения кожи с тяжелой клиникой и высокой летальностью. При купании в контаминированной воде через поврежденную кожу может проникать возбудитель и вызывать раневую инфекцию (целлюлиты, миозиты), похожие на газовую гангрену.
Среди факторов патогенности V. vulnificus необходимо отметить капсулу, защищающую бактерий от фагоцитоза, и комплекс ферментов (цитотоксин — гемолизин, эластазу, коллагеназу, фосфолипазы).
Диагноз ставят бактериологически (как при холере) с высевом на TCBS-arap (образует желтые колонии, так как ферментирует сахарозу) и по ферментации лактозы. Лечение включает интенсивную антибактериальную терапию (гентамицин, тетрациклин, левомицетин). Остальные виды рода Vibrio сходны по морфологии и физиологии. Встречаются в природе редко, малоопасны для человека, редко идентифицируются в микробиологических лабораториях.
16.2.2.3. Представители родов Aeromonas, Plesiomonas
Биологические свойства. Бактерии рода Aeromonas представляют собой подвижные коккобациллы размером 1,0/3,5x0,3/1,0 мкм с одним полярным жгутиком. В мазках располагаются одиночно, парами, короткими цепочками. Хемоорганотрофы. Метаболизм окислительный и бродильный. Температурный оптимум 22—28 *С, большинство растет при 37 °С. Оксидаза- и каталазаположительны. Разжижают желатин, восстанавливают нитраты, продуцируют ДНКазу, органил-дегидролазу, уреазу. Устойчивы к вибриоциду О/129. Обитают в пресной и морской воде, в сточных водах. Род Aeromonas включает в себя виды A. hydrophila и А.
veronii. Типовой вид A. hydrophila патогенен для рыб и амфибий; для человека условно-патогенны: у лиц с иммунодефицитами могут вызывать гастроэнтериты.
Эпидемиология. Поскольку аэромонады встречаются в пресной и морской воде и патогенны для гидробионтов, человек может заразиться при проведении ремонтных работ в мелиоративных системах и при купании. Возбудитель проникает через поврежденную кожу и вызывает раневые инфекции (целлюлиты, мионекрозы). При наличии заболеваний желудочно-кишечного тракта, печени в случае проглатывания инфицированной воды при купании могут возникнуть гастроэнтериты.
Патогенез. A. veronii и A. hydrophila образуют холе-роподобный токсин (токсин Азао), индуцирующий обильную водянистую диарею с болями в животе. К факторам патогенности можно отнести внеклеточные ферменты: протеазы, амилазы, липазы, нук-леазы.
Клиника. Аэромонады могут вызывать: 1) раневые инфекции при контакте инфицированной водой, почвой в теплый сезон; 2) диареи, регистрируемые в теплый сезон (купальные вспышки); 3) септицемии, обычно наблюдающиеся после раневых инфекций (мионекроз, целлюлит); 4) редко наблюдают внутрибрюшинные абсцессы, перитониты, эндокардиты, пневмонии.
Микробиологическая диагностика. Бактериологическая диагностика основана на выделении и идентификации возбудителя. Материалом для исследования служат испражнения или ректальные мазки, кровь, раневое отделяемое. Аэромонады хорошо растут на обычных средах; на кровяном агаре с ампициллином (10 мкг/л) образуют зоны be-гемолиза; большинство аэромонад не ферментируют лактозу (агар Плоскирева). Дифференциацию аэромонад проводят на средах для идентификации энте-робактерий. В отличие от последних они оксидазаполо-жительны, устойчивы к вибриоциду 0/129 (что отличает их от вибрионов) и образуют индол (что отличает их от псевдомонад).
Лечение и профилактика. Обычно диареи, вызываемые аэромонадами, не требуют этиотропного лечения (только симптоматическое). Другие формы болезни требуют антибактериальной терапии. Возбудители обычно резистентны к пенициллинам и цефалоспо-ринам I и II поколений; чувствительны к аминог-ликозидам, фторхинолонам и цефалоспоринам III поколения.
Специфическая профилактика не разработана. Не специфическая профилактика носит санитарно-просветительный характер.
|
Таблица 16.16. Представители рода Vibrio, имеющие медицинское значение (кроме V. cholerae). | ||
|
Название видов |
Эпидемиология |
Клинические проявления |
|
V. parahaemo-lyticus |
Распространен повсеместно в пресной и морской воде. Заболевание эпидемично в Японии и других странах Юго-Восточной Азии, заражаются при употреблении сырых морских продуктов и при купании |
Острый гастроэнтерит, раневая инфекция |
|
V, vulnificus |
Распространен в прибрежных водах морей и устьях рек; заражаются при употреблении гидробионтов (устриц, рыб, крабов) и при купании |
Энтерит, целлюлит, септицемия |
|
V. alginolyticus |
Распространен в морской воде; заражение происходит (через поврежденные кожные покровы) при купании |
Раневая инфекпия. поражение мягких тканей |
|
V. minictts |
Распространен в прибрежных водах морей; заражение происходит при употреблении сырых гидробионтов (устрицы и др.) |
Диарея |
|
V. holiisae |
Распространен в прибрежных водах Атлантического и Тихоокеанского побережья США; заражаются при употреблении сырых гидробионтов |
Диарея, гастроэнтерит, патогенность предполагается |
|
V. furnissii |
Распространен в морской воде и устьях рек стран Ближнего Востока и Юго-Восточной Азии; заражаются при купании (че-рез поврежденную кожу) и при употреблении гидробионтов. |
Диарея, гастроэнтерит, поражение мягких тканей |
|
V. fluviales |
Распространен повсеместно, эндемичен в Бангладеш, США; заражаются при употреблении сырых гидробионтов и при купании в контаминированной воде |
Холероподобный гаст-роэнтерит |
|
V. damsela |
Распространен в морской воде, заражение происходит через поврежденную кожу при купании в контаминированной воде |
Раневая инфекция |
|
V. metschnicovi |
Распространен повсеместно в пресной и морской воде; заражаются при употреблении сырых гидробионтов и при купании |
Инфекции мочевого тракта, перитониты, раневая инфекция |
Плезиомонады (род Plesiomonas)
К роду Plesiomonas относится единственный (типовой) вид — Plesiomonas shigelloides (ранее входил в семейство Enterobacteriaceae). Его образуют прямые подвижные (лофотрихи) палочки размером 3,0x0,8-5-1,0 мкм. Хемоорганотрофы. Метаболизм ферментативный и окислительный. Температурный оптимум 30 °С. Углеводы. Ферментируют с образованием кислоты (но не газа). Оксидаза- и каталазаполо-жительны. Образуют индол, восстанавливают нитраты, реакция Фогеса—Проскауэра отрицательна, образуют орнитин и лизин, декарбоксилазу и аргинин, дегидролазу. Большинство штаммов чувствительны к вибриоциду 0/129.
Выделяются из гидробионтов (моллюски, рыбы) и млекопитающих. У человека могут вызывать диареи.
Плезиомонады встречаются в почве и в поверхностных слоях пресноводных водоемов, в устьях субтропических и тропических рек. В теплый сезон их можно выделить из морской воды. Бактерии можно обнаружить в амфибиях, рептилиях, свиньях, коровах, курах,
кошках, собаках. В тропиках их можно обнаружить в моллюсках, рыбах. Человек заражается, употребляя в пищу контаминированную воду, сырых моллюсков, неправильно приготовленных ракообразных, мясо птицы. Заболевание регистрируется редко.
К факторам патогенности относятся цитотокси-ны и энтеротоксин, похожие на холероген, а также адгезины (обеспечивающие колонизацию тонкого кишечника); жгутики и эндотоксин.
Плезиомонады вызывают гастроэнтериты, реже — внекишечные поражения (на фоне иммунодефицита). Обычно заболевания встречаются редко и протекают легко (хотя не исключены кровавые диареи). У иммуноде-фицитных больных могут быть менингиты, септицемии, артриты, холециститы и т. п.; особенно тяжело протекают менингиты у новорожденных (летальность — до 80 %).
Микробиологическая диагностика. Основана на выделении и идентификации возбудителя. Исследуемый материал — испражнения или ректальные мазки, при внекишечных локализациях — мазки из очагов поражений. Возбудитель хорошо растет на простых средах.
На кровяном агаре вырастают серые, мутные негемо-лизирующие S-колонии, на среде Плоскирева — лак-тозаотрицательные колонии. Идентификация возбудителя проводится по биохимическим тестам для энтеробактерий.
Для лечения рекомендуется антибиотикотерапия. Возбудитель обычно чувствителен к большинству антибиотиков широкого спектра действия, устойчив к пенициллинам.
16.2.3. Семейство Pasteurellaceae
В семейство Pasteurellaceae входят гемо-фильные бактерии (род Haemophilus) и пасте-реллы (род Pasteurella).
16.2.3.1. Гемофильные бактерии (род Haemophilus)
В группу гемофильных бактерий объединены мелкие, грамотрицательные бактерии, которые способны расти только на обогащенных питательных средах, содержащих цельную или лизированную кровь или ее производные в качестве факторов роста (см. ниже). В названии рода Haemophilus отражена зависимость этих бактерий от крови при росте на искусственных питательных средах (от греч. haima — кровь, philos — любить). Многие микроорганизмы этого рода в норме обитают на слизистых оболочках дыхательных путей человека.
Наиболее важными патогенами для человека являются Haemophilus influenzae, преимущественно типа b, вызывающие инфекции с респираторным механизмом заражения (менингиты, синуситы, бронхиты и др.), а также возбудитель мягкого шанкра Н. ducreyi.
Haemophilus influenzae
Гемофильные палочки впервые были выделены русским бактериологом М. И. Афанасьевым в 1891 г. и позднее, в 1892 г., немецким бактериологом Р. Пфейффером от больных, умерших от гриппа. Поэтому Н. influenzae долгое время считали возбудителем гриппа; в связи с чем эти бактерии носили названия «палочка инфлюэнцы» (от англ. influenza — грипп) или «палочка Пфейффера».
Таксономическое положение. Бактерии рода Haemophilus относятся к семейству Pasteurellaceae и насчитывают около 20 видов. Наибольшее значение в патологии человека
имеют Н. influenzae (в том числе биовар aegyp-tius) и Н. ducreyi. Морфология и тинкториальные свойства.
Гемофилы представляют собой мелкие грамотрицательные сферические, овоидные или палочковидные бактерии, иногда образующие пары, короткие цепочки или нити. Такое свойство микробов принято называть «плео-морфизмом». Морфология этих бактерий зависит от возраста чистой культуры или типа питательной среды. Гемофильные бактерии неподвижны, спор не образуют, имеют пили (фимбрии). Образование капсулы является непостоянным признаком, и ее обнаружение может служить своеобразным маркером вирулентности штамма (см. далее).
Культуральные свойства. Гемофильные бактерии — факультативные анаэробы, однако лучше растут в аэробных условиях. Практически все виды нуждаются в готовых факторах роста, присутствующих в крови: Х-факторе (протопорфирин IX в составе гематина или гемина), а также V-факторе (никотинами-дадениндинуклеотид — НАД или НАД-фос-фат — НАДФ). Это связано с тем, что гемофилы не способны синтезировать гем, входящий в состав ферментов дыхательной цепи, и/или НАД (НАДФ), являющийся кофактором окислительно-восстановительных ферментов.
Для культивирования гемофильной палочки применяют шоколадный агар — питательную среду коричневого цвета, которую получают путем прогревания кровяного агара при 80 °С в течение 15 мин. В результате нагревания происходит гемолиз и высвобождение из эритроцитов гемина и НАД. Оптимальная температура роста бактерий 35—37 "С. Колонии появляются через 36-48 ч. Для Н. influenzae характерна способность к образованию R- и S-форм колоний (R-, S-диссоциация). Слизистые, более крупные (3—4 мм в диаметре) радужные S-формы колоний характерны для капсульных штаммов. Слабовирулентные бескапсульные варианты гемофильной палочки образуют R-колонии — более мелкие (около 1 мм), мелкозернистые, с неровными краями.
Для гемофильных бактерий характерен так называемый «феномен кормушки» или «феномен сателлита», который проявляется
в их способности расти на кровяном агаре вокруг колоний стафилококков или других бактерий, продуцирующих НАД или вызывающих alfa-гемолиз. Для самих гемофильных палочек способность вызывать гемолиз не характерна. Таким образом, мелкие радужные колонии гемофильных бактерий могут быть обнаружены на кровяном агаре в зоне гемолиза, образуемой S. aureus.
Идентификация гемофильных палочек основана на их потребности в факторах роста (табл. 16.17) и некоторых биохимических тестах.
Биохимическая активность. Гемофильные бактерии — хемоорганотрофы. Метаболизм дыхательный и бродильный. Утилизируют глюкозу до кислоты, восстанавливают нитрат до нитрита. Другие углеводы ферментируют плохо. Н. influenzae разделяют на 8 биоваров (I—VIII) в зависимости от их способности продуцировать индол, уреазу, орнитиндекар-боксилазу. Кроме того, вид Н. influenzae включает биовар aegyptius (табл. 16.18). Каталазная и оксидазная активность у различных видов гемофильных бактерий — вариабельный признак.
Антигенные свойства. Н. influenzae обладают соматическим О-антигеном и капсульным полисахаридным К-антигеном. Различают 6 серотипов Н. influenzae (a, b, с, d, e, f) в зависимости от особенностей строения кап-сульного антигена. Капсульный антиген ге-мофильной палочки серотипа b представляет собой полимер рибозы и рибитола — поли-рибозорибитол фосфат (PRP). Капсульные варианты гемофилов могут быть типированы с помощью теста «набухания капсулы» или РИФ с помощью специфических сывороток. Большинство вариантов Н. influenzae, представителей нормальной микрофлоры верхних отделов респираторного тракта, являются бескапсульными формами, которые принято называть «нетипируемыми».
Факторы вирулентности. Ведущим фактором вирулентности Н. influenzae является капсула, которая защищает бактерии от фагоцитоза, обеспечивает выживаемость бактерий в организме и способствует распространению инфекции. Штаммы, имеющие капсулу (преимущественно типа b), вызывают наиболее тяжело протекающие инфекции.
Гемофильные палочки могут продуцировать IgA-протеазу, способную инактивировать секреторные антитела. Лили и IgA-протеаза возбудителя играют ведущую роль в прикреплении микроорганизмов к эпителию респираторного тракта и его колонизации.
Экзотоксин Н. influenzae не продуцирует. ЛПС наружной мембраны играет роль эндотоксина, участвуя также в процессах адгезии и инвазии гемофильной палочки. Эндотоксин может также вызывать паралич ресничек мерцательного эпителия респираторного тракта человека, способствуя тем самым микробной колонизации верхних дыхательных путей.
Резистентность. Бактерии малоустойчивы в окружающей среде: быстро погибают, нахо дясь вне организма человека. Гемофилы до вольно чувствительны к нагреванию и обыч ным дезинфицирующим средствам. Однако у Н. influenzae выявлена способность к продук ции р-лактамаз, что обуславливает их высо кую устойчивость к некоторым Р-лактамным антибиотикам.
Эпидемиология. Н. influenzae патогенны только для человека.
Источник инфекции — человек, больной или бактерионоситель. Бескапсульные маловирулентные штаммы способны в норме колонизировать слизистые оболочки верхних дыхательных путей здоровых детей (около 60—90 %) и взрослых (около 35 %). Однако и имеющие капсулу штаммы Н. influenzae типа b выделяются из носоглотки у 2 % бессимптомных носителей.
Ведущий механизм заражения гемофильной инфекцией — респираторный, путь передачи — воздушно-капельный (при распылении капель секрета верхних дыхательных путей при кашле, разговоре, чихании).
Наиболее подвержены гемофильной инфекции дети в возрасте от 2 месяцев до 6 лет. Однако менингиты и септицемии, вызванные Н. influenzae типа b, чаще встречаются у детей от 6 месяцев до 2 лет. Пневмонии, синуситы и другие инфекции дыхательных путей встречаются также и у пожилых людей, пациентов с хронической легочной паталогией, со сниженным иммунитетом, а также у курильщиков.
Патогенез. Проникая через верхние дыхательные пути, В. influenzae прикрепляется к
мерцательному эпителию и колонизирует его. Бескапсульные варианты гемофильных бактерий часто остаются во входных воротах инфекции, не вызывая симптомов заболевания (бессимптомное носительство). Тем не менее, у людей со сниженным иммунитетом они способны проникать в подслизистый слой и с помощью эндотоксина вызывать местные ГВЗ — средние отиты (поражение среднего уха), синуситы (воспаление придаточных пазух носа), ларинготрахеиты, бронхиты, пневмонии.
N influenzae, преимущественно типа b, может распространяться в организме гематоген-но, вызывая септицемию, септический артрит, эндокардит. После проникновения через ге-матоэнцефалический барьер, капсульные варианты гемофильной палочки вызывают тяжелые гнойные менингиты. Поражение мозга является следствием воспалительной реакции в ответ на инвазию возбудителя. Воспалительный экссудат накапливается в спинномозговом канале и желудочках мозга и служит хорошей питательной средой для гемофильной палочки, способствуя ее размножению. Нарушение оттока жидкости из субарахноидального пространства приводит к повышению внутричерепного давления, субдуральному отеку, а васкулит и тромбофлебит мягкой мозговой оболочки ведут к некротическим изменениям мозговой ткани. Гнойный менингит, вызванный N. influenzae типа b, заканчивается летально в 5 % случаев, даже при проведении адекватной терапии.
N. influenzae типа b является также возбудителем острого бактериального эпиглоттита (воспаление надгортанника) у детей 2—5 лет, который приводит к нарушению проходимости дыхательных путей и асфиксии.
Клиника. Клиническая картина заболевания определяется локализацией воспалительного процесса. Симптомы менингита, вызванного гемофильными бактериями, не отличаются от таковых при менингококковой или пневмококковой инфекциях, поэтому диагностика базируется, главным образом, на выделении и идентификации возбудителя. Гнойные поражения твердой и мягкой мозговых оболочек приводят к тяжелым осложнениям — потере зрения, глухоте, гидроцефалии, слабоумию.
У детей возможны фулминантные молниеносные формы ларинготрахеита и эпиглот-
тита с отеком гортани, требующие срочной трахеотомии и интубации.
По данным мировой статистики, гемо-фильная инфекция занимает одно из первых мест среди причин детской смертности. Летальность при гнойном менингите, сепсисе и эпиглоттите в отсутствие адекватного лечения составляет 90 %.
Иммунитет. В течение первых 3—6 месяцев жизни дети защищены от инфекции материнскими IgG, полученными пассивно через плаценту. Поэтому в этом возрасте заболевания редки, а пик заболеваемости гемофильной инфекцией (в особенности типа b) приходится на возраст от 6 месяцев до 2 лет, когда концентрация материнских IgG снижается, а ребенок не способен самостоятельно синтезировать необходимое количество антител к полисахаридному капсульному антигену N. influenzae. Это объясняется тем, что поли-рибозорибитолфосфат капсульного антигена типа b является Т-независимым антигеном, антитела к которому образуются без участия Т-хелперов. У младенцев способность синтезировать антитела к таким антигенам снижена. Антитела же против других антигенов N. influenzae не способны опсонизировать капсульные штаммы гемофильной палочки.
Иммунитет после перенесенной гемофильной инфекции мало изучен. Однако известно, что к 5—6 годам в сыворотке крови многих детей (даже не иммунизированных и не переболевших) имеются естественно приобретенные протективные антитела против капсульного антигена N. influenzae типа b (анти-PRP антитела). Тем не менее, пневмония и артрит, вызванные N. influenzae, могут развиваться у взрослых в присутствии таких антител.
Микробиологическая диагностика. Материал для исследования — мазок из носоглотки, кровь, мокрота или ликвор. При отитах или синуситах исследуют также гнойное отделяемое, а при септических артритах — суставную жидкость.
Методы диагностики. Микроскопическое исследование малоинформативно, однако применяется при гнойном менингите (изучение мазков из цереброспинальной жидкости, окрашенных по Граму). Для ускоренной диагностики и дифференциации гемофильной палочки
от других возбудителей менингита используют серологические тесты с целью обнаружения b-капсульного антигена Н. influenzae: встречный иммуноэлектрофорез, прямую РИФ или реакцию латекс-агглютинации с анти-b-антитела-ми. При высокой концентрации возбудителя в исследуемом материале возможна также постановка «теста набухания капсулы».
Для выделения и идентификации возбудителя из материала от больных применяют бактериологический метод исследования. Посев для выделения гемофилов производят на шоколадный или кровяной агар (как описано выше) и инкубируют до появления колоний в течение 24—48 ч. Н. influenzae дифференцируют от других близкородственных грамнегативных палочек по их потребности в Х- и V-факторах роста, отсутствию гемолиза на кровяном агаре и другим тестам.
Лечение. Проводят с помощью антибиотиков. Для антимикробной терапии «гемофиль-ного менингита» важным принципом выбора антибиотика является его способность накапливаться в ликворе. В отсутствие адекватного лечения уровень летальных исходов составляет около 90 %, причем смерть может наступить в первые 24 ч от начала заболевания. Поэтому лечение назначают эмпирически до получения результатов антибиотикограммы. Препаратами выбора являются цефалоспори-ны III поколения (например, цефтриаксон, цефотаксим). Многие штаммы Н. influenzae типа b чувствительны к ампициллину, но около 25 % продуцируют Р-лактамазу, которая контролируется трансмиссивной плазмидой.
При синуситах, отитах и других инфекциях дыхательных путей, вызванных гемофилами, назначают Р-лактамные антибиотики с ингибиторами Р-лактамазы (например, амоксициллин с клавулановой кислотой) или бисептол.
Профилактика. Для создания искусственно приобретенного активного иммунитета против Н. influenzae типа b применяют субкорпускулярную вакцину, содержащую очищенный капсульный антиген (RPR). Однако ввиду низкой иммуногенности этого препарата его назначают только детям старше 1,5 лет.
Для повышения эффективности вакцинации против Н. influenzae b-инфекции предложено использовать конъюгированные вакцины,
содержащие RPR-антиген на белке-носителе. В качестве таких носителей применяют дифтерийный либо столбнячный анатоксины, или белки наружной мембраны менингококка группы В (комбинированная вакцина для профилактики менингококкового и гемофильного менингитов). Схема вакцинации предусматривает повторное многократное введение препарата детям, начиная с 2—3-месячного возраста, вместе с введением АКДС, а также вакцин против гепатита В и полиомиелита.
Массовая вакцинация против гемофильной инфекции за рубежом позволила значительно снизить частоту развития менингитов гемофильной этиологии у детей. Применение вакцины, однако, не защищает от носительства гемофильных палочек. В России отечественной вакцины нет, но разрешены к применению зарубежные препараты. Иммунизация против гемофильной инфекции в России пока не включена в календарный план обязательной вакцинации детей.
Пассивная иммунизация с помощью донорских сывороточных препаратов, содержащих высокие концентрации IgM, может быть назначена детям со слабым иммунным ответом на вакцину и иммунодефицитным лицам.
Контакт с пациентами, страдающими гемофильной инфекцией, малоопасен для взрослых, но представляет определенный риск для неиммунизированных детей. Поэтому детям в возрасте до 4 лет, находившимся в тесном контакте с больным, а также для санации бактерионосителей рекомендуется введение рифампицина с профилактической целью. Рифампицин выделяется со слюной, что уменьшает концентрацию возбудителя в верхних дыхательных путях, снижая тем самым риск распространения возбудителя в популяции. Однако злоупотреблять химиопрофи-лактикой гемофильной инфекции не следует из-за возможности развития лекарственной устойчивости Н. influenzae.
Haemophilus influenzae биовар aegyptius
Я. influenzae биовар aegyptius (прежнее название — Я. aegyptius) был выделен Р. Кохом в 1883 г. в Египте от больного с гнойным конъюнктивитом. Эти бактерии принято называть «бацилла Коха—Уикса» или «Я. influenzae биотип III».
Морфологические, тинкториальные и культуральные свойства этих бактерий не отличаются от таковых Н. influenzae. Биохимические признаки для их дифференциации приведены в табл. 16.18.
Н. influenzae биовар aegyptius вызывает гнойный конъюнктивит с высокой контагиозностью, распространенный повсеместно. Передается от человека к человеку контактным путем через грязные руки, полотенце, контактные линзы, косметику (тушь для ресниц), а также иногда респираторно. Инкубационный период составляет 1—3 дня.
Полагают также, что биовар aegyptius гемофильной палочки вызывает пурпурную (красную) бразильскую лихорадку — тяжелое инфекционное заболевание детей, которое характеризуется лихорадкой, пурпурой, шоком и заканчивается гибелью больного. Механизм заражения бразильской лихорадкой — респираторный.
При конъюнктивите исследуют мазок со слизистой оболочки глаз или гнойное отделяемое. Для диагностики бразильской лихорадки берут кровь пациента. Применяют бактериоскопический и бактериологический методы исследования. Идентификацию возбудителя проводят с помощью реакции агглютинации со специфической сывороткой. Для лечения применяют антибиотики, при конъюнктивите антибиотики назначают местно — мази и глазные капли с тетрациклином, аминогликозидами и сульфаниламидами. Специфическая профилактика не разработана.
Haemophilus ducreyi
Возбудитель мягкого шанкра был выделен русским врачом О. В. Петерсеном (1887), а подробно описан итальянским венерологом А. Дюкре (1890).
Мягкий шанкр (син. шанкроид) — это венерическое (сексуально-трансмиссивное) заболевание, симптомы которого напоминают сифилис.
Источником инфекции является больной человек. Механизм заражения — контактный, путь инфицирования — половой и контактно-бытовой. Заболевание довольно распространено в странах Африки и Южной Америки.
Инкубационный период составляет 3—5 дней, однако первые симптомы заболевания (красное пятно в месте проникновения возбудителя) можно наблюдать уже в первые сутки после инфицирования. Характерные для шанкроида поражения появляются в очаге инвазии возбудителя: на гениталиях или иногда — экстрагенитально в результате аутозаражения. Локально процесс представляет собой мягкую шероховатую язву со значительным отеком. Регионарные
лимфоузлы увеличены и болезненны. Мягкий шанкр отличается от твердого шанкра при сифилисе болезненностью при пальпации и кровоточивостью. Язва заживает медленно, и существует риск проникновения возбудителя в кровоток. Заболевание необходимо дифференцировать с сифилисом, простым герпесом и венерической лимфогранулемой.
Иммунитет после перенесенного заболевания не вырабатывается.
Микробиологическая диагностика. Основана на обнаружении мелких грамотрицательных палочек в отделяемом из язвы, обычно в ассоциации с другими гноеродными микробами. При бактериологическом исследовании определяют потребность Н. ducreyi в факторах роста (требует Х-фактор, но не нуждается в добавлении V-фактора). Растет на шоколадном агаре, содержащем ванкомицин (3 мкг/мл), при температуре 33 "С в атмосфере с 10 % С02. Н. ducreyi образуют мелкие сероватые колонии без гемолиза.
В некоторых странах для идентификации возбудителя применяют ПЦР. С этой целью также исследуют содержимое язвы.
Лечение. Проводят с помощью антибиотиков: назначают внутримышечно цефтриаксон, перорально триметоприм — сульфометоксазол (бисептол) или эритромицин в течение 2 недель. Тетрациклин, суль-фонамиды и пенициллин в настоящее время не применяют из-за формирования у Н. ducreyi устойчивости к ним.
Специфическая профилактика. Не разработана.
Другие виды бактерий рода Haemophilus
Н. parainfluenzae напоминает Н. influenzae и является обычным обитателем респираторного тракта человека. Не нуждается в Х-факторе для роста. Вирулентность значительно ниже, чем у Н. influenzae, но иногда этот возбудитель выделяется от больных с пневмонией, при инфекционном эндокардите и уретрите.
Н. haemoglobinophilus нуждается в Х-факторе и не требует V-фактора; вызывает заболевания у собак, для человека непатогенна.
Н. haemolyticus встречается в норме в носоглотке человека и может вызывать инфекции верхних дыхательных путей у детей.
Н. aphrophilus является представителем нормальной микрофлоры полости рта и респираторного тракта и иногда обнаруживается в материале от больных при инфекционном эндокардите и пневмонии. По своим свойствам напоминает бактерии рода Actinobacillus,
которые также относятся к семейству steurellaceae вызывает заболевание, симптомы которого напоминают актиномикоз.
16.2.3.2. Пастереллы (род Pasteurella)
Род Pasteurella включает группу бактерий, преимущественно патогенных для животных, которые могут также обнаруживаться на слизистых оболочках верхних дыхательных путей и пищеварительного тракта человека. Первоначально к этому роду относили также все иерсинии и франциселлы.
Некоторые виды пастерелл вызывают болезни человека. Это — бактериальные зоонозные инфекционные заболевания с контактным механизмом передачи, которые носят локальный характер и характеризуются поражением наружных покровов и лимфаденитами.
Таксономическое положение. Бактерии рода Pasteurella относятся к семейству Pasteurellaceae. Род Pasteurella включает 4 вида бактерий: P. multocida, P. haemolytica, P. pneumotropica и Р. игеае.
Морфологические и тинкториальные свойства. Пастереллы — это мелкие неподвижные грамотрица-тельные коккобактерии сферической или овальной формы, а также палочки, располагающиеся одиночно,
попарно или, реже, в коротких цепочках. Пастереллы обычно окрашиваются биполярно, особенно в препаратах, приготовленных из инфицированных тканей животных.
Культуральные и биохимические свойства. Пастереллы — факультативные анаэробы, которые хорошо растут на обычных питательных средах при температуре 37 "С. Все они оксидаза- и каталаза-по-зитивные, ферментируют глюкозу до кислоты (без газообразования), восстанавливают нитрат до нитрита. Внутри рода бактерии различаются по биохимической активности.
Антигенные свойства. Мало изучены. У пастерелл имеется О-антиген, как и у прочих грамотрицатель-ных бактерий.
Факторы патогенности. Пастереллы, подобно фран-циселлам и иерсиниям, являются факультативными внутриклеточными паразитами. Среди факторов патогенности следует отметить наличие эндотоксина.
Эпидемиология. Ведущий механизм заражения человека при инфекциях, вызванных пастереллами, — контактный, путь — раневой при укусе животных.
Резервуаром возбудителя являются различные виды диких и домашних животных и птиц. Pasteurella multocida вызывает геморрагическую септицемию
различных животных (лошадей, овец, свиней, кур, кроликов, кошек и др.); холеру птиц и пневмонию сельскохозяйственных животных. Бактерии этого вида распространены повсеместно. Выделяют их из респираторного и пищеварительного тракта многих домашних и диких животных. Этот микроорганизм иногда обнаруживается в составе нормальной микрофлоры человека. P. multocida может также вызывать заболевания различных органов у человека и является наиболее частым микроорганизмом, обнаруживаемым в ране у человека, нанесенной кошкой или собакой при укусе.
Pasteurella haemolytica обнаруживается в верхних отделах респираторного тракта крупного рогатого скота, овец, свиней, лошадей и кур. Вызывает пневмонию и «транспортную лихорадку» у крупного рогатого скота, овец и коз. P. haemolytica является частой причиной эпизоотии пневмонии крупного рогатого скота и овец или куриной холеры у цыплят и индеек, приводящих к большим экономическим потерям. Инфекции человека вызывает редко.
Pasteurella pneumotropica — нормальный обитатель респираторного тракта и кишечника мышей и крыс, может вызывать пневмонию и сепсис при дисбак-териозе у грызунов. Некоторые инфекции человека могут быть связаны с укусами животных.
Pasteurella ureae редко обнаруживается у животных, но встречается в ассоциации с другими микроорганизмами при хронических респираторных заболеваниях и других гнойных инфекциях человека.
Клиника. Наиболее часто проявление инфекции, вызванной бактериями рода Pasteurella, связано с укусом животного. Инкубационный период 1—5 дней. Заболевание характеризуется острым началом с покраснением, отеком и болью в очаге в первые часы после укуса. Возможна регионарная лимфаденопа-тия, температура тела повышается незначительно.
Иногда бактериемия или хроническая респираторная инфекция, вызванные пастереллами, развиваются без видимого контакта с животными. В этих случаях возможный механизм заражения — аэрогенный.
Иммунитет. После перенесенного заболевания мало изучен.
Микробиологическая диагностика. Поскольку клиническая симптоматика заболеваний, вызываемых пастереллами, неспецифична, микробиологическая диагностика позволяет помочь клиницистам в постановке правильного диагноза. Основной метод исследования — бактериологический. Материал для исследования — кровь, раневое отделяемое, мокроту — засевают на питательные среды, культивируют
и проводят идентификацию выделенных микроорганизмов. Следует дифференцировать пастереллы и сходные с ними по ряду признаков бактерии родов Haemophilus, Actinobacillus, Yersinia и Francisella.
Лечение. Проводят с помощью антибиотиков (например, тетрациклинов).
Специфическая профилактика. Не разработана.
16.2.4. Другие роды
16.2.4.1. Возбудитель донованоза (род Calymmatobacterium)
Донованоз (гранулема венерическая, син. пятая венерическая болезнь) вызывается Calymmatobacterium granulomatis (палочка Арагана—Вианны). Характеризуется хроническим течением (инкубационный период — от одной недели до 3 месяцев), поражением кожи половых органов в виде неравномерных папилломатозных разрастаний эпидермиса и сосочкового слоя дермы, наличием язв. Передается половым, реже бытовым путем. Мужчины болеют чаще, чем женщины. Встречается, главным образом, в тропических и субтропических странах.
Бактерии рода Calymmatobacterium — плеоморфные палочки размером 0,5-/1,5x1,0/2 мкм с закругленными концами. Имеют капсулу, неподвижны. Могут выращиваться в желточном мешке куриного эмбриона или на средах, содержащих яичный желток.
Микробиологическая диагностика. Основывается на клинических и микроскопических данных. При микроскопии мазков из пораженных участков кожи, окрашенных по Романовскому—Гимзе, обнаруживают внутриклеточные бактерии (тельца Донована).
Лечение. Эффективны ампициллин, тетрациклины.
Профилактика. Не специфическая, такая же, как при гонорее.
16.2.4.2. Эйкенеллы (род Eikenella) Представители нормальной микрофлоры челове ка, способные при определенных условиях вызывать гнойно-воспалительные процессы (абсцессы) раз личной локализации.
Таксономия. Род Eikenella. Вид Eikenella corrodens.
Морфология и тинкториальные свойства. Эйкенеллы — мелкие грамотрицательные палочки размер 1,5—4 мкм. В мазке располагаются беспорядочно, могут образовывать короткие цепочки. Жгутиков не имеют, неподвижны, спор не образуют.
Культуральные и биохимические свойства. По типу дыхания эйкенеллы — факультативные анаэробы.
Оптимальная температура культивирования 35—37 °С. Требовательны к питательным средам. На жидких средах с добавлением холестерола или 3% сыворотки крови дают скудный рост. Для выделения в аэробных условиях необходимо добавление к питательной среде гемина. На плотных средах образуют мелкие колонии, которые вырастают как бы в углублениях среды. Культуры на плотных средах имеют запах хлорной извести. Рост микроорганизмов стимулирует повышение концентрации СO2 до 5—10 %.
Эйкенеллы обладают слабой ферментативной активностью. Разлагают лизин, восстанавливают нитраты в нитриты, дают положительную оксидазную реакцию. Не имеют уреазы и каталазы. Глюкозу и аргинин не разлагают, индол не продуцируют.
Факторы патогенности. Обладают слабой гемолитической активностью (-гемолиз).
Распространение. Встречаются в полости рта и в кишечнике человека.
Могут вызывать оппортунистические инфекции, высеваются в ассоциациях с другими микробами при абсцессах головы, шеи, органов брюшной полости. Выделяются из крови при сепсисе.
Микробиологическая диагностика. Материал для исследования — гной, кровь, раневое отделяемое. Основной метод диагностики — бактериологический.
Лечение. Применяют антибиотики тетрациклино-вого ряда, цефалоспорины, аминогликозиды.
Специфическая профилактика. Не разработана.
16.3. Палочки грамотрицательные аэробные
16.3.1. Бордетеллы (род Bordetella)
Бордетеллы — это группа мелких грамотрица-тельных бактерий, обитающих в респираторном тракте человека и некоторых видов животных. Длячеловекапатогенны Bordetella pertussisn B. parapertussis, которые вызывают коклюш и паракок-люш соответственно. Возбудитель коклюша впервые был выделен из мокроты больного ребенка в 1906 г бельгийским бактериологом Ж. Борде и французским ученым О. Жангу, отчего получил название «палочка Борде—Жангу». Современное название рода Bordetella — в честь Ж. Борде.
Возбудители коклюша и паракоклюша — В. pertussis и В. parapertussis
Коклюш и паракоклюш — это острые ан-тропонозные инфекционные заболевания человека, которые характеризуются поражением верхних дыхательных путей и приступами спазматического кашля.
Таксономическое положение. Возбудители коклюша Bordetella pertussis и паракоклюша Bordetella parapertussis относятся к роду Bordetella.
Морфология и тинкториальные свойства. Bordetella pertussis и Bordetella parapertussis — очень мелкие короткие грамотрицательные палочки. Имеют микрокапсулу, неподвижны. При окраске толуоидиновым синим у них выявляются метахроматически окрашенные гранулы (липоиды), расположенные биполярно.
Культуральные свойства. Все бордетеллы — строгие аэробы. В. pertussis очень требовательны к условиям культивирования: для их выделения используют сложные питательные среды с добавлением сорбентов или веществ с высокой сорбционной способностью (активированный уголь, кровь, альбумин), так как в процессе жизнедеятельности эти бактерии выделяют ненасыщенные жирные кислоты, сульфиды и перекиси, способные ингибиро-вать их рост. Для выделения бордетелл из клинического материала применяют казеиново-угольный агар (КУА) или среду Борде—Жангу (картофельно-глицериновый агар с добавлением 20 % крови и пенициллина). Посевы инкубируют при температуре 35—37 °С в течение 3—7 дней при высокой влажности воздуха (например, в запечатанном пластиковом пакете). Другие виды бордетелл (В. parapertussis, В. bronchiseptica, В. avium) могут расти на простых питательных средах, образуя видимые колонии уже через 24—48 ч культивирования. На среде Борде—Жангу В. pertussis образует мелкие сероватые блестящие колонии, напоминающие капли ртути или жемчужины, у вирулентных штаммов — с небольшой зоной гемолиза.
Для бордетелл характерна R—S-трансфор-мация. Свежие изоляты бордетелл, т. е. чистая культура бактерий, выделенная непосредственно от больного, представляет собой вирулентную S-форму (IV фаза), продуцирующую токсины. В процессе пассирования на питательных средах бордетеллы, постепенно
Таблица 16.19. Дифференциация различных видов бордетелл
|
Признак |
В. pertussis |
вид микроорганизма | ||
|
В. parapertussis |
В. bronchiseptka |
В. avium | ||
|
Подвижность |
- |
- |
+ |
+ |
|
Время культивирования на среде Борде—Жангу |
3—6 суток |
2—3 суток |
1—2 суток |
1 —2 суток |
|
Рост на МПА |
- |
+ |
+ |
+ |
|
Пигментообразование |
- |
+ |
- |
-/+ |
|
Биохимическая активность: > тест на уреазу > тест на оксидазу > восстановление ни гратов до нитритов > тест на каталазу |
- + - + |
+ - - + |
+ + + + |
- + - + |
|
Факторы патогенности: > пертусеис-токсин > внеклеточная аденилатииклаза > трахеальный цитотоксин |
+ + + |
- + + |
- + + |
- - + |
утрачивая поверхностные антигены, превращаются в авирулентную R-форму (II фаза), проходя при этом ряд промежуточных стадий (фазы II и III). Бордетеллы IV фазы не продуцируют факторов патогенности, типичных для возбудителя коклюша.
Биохимическая активность. Очень низкая. Бордетеллы расщепляют глюкозу и лактозу до кислоты без газа (табл. 16.19).
Антигенные свойства. Бордетеллы имеют соматический термостабильный родоспецифи-ческий О-антиген, обнаруживаемый у S-форм всех видов бордетелл. Кроме того, у них имеются 14 поверхностных термолабильных кап-сульных К-антигенов, которые принято называть «факторами» и обозначать арабскими цифрами. Так, В. pertussis имеет 6 различных сероваров (факторы с 1-го по 6-й). Фактор 7 является общим для всех бордетелл. Для В. parapertussis специфическим является фактор 14, а для В. bronchiseptica — фактор 12. К-антигены бордетелл часто называют агглютиногенами, так как их выявляют в реакции агглютинации.
Серотипирование возбудителей коклюша осуществляют в реакции агглютинации с соответствующими К-сыворотками с целью эпидемиологического маркирования. Авирулентные R-формы бордетелл утрачивают капсулу и не агглютинируются К-сыворотками.
Разновидности (вариации) бордетелл. Бордетеллы, выделенные от больных, раз-
личаются по вирулентности, гемолитической активности и способности продуцировать токсины. Выделяют два механизма «превращения» бордетелл в авирулентные негемолитические и нетоксигенные формы. Фенотипическая (модификационная) изменчивость связана с появлением авирулентных разновидностей в результате культивирования В. pertussis в неблагоприятных для них условиях: при температуре +25...+28 °С или в присутствии MgS04. Генотипическая изменчивость обусловлена необратимыми изменениями (мутациями), возникающими в геноме бордетелл при длительном пассировании на искусственных питательных средах, т. е. вне человеческого организма, в результате чего происходит образование новых авирулентных фаз возбудителя (фазы II, III и IV).
Факторы патогенности. В. pertussis обладает целым рядом факторов патогенности, которые вовлечены в патогенез развития коклюша.
Факторы адгезии: пили (фимбрии), филамен-тозный гемагглютинин, пертактин — белок наружной мембраны клеточной стенки (молекулярная масса 69 кДа) и капсулъные агглютжогены играют роль в адгезии бактерий к мерцательному эпителию верхних дыхательных путей (бронхов, трахеи). Ведущая роль в процессе адгезии к эпителию респираторного тракта человека принадлежит филаментозному гемагглютинину, который является белком, способным избирательно
связываться с гликолипидными рецепторами ресничек эпителия трахеи и бронхов. Токсины бордетелл
а) Пертуссис-токсин (син. пертуссин, кок люшный токсин, лимфоцитоз-стимулирую- щий фактор, гистамин-сенсибилизирующий фактор) стимулирует работу аденилатциклазы в клетках респираторного тракта путем инги- бирования регуляторного белка G.. Пертуссин представляет собой фермент, который отно сится к категории АДФ-рибозилтрансфераз и состоит из 2 основных субъединиц: А (от англ. active — активная субъединица) и В (от англ. binding — связывающая субъединица). С по мощью субъединицы В пертуссис-токсин при крепляется к клеткам-мишеням. Субъединица А участвует в рибозилировании регуляторно го белка G.. Этот белок в норме ингибирует аденилатциклазу. Измененный под действием субъединицы А, белок G. не способен боль ше регулировать активность клеточной аде нилатциклазы. В результате этого процесса происходит неконтролируемый синтез цАМФ. Накопление цАМФ в клетках приводит к их извращенному функционированию.
Пертуссис-токсин повышает проницаемость сосудов; усиливает чувствительность к гиста-мину и серотонину; стимулирует миграцию лимфоцитов, моноцитов; подавляет киллинг-активность фагоцитов; может вызывать повышение синтеза инсулина и, как следствие, снижение концентрации глюкозы в крови и пр.
Пертуссин является экзотоксином, под действием формалина превращается в анатоксин.
б) Внеклеточная аденилатицклаза за счет поступления внутрь эпителиоцитов дыха тельных путей еще более усиливает синтез и накопление цАМФ внутри клеток хозяина. Этот фактор патогенности бордетелл также подавляет хемотаксис фагоцитов, нарушает «переваривающую» способность фагоцитов за счет ингибирования «респираторного взрыва» внутри фаголизосомы.
в) Трахеальный цитотоксин, являясь фраг ментом пептидогликана бордетелл, повреж дает эпителиоциты респираторного тракта. Механизм его действия мало изучен. Вероятно, он стимулирует продукцию цитокинов, оказы вающих повреждающее воздействие на эпите лиоциты респираторного тракта.
г) Дерматонекротический токсин (син. тер молабильный токсин) инактивируется при на гревании до 56 С в течение 15 мин. Наряду с трахеальным цитотоксином, дерматонекро тический токсин оказывает повреждающее действие на эпителий респираторного тракта, вызывая местную воспалительную реакцию. При внутрикожном введении лабораторным животным вызывает некроз в месте инъекции. При внутривенном и внутрибрюшинном вве дении мышам вызывает гибель последних.
д) Термостабильный эндотоксин — ЛПС клеточной стенки бордетелл, который стиму лирует выработку цитокинов, участвующих в повреждении эпителиальных клеток верхнего отдела респираторного тракта, а также акти вирует комплемент.
Резистентность. Вне человеческого организма бордетеллы быстро погибают. Они довольно чувствительны к дезинфектантам, быстро инактивируются при нагревании.
Эпидемиология. Коклюш и паракоклюш — типичные антропонозные инфекции: болеют только люди. Источником инфекции является больной человек (особенно в катаральном периоде заболевания) и иногда — бактерионоситель. Возбудитель проникает в организм через дыхательные пути при кашле, разговоре, чихании (респираторный механизм заражения, путь передачи инфекции — воздушно-капельный).
Контагиозность коклюша очень высока: индекс контагиозности колеблется около 0,75— 0,9, т. е. после контакта неиммунизированного человека с коклюшным больным вероятность развития заболевания составляет 75—90 %.
Естественная восприимчивость людей высокая, поэтому коклюш распространен повсеместно и может быстро приобретать эпидемический характер среди неиммунных лиц. Болеют, главным образом, дети до 5 лет. Наиболее опасен коклюш для детей первого года жизни, у которых, вследствие развития осложнений, заболевание может закончиться летальным исходом.
Паракоклюш встречается значительно реже, носит эпизодический характер и, как правило, протекает легче коклюша.
Патогенез. Бордетеллы являются неинва-зивными микробами, т. е. они не проникают внутрь клетки-мишени. Проникнув через верхние дыхательные пути, возбудите-
ли коклюша прикрепляются к поверхности эпителия бронхов и трахеи и размножаются. В кровь бактерии не поступают. Микробы вызывают поражение эпителиальных клеток дыхательных путей. Позднее может развиться некроз отдельных участков эпителия и полиморфно-нуклеарная инфильтрация с развитием перибронхиального воспаления и интерстициальной пневмонии. Выделяя токсины и раздражая рецепторы клеток, микроб вызывает кашель.
Присоединение вторичной инфекции стафилококковой этиологии или вызванной Н. influenzae может провоцировать бактериальную пневмонию. Обструкция (закупоривание) мелких бронхиол слизистыми пленками (пробками) приводит к ателектазам и снижению насыщенности крови кислородом. Это, вероятно, способствует развитию судорог и затяжных приступов кашля у младенцев.
Клиника. Инкубационный период при коклюше составляет около 2 недель, после чего начинается катаральный период, характеризующийся легким кашлем и чиханием. Температура тела повышается незначительно. В этом периоде возбудитель выделяется в большом количестве с каплями слизи, и больной является опасным источником инфекции. Во время следующего, пароксизмального периода кашель усиливается и приобретает характер «петушиного крика» (от франц. со-queluche). Приступообразный спазматический кашель сопровождается тяжелой гипоксией, судорожным синдромом и нередко заканчивается рвотой. Частые продолжительные приступы сухого кашля могут приводить к перевозбуждению дыхательного центра, развитию апноэ и гипоксической энцефалопатии.
Тяжелые формы коклюша с развитием осложнений встречаются преимущественно у новорожденных детей, у детей же старшего возраста и иногда у взрослых людей заболевание характеризуется обычно периодическими приступами кашля. В формуле крови отмечается выраженный лейкоцитоз (16 000-30 000 в 1 мл) в сочетании с абсолютным лимфо-цитозом. Выздоровление наступает очень медленно (иногда в течение 1—2 месяцев). Характерно преобладание легких, стертых и атипичных форм течения коклюша.
Симптомы, напоминающие коклюш, могут вызывать некоторые типы аденовирусов и Chlamydia pneumoniae.
Иммунитет. После перенесенного заболевания формируется прочный иммунитет. Повторные случаи заболевания встречаются очень редко и протекают легко. Большое значение имеют антитела (IgA), препятствующие прикреплению возбудителя к цилиарному эпителию верхних дыхательных путей.
Следует подчеркнуть, что иммунитет ви-доспецифический, поэтому антитела против B.pertussis не защищают от заболеваний, вызванных В. parapertussis или В. bronchiseptica.
Микробиологическая диагностика. Материал для исследования — слизь с задней стенки глотки) — принято забирать методом «кашлевых пластинок». С помощью этого метода материал от больного засевают во время приступа кашля непосредственно на чашку Петри с питательной средой, держа ее перед лицом пациента. Мазки из носоглотки исследуют редко, так как возбудитель коклюша быстро погибает на ватном тампоне при высушивании (хлопок подавляет рост бордетелл). При необходимости исследуют мазки с задней стенки глотки, используя специальные тампоны из альгината кальция, смоченные в растворе пенициллина.
Методы диагностики. Для ускоренной диагностики применяют прямую РИФ со специфической флюоресцентной сывороткой и материалом из зева больного. Однако чувствительность и специфичность этого метода составляют не более 50 %, поэтому возможны ложноположи-тельные и ложноотрицательные результаты.
Бактериологический метод позволяет выделить и отдифференцировать возбудители коклюша и паракоклюша. Бактериологическое исследование проводят, делая посев на плотные питательные среды с антибиотиками (см. выше). Для идентификации возбудителя применяют реакцию агглютинации на стекле с К-сыворотками.
Серологическая диагностика малоинформативна, поскольку в процессе заболевания титр агглютининов и преципитирующих антител увеличивается лишь к 3-й неделе заболевания. Тем не менее, для подтверждения клинического диагноза применяют развернутую реакцию агглютинации и РСК с парными сыворотками.
Лечение. В. pertussis чувствительна ко многим антимикробным препаратам (кроме пенициллина). Однако антимикробную терапию (эритромицин, ампициллин) назначают лишь в тяжелых случаях коклюша и детям в возрасте до 1 года. Нормальный человеческий иммуноглобулин также применяют для лечения тяжелых или осложненных форм коклюша. Назначение эритромицина в катаральном периоде заболевания способствует элиминации микроба. Лечение антибиотиками после начала пароксизмальной стадии заболевания редко ускоряет выздоровление.
В качестве поддерживающей терапии назначают кислородные ингаляции и анти-гистаминные или седативные препараты. Пребывание на свежем воздухе, проветривание помещений снижают частоту приступов кашля у заболевших.
Профилактика. В течение первого года жизни каждому ребенку необходима базовая трехкратная вакцинация убитой коклюшной вакциной в составе АКДС (адсорбированной коклюшно-дифтерийно-столбнячной вакцины). Вакцина содержит инактивированные нагреванием или мертиолатом В. pertussis I фазы (цельные микробные клетки) в комбинации с дифтерийным и столбнячным анатоксинами, сорбированными на гидроокиси алюминия. Иммунизацию проводят, начиная с 3-месячного возраста, троекратно, с интервалами между введением препарата в 4—6 недель. К сожалению, при введении этой вакцины возможно развитие поствакцинальных осложнений, в том числе неврологических (энцефалопатия и даже энцефалит). Однако вероятность и частота возникновения таких осложнений значительно ниже, чем опасность развития заболевания, и составляет 1 случай на 1 млн доз вакцины. Прекращение вакцинации против коклюша с помощью АКДС в некоторых регионах привело к значительному росту заболеваемости.
В настоящее время разработаны и применяются бесклеточные (ацеллюлярные, субкорпускулярные вакцины), содержащие очищенные антигены возбудителя коклюша (филамен-тозный гемагглютинин, пертактин, агглюти-ногены или пертуссис-анатоксин) в различных комбинациях.
Для экстренной профилактики коклюша у контактировавших неиммунизированных лиц
назначают нормальный человеческий иммуноглобулин и/или эритромицин в первые 5 дней после контакта с заболевшим.
Bordetella bronchiseptica. Bordetella avium
В. bronchiseptica и В. avium представляют собой мелкие грамотрицательные палочки, имеющие жгутики. Являются паразитами млекопитающих и птиц. Локализуются и размножаются среди ресничек эпителия дыхательного тракта. Антигенные и другие свойства, а также принципы идентификации и дифференциальной диагностики описаны выше.
В. bronchiseptica крайне редко вызывает у людей заболевание, напоминающее паракоклюш. Иногда обнаруживается в носоглотке людей со сниженным иммунитетом, а также у людей, содержащих домашних животных (кроликов, собак и др.). Возможно бессимптомное носительство у человека. Патогенность В. avium для человека не доказана.
16.3.2. Бруцеллы (род Brucella)
Бруцеллы являются возбудителями бруцеллеза — острого или хронического антропозоо-нозного инфекционного заболевания, которое характеризуется интоксикацией, преимущественным поражением опорно-двигательного аппарата, нервной, сердечно-сосудистой, мочеполовой систем и других органов, аллерги-зацией организма, затяжным течением, приводящим, как правило, к инвалидизации.
Характеристика возбудителя: возбудители бруцеллеза относятся к роду Brucella, который включает в себя следующие виды: В. melitensis, В. abortus, В. suis, В. ovis, В. canis, В. meotomae. Название рода связано с именем Д. Брюса, открывшего в 1886 г. возбудителя бруцеллеза.
Морфология. Бруцеллы — мелкие грамотрицательные микробы шаровидной, овоидной или палочковидной формы. Спор не образуют, неподвижны. При действии специфического бактериофага или при выращивании на среде с 10 % иммунной сыворотки образуют нежную капсулу.
Культуральные свойства. Аэробы. Требовательны к питательным средам: на простых питательных средах не растут, растут на сложных питательных средах (сыво-роточно-декстрозный и кровяной агар).
Характеризуются замедленным ростом на питательных средах, посевы инкубируют не менее 3 недель. В жидких средах вызывают равномерное помутнение с небольшим осадком, но без пленки на поверхности. На плотных средах формируют мелкие круглые выпуклые гладкие прозрачные голубовато-серые колонии. Гемолиза не дают, пигмента не образуют. Наблюдается диссоциация от S- к R-формам колоний. В гладкой форме некоторые штаммы бруцелл лизируются бруцеллезным фагом. Температурный оптимум роста — 37 °С, оптимум рН 6,6—7,4. Под действием антибиотиков превращаются в L-формы. Хорошо культивируются в желточном мешке куриного эмбриона.
Биохимическая активность. Очень низкая: содержат каталазу и оксидазу, нитраты редуцируют в нитриты, цитраты не утилизируют, реакция Фогеса—Проскауэра отрицательна, продуцируют сероводород. Дифференциально-диагностические признаки бруцелл представлены в табл. 16.20.
Антигенная структура. Сложная и близкая для разных видов бруцелл. Имеют соматический О- и капсульный антигены. Различные виды бруцелл различаются количественным соотношением А- (абортус) и М- (мелитен-зис) антигенов.
Факторы патогенности. Бруцеллы являются факультативными внутриклеточными паразитами млекопитающих, включая человека. Обладают высокой инвазивной способностью, образуют фермент агрессии гиалурони-дазу. Основными факторами вирулентности являются эндотоксин и капсула.
Устойчивость в окружающей среде и к антимикробным препаратам. Бруцеллы длительно сохраняются в окружающей среде: в молоке — до 45 дней; в масле, сливках, простокваше и свежих сырах — в течение всего периода их пищевой ценности; в брынзе — до 60 дней; в замороженном мясе — свыше 5 мес, в засоленных шкурах — 2 мес, в шерсти — до 3-4 мес, в воде — до 5 мес; в почве — до 3 мес Малоустойчивы к высокой температуре, при кипячении погибают моментально, при 60 °С — в течение 30 мин.
Чувствительны к большинству антибиотиков; к действию обычно применяемых анти-
септиков и дезинфектантов в обычных концентрациях.
Эпидемиология. Резервуаром возбудителя в природе являются сельскохозяйственные и домашние животные — крупный и мелкий рогатый скот, свиньи, реже — олени, лошади, собаки, кошки.
Бруцеллез распространен на всех континентах, особенно в странах с развитым животноводством. Источник инфекции — больные сельскохозяйственные и домашние животные. Возбудителями бруцеллеза крупного рогатого скота являются В. abortus, мелкого рогатого скота — В. melitensis, свиней — В. suis, оленей — В. neotome, собак — В. canis, баранов — В. ovis. Наибольшее эпидемическое значение для человека имеют В. melitensis, В. abortus и В. suis. Больной человек не заразен, является биологическим тупиком. Как для всех зоонозов, для бруцеллеза характерна множественность механизмов и путей передачи. Больные животные выделяют бруцеллы с молоком, мочой, калом, околоплодными водами и др. Человек заражается главным образом фекально-ораль-но пищевым путем (сырое молоко, молочные продукты, мясо и др.) и контактно при уходе за больными животными и т. п. Восприимчивость человека к бруцеллам высокая. Заболевания носят спорадический характер или в виде отдельных вспышек, что зависит от видовой принадлежности возбудителей.
Патогенез. Бруцеллы проникают в организм через кожу или слизистые оболочки и распространяются по лимфатическим путям. В отличие от туляремии, сибирской язвы, при бруцеллезе на месте внедрения не развивается первичный аффект. Иногда наблюдается увеличение регионарных лимфатических узлов. Дальнейшая судьба возбудителя зависит от ряда факторов: вирулентности, величины инфицирующей дозы, иммунореактивности организма. При попадании в организм больших доз вирулентных бруцелл очень быстро может наступить диссеминация возбудителя. При малых инфицирующих дозах и при пониженной вирулентности бруцеллы могут длительно задерживаться в регионарных лимфатических узлах, фаза генерализации запаздывает или вообще отсутствует. В основе развивающихся в ранний период бруцеллеза диффузных изменений сосудов и паренхиматозных органов лежит токсическое действие бруцелл. Из кровотока бруцеллы оседают в воспалительных очагах,
лимфатических узлах, селезенке и костном мозге, где длительно могут сохраняться, располагаясь внутрик-леточно. При обострениях процесса бруцеллы вновь усиленно размножаются, попадают в кровоток, вызывая повторные волны генерализации. Длительное пребывание возбудителя в организме приводит к его аллергизации. Со 2—3-й недели, а иногда и с самого начала заболевания на первый план в патогенезе выдвигаются аллергические поражения. Аллергия при бруцеллезе играет двоякую роль. С одной стороны, аллергическое воспаление лежит в основе большинства клинических проявлений болезни, особенно в хронической стадии. С другой стороны, аллергическая реакция препятствует распространению бруцелл в организме, что имеет большое значение для предупреждения повторных генерализаций процесса.
Клиника. Инкубационный период колеблется в пределах 1—3 недель, но может затягиваться и до нескольких месяцев. Болезнь начинается постепенно, иногда — остро. Болезнь протекает с длительной лихорадкой, ознобами, потливостью, болями в суставах, мышцах, с симптомами поражения сердечнососудистой, нервной, мочеполовой систем, опорно-двигательного аппарата и т. д. Клиника бруцеллеза характеризуется большим полиморфизмом и зависит от характера пораженного органа. Выделяют острый (с давностью до 3 мес), подострый (с давностью до 6 мес), хронический (с давностью свыше 6 мес.) и латентный бруцеллез. При хроническом бруцеллезе возможны состояния компенсации, субкомпенсации и декомпенсации. Хронический бруцеллез может быть первично-хронический или вторично-хронический; то же относится и к латентному бруцеллезу.
Иммунитет при бруцеллезе клеточно-гумо-ральный, в основном нестерильный и относительный. После выздоровления иммунитет угасает, возможна реинфекция. Ввиду относительности иммунитета, большие инфицирующие дозы бруцелл могут вызвать его прорыв у больных хроническим или латентным бруцеллезом, что ведет к тяжелому течению болезни.
Микробилогическая диагностика. Материалом для исследования служат: кровь, пунктат красного костного мозга, моча, испражнения, молоко и молочные продукты, кусочки органов.
Для диагностики бруцеллеза используют все методы микробиологической диагностики. Серодиагностику и аллергические пробы проводят в базовых лабораториях, чистую культуру бруцелл выделяют и идентифициру-
ют в специальных лабораториях с соблюдением правил техники безопасности.
Посев крови для выделения гемокультуры проводят в первые дни болезни при наличии лихорадки; при отрицательных результатах исследование многократно повторяют (бактериемия может наблюдаться в течение года и более). Учитывая медленный рост бруцелл, посевы выдерживают в термостате до 1 мес. Пунктат костного мозга засевают на те же среды; миелокультуры при бруцеллезе удается получить в 1,5—2 раза чаще, чем гемокуль-туру. Миелокультуры могут быть получены в остром, под остром и даже хроническом периоде заболевания. Мочу для выделения урино-культуры предварительно центрифугируют, из осадка делают посевы. Уринокультуры выделяют как при остром бруцеллезе, так и в период реконвалесценции. Процент высеваемости невелик и зависит от периода заболевания (5—14%). Аналогичным образом поступают с молоком. Копрокультуры выделяют крайне редко. Нередко культура бруцелл выделяется из желчи. Незначительный процент положительных результатов дают бактериологические исследования мокроты, суставной жидкости, влагалищных выделений и др. Наибольшую высеваемость бруцелл, особенно из бактериально загрязненного материала, получают при посевах исследуемого материала в желток свежего куриного яйца или в желточный мешок куриного эмбриона. Зараженные яйца выдерживают в термостате 5 дней, а затем делают высев на питательные среды.
Для биопробы используют белых мышей и морских свинок. Животных заражают кровью внутрибрюшинно; осадком мочи и молока — подкожно. Через 20—30 дней у зараженного животного берут кровь и ставят с ней реакцию агглютинации. Затем животных забивают, вскрывают и делают посевы крови из сердца, взвеси внутренних органов и лимфатических узлов. Выделенные чистые культуры бруцелл дифференцируют по способности роста в отсутствие повышенной концентрации углекислого газа, выделению сероводорода, чувствительности к бруцеллезному фагу и бактериостатическому действию анилиновых красителей (фуксина и тионина). Преимуществом биологического метода ис-
следования является возможность выделения бруцелл из материалов, контаминированных посторонней микрофлорой или содержащих небольшое количество возбудителей.
В сыворотке больных бруцеллезом накапливаются агглютинирующие (вначале IgM, затем IgG), неполные блокирующие (IgA, IgG) и опсонические (IgG) антитела. Для их выявления с диагностической целью используют реакцию Райта (развернутая агглютинация) и Хеддельсона (пластинчатая агглютинация), РПГА, РИФ, ИФА, реакцию Кумбса, опсо-нофагоцитарную реакцию. Реакция агглютинации — один из основных диагностических методов при бруцеллезе у людей и сельскохозяйственных животных. Агглютинины, как правило, появляются в крови в ранние сроки после заражения, поэтому наибольшую диагностическую ценность реакция агглютинации представляет при остром бруцеллезе. РСК также является специфической для бруцеллеза, она появляется позже, чем реакция агглютинации, но держится дольше, что повышает ее диагностическую ценность у больных хроническим бруцеллезом. Гемагглютинирующие антитела в РПГА можно обнаружить в 91—100 % случаев у больных острым и подострым бруцеллезом; при хроническом бруцеллезе и резидуальных явлениях гемагглютинины обнаруживаются реже, однако значительно чаще, чем агглютинины. РИФ выявляет антитела в сыворотке при остром, подостром и хроническом бруцеллезе чаще, чем реакция агглютинации. Реакция Кумбса рекомендуется в качестве диагностического метода при хронических и латентных формах бруцеллеза. Опсонофагоцитарную реакцию проводят с 15—20-го дня болезни. Она основана на способности сегментоядерных нейтрофилов фагоцитировать бруцеллы благодаря наличию в крови человека специфических опсонинов, нарастающих в процессе бруцеллезной инфекции. Реакция специфична и чувствительна, однако не отражает количества опсонинов в крови. В условиях массового обследования на бруцеллез применяют пластинчатую реакцию агглютинации Хеддельсона в сочетании с кожно-аллергической пробой Бюрне. Рекомендуется определять состав сывороточных иммуноглобулинов в различные фазы заболевания. В ранние сроки после заражения появляются IgM, в более
поздние — IgG. Эти иммуноглобулины дифференцируют с помощью цистеиновой пробы.
Аллергический метод применяют для выявления ГЗТ к бруцеллам, наблюдающейся у больных бруцеллезом, инфицированных бру-целлами лиц и привитых живой бруцеллезной вакциной. Ее ставят с 15-20-го дня болезни. Аллергическая реакция бывает положительной в течение многих лет после перенесенного заболевания и у привитых. Серологические реакции и кожно-аллергическая проба по своему диагностическому значению не равноценны, вследствие чего не могут заменить друг друга. Это обуславливает необходимость применения комплексного сероаллергичес-кого метода, являющегося наиболее надежным способом диагностики бруцеллеза.
Лечение. При остром и хроническом бруцеллезе с выраженными признаками активности необходимо назначение антибиотиков широкого спектра. Наиболее эффективно сочетание стрептомицина с препаратами широкого спектра действия. Антибиотики не действуют на бруцеллы, расположенные внутриклеточ-но, поэтому их можно назначать только при наличии бактериемии, а при хроническом бруцеллезе они неэффективны. Кроме того, антибиотики не предупреждают рецидивов бруцеллеза, поэтому широко применяется специфическая иммунотерапия убитой лечебной бруцеллезной вакциной (5—7 внутривенных вливаний в нарастающих дозах 1—2 раза в неделю) или бруцеллина (внутримышечно по 2 раза в неделю). При острых и рецидивирующих формах назначают бруцеллезный иммуноглобулин.
Профилактика. Направлена на ликвидацию источника инфекции; на разрыв механизма и путей передачи инфекции и на создание невосприимчивости коллектива. Для специфической профилактики применяют живую бруцеллезную вакцину, предложенную П. А. Вершиловой, из штамма ВА-19А, полученную из В. abortus и создающую перекрестный иммунитет против других видов бруцелл. Вакцинацию проводят по эпидпоказаниям. Не специфическая профилактика такая же, как и при других зоонозах, и сводится в основном к санитарно-ветеринарным мероприятиям.
16.3.3. Франциселлы (род Francisella)
Francisella tularensis является возбудителем туляремии — острого или хронического системного природно-очагового заболевания человека и животных, которое характеризуется лихорадкой, интоксикацией и поражением лимфатических узлов.
Возбудитель туляремии Francisella tularensis был открыт в местечке Туляре (Калифорния) в 1911 г. Г. Мак-Коем и X. Чепином; детально изучен Э. Френсисом. Выделяют 3 подвида, отличающихся по антигенным свойствам и вирулентности: голарктический, распространенный в Европе, Азии и Северной Америке, умеренно патогенный для домашних кроликов; среднеазиатский, распространенный в долинах рек Средней Азии, умеренно патогенный для домашних кроликов; неарктический, или американский, распространенный в Северной Америке, высокопатогенный для домашних кроликов. Голарктический подвид делится на биовары: японский, распространенный на Японских островах; эритроми-циночувствительный, распространенный в Европе, Азии, Северной Америке и чувствительный к антибиотикам-макролидам; эритромицинустойчивый, распространенный в Восточной Европе и Западной Сибири.
Морфология. Возбудитель туляремии представляет собой очень мелкие (0,3—0,5 мкм) полиморфные грамотрицательные палочки; спор не образует, неподвижен, может образовывать капсулу.
Культуральные свойства. Факультативный анаэроб. На простых питательных средах не растет. Культивируются на желточных средах (среда Мак-Коя или Чепина) или на средах с добавлением крови и цистеина (среда Френсиса). Оптимальная температура роста 37—38 С, оптимум рН 6,8—7,4. На плотных средах образует мелкие колонии молочно-белого цвета. Хорошо культивируется в желточном мешке куриного эмбриона. При культивировании на искусственных питательных средах происходит аттенуация бактерий и превращение их из вирулентной S-формы в авирулентную и неиммуногенную R-форму.
Вакцинные штаммы бактерий представляют собой промежуточную форму изменчивости, которую обозначают как SR-вариант.
Биохимическая активность. Очень низкая, ферментируют до кислоты глюкозу и мальтозу; непостоянно ферментируют маннозу, левулезу, образуют сероводород.
Антигенная структура. Содержит соматический О- и поверхностный Vi-антигены. Имеют антигенную близость с бруцеллами. В R-фор-ме теряют Vi-антиген, а вместе с ним вирулентность и иммуногенность.
Факторы патогенности. Неарктический подвид обладает высокой патогенностью для человека при кожном пути заражения, голарктический и среднеазиатский подвиды умеренно патогенны. Вирулентными являются S-формы колоний. Патогенные свойства связаны с оболоченным антигенным комплексом и токсическими веществами типа эндотоксина. Возбудитель патогенен для млекопитающих многих видов, особенно для мелких грызунов и зайцев. Из лабораторных животных к нему высокочувствительны морские свинки и белые мыши.
Экологическая ниша. Резервуаром возбудителя в естественных условиях являются дикие животные (около 50 видов), главным образом мелкие грызуны и зайцы; среди домашних животных — овцы, свиньи, крупный рогатый скот.
Устойчивость в окружающей среде. В окружающей среде бактерии могут долго сохраняться, особенно при низкой температуре. Они нестойки к высоким температурам и УФ-лучам. При 60 °С гибнут через 5-10 мин, а при кипячении — через 1—2 мин. При 0— 4 °С сохраняются в воде и фураже до 6 мес. Чувствительны к большинству антибиотиков (стрептомицин, тетрациклин, левомицетин, эритромицин и др.). Высокочувствительны к действию обычно применяемых антисептиков и дезинфектантов (лизол, хлорамин убивают их через 3—5 мин).
Эпидемиология. Туляремия — природно-очаговое заболевание. Источником инфекции в естественных условиях являются главным образом мелкие грызуны (полевые мыши, водяные крысы, ондатры, хомяки) и зайцы. На территории природных очагов туляремией могут заражаться овцы, свиньи, крупный
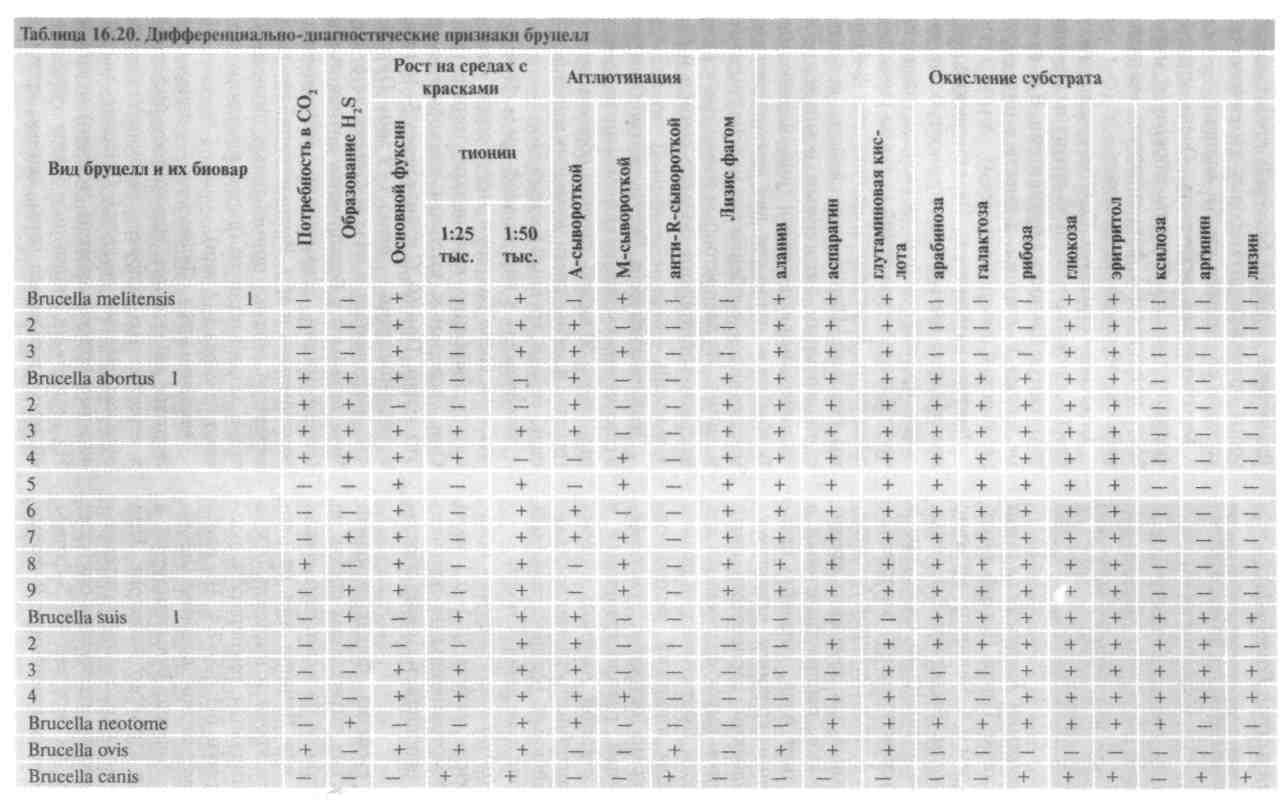
Туляремия распространена в Европе, в том числе в России, а также в Азии, Северной Америке; встречается в виде спорадических случаев или эпидемических вспышек. Болеют чаще жители сельской местности и лица, имеющие профессиональный контакт с грызунами (сельскохозяйственные работы, охота и т. д.).
Патогенез. Возбудитель туляремии попадает в организм человека через кожу, слизистые оболочки глаз, дыхательных путей, желудочно-кишечного тракта. В патогенезе туляремии выделяют несколько фаз: внедрение и первичная адаптация возбудителя, лимфогенное распространение, первичные регионарно-очаговые и общие реакции организма, гематогенные метастазы и генерализация процесса, вторичные очаги, реактивно-аллергические изменения, обратный метаморфоз и выздоровление. Ведущее значение в патогенезе имеет фаза лимфогенного распространения возбудителя. В месте его внедрения нередко развивается первичный аффект с регионарным первичным лимфаденитом. Периаденит выражен умеренно. Микроб и его токсины проникают в кровь, что приводит к бактериемии и генерализации процесса, метастазированию и развитию вторичных туляремийных бубонов.
Иммунитет. После перенесенной инфекции сохраняется длительно, иногда пожизненно; развивается аллергизация организма к антигенам возбудителя.
Клиника. Инкубационный период длится от нескольких часов до 3 недель, в среднем 3-7 дней. Болезнь начинается остро, внезапно, без продрома с повышения температуры тела до 38—39 °С; появляется озноб, резкая головная боль, интоксикация. Клиническая картина обусловлена характером пораженных органов. Различают бубонную, язвенно-бубонную, глазо-бубон-ную, абдоминальную, легочную и генерализованную (септическую) клинические формы туляремии. Болезнь протекает длительно (около месяца). Летальность при заражении неарктическим подвидом — около 6 %; при заражении другими подвидами — 0,1 % и ниже.
Микробиологическая диагностика. Материал для исследования — кровь, пунктат из бубона,
соскоб из язвы, отделяемое конъюнктивы, налет из зева, мокрота и др. — определяется кчиничес-кой формой болезни. Кроме того, на исследование можно брать воду и пищевые продукты. В природных очагах туляремии проводят плановые систематические исследования для выделения возбудителя туляремии от грызунов.
Для диагностики применяют все методы микробиологической диагностики. Исследование проводят в режимных лабораториях.
Бактериологический метод в диагностике туляремии у человека редко дает положительные результаты. Чистую культуру, как правило, выделяют после накопления ее на восприимчивых лабораторных животных. Для биопробы применяют белых мышей и морских свинок. Мышей заражают подкожно, морских свинок — внутрибрюшинно; животные погибают на 3—6-е сутки, иногда позднее. Зараженных животных содержат в особых условиях (как при диагностике чумы) и наблюдают за ними в течение 6—14 дней. Если экспериментальные животные на протяжении 7—15 дней не погибают, их забивают на 15-20-й день и трупы вскрывают. При наличии туляремии обнаруживают пато-логоанатомические изменения в виде продуктивного процесса с некрозом. Чистую культуру выделяют из внутренних органов на желточной среде, глюкозоцистеиновом кровяном агаре, среде Емельяновой и др. При идентификации опираются на морфологию и тинкториальные свойства возбудителя, отсутствие роста на МПА, агглютинацию гомологичной сывороткой, па-тогенность для белых мышей и морских свинок. Чистую культуру можно выделить, заражая 12-дневные куриные эмбрионы в желточный мешок. Для выделения чистой культуры возбудителя из воды последнюю центрифугируют или фильтруют через бактериальные фильтры и полученным осадком заражают лабораторных животных. При исследовании пищевых продуктов их промывают мясопептонным бульоном — МПБ, цетрифугируют и осадком заражают лабораторных животных.
Параллельно с бактериологическим исследованием из исследуемого материала готовят мазки-отпечатки, которые окрашивают по Романовскому—Гимзе. В мазках из органов можно обнаружить мелкие кокковидные и палочковидные бактерии, которые распола-
гаются внутриклеточно и в виде скоплений, образуя нежную капсулу.
Для серодиагностики используют развернутую реакцию агглютинации, РПГА, РСК на холоде, РИФ.
Аллергические пробы применяют для ранней диагностики туляремии (с 5-го дня от начала болезни). Используют два вида тулярина и, соответственно, 2 способа их введения: накожный и внутрикожный. Так как концентрация аллергена в обоих видах тулярина различная, недопустимо использовать накожный тулярин для внутрикожной пробы и наоборот. Результаты аллергической реакции учитывают в динамике через 24—36—48 ч. За положительный результат принимают инфильтрат диаметром не менее 5 мм. У вакцинированных или переболевших туляремией лиц в течение ряда лет аллергические пробы остаются положительными (анамнестическая реакция).
Лечение. Применяют антибиотики стрепто-мицинового и тетрациклинового ряда. В случаях затяжного течения заболевания проводят комбинированную антибиотикотерапию и вакцинотерапию с применением убитой лечебной вакцины, которая вводится различными путями в дозах от 1 до 15 млн микробных тел с интервалом 3—6 дней. Курс лечения 6— 10 инъекций.
Профилактика. Проводится в направлении всех трех звеньев эпидемического процесса: мероприятия 1 -й группы направлены на источник инфекции; мероприятия 2-й группы — на разрыв механизма и путей передачи; мероприятия 3-й группы — на восприимчивый коллектив. Для специфической профилактики применяют живую туляремийную вакцину, полученную отечественными учеными Б. Я. Эльбертом и Н. А. Гайским из штамма № 15. Вакцина обеспечивает прочный иммунитет при заражении европейским и голарктическим подвидами и эффективна против американской разновидности возбудителя. Вакцинацию проводят по эпидемическим показаниям, а также лицам, относящимся к группам риска. Допускается одновременная вакцинация против туляремии и бруцеллеза; туляремии и чумы; а также против туляремии и некоторых других инфекций.
Не специфическая профилактика такая же, как при других зоонозах, и направлена, в первую очередь, на борьбу с грызунами.
16.3.4. Легионеллы (род Leogionella)
Болезнь легионеров (син. питтсбургская пневмония, лихорадка Понтиак, лихорадка Форт-Брагг) — группа инфекционных болезней, вызываемых Legionella pneumophila, характеризующихся поражением респираторного тракта, развитием тяжелых пневмоний и сопровождающихся нарушениями со стороны ЦНС и почек.
Болезнь получила название в связи со вспышкой среди участников съезда организации «Американский легион» в 1976 г. в г. Филадельфии (США).
Морфологические и культуральные свойства. Возбудитель был открыт в 1977 г. Д. Мак-Дейдом и С. Шепардом; отнесен к семейству Legionellaceae роду Legionella и является наиболее важным представителем этого рода.
Легионеллы — грамотрицательные палочки размером 2/3*0,5/0,7 мкм, иногда встречаются нитевидные формы до 20 мкм; подвижны, имеют жгутики и фимбрии. Спор не образуют. Характерно наличие внутренней и внешней мембран; полисахаридная капсула отсутствует; имеют внутриклеточные жировые вакуоли, а также множество рибосом. Нуклеоид диффузно распределен в цитоплазме. Геномная ДНК имеет молекулярную массу 2,5х109 Да, что соответствует примерно 3000 генов. Аэробы. Требовательны к условиям культивирования. Растут при определенном наборе аминокислот, ростовых факторов, рН среды и температуры на искусственных питательных средах (угольно-дрожжевом агаре). Легионеллы являются факультативными внутриклеточными паразитами, поэтому растут в желточном мешке куриных эмбрионов, в культуре клеток животных и человека (фибробласты легкого человека). Время генерации составляет 2—4 ч, характерно высокое накопление возбудителя (до 10^12-10^13мк/мл).
На плотной среде через 3—5 суток образуют характерные колонии с коричневым пигментом, диффундирующим в агар.
Легионеллы имеют сложную ферментативную систему: набор протеолитических ферментов, эстераз, гликолитических ферментов.
Ферментативная активность зависит от среды культивирования и условий обитания.
Антигенность и вирулентность. Антигенная структура достаточно сложная, основными антигенами являются типо- и группоспецифи-ческие. По антигенам у легионелл выделяют не менее 8 серогрупп. Имеется антигенное родство между L. pneumophila и Chlamydia psittaci.
Факторами патогенности являются термостабильный белково-полисахаридный эндотоксин, проявляющийся гемолитической активностью, и цитолизин, обладающий ци-тотоксическим, а также протеолитическим действием.
Резистентность. Легионеллы устойчивы к действию физических и химических факторов. Устойчивость к большинству дезинфек-тантов такая же, как у неспорообразующих бактерий. Чувствительны к УФ-облучению, а также к антибиотикам (рифампицин, эритромицин, тетрациклин и др.). В водопроводной воде и водоемах выживают до одного года.
К легионеллам чувствительны морские свинки, белые мыши, обезьяны (гамадрилы, макаки).
Патогенез и клиника. Входные ворота инфекции — дыхательные пути. Возбудитель вызывает пневмонию, т. е. воспалительно-некротическое воспаление, захватывающее бронхиолы и альвеолы. При гибели бактерий высвобождается эндотоксин, который вызывает интоксикацию, обуславливает системное поражение с дыхательной и почечной недостаточностью, энцефалопатией, нарушениями деятельности сердечно-сосудистой системы.
Инкубационный период — от 2 до 10 дней. Выделяют три клинические формы легио-неллеза: 1) болезнь легионеров, протекающую с тяжелой пневмонией; 2) лихорадка Понтиак — респираторное заболевание без пневмонии; 3) лихорадка Форт-Брагг — острое лихорадочное заболевание с экзантемой.
Заболевание начинается остро, протекает с повышенной до 40 °С температурой, ознобом, головными болями, кашлем с мокротой (иногда с примесью крови), недомоганием, диареей и другими симптомами. Иногда развивается инфекционно-токсический шок со смертельным исходом. Летальность при леги-онеллезе достигает 20 %.
Эпидемиология. Легионеллы распространены повсеместно, обитают в естественных и искусственных водоемах, часто паразитируют в амебах. Наибольшее эпидемиологическое значение имеет наличие возбудителя в системах водоснабжения и кондиционирования воздуха. Поступление возбудителя в организм происходит при вдыхании водных аэрозолей, образующихся в душевых, в кондиционерах, в ваннах. Заболевание чаще встречаются в летне-осенние месяцы, от больного человека здоровому не передается. Легионеллез зарегистрирован в странах Европы, в том числе в России и в США.
Заболевания животных и птиц неизвестны.
Иммунитет. Иммунитет после перенесенного заболевания носит выраженный клеточный характер, штаммоспецифичен. Антитела и фагоцитоз большой роли не играют.
Микробиологическая диагностика. Поскольку клиническая диагностика легионеллеза сложна, решающими при постановке диагноза являются данные микробиологических и серологических исследований: обнаружение на 2—10-е сутки антигенов в крови и в моче (в ИФА, РИА и других методах с помощью моно-клональных антител), обнаружение через 1-3 недели антител в крови (ИФА). Применяют генодиагностику (ПЦР), а также выявление возбудителя в мокроте, слизи, биоптатах. Для посева материала обычно используют среду Мюллера—Хинтона с добавлением солей железа и L-цистеина. Можно использовать биопробу на морских свинках или белых мышах.
Лечение. Применяют антибиотики: эритромицин в сочетании с рифампицином. Могут применяться фторхинолоны.
Профилактика. Специфическая профилактика не разработана. Меры неспецифической санитарно-гигиенической профилактики сводятся в основном к гигиеническому содержанию, периодической очистке кондиционеров, душевых установок, выявлению водного резервуара возбудителей и его оздоровлению.
16.3.5. Бартонеллы (род Bartonella)
Бартонеллы объединяют группу грамотри-цательных факультативно-аэробных внутриклеточных бактерий, нуждающихся для своего роста в гемине или продуктах расщепления
эритроцитов. Бартонеллы вызывают ряд болезней, именуемых бартонеллезами.
Возбудители бартонеллезов выделены в отдельные семейство Bartonellaceae подгруппы альфа-2 протеобактерий, включающее 12 видов, 5 из которых патогенны для человека.
Морфологические и культуральные свойства. Бартонеллы — короткие палочки размером 0,34-0,5x1*3 мкм, иногда кокковидной формы. Грамотрицательны, по Романовскому—Гимзе окрашиваются в красно-фиолетовый цвет. Для В. henselae и В. bacilliformis характерно наличие 1—4 жгутиков, имеются пили. Бактерии имеют трехслойную клеточную стенку, состоящую из 12 протеинов (молекулярная масса 28—174 кДа); размер генома невелик.
Внутриклеточные паразиты, размножаются простым делением в эритроцитах и клетках системы моноцитарных фагоцитов, эндоте-лиальных клетках; требовательны к условиям культивирования. Растут на питательных средах, содержащих кровяной агар, могут культивироваться в РКЭ, в платяных вшах, кошачьих блохах. Оптимальная температура 26-37 "С.
Бартонеллы чувствительны к действию обычных дезинфектантов.
Факторы патогенности. Плохо изучены. Известно, что внедрение бартонелл в клетку происходит с помощью адгезинов, т. е. протеинов внешней мембраны. На месте внедрения иногда возникает «первичный аффект» (например, при болезни кошачьих царапин). Основными мишенями бартонелл являются эритроциты и эндотелиальные клетки. В местах прикрепления бартонелл к чувствительным клеткам формируются скопления (кластеры) микроорганизмов, возникает воспалительная реакция с разрастанием клеток эндотелия и прилегающих тканей. Часть клеток эндотелия подвергается некрозу. В результате этого процесса развивается ангиоматоз или лимфоаде-нопатия с поражением костномозговых клеток и эритроцитов. Бактерии при этом могут быть обнаружены в эритроцитах и клетках эндотелия сосудов, селезенки, лимфатических узлах, печени, костного мозга, кожи.
Эпидемиология, клиника и диагностика. Человек высоковосприимчив к некоторым видам бартонелл. Резервуаром и источни-
ком возбудителя является больной или носитель, иногда — обезьяны. Механизм передачи, трансмиссивный или парентеральный.
Бартонеллез широко распространен, встречается в Южной и Северной Америке, а также в Европе, в том числе в России. Клиника болезней, вызываемых бартонеллами, крайне разнообразна — от легких местных расстройств лимфо- и кровообращения (болезнь кошачьих царапин, лимфоаденопатия, бациллярный ангиоматоз кожи) до более тяжелых острых, часто рецидивирующих (траншейная лихорадка) или длительно текущих болезней (пурпурный гепатит, эндокардит, перуанская бородовка и др.). Наиболее злокачественно протекает лихорадка Оройя, при которой смертность достигает 40 %.
После перенесенного заболевания остается иммунитет.
Диагноз ставится на основании клинико-эпидемиологических данных и подтверждается микробиологическими методами. Применяют микроскопию, мазки крови, окрашенные по Романовскому—Гимзе, посев крови на среды с кровяным агаром, заражение РКЭ, культур клеток, а также серологические методы (РСК, РПГА, ИФА, ПЦР).
Лечение и профилактика. Прогноз зависит от формы бартонеллеза. Лечение — антибиотиками (группа тетрациклина, макролиды, фторхинолоны), а также другими антибкате-риальными препаратами (новарсенол).
Специфическая профилактика не разработана. Неспецифические меры борьбы сводятся к уничтожению переносчиков (москиты, вши, блохи, клещи), устранению контактов с больными, санации домашних животных (кошек).
Возбудитель болезни кошачьих царапин (син. лимфоретикулез доброкачественный). Известен в США, Франции и России. Возбудитель В. henselae назван в честь Д. Хенсель, выделившей возбудителя.
Заражение человека происходит контактным путем, через повреждения кожи или конъюнктиву глаза. Инкубационный период 3—12 суток. Проявляется в виде одиночных или группы папул или папулопустул на месте царапин или укуса кошки с последующим развитием лимфаденита и нарушением обще-
го самочувствия. Возможно заражение через укус кошачьих блох.
Лечение — антибиотиками. Прогноз благоприятный.
Возбудитель окопной или траншейной лихорадки (син. волынская лихорадка и др.). Возбудитель B.quintana. Острая форма барто-неллеза, отличается полиморфностью клинического проявления с острым началом (температура 39—39,5 °С), нарушением общего самочувствия, появлением розеолезной сыпи (у 20—80 %). Возможны повторные приступы лихорадки и рецидивы.
Заражение — трансмиссивно платяными вшами через расчесы. Заболевание неконтагиозно. Инкубационный период 10—14 суток. Прогноз благоприятный. Диагноз ставится на основании клинико-эпидемиологических данных, а также обнаружения антигенов и антител в крови постановкой ПЦР. Иммунитет непродолжительный. Лечение — антибиотиками.
Возбудитель болезни Карриона {В. bacil-liformis). Болезнь распространена в Южной Америке (Перу, Эквадор, Колумбия и др.). Выделяют две формы: 1) острая, протекающая с высокой температурой, резко выраженной анемией и летальностью до 40 %, известная как лихорадка Оройя; 2) кожная форма, развивающаяся спустя 1—2 мес. после острой формы с формированием на коже и слизистых оболочках сыпи и множественных кровоточащих папул, в силу чего болезнь получила название перуанской бородавки.
Тождество двух форм болезни доказано студентом медицинского факультета г. Лимы Д. Каррионом (в опыте самозаражения), по имени которого и названо заболевание.
Переносчиками инфекции являются москиты. Инкубационный период 17—21 сутки. Резервуар возбудителя — мышевидные грызуны. Заболевание неконтагиозно. После перенесенного заболевания остается пожизненный иммунитет.
Клинико-эпидемиологический диагноз подтверждается выявлением бартонелл в крови и серологическими реакциями.
Лечение — антибиотиками.
Возбудитель бациллярного гепатита. Заболевание протекает с преимущественным поражением паренхимы печени, вследствие бациллярного поражения мелких сосудов печени (фор-
мирования в них кист), что ведет к застойным явлениям в этом органе. Развивается гепатосп-леномегалия, анемия, тромбоцитопения.
Диагноз подтверждается микроскопическим исследованием препаратов.
16.3.6. Аэробные неферментирующие грамотрицательные палочки
Группа аэробных неферментирующих бактерий включает оксидазаположительные грамотрицательные палочки, окисляющие, а не ферментирующие углеводы (см. ниже). К неферментирующим относят представителей родов Pseudomonas, Burkholderia, Alcaligenes, Eikenella, Flavobacterium, Kingella, Moraxella и некоторые другие. Многие из этих бактерий хорошо растут на простых питательных средах и в норме обитают в окружающей среде (почве, воде, на растениях), а также обнаруживаются в организме человека. В то же время они являются возбудителями оппортунистических инфекций человека и животных.
16.3.6.1. Псевдомонады (род Pseudomonas)
Таксономическое положение. Современная классификация псевдомонад основана на методах молекулярной гибридизации и куль-туральных особенностях микроорганизмов. Некоторые бактерии рода Pseudomonas сравнительно недавно получили новое наименование — Burkholderia.
Род Pseudomonas включает вид Pseudomonas aeruginosa — синегнойную палочку, возбудитель многих ГВЗ; род Burkholderia — виды Burkholderia (Pseudomonas) mallei — возбудитель сапа и Burkholderia (Pseudomonas) pseudomallei — возбудитель, вызывающий мелиоидоз и другие.
Pseudomonas aeruginosa (синегнойная палочка)
А. Люкке в 1862 г. было впервые описано нагноение раны с характерным сине-зеленым окрашиванием повязок, вызванное синегнойной палочкой. В чистой культуре Pseudomonas aeruginosa была выделена лишь в 1882 г. С. Жессаром.
Морфологические и тинкториальные свойства. P. aeruginosa относится к семейству Pseudomonadaceae. Это грамотрицательные прямые палочки размером 1—3 мкм, расположенные одиночно, попарно или в виде коротких цепочек. Синегнойные палочки под-
вижны за счет наличия одного, редко двух полярно расположенных жгутиков. Спор не образуют, имеют пили (фимбрии). При определенных условиях могут продуцировать капсулоподобную внеклеточную слизь поли-сахаридной природы. Встречаются также, так называемые, мукоидные штаммы, образующие повышенное количество слизи. Такие бактерии выделяются чаще всего из мокроты больных муковисцидозом.
Культуральные свойства. Все псевдомонады — облигатные аэробы, которые хорошо растут на простых питательных средах. Возбудитель довольно часто находится в патологическом материале в ассоциации с другими микроорганизмами, поэтому для выделения чистой культуры синегнойной палочки применяют селективные или дифференциально-диагностические питательные среды с добавлением антисептиков — малхитовый агар с добавлением бриллиантового зеленого или ЦПХ-агар с ацетамидом или N-цетипиридоний хлоридом. Оптимальная температура роста 37 °С, однако синегнойная палочка способна расти при 42 °С, что позволяет отличать ее от других псевдомонад. На жидкой питательной среде бактерии образуют характерную серовато-серебристую пленку на поверхности. Колонии синегнойной палочки гладкие округлые, суховатые или слизистые (у капсульных штаммов). Культуры синегнойной палочки, выделенные от больных муковисцидозом, продуцируют мукоидные колонии вследствие избыточной продукции альгината и экзополисахаридов. На кровяном агаре вокруг колоний синегнойной палочки наблюдаются зоны гемолиза.
При культивировании на плотных питательных средах P. aeruginosa продуцирует триметиламин, придающий культурам этих бактерий своеобразный сладковатый запах жасмина, земляничного мыла или карамели. Характерным биологическим признаком бактерий вида P. aeruginosa является способность синтезировать водорастворимые пигменты, окрашивающие в соответствующий цвет повязки больных или питательные среды при их культивировании. Чаще всего они вырабатывают феназиновый пигмент — пиоцианин сине-зеленого цвета, но могут образовывать и зеленый флюоресцирующий в УФ-лучах
пигмент флюоресцеин (пиовердин), а также красный (пиорубин), черный (пиомеланин) или желтый (alfa-оксифеназин).
Биохимические свойства. Синегнойная палочка обладает низкой сахаролитической активностью: не ферментирует глюкозу и другие углеводы, однако для получения энергии способна их окислять. Для дифференциальной диагностики, позволяющей отличать псевдомонады от других грамотрицательных палочек, применяют OF-тест (тест окисления-ферментации глюкозы) на среде Хью-Лейфсона. С этой целью делают посев чистой культуры псевдомонад в две пробирки с этой полужидкой или, иногда, жидкой средой. Одну пробирку инкубируют в аэробных условиях, другую — в анаэробных. Псевдомонады способны только окислять глюкозу (цвет индикатора меняется только в пробирке после аэробного инкубирования). P. aeruginosa восстанавливает нитраты в нитриты, редуцируя их до газообразного азота, а также обладает протеолитической активностью: разжижает желатину, гидролизует казеин. Синегнойная палочка имеет каталазу и цитохромоксидазу (псевдомонада оксидазапозитивны), участвующую в переносе электронов при дыхании.
Многие штаммы синегнойной палочки продуцируют бактериоцины, называемые пиоци-нами или пиоцианинами, — протеины, обладающие бактерицидными свойствами. Для эпидемиологического маркирования и внутривидовой идентификации P. aeruginosa проводят пиоцинотипирование штаммов, выделенных от больных и из окружающей среды. С этой целью определяют спектр продуцируемых исследуемым штаммом пиоцинов или чувствительность этого штамма к пиоцинам других псевдомонад.
Антигенные свойства. Синегнойная палочка имеет сложную антигенную структуру: у нее обнаружены О- и Н-антигены. Липополисахарид клеточной стенки является типо- или группо-специфическим термостабильным О-антиге-ном, на основе которого проводят серотипиро-вание штаммов P. aeruginosa. Термолабильный жгутиковый Н-антиген бывает двух типов и обладает протективным действием, поэтому на его основе созданы вакцинные препараты. На поверхности клеток синегнойной палочки обнаружены также антигены пилей (фимбрий).
Кроме того, P. aeruginosa продуцирует целый ряд внеклеточных продуктов, обладающих антигенными свойствами: экзотоксин А, протеа-зу, эластазу, внеклеточную слизь.
Факторы патогенности. P. aeruginosa обладает целым рядом факторов патогенности, которые вовлечены в патогенез синегнойной инфекции.
Факторы адгезии и колонизации. Адгезивные свойства бактерий определяются наличием пилей (фимбрий) на поверхности клеток P. aeruginosa. Синегнойная палочка обладает тропизмом к эпителию мочевого пузыря, респираторного тракта, конъюнктивы глаз. Экстрацеллюлярная слизь синегнойной палочки покрывает поверхность микробной клетки, но в отличие от капсулы, не имеет четких границ и легко выделяется во внешнюю среду. Гликолипопротеид, входящий в состав внеклеточной слизи P. aeruginosa, также принимает участие в процессе адгезии (преимущественно на муцине эпителия дыхательных путей). Это капсулоподобное вещество обладает антигенными и токсическими свойствами, защищает бактерии от фагоцитоза, участвует в развитии лейкопении. Мукоидные штаммы синегнойной палочки, продуцирующие большое количество слизи, обусловливают хроническое течение заболевания, в особенности при муко-висцидозе, остеомиелите, хроническом отите.
Токсины. Л ПС наружной мембраны клеточной стенки P. aeruginosa обладает свойствами эндотоксина и участвует в развитии лихорадки, олигурии, лейкопении у больных.
Экзотоксин А синегнойной палочки является цитотоксином, который вызывает глубокие нарушения клеточного метаболизма в результате подавления синтеза белка во всех клетках и тканях. Подобно дифтерийному токсину, он является АДФ-рибозизилтрансферазой, которая ингибирует фактор элонгации EF-2 и поэтому вызывает нарушение синтеза белка. Доказано, что он также подавляет синтез иммуноглобулинов, вызывает нейтропению. Экзотоксин А обладает высокой летальностью при введении его в очищенном виде животным. Например, при внутрибрюшинном введении мышам 0,1 мкг токсина они погибают через 40—50 ч после инъекции. Токсинообразование у различных штаммов синегнойной палочки контролиру-
ется структурным геном в составе хромосомы, а также регуляторным геном-репрессором при участии ионов железа. Экзотоксин А продуцируется в неактивной форме и активируется при участии различных ферментов внутри организма. Экзотоксин А является протективным антигеном: антитоксические антитела защищают клетки от его повреждающего действия, а также препятствуют развитию бактериемии и синегнойного сепсиса.
Экзоэнзим S (экзотоксин S) обнаруживается только у высоковирулентных штаммов синегнойной палочки. Механизм его повреждающего действия на клетки пока неясен, однако известно, что инфекции, обусловленные экзоэнзим S-продуцирующими штаммами синегнойной палочки, нередко заканчиваются летально. Экзотоксины А и S нарушают также активность фагоцитов.
Лейкоцидин является цитотоксином с выраженным токсическим воздействием на грану-лоциты крови человека.
Энтеротоксин и факторы проницаемости играют определенную роль в развитии местных тканевых поражений при кишечных формах синегнойной инфекции, вызывая нарушения водно-солевого обмена.
Ферменты агрессии. P. aeruginosa продуцирует гемолизины двух типов: термолабильную фосфолипазу С и термостабильный гликолипид. Фосфолипаза Сразрушает фосфолипиды в составе сурфактантов на альвеолярной поверхности легких, вызывая развитие ателектазов (бронхо-эктазов) при бронхолегочной патологии.
Нейраминидаза участвует в колонизации муцина респираторного тракта, поэтому играет важную роль в патогенезе бронхолегочных заболеваний синегнойной этиологии и муко-висцидоза.
Различные протеолитические ферменты (протеазы трех типов, эластаза), а также экзотоксин А вызывают геморрагии, деструкцию тканей и некроз в очагах поражения при инфекциях глаз, пневмониях, септицемии синегнойной этиологии. Эластаза синегнойной палочки расщепляет эластин, казеин, фибрин и гемоглобин. Протеаза разрушает сывороточные IgA. Высокая протеолитическая активность штаммов P. aeruginosa является маркером их патогенности.
Резистентность. Отличительной особенностью P. aeruginosa является очень ограниченная потребность в питательных веществах, что обеспечивает ей сохранение жизнеспособности в условиях почти полного отсутствия источников питания. Известно, что синегнойная палочка хорошо сохраняется в пресной, морской и даже дистиллированной воде. В водопроводной воде P. aeruginosa живет и размножается более 2,5 месяцев. Доказано также, что культуры синегной-ной палочки сохраняют жизнеспособность даже в растворах дезинфицирующих средств (например, фурациллина), предназначенных для хранения катетеров и различных медицинских инструментов, промывания ран в ожоговых и хирургических стационарах.
В то же время P. aeruginosa чувствительна к высушиванию, действию хлорсодержащих дезинфицирующих препаратов. Она легко ина-ктивируется при воздействии высоких температур (при кипячении, автоклавировании).
Довольно высокая устойчивость P. aeruginosa к антибиотикам объясняется плохой проницаемостью наружной мембраны бактерий из-за врожденного дефекта поринов, а также способностью синтезировать пенициллиназу.
Экология псевдомонад. Естественной средой обитания псевдомонад являются почва и различные пресные и соленые водоемы. Однако они широко распространены не только в природе. Около 5—10 % здоровых людей являются носителями различных штаммов P. aeruginosa (они в норме колонизируют кишечник) и около 70 % пациентов, находящихся в стационаре. В клинике псевдомонады также встречаются повсеместно: в водопроводных и вентиляционных системах, на фруктах и овощах, комнатных растениях, на поверхности мыла, щетках для мытья рук, полотенцах, в дыхательных аппаратах и т. д. Способность псевдомонад расти в очень слабых водных растворах веществ и в дистиллированной воде, применяемой для приготовления различных растворов, объясняет их возможное присутствие в препаратах антисептиков, детергентов и в растворах для инъекций.
Эпидемиология. Заболевание может развиться в результате аутоинфицирования (эндогенное заражение) или экзогенно. Источником инфекции являются люди (больные или бактерионосители), а также различные естест-
венные резервуары природы. Поэтому си-негнойную инфекцию можно считать сапро-антропонозом. Механизмы и пути заражения при инфекциях, вызванных синегнойной палочкой, могут быть различными: возможны контактный, респираторный, кровяной или фекально-оральный механизмы заражения.
Синегнойная инфекция может возникнуть как у иммунодефицитных лиц с тяжелой сопутствующей патологией (диабет, ожоговая болезнь, лейкоз, муковисцидоз, иммуносуп-рессия при онкологических заболеваниях и трансплантации органов), так и на фоне нормальной иммунологической реактивности организма. Показано, что адгезивная активность P. aeruginosa усиливается при повышении температуры окружающей среды и атмосферного давления, поэтому посещение бассейна, бани, принятие лечебных ванн также могут спровоцировать синегнойную инфекцию.
Синегнойная палочка является возбудителем внутрибольничных (госпитальных) инфекций, т. е. заболеваний, возникающих у людей, находящихся на лечении в стационаре. Заражение синегнойной инфекцией в клинике может быть связано с медицинскими манипуляциями (катетеризация мочевого пузыря, эндоскопическое исследование, промывание ран, перевязка, обработка антисептиками ожоговой поверхности, применение аппарата для искусственной вентиляции легких и др.), когда инфицирование происходит через грязные руки персонала, инструменты или при использовании контаминированных растворов.
Патогенез. Синегнойные палочки обычно проникают в организм человека через поврежденные ткани. Прикрепляясь, они заселяют раневую или ожоговую поверхность, слизистые оболочки или кожу, и размножаются. При отсутствии у человека иммунных механизмов против синегнойной инфекции локальный процесс (инфекция мочевыво-дящих путей, кожи, респираторного тракта) может генерализоваться. Бактериемия приводит к диссеминации возбудителя и развитию сепсиса, часто приводящего к формированию вторичных гнойных очагов инфекции. Под воздействием факторов патогенности (экзотоксина, ферментов агрессии) происходит нарушение функционирования органов и сис-
тем. Как осложнение, может развиться синдром диссеминированного внутрисосудистого свертывания, шок, а также респираторный дистресс-синдром.
Клиника. Синегнойная палочка вызывает ГВЗ различной локализации: раневые инфекции, ожоговую болезнь, менингиты, инфекции мочевыводящих путей, кожи (гангренозная эктима, ecthyma gangrenosum), заболевания глаз (кератит), некротическую пневмонию, сепсис. P. aeruginosa является возбудителем злокачественного наружного отита у диабетиков. Смертность от синегнойного сепсиса составляет около 50 %.
Иммунитет. В сыворотке крови здоровых людей, а также переболевших инфекциями си-негнойной этиологии обнаруживают антитоксические и антибактериальные антитела, однако эти антитела типоспецифические и их роль в защите от повторных заболеваний мало изучена..
Микробиологическая диагностика. Материал для исследования: кровь (при септицемии), спинномозговая жидкость (при менингите), гной и раневое отделяемое (при инфицированных ранах и ожоговых поражениях), моча (при инфекциях мочевыводящих путей), мокрота (при муковисцидозе и инфекциях респираторного тракта) и др. Бактериоскопия мазков из исследуемого материала малоинформативна из-за отсутствия у синегнойной палочки морфологических и тинкториальных особенностей. Основным методом диагностики является бактериологическое исследование клинического материала, которое позволяет не только идентифицировать возбудитель, но и определить чувствительность бактерий к антимикробным препаратам. При идентификации P. aeruginosa учитывают их рост на ЦПХ-агаре, возможное пигментообразова-ние, наличие специфического запаха при росте культуры на плотной питательной среде, положительный цитохромоксидазный тест, выявление термофильно(рост при 42 °С), а также способность окислять глюкозу в OF-тесте. Для внутривидовой идентификации бактерий применяют серотипирование, пиоцинотипирование, а также определяют чувствительность выделенной культуры к бактериофагам.
Серологический метод исследования направлен на обнаружение специфических антител к антигенам синегнойной палочки
(обычно экзотоксину А и Л ПС) с помощью РСК, РПГА, опсонофагоцитарной реакции и некоторых других тестов.
Лечение. При лечении синегнойной инфекции применяют антибиотики, причем рекомендуется использование комбинации препаратов из разных групп. Антимикробная терапия назначается только после получения результатов антибиотикограммы. При ургентных инфекциях антибиотики назначаются эмпирически. Препаратами выбора являются цефалоспорины (цефтазидим, цефоперазон) и другие р-лактам-ные препараты (тикарциллин, мезлоциллин, пиперациллин, имипенем), аминогликозиды (гентамицин, тобрамицин, амикацин), а также азтреонам и ципрофлоксацин.
Для лечения тяжелых форм синегнойной инфекции применяют также гипериммунную плазму, полученную из крови добровольцев, иммунизированных поливалентной корпускулярной синегнойной вакциной.
При местном лечении инфекций кожи (трофических язвах, эктиме, ожоговых ранах), вызванных P. aeruginosa, применяют антисинегнойный гетерологичный иммуноглобулин, получаемый из сыворотки крови баранов, гипериммунизированных взвесью культур синегнойных палочек 7 различных иммунотипов, убитых формалином.
Кроме того, для лечения гнойных инфекций кожи, абсцессов, термических ожогов, осложненных синегнойной инфекцией, циститов, маститов и др. заболеваний синегнойной этиологии (кроме сепсиса) можно применять синегнойный бактериофаг («бактериофаг пи-оцианеус») или поливалентный жидкий пио-бактериофаг.
Специфическая профилактика. Эффективная стерилизация, дезинфекция и антисептика, а также соблюдение правил асептики являются основными мерами неспецифической профилактики синегнойной инфекции в стационаре. План профилактических мероприятий обязательно должен включать контроль за обсемененностью внешней среды (воздух, различные предметы, инструменты и аппаратура), соблюдение правил личной гигиены.
С целью неспецифической профилактики больным рекомендуется назначать иммуно-модуляторы.
Пациентам с ослабленным противоинфекци-онным иммунитетом показана также пассивная специфическая иммунизация гипериммунной плазмой или нормальным человеческим иммуноглобулином в профилактических целях.
Для создания активного иммунитета применяют вакцины. В настоящее время известно много способов получения вакцин против синегнойной инфекции: имеются вакцины из ЛПС, полисахаридные субкорпускулярные (химические) вакцины, рибосомные вакцины, препараты из жгутиковых антигенов и компонентов внеклеточной слизи, а также анатоксины из внеклеточных протеаз и экзотоксина А. Активная иммунизация против инфекций, вызываемых P. aeruginosa, показана больным из групп риска (пациентам с муковисцидозом, диабетом, а также иммунодефицитным лицам). Однако в связи с тем, что иммунный ответ на вакцинные препараты у людей с иммуноде-фицитами бывает поздним и не всегда полноценным, большое значение придается комбинированию методов активной и пассивной иммунизации. В нашей стране применяются поливалентная корпускулярная синегнойная вакцина (из 7 штаммов P. aeruginosa) и стафи-ло-протейно-синегнойная вакцина.
16.3.6.2. Буркхольдерии (род Burkholderia)
Возбудитель сапа — Burkholderia (Pseudomonas) mallei
Возбудитель сапа — Burkholderia mallei был открыт в 1882 г. Ф. Леффлером и X. Шутцем.
Биологические свойства. Возбудитель сапа — мелкая грамотрицательная палочка; жгутиков, спор и капсул не имеет. Аэроб. Хорошо растет на простых питательных средах, пигмента не образует. Штаммы возбудителя сапа различаются по антигенной структуре. Ведущим фактором патогенности является эндотоксин (маллеин), который действует на клетки гладкой мускулатуры различных органов, вызывает лихорадку и снижение массы тела.
Резистентность. Burkholderia mallei чувствительны к высушиванию, нагреванию и многим дезинфектантам (кроме лизола). Во влажной среде и гниющих материалах сохраняется около месяца.
Эпидемиология. Сап — зооантропонозная особо опасная инфекция. Основным резервуа-
ром возбудителя и источником инфекции являются парнокопытные животные (лошади, ослы, мулы, верблюды, зебры), а также хищники, поедающие мясо этих животных. Случаи заражения человека от животных обычно связаны с профессиональной деятельностью человека (ветеринарные врачи, работники животноводства). Заболевание может передаваться от человека к человеку, однако заболеваемость людей обычно носит спорадический характер. Описаны случаи внутрисемейного заражения сапом.
Механизм заражения чаще всего контактный (при уходе за больными животными), возможны также фекально-оральный (путь заражения — пищевой) и респираторный механизмы передачи возбудителя.
Сап встречаетсявстранахСредиземноморья, Юго-Восточной Азии. В России существует опасность завоза инфекции из-за рубежа.
Патогенез и клиника. Входными воротами инфекции являются слизистые оболочки глаз, носа, верхних дыхательных путей, поврежденные кожные покровы. На месте проникновения возбудителя образуются папулы, которые затем превращаются в пустулы и язвы. Инфекционный процесс редко носит локальный характер. При сапе наблюдается бактериемия, септицемия с образованием вторичных гнойных очагов в мышцах и внутренних органах.
Инкубационный период составляет в среднем 1—5 дней. Заболевание протекает тяжело. Во внутренних органах формируются гранулемы и абсцессы. Острая форма сапа длится 7-14 дней и в 100 % случаев заканчивается летально.
Иммунитет. Изучен плохо.
Микробиологическая диагностика. Основана на обнаружении возбудителя в отделяемом из носа, в содержимом гнойных язв, мокроте или крови, а также в секционном материале после аутопсии. Исследование проводят только в специализированных лабораториях с соблюдением правил работы с возбудителями особо опасных инфекций. Применяют бактериоскопический (ориентировочный), бактериологический (выделение и идентификация возбудителя) и серологический (РСК, реакция агглютинации) методы. Кожно-аллергическая проба с маллеином (фильтратом бульонной культуры возбудителя) также позволяет поставить диагноз сапа.
Лечение. Применяют антибиотики — ами-ногликозиды, тетрациклины.
Специфическая профилактика. Не разработана. Не Специфическая профилактика сапа включает тщательной соблюдение правил индивидуальной защиты при уходе за больными животными и при работе с инфекционным материалом, а также ветеринарный надзор с целью выявления больных животных и инфицированных продуктов животного происхождения.
Возбудитель мелиоидоза — Burkholderia (Pseudomonas) pseudomallei
Возбудитель мелиоидоза (ложного сапа) — Burkholderia pseudomallei был выделен в 1912 г. английским врачом Р. Уайтмором в Бирме.
Биологические свойства. Burkholderiapseudoma-llei — мелкая подвижная неспорообразующая грамотрицательная палочка. Окрашивается биполярно. Аэроб. Хорошо растет на простых питательных средах, образует кремовые или оранжевые колонии, гладкие или шероховатые. Растет медленно (около 72 ч). Подобно синегнойной палочке, может расти при температуре 42 "С. Окисляет глюкозу, лактозу и некоторые другие углеводы. Имеет О- и Н-анти-гены. Среди факторов патогенности называют летальный и дерматонекротический токсины, ЛПС, протеазы и гемолизин.
Резистентность. Burkholderia pseudomallei довольно устойчива в окружающей среде: в отличие от возбудителя сапа, сохраняет жизнеспособность при высушивании, в течение месяца сохраняется в моче, фекалиях и трупах животных. Однако весьма чувствительна к различным дезинфектантам.
Эпидемиология. Возбудитель мелиоидоза распространен в природе: его выделяют из образцов почвы, воды, на рисовых полях, с поверхности овощей и фруктов.
Мелиоидоз — зоонозное инфекционное заболевание, протекающее по типу септи-копиемии. Источником инфекции являются грызуны, различные сельскохозяйственные (свиньи, лошади, крупный и мелкий рогатый скот) и дикие животные. Случаев заражения человека от человека не описано.
Возбудитель проникает в организм человека через поврежденную кожу (контактный меха-
низм заражения), слизистые оболочки (респираторный и фекально-оральный механизмы). Не исключается также заражение через переносчиков (кровяной механизм, путь передачи инфекции — трансмиссивный). Естественная восприимчивость людей невысокая.
Мелиоидоз — эндемичное заболевание, встречается преимущественно в странах Юго-Восточной Азии и Австралии.
Патогенез и клиника. Патогенез мелиоидоза мало изучен. Из первичного очага возбудитель быстро попадает в кровь, вызывая бурную интоксикацию. Оседая в различных внутренних органах, он приводит к возникновению множественных абсцессов.
Инкубационный период составляет в среднем 2—3 дня. Заболевание протекает остро, хотя возможно и латентное течение. Болезнь в большинстве случаев заканчивается летально.
Иммунитет. Не изучен.
Микробиологическая диагностика. Материал для исследования — кровь, моча, испражнения, мокрота, рвотные массы, гной, секционный материал. Применяемые методы исследования: бактериоскопический (обнаруживают биполярно окрашенные палочки), бактериологический (выделение и идентификация возбудителя), биологический (биопроба на мышах или морских свинках) и серологический (реакция агглютинации, РСК, РПГА).
Лечение. Применяют сульфаниламидные препараты и антибиотики.
Специфическая профилактика. Не разработана. Основные профилактические мероприятия сводятся к ветеринарному надзору и санитарно-разъяснительной работе в очагах возникновения болезни.
16.3.6.3. Кингеллы (род Kingella)
Бактерии рода Kingella получили свое название в честь американского бактериолога Э. Кинг, которая впервые подробно описала их. Кингеллы относят к группе так называемых неферментирующих грамотрицательных бактерий.
Кингеллы являются представителями нор-мофлоры полости рта и носоглотки, однако способны вызывать оппортунистические инфекции.
Таксономическое положение. Род Kingella включает 3 вида: К. kingae, К. denitrificans,
К. indologenes, из которых К. kingae имеет наибольшее медицинское значение. Семейство кингелл не определено.
Морфологические и тинкториальные свойства. Кингеллы — грамотрицательные прямые палочки длиной 1 мкм с закругленными или квадратно очерченными концами, расположенные попарно или в виде коротких цепочек. Спор и капсул не образуют. Жгутиков не имеют. Обычно неподвижны, однако могут иметь фимбрии (пили), благодаря которым способны передвигаться рывками, особенно по поверхности твердого субстрата.
Культуральные свойства. Аэробы или факультативные анаэробы, лучше культивируются в аэробных условиях. Оптимальная температура роста 33—37 "С. Плохо растут на простых питательных средах, так как нуждаются в факторах роста животного происхождения. На кровяном агаре образуют зоны р-гемолиза.
Кингеллы способны образовывать колонии двух типов: 1) плоские, распространяющиеся по поверхности, вызывающие коррозию плотной питательной среды, — R-формы. Этот тип колоний связан со способностью бактерий к движению благодаря наличию фимбрий; 2) гладкие, выпуклые S-колонии, характерные для неподвижных кингелл, не имеющих фимбрий.
Биохимические свойства. Кингеллы обладают слабо выраженной биохимической активностью: сбраживают глюкозу и некоторые другие углеводы до кислоты, без газообразования. Обладают слабой протеолитической активностью: расщепляют казеин, могут образовывать индол на среде с триптофаном. Оксидазаположительны, катала-заотрицательны.
Антигенные свойства. Мало изучены. Имеют О-антиген.
Факторы патогенности. Вирулентность кингелл, вероятно, определяется наличием эндотоксина, а также фимбриями. Адгезины бактерий и пили обеспечивают их способность к адгезии.
Резистентность. Кингеллы малоустойчивы в окружающей среде. Довольно быстро погибают при высоких температурах: уже при температуре 45 "С их гибель наступает через 10—15 мин. Они также высокочувствительны
к антисептикам и антибиотикам (например, пенициллину, ампициллину и эритромицину).
Эпидемиология и клиника. Кингеллы выделяют со слизистых оболочек верхних дыхательных путей и полости рта человека, считая их представителями нормальной микрофлоры полости рта, комменсалами носоглотки человека.
Бактерии рода Kingella вызывают так называемые оппортунистические инфекции у лиц со сниженным иммунитетом. К. kingae, например, является возбудителем менингитов, артритов и остеомиелитов, а также септических эндокардитов, в особенности у людей с искусственными клапанами сердца. Считается, что эти бактерии способны проникать в кровоток даже при таких простых манипуляциях, как чистка зубов, если эта процедура сопровождается повреждением десен или другими микротравмами.
Иммунитет. Мало изучен.
Микробиологическая диагностика. Основана на применении бактериологического метода исследования различных клинических материалов: крови (при септическом эндокардите или септицемии), спинномозговой жидкости (при менингите), синовиальной жидкости (при септическом артрите) и др.
Лечение. Поскольку кингеллы отличаются высокой чувствительностью к Р-лактамным антибиотикам и макролидам, пенициллин, ампициллин и эритромицин могут быть назначены при лечении заболеваний, вызванных этими микроорганизмами.
Специфическая профилактика. Не разработана.,
16.3.6.4. Моракселлы (род Moraxella) и бранхамеллы (подрод Branhamella)
Бактерии рода Moraxella являются представителями нормальной микрофлоры слизистых оболочек верхних дыхательных путей человека и некоторых животных. Могут вызывать различные заболевания у людей с нарушениями иммунитета.
Подобно кингеллам, моракселлы относятся к группе неферментирующих грамотрицательных бактерий. Впервые были выделены офтальмологами В. Мораксом и К. Аксенфельдом в 1896 г. Бактерии под-рода Branhamella названы так в честь американского бактериолога С. Э. Брэнэм (S. E. Branham).
"Таксономическое положение. Семейство моракселл не определено. Род Moraxella разделен на два подро-
да. Подрод Moraxella объединяет 6 видов бактерий: Moraxella lacunata (типовой вид), М. atlantae, M. bovis, М. nonliquefaciens, M. osloensis, М. phenylpyruvica. К под-роду Branhamella относятся следующие виды бактерий: Branhamella catarrhalis, В. caviae, В. cuniculi, В. ovis.
Морфологические и тинкториальные свойства. Моракселлы — это мелкие грамотрицатель-ные палочки (подрод Moraxella) или кокки (подрод Branhamella), расположенные попарно или в виде коротких цепочек. Для моракселл характерен плео-морфизм — в культурах наблюдается изменчивость размера и формы клеток: встречаются нитевидные клетки и длинные цепочки бактерий. Плеоморфизм моракселл усиливается в отсутствие кислорода или при температуре выше оптимальной. У бранхамелл клетки имеют форму кокков, они обычно мелкие, расположены одиночно или попарно; соприкасающиеся стороны клеток уплощены.
Клеточная стенка моракселл имеет истинные воски. Все моракселлы образуют капсулу. Они неподвижны. Бактерии подрода Moraxella могут иметь фимбрии. Так же как и у кингелл, у моракселл имеется способность к движению рывками по твердой поверхности благодаря наличию фимбрий.
Культуральные свойства. Моракселлы — аэробы. Оптимальная температура роста 33—35 °С, бранхамел-лы могут расти и при 22 °С. Все бактерии рода Moraxella требовательны к составу питательных сред, нуждаются в добавлении аминокислот, биотина, лактата (сукци-ната) в качестве источника углерода и энергии.
Бактерии подрода Moraxella на плотных питательных средах могут образовывать два типа колоний: 1) шероховатые с неровными краями, иногда с коррозией питательной среды у фимбриеобразующих штаммов; 2) очень мелкие гладкие колонии е ровными краями у штаммов без фимбрий.
Бактерии, относящиеся к подроду Branhamella, образуют мутные складчатые колонии с приподнятым центром.
Биохимические свойства выражены слабо. Моракселлы относятся к неферментирующим бактериям, поэтому при утилизации углеводов кислото-образование не наблюдается. Могут восстанавливать нитраты. Каталаза- и оксидазапозитивны.
Branhamella catarrhalis по своим морфологическим и тинкториальным свойствам похожа на бактерии рода Neisseria, однако отличается от них по биохимическим свойствам: неспособностью окислять углеводы, а также ДНКазной активностью. В. catarrhalis продуцирует бутират эстеразу, обнаружение которой
используется при экспресс-диагностике заболеваний, вызываемых этим микроорганизмом.
Антигенные свойства моракселл мало изучены.
Факторы патогенности. Вирулентность моракселл определяется наличием эндотоксина, фимбрий. Бранхамеллы способны, кроме того, продуцировать ДНКазу.
Резистентность. Все моракселлы малоустойчивы в окружающей среде. Отличаются также высокой чувствительностью к пенициллину, за исключением Branhamella catarrhalis, продуцирующей beta-лактамазу.
Эпидемиология и клиника. Бактерии рода Moraxella обнаруживаются в норме на слизистых оболочках верхних дыхательных путей человека и животных. Однако способны вызывать различные заболевания, преимущественно у людей со сниженной иммунологической реактивностью. Эти заболевания развиваются как эндогенные оппортунистические инфекции. Они характеризуются различной локализацией и клинической симптоматикой. Моракселлы могут вызывать у человека эндокардит, конъюнктивит, менингит, уретрит, различные респираторные инфекции (бронхит, пневмонию, фарингит, отит, синусит).
Иммунитет. Мало изучен.
Микробиологическая диагностика. Основана на бактериологическом исследовании материала, взятого от больных.
Лечение. Большинство моракселл чувствительны к Р-лактамным антибиотикам. Однако, учитывая способность бранхамелл продуцировать beta-лактамазу, для лечения инфекций, вызванных всеми видами моракселл и бранхамелл, рекомендуется применять антибиотики других групп.
Специфическая профилактика. Не разработана..
