
- •Міністерство освіти і науки, молоді та спорту україни
- •Міністерство освіти і науки, молоді та спорту україни
- •Самостійна робота № 1
- •Основні параметри хімічного зв’язку
- •Ковалентний зв'язок
- •Ковалентний неполярний та полярний зв'язок.
- •Іонний зв'язок
- •Металічний зв'язок
- •Водневий зв'язок
- •Завдання для самостійної роботи.
- •Самостійна робота № 2
- •Оксиген Електронна будова
- •Хімічні властивості
- •Застосування кисню
- •Застосування озону
- •Сульфур Електронна будова
- •Фізичні властивості
- •У природі
- •Хімічні властивості
- •Застосування
- •Добування
- •Застосування сульфатної кислоти
- •Застосування сульфатів
- •Виробництво сульфатів Контактний спосіб
- •Нітроген і фосфор
- •Застосування
- •Солі амонію
- •Добування солей амонію в лабораторії.
- •Промисловий синтез амоніаку
- •Хімічні властивості
- •Нітратна і ортофосфатна кислота Нітратна кислота – hno3
- •Застосування
- •Ортофосфатна кислота - н3ро4
- •Застосування
- •Силіцій (кремній)
- •Хімічні властивості силіцію
- •Оксиди карбону і силіцію
- •Добування карбону (іv) оксиду
- •Карбонатна кислота і карбонати
- •Твердість води
- •Колообіг карбону у природі
- •Силікатна кислота і силікати
- •Генетичний зв'язок між класами неорганічних сполук
- •Приклади хімічних рівнянь
- •Гідроген
- •Поширення в природі
- •Ізотопи гідрогену
- •Одержання
- •Фізичні властивості
- •Хімічні властивості
- •Використання
- •Галогени (f, Cl, Br, I). Загальна характеристика
- •Хлоридна кислота.
- •Бром. Йод.
- •Завдання для самостійної роботи.
- •Самостійна робота № 3
- •Алотропні модифікації карбону
- •Будівельні матеріали
- •Завдання для самостійної роботи
- •Самостійна робота № 4
- •Корозія металів
- •Захист від корозії
- •Лужні метали
- •Поширення у природі
- •Одержання
- •Фізичні та хімічні властивості
- •Сполуки лужних металів
- •Використання лужних металів та їх сполук
- •Лужноземельні метали
- •Фізичні та хімічні властивості
- •Сполуки лужноземельних металів
- •Біологічна роль лужних та лужноземельних металів
- •Завдання для самостійної роботи
- •Самостійна робота № 5
- •Алюміній
- •Найважливіші сполуки алюмінію
- •Застосування
- •Фізичні та хімічні властивості заліза
- •Найважливіші сполуки феруму Сполуки феруму (іі)
- •Сполуки феруму (ііі)
- •Застосування
- •Завдання для самостійної роботи
Нітроген і фосфор
V група, головна підгрупа
N – азот (нітроген )
– азот (нітроген )
P – фосфор
As – арсен
Sb – стибій
Bi – бісмут
Збільшується радіус атомів, зростають металічні та відновні властивості. Зменшується електронегативність, стійкість водневих сполук ( RH3).
N – Нітроген (азот)
Електронна будова
7N – 1s22s22p6 n =2
p
↑
↑
↑
↑↓
Ступінь окиснення нітрогену може бути від -3 (коли атом відтягує 3 електрони від атома менш електронегативного елемента) до +5 ( коли 1, 2, 3, 4 або всі 5 валентних електронів відтягуються до атомів більш електронегативних елементів, ніж нітроген).
Фізичні властивості
Без кольору, запаху і смаку, погано розчинний у воді. Ткип = -198 оС. Молекула N≡Nдуже стійка (міцний потрійний зв'язок) N2.
:N![]() N:
N:
Поширення в природі
В повітрі – 78 %. NaNO3 – чилійська селітра, натрій нітрат.
Добування
У промисловості – фракціонування рідкого повітря:
ТкипО2 = -183 оС; ТкипN2 = -198 oC
В лабораторії – розклад нітриту амонію
NH4NO2 = N2 + 2H2O – бурхливо, краще:
NH4CI + NaNO2 = N2 + NaCI + 2H2O
Хімічні властивості нітрогену
Відновник: висока температура (електрична дуга 3000 оС) N2 + O2 = 2NO – Q
О кисник:
при кімнатній температурі – лише з
літієм, з іншими металами при нагріванні:
кисник:
при кімнатній температурі – лише з
літієм, з іншими металами при нагріванні:
6Li + N2 = 2Li3N нітрити.
3Ca + N2 = Ca3N2
З воднем при високій температурі (500 оС) і тиску, у присутності каталізатора – Fe.
3H2 + N2 = 2NH3 + Q.
Застосування
Використовується азот для добування амоніаку, для наповнення електроламп (інертне середовище).
Фосфор – Р
Електронна будова
15Р – 1s22s22p63s23p6 n = 3
О сновний
стан атома
сновний
стан атома
![]() -3
-3
↑
↑
↑
↑↓
 +3
+3
![]()
Збуджений стан атом
↑
↑
↑
↑
↑
 +5
+5
![]()
Фізичні властивості
Алотропічні модифікації фосфору
Структура простих речовин
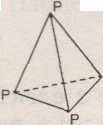
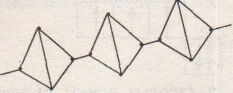
білий фосфор, Р4 червоний фосфор, (Р4)n
активний нестійкий неактивний, стійкий
Найменш активний найстійкіший
чорний фосфор Р2
Білий фосфор – ρ = 1,8 г/см3, Тпл = 44,1 оС, отруйний.
Червоний - ρ = 2 - 2,4 г/см3, Тпл = 390 оС, атомні гратки, неотруйний.
Чорний - ρ = 2,7 г/см3, атомні гратки, неотруйний.
У природі
У вільному стані не існує, основні мінерали:
Ca3(PO4)2 – фосфорити
C a5(PO4)3
∙ x
апатити
a5(PO4)3
∙ x
апатити
x = F-, CI-, OH-
Добування
2Ca3(PO4)2
+ 10C
+ 6SiO2
![]() P4
+
6 CaSiO3
+ 10CO
(в електропечах)
P4
+
6 CaSiO3
+ 10CO
(в електропечах)
Ca3(PO4)2
+ 5C
+ 3SiO2
![]() 2P
+
3CaSiO3
+ 5CO
2P
+
3CaSiO3
+ 5CO
Хімічні властивості фосфору
Активність значно вище, ніж у N2.
Відновник:
5O2 + 4P = 2 P2O5 надлишок О2, 3О2 + 4Р = 2Р2О3 надлишок Р.
2P + 3CI2 = 2PCI3 – хлорангідрид фосфітної кислоти,
РСІ3 + 3Н2О = Н3РО3 + 2НСІ – (фосфітна кислота) три хлорид фосфору,
РСІ3 + СІ2 = РСІ5 – пентахлорид фосфору,
РСІ5 + 4Н2О = Н3РО4 + 5HCI.
3Р + 5НNO3 + 2H2O = 3H3PO4 + 5NO.
Р4 +16Н2О
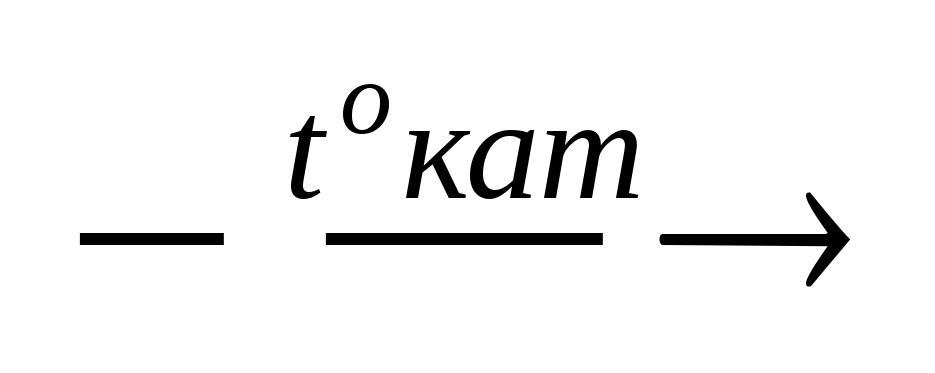 4Н3РО4
+ 10Н2.
4Н3РО4
+ 10Н2.Окисник: 2Р + 3Mg = Mg3P2 фосфід магнію.
Застосування
Білий фосфор широко не застосовується. Його використовують для добування інших алотропних форм, фосфатних кислот, як бойову запальну речовину, для утворення димових завіс.
Червоний фосфор використовується для виробництва сірників, у металургії, для виготовлення фосфорорганічних препаратів.
Амоніак – NH3
Молекула амоніаку являє собою диполь: спільні електронні пари зміщенні до атома нітрогену.
. . . .

 NH3
H
:
N:
Н
N
NH3
H
:
N:
Н
N
. . ↑
Н Н Н Н
Добування в лабораторії
Дія лугів на солі амонію:
а) (NH4)2SO4 + 2NaOH = Na2SO4 + 2NH3↑ + 2H2O
NH4+ + OH- = NH3 + H2O
б) 2NH4CI + Ca(OH)2 = CaCI2 + 2NH3↑ + 2H2O
NH4+ + OH- = NH3 + H2O
Фізичні властивості амоніаку
Безбарвний газ, з характерним запахом різким задушливим запахом, добре розчинний у воді внаслідок утворення між NH3 і H2O водневих зв’язків. Дуже уражає слизові оболонки очей і дихальних шляхів. В 1 л H2O при 20 оС розчиняється 700 л NH3, при температурі нижче за -33,4 оС переходить у рідкий стан.
Хімічні властивості амоніаку
Піраміда, завдяки напрямлено сі в просторі неподіленої електронної пари нітроген амоніаку має електроннодонорні властивості.
 Н
Н
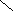
 Н
Н

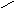

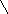 НN
: + = N
НN
: + = N
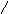 Н
Н
H H H
Донорно-акцепторна взаємодія
Основа (акцептор протона): з кислотами утворює солі:
NH3 + HCI = NH4CI.
Реагує з водою, утворює амоніачну воду:
 NH3
+ H2O
↔ NH4+
+ OH-
H
H
NH3
+ H2O
↔ NH4+
+ OH-
H
H
 O
– H
…N
– H
Лужна
реакція середовища
O
– H
…N
– H
Лужна
реакція середовища
H
Але в розчині лише невелика частина молекул NH3 перетворюється на іони амонію NH4+. Тому амоніачна вода пахне амоніаком.
Формула амоніачної води: NH3∙Н2О. ЇЇ називають амоній гідроксидом або нашатирним спиртом. NH3∙Н2О ↔ NH4+ + OH- (слабка і нестійка основа).
Відновник: найлегше окислюється до N2, в присутності каталізатора – до NО.
3Br2 + 8NH3 = N2↑ + 6NH4Br
4NH3 + 3O2
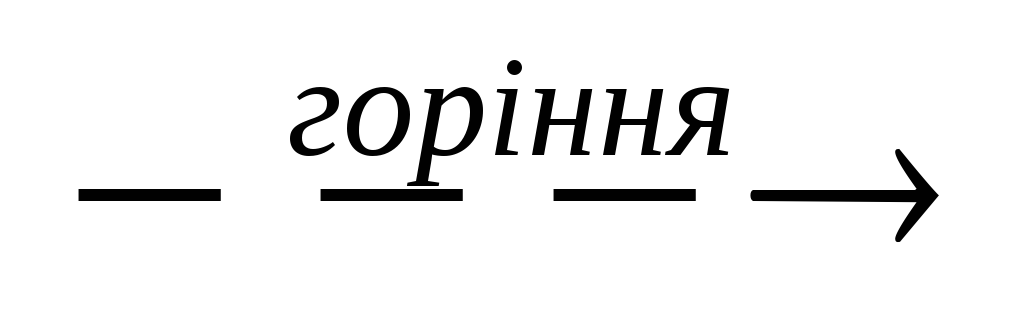 2N2
+ 6H2O
2N2
+ 6H2O
NH3
+ 5O2
![]() 4NO + 6H2O
4NO + 6H2O
3. 3CuO + 2NH3 = N2↑ + 3Cu + 3H2O
