
- •Оптические методы анализа воды. Определение концентрации вещества в растворе с помощью фотоэлектроколориметра
- •Определение физических свойств воды в лабораторных условиях
- •Лабораторная работа № 5. Определение содержания в воде гидрокарбонатных ионов hco3¯ и щелочности воды
- •Определение окисляемости воды перманганатным способом
- •1. Определение содержания нитритов в воде
- •2. Определение содержания нитратов
- •3.Определение содержания аммиака и ионов аммония
ГОСУДАРСТВЕННЫЙ КОМИТЕТ РЫБНОГО ХОЗЯЙСТВА УКРАИНЫ
КЕРЧЕНСКИЙ ГОСУДАРСТВЕННЫЙ МОРСКОЙ ТЕХНОЛОГИЧЕСКИЙ
УНИВЕРСИТЕТ
Кафедра технологии и химии морепродуктов
ГИДРОХИМИЯ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по выполнению лабораторных работ
для студентов направления 6.090201
«Водные биоресурсы и аквакультура»
дневной и заочной форм обучения
Керчь, 2009
Авторы: Ерж Б.В., к.х.н., доцент кафедры «Технологии и химии морепродуктов» Керченского Государственного Морского Технологического Университета
Головач Г.И., ст. преподаватель кафедры «Технологии и химии морепродуктов» Керченского Государственного Морского Технологического Университета
Андрейкина Н.И., к.х.н., доцент кафедры «Технологии и химии морепродуктов» Керченского Государственного Морского Технологического Университета
Рецензент: Губанова А.Г., к.т.н., зав.кафедрой «Технологии и химии морепродуктов» Керченского Государственного Морского Технологического Университета
Методические указания рассмотрены и одобрены на заседании кафедры ТХМ КГМТУ,
протокол № 10 от 2.07.2009г.
Методические указания рассмотрены и рекомендованы к утверждению на заседании методической комиссии ТФ КГМТУ,
протокол № 1 от 22.09.2009г.
Методические указания утверждены на заседании Методического совета КГМТУ,
протокол № 1 от 15.10.2009г.
© Керченский Государственный Морской Технологический Университет
ВВЕДЕНИЕ
В течение двух-трех последних десятилетий химический анализ природных вод претерпевал весьма существенные изменения, обусловленные как общим развитием естественных наук, так и быстрым расширением и усложнением задач, выдвигаемых практикой. Эти задачи в свою очередь определялись новыми знаниями о свойствах и возможных областях использования водных биоресурсов.
В настоящее время происходит интенсивное освоение и использование биологических ресурсов Мирового океана, изучаются новые районы и объекты промысла. Решаются вопросы преобразования и комплексного использования внутренних водоемов страны. Первостепенную важность приобретает охрана природных вод от загрязнения отходами человеческой деятельности. Решение всех этих вопросов требует глубоких гидрохимических исследований.
Цель настоящих методических указаний – оказание помощи студентам специальности «Водные биоресурсы» в овладении навыками грамотного выполнения гидрохимического анализа, первичной обработке полученных результатов и их графическому оформлению.
Данный практикум содержит подробное описание лабораторных работ, контрольные вопросы по каждой из них, перечень необходимого оборудования, химической посуды, список литературы, в которой рассматриваемые вопросы изложены более подробно. Практикум может быть полезен студентам не только при изучении курса «Гидрохимия», но и в дальнейшей практической деятельности.
Лабораторная работа № 1.
Методы и техника лабораторного анализа воды
Цель работы. Изучить технику безопасности при работе в химических лабораториях, методы химического анализа воды, технику лабораторного анализа, порядок заполнения бланков для записи результатов и характер отчетности по всем гидрохимическим лабораторным работам.
Принадлежности. Тетрадь. Лабораторный практикум по гидрохимии.
Требования техники безопасности при работе в химических лабораториях
Общие требования.
При работе в гидрохимической лаборатории необходимо соблюдать максимальную осторожность. Неаккуратность, небрежность, невнимательность, недостаточное знакомство с приборами и свойствами веществ, с которыми ведется работа, могут привести к несчастному случаю.
В помещениях необходимо поддерживать чистоту, на рабочих столах и возле работающих не должно быть ничего лишнего.
Химические реакции необходимо выполнять только с такими количествами и концентрациями веществ, в такой посуде, приборах и при таких условиях, которые указаны в соответствующих руководствах.
Беря вещество, следует внимательно читать этикетку и при малейшем сомнении выявить у лаборанта или преподавателя квалификацию вещества или осуществлять проверку его. Запрещается оставлять вещество в посуде без этикеток и подписей.
Совершенно недопустимо пробовать химические реактивы на вкус.
Уходя из лаборатории, нельзя оставлять включенными нагревательные приборы, горящие горелки, открытые газовые краны.
Нельзя работать при плохой или неисправной вентиляции в лаборатории или в вытяжном шкафу. При перерыве в действии вентиляции все работы в вытяжных шкафах, связанные с выделением вредных веществ, газов и паров, следует немедленно прекращать.
Необходимо следить за чистотой рук и мыть их каждый раз, когда на них попадает какое-либо вещество. Нельзя вытирать руки и посуду одним и тем же полотенцем, особенно при работе с вредными веществами.
Обращение со стеклом.
Химическая посуда, в основном тонкостенная и хрупкая, требует бережного обращения, так как при небрежном отношении к посуде возможны различные травмы. Химическую посуду следует держать в руках осторожно, не сжимая сильно пальцами. При мытье посуды ершами нужно быть осторожным, чтобы не пробить дно или стенки сосуда.
В случае небольшого пореза стеклом следует удалить осколки стекла, смыть кровь вокруг раны ватным тампоном, смоченным раствором перманганата калия, смазать йодом и завязать бинтом. При небольших порезах ранку покрывают клеем БФ-6. При глубоких артериальных ранах после удаления стекла нужно крепко перевязав руку выше пореза жгутом, удалить кровь вокруг раны, наложить несколько слоев стерильной марли, затем толстый слой гигроскопической ваты и обратиться к врачу.
Обращение с реактивами.
Очень большое значение имеет знание свойств химических соединений, с которыми гидрохимику приходится иметь дело. При работе с реактивами и растворами всегда следует помнить, что наполнение пипеток растворами кислот, щелочей и других веществ выполняют только при помощи груши или применяют пипетки с шаром.
Всю работу с вредными и ядовитыми веществами необходимо проводить только под тягой.
При работе с жидкими кислотами нужно помнить, что они могут быть причиной тяжелых, плохо заживающих химических ожогов. При переливании и разбавлении больших количеств дымящихся кислот (соляная, азотная) нужно надевать респиратор либо обвязывать нос и рот марлевой повязкой, смоченной раствором соды. Переливание малых количеств кислоты следует выполнять только в вытяжном шкафу.
При ожоге щелочами пораженное место следует обмыть сначала большим количеством воды, а затем 2%-ным раствором уксусной кислоты.
При разбавлении кислот необходимо лить кислоту в воду, не наоборот.
При попадании сильных кислот (азотная, соляная, серная) на тело облитое место следует обмыть сначала большим количеством воды, а затем 5%-нътм раствором питьевой соды (гидрокарбоната натрия).
При растворении щелочи в воде происходит сильное разогревание раствора, поэтому щелочи следует растворять в фарфоровой посуде.
При попадании в рот щелочного раствора иодида калия полость рта промыва ют сначала водой, затем 2%-ным раствором борной кислоты до исчезновения мыльного вкуса во рту и снова водой. Затем полость рта смазывают пищевым жиром.
Если в полость рта попал раствор нитрата серебра необходимо промыть рот большим количеством хлорида натрия.
Работа с нагревательными приборами.
Все нагревательные приборы необходимо устанавливать на теплоизоляционной подставке
Нельзя брать горячую посуду голыми руками. Обычно нагретые предметы берут щипцами, колбодержателями, жгутом из полотенца или бумаги.
Необходимо внимательно следить за работой нагревательных приборов и не оставлять их без присмотра.
При ожогах первой степени (покраснении колеи) обожженное место следует погрузить в раствор перманганата калия или наложить вату, смоченную этим раствором, при этом концентрация раствора перманганата калия должна быть тем больше, чем сильнее ожог.
При ожогах второй степени (появление пупырей) обожженное место обрабатывают раствором перманганата калия или 5%-ным раствором танина.
При ожогах третьей степени (разрушении тканей) рану покрывают стерильной повязкой и обращаются к врачу.
Обращение с газовой сетью.
При входе в помещение необходимо проверить присутствие газа на запах. Если запах газа ощущается, следует немедленно сообщить по телефону 04. До выяснения и устранения причин появления газа помещение закрыть, ничего не зажигать и не включать электроосвещение или электрооборудование.
Во время работы не оставлять без наблюдения горящие газовые приборы, горелки и т.п.
При выходе из помещения газ необходимо перекрыть у каждой горелки и на центральном вводе в лабораторию.
Методы химического анализа воды
Объем гидрохимических работ, количество, сроки, место и способы взятия проб зависят от целей гидрохимических исследований.
Для рыбохозяйственных целей могут быть выполнены:
газовый анализ воды (определяют физические свойства воды, содержание растворенного кислорода, углекислого газа, концентрацию ионов водорода (рН), наличие и количество сероводорода, аммиака);
краткий анализ воды (кроме определений, перечисленных в газовом анализе, определяют окисляемость, щелочность, карбонатную жесткость воды и общее содержание растворенного железа);
3)полный общий анализ воды, который включает определение физических свойств (температуры, прозрачности, цвета, запаха и вкуса); содержания кислорода, углекислого газа, сероводорода, аммиака; концентрации ионов водорода (рН) и щелочности, общей, карбонатной жесткости; окисляемости нефильтрованной и фильтрованной воды; содержания альбуминоидиого азота, солевого аммиака, нитритов, нитратов, фосфатов, различных форм железа, кремния; сульфатов, хлоридов, кальция и магния.
Целью специальных исследований может быть определение содержания металлов и микроэлементов.
Полученные результаты сравнивают с нормативными значениями показателей качества воды, приведенными в таблице.
Большинство природных вод мало минерализовано, поэтому для количественного определения многих компонентов, растворенных в воде, требуются точные методики. Вместе с тем они должны быть достаточно простыми, не требующими сложного и дорогостоящего оборудования, доступными для выполнения в полевых условиях и в относительно небольших гидрохимических лабораториях рыбоводных хозяйств.
Методики исследования химического состава воды должны быть едиными при изучении водоемов в различных целях; для того чтобы полученные данные можно было сравнить и использовать.
Определения не должны занимать много времени, так как надо стремиться все необходимые показатели определить в течение 1 -2 сут.
Используемые в настоящее время в практических целях методы химического анализа природных вод можно разделить на:
1) химические (весовые, объемный анализ); 2) электрохимические (потенциометрический, кондуктометрический, полярографический); 3) оптические (фотометрические и спектрофотометрические, люминесцентный, спектральный анализ); 4) фотохимические, 5) хроматографичсские (жидкостная колоночная хроматография, тонкослойная хроматография, газовая хроматография и т.д.).
Наиболее распространены в гидрохимии первые три группы методов. К химическим методам относятся методы, предусматривающие проведение химической реакции и последующее количественное определение образующихся продуктов. Из химических методов при анализе природных вод широко используется метод объемного анализа. Основным преимуществом объемного анализа являются простота, быстрота определения, а также широкие возможности использования разнообразных химических свойств веществ. Именно благодаря этим достоинствам метода объемного анализа в настоящее время являются основными при определении макрокомпонентов природных вод. Суть объемного метода заключается во взаимодействии исследуемого компонента с реактивом, который добавляется в виде раствора определенной концентрации (титрованный раствор) до того момента, когда количество прибавленного реактива не станет эквивалентно количеству определяемого компонента в растворе. Этот процесс называется титрованием, а момент окончания титрования - точкой эквивалентности. Конец титрования обычно устанавливают по изменению цвета индикатора, т.е. вещества, которое изменяет вою окраску при концентрациях реагирующих веществ, близких к точке эквивалентности. Индикатор и условия титрования выбирают так, чтобы точка титрования индикатора совпадала с точкой эквивалентности или была, возможно, ближе к последней.
Процесс титрования осуществляется следующим образом.
В коническую колбу помещают исследуемую пробу воды, раствор индикатора, по каплям добавляют из бюретки титрующий раствор при постоянном перемешивании. Титрование продолжают до изменения цвета окраски в колбе. Обычно для установления конечной точки титрования используют «свидетель», в качестве которого обычно применяется проба, оттитрованная до эквивалентной точки. Сравнение окрасок следует производить на белом фоне. По окончании титрования по бюретке отмечают количество затраченного на титрование раствора.
В зависимости от типа реакций методы объемного анализа делятся на четыре большие группы: 1) кислотно-основное титрование, 2) титрование окислителями и восстановителями; 3) методы осаждения; 4) методы, основанные на образовании комплексов.
При кислотно-основном титровании в качестве титрованных растворов обычно применяют кислоты и щелочи. Определять этим методом можно кислоты, щелочи, соли слабых кислот и оснований; в частности, в гидрохимии этим методом определяют диоксид углерода и гидрокарбонаты.
Титрование окислителями и восстановителями применяется в гидрохимии в основном при определении растворенного кислорода и окисляемости.
Методы объемного анализа, основанные на реакциях осаждения, используются при определении сульфатов и хлоридов.
Примером титрования с образованием комплексов могут служить реакции взаимодействия ионов кальция и магния с трилоном Б, которые лежат в основе определения общей жесткости воды.
Электрохимические методы основаны на измерении электрохимических свойств компонентов - окислительного потенциала, электрической проводимости, силы полярографического тока и т.д. Простота выполнения определений, легкость автоматизации, высокая чувствительность делают эти методы весьма перспективными в анализе вод.
В основе оптических методов лежит способность всех веществ поглощать лучистую энергию в виде квантов, соответствующих определенным длинам волн. Линии или полосы поглощения при этом располагаются в ультрафиолетовой, видимой или инфракрасной областях спектра и могут использоваться для количественной оценки (см. лаб. раб.№2.).
В процессе выполнения анализа записи следует вести в табличной форме. При применении объемного метода рекомендуется форма табл.1(приложение), фотоколориметрического - табл.2(приложение) и при определении окисляемости перманганатным методом - табл.3 (приложение).
Такие таблицы позволяют легко произвести расчет, устранить неясности и при необходимости быстро проверить правильность вычислений.
Пользуясь указанными выше методами, результаты анализа выражают в виде
Таблица 1
ХИМИЧЕСКИЙ СОСТАВ ВОДЫ ДЛЯ ПРУДОВЫХ ХОЗЯЙСТВ
(НОРМА № 9153)
-
Показатели
Единица
измерения
Норма
Допустимые границы
Цветность
летние пруды
зимовальные пруды
Кислород
Углекислота свободная
летние пруды
зимовальные пруды
Сероводород
Активная реакция рН
Щелочность
Жесткость общая
Окисляемость
летние пруды
зимовальные пруды
Азот альбуминоидный
летние пруды
зимовальные пруды
Аммиак солевой
летние пруды
зимовальные пруды
Нитриты
летние пруды
зимовальные пруды
Нитраты
летние пруды
зимовальные пруды
Фосфаты
летние пруды
зимовальные пруды
Железо общее
летние пруды
зимовальные пруды
Хлориды
летние пруды
зимовальные пруды
Сульфаты
зимовальные пруды
(за исключением районов с почвами, богатыми гипсом)
Град
град
см3О2/л
см3О2/л
см3О2/л
мгН2S/л
моль/л
град
мгО2/л
мгО2/л
мг/л
мг/л
мг/л
мг/л
мг/л
мг/л
мг/л
мг/л
мгР2О5/л
мгР2О5/л
мг Fe/л
мг Fe/л
мг Сl¯/л
мг Сl¯/л
мгSO4¯/л
До 30
До 30
Больше 4
До 10
До 20
0
7-8
1,8-3,5
5-8
До 30
До 10
Дли мг
Доли мг
Доли мг
Доли мг
До 0,2
0
Доли мг
Доли мг
До 1
До 0,1-0,2
Десятые
доли мг
До десятых
долей мг
-
-
До 50
До 50
Не ниже 3
До 50
До 50
0
От 6 до 9
-
3-5
До 40
До 20
До 2
До 0,5
До 2
До 1,5
До 0,3
Тысячные доли мг
До 2
До 2
До 3
До 0,5
До 2
До 2
До 5000
До 100
До 100
концентраций ионов, причем обычно количество ионов определяют в мг/л, а содержание основных ионов в воде (НСО3¯, SО42¯, Сl¯, Са2+, Мg2+, Nа+, К+) выражают еще и в моль/л (экв). Последнее дает, например, возможность определить эквивалентное количество вещества, приходящееся на анионы НСОз¯, SО42¯, Сl¯ и катионы Са2+, Мg2+, и рассчитать содержание в воде Nа+ и К+, так как вода, как и любой раствор электронейтральна..
Такое выражение результатов позволяет оценить качество воды по соотношению в ней ионов. Если принять сумму катионов за 50% и сумму анионов за 50%, то можно вычислить количество каждого катиона и каждого аниона от их обшей суммы и таким образом установить, к какому типу принадлежит вода.
Содержание в воде газов (кроме мг/л) выражают также в мл/л.
Техника лабораторного анализа.
Химический анализ воды требует особой аккуратности. В процессе работы необходимо постоянно себя контролировать, чтобы не допускать случайных ошибок. Наиболее часто ошибки происходят из-за неправильного пользования бюретками и пипетками.
Работа с бюретками.
Бюретка должна быть закреплена в штативе вертикально.
Перед наполнением бюретки раствором ее необходимо промыть дистиллированной водой, а затем этим раствором.
В кончике бюретки при ее заполнении не должно оставаться пузырьков воздуха. Воздух легко можно удалить, если кончик поднять вверх и слегка приоткрыть за жим (когда бюретка заполнена раствором). После того как воздух выйдет, и из кончика будет вытекать раствор, зажим закрывают.
Зажим в закрытом состоянии не должен пропускать раствор, т.е. при стоянии заполненной бюретки уровень жидкости в ней не должен меняться.
Если заполнение бюретки осуществлять с помощью воронки перед началом титрования и приведением жидкости к нулевой отметке, воронку необходимо убрать, а кончик бюретки протереть фильтровальной бумагой.
Кончик бюретки должен быть такого диаметра, чтобы объем одной капли раствора из него не превышал 0,02-0,03 мл.
Отсчет производят по нижней границе мениска жидкости в бюретке, причем глаза наблюдателя должны находиться на одном уровне с мениском. Для удобства от счета рекомендуется пользоваться полоской зачерненной бумаги и при отсчете держать ее на 1 мм ниже нижней границы мениска жидкости. Точность отсчет по бюреткам объемом 10-15 мл составляет 0,01 мл.
Работа с пипетками.
1. Перед наполнением пипетки раствором ее необходимо тщательно ополоснуть этим раствором. Погружать пипетку в большой объем точного раствора не рекомендуется. Необходимо в хорошо вымытый раствором химический стакан набрать небольшой объем его и отмеривать пипеткой раствор из стакана.
Наполнить пипетку раствором следует так, чтобы нижний край мениска коснулся соответствующей метки. После этого каплю с кончика пипетки снимают фильтровальной бумагой.
Пипетки на 10 мл могут градуироваться до конца (тогда метка 10 мл расположена у верхнего края пипетки). Если такой пипеткой необходимо отмерить объем раствора 10 мл, то жидкость сливают из пипетки полностью. Используют пипетки, у которых метка 10 мл находится у нижнего сужающегося конца. Чтобы отмерить такой пипеткой раствор объемом 10 мл, необходимо слить раствор строго до метки 10 мл.
4. Выливать раствор из пипетки следует, приведя в соприкосновение ее кончик с внутренней стенкой склянки. После опорожнения пипетки ее держат в течение нескольких секунд (15-20), чтобы дать возможность раствору стечь со стенок. Оставшаяся в кончике пипетки капля во внимание не принимается. Запрещается выдувать растворы из пипеток.
5. Удерживать раствор в пипетке и регулировать его сливание необходимо с помощью указательного пальца (а не большого).
6. Если необходимо отмерить целое число миллилитров раствора (например, 3, 5, 10, 15 мл и т. д.), то лучше пользоваться так называемыми пипетками Мора, т.е. пипетками с единственным делением, указывающим объем данной пипетки.
Правила титрования.
1. Титрованием называется медленное добавление определенного раствора в титруемую жидкость при энергичном перемешивании последней до изменения цвета или появления осадка в присутствии соответствующего индикатора.
При титровании изменение окраски раствора необходимо сравнивать только на белом фоне, используя для этого белый лист бумаги.
До тех пор пока титрование не окончено, нельзя убирать колбу или стакан с титруемым раствором из-под бюретки.
Если кажется, что титрование закончено (произошло соответствующее изменение окраски жидкости), следует снять показания объема слитого из бюретки раствора, затем добавить одну каплю и вновь посмотреть цвет титруемой жидкости. Если от добавления одной капли цвет жидкости не изменился, значит, титрование закончено. При изменении цвета следует сделать новый отсчет по бюретке.
Для приготовления растворов, применяемых для гидрохимических определений, следует использовать только реактивы с квалификацией ч.д.а. (чистый для анализа).
По каждой выполненной лабораторной работе необходимо предъявить полностью обработанные и аккуратно оформленные пастой или чернилами результаты определения. Необходимо сравнить полученные результаты с нормативными значениями показателей качества воды, приведенными в табл. 1.
Порядок выполнения работы. Тщательно изучают технику безопасности при работе в химических лабораториях, методы химического анализа воды, технику лабораторного анализа. Знакомятся с нормативами химического состава воды для прудовых хозяйств (см. табл. 1), с порядком заполнения бланков для записи результатов химического анализа воды различными методами и с характером отчетности по всем гидрохимическим лабораторным работам.
Отчет. Отчет по данной лабораторной работе заключается в собеседовании с преподавателем.
КОНТРОЛЬНЫЕ ВОПРОСЫ
Какие определения включают краткий и полный анализы воды?
Какие требования техники безопасности нужно выполнять в химической лаборатории при работе со стеклом?
Какие требования техники безопасности следует выполнять при работе с газовыми и электронагревательными приборами?
Каковы основные правила обращения с химическими реактивами?
Какие существуют формы выражения химического анализа воды?
Каковы основные правила работы с бюретками, с пипетками в химической лаборатории?
Как правильно вести титрование?
ЛАБОРАТОРНАЯ РАБОТА № 2.
Оптические методы анализа воды. Определение концентрации вещества в растворе с помощью фотоэлектроколориметра
Цель работы. Ознакомиться с основными оптическими методами, применяемыми при гидрохимических исследованиях, изучить устройство и принцип работу фотоэлектроколориметра КФК-2, научиться определять концентрацию вещества в растворе по градуировочному графику.
Оборудование и принадлежности.
Фотоэлектроколориметр КФК-2 с набором кювет.
Лабораторный практикум.
Тетрадь, миллиметровая бумага, линейка, карандаш.
Общие сведения. Из оптических методов наибольшее распространение в практике гидрохимического анализа нашли спектрофотометрический и фотометрический методы. В основе данных методов лежит закон Бугера-Ламберта-Бера, устанавливающий зависимость между поглощающей способностью исследуемого вещества, концентрацией и толщиной слоя, которому подчиняются практически все химические вещества:
D = lg(I/I0) = εCl (1)
где I - интенсивность света, прошедшего через раствор; I0 - интенсивность падающего на раствор света, ε - молярный коэффициент поглощения; С - концентрация поглощающего вещества, моль/л; l - толщина светопоглощающего раствора, см.
Спектрофотометрический метод включает определение спектра поглощения или измерение светопоглощения (как в ультрафиолетовой, так и в видимой или инфракрасной областях спектра) при строго определенной длине волны (монохроматическое излучение), которая соответствует максимуму кривой поглощения исследуемого вещества.
Фотометрический метод основан на определении спектра поглощения или измерении светопоглощения в видимом участке спектра. В отличие от спектрофотометрического, в фотометрическом методе используют световое излучение, пропущенное через широкополосные светофильтры
Фотометрический метод является одним из наиболее распространенных и сравнительно простых методов анализа, используемых в настоящее время в гидрохимии. Выполнение определения данным методом включает две основные процедуры: переведение исследуемого компонента в соединение, поглощающее свет, и намерение его концентрации путем определения светопоглощения раствора.
В зависимости от технических условий концентрацию раствора можно измерять:
- визуально (колориметрически) - путем сравнения цвети и интенсивности окраски исследуемого раствора с цветом и интенсивностью окраски стандартного раствора. Этот способ называется колориметрическим и в настоящее время применяется сравнительно редко;
- фотоколориметрически - с помощью приборов, снабженных фотоэлементами (фотоэлсктроколориметры), превращающими световую энергию в электрическую, и светофильтрами, отсекающими определенную узкую область спектра. Этот способ называется фотоколориметрическим и имеет существенные преимущества перед колориметрическим, поскольку является объективным и не зависит от особенностей наблюдателя, проводящего визуальное сравнение.
Концентрацию определяемого компонента при фотометрическом определении находят по градуировочному графику. Для этого путем последовательного разбавления готовят серию 5-6 стандартных растворов исследуемого компонента и измеряют их оптические характеристики. Строят градуировочный график, откладывая по оси абсцисс концентрации стандартных растворов исследуемых компонентов, по оси ординат - оптическую плотность растворов. Затем измеряют оптическую плотность исследуемого раствора и наносят ее значение на градуировочный график. Опуская перпендикуляр на ось абсцисс, определяют концентрацию анализируемого компонента. Для измерения светопоглощения раствора в настоящее время используются такие фотоколориметры, как ФЭК-60, КФК-2 и др.
Достоинством фотометрического метода является его высокая чувствительность - 10¯5 - 10¯8 % (массовая доля), погрешность 15-20%, возможность использования для определения широкого круга веществ.
Фотометрический метод используется при определении большого числа компонентов, главным образом соединений биогенных элементов, тяжелых металлов, основных групп загрязняющих веществ: фенолов, детергентов, нефтепродуктов, и специфических веществ: ксантогенатов, цианидов, метилового спирта, фторидов и т.д.
Перед началом выполнения гидрохимических исследований с применением оптических методов необходимо внимательно изучить устройство, принцип действия и порядок работы на фотоэлектроколориметрах.
Колориметр фотоэлектрический концентрационный КФК-2
КФК-2 предназначен для измерения в отдельных участках диапазона длин волн 315-980 нм, выделяемых светофильтрами, коэффициентов пропускания и оптической плотности жидкостных растворов и твердых тел, а также определения концентрации веществ в растворах методом построения градуировочных графиков.
Колориметр позволяет также производить измерения коэффициентов пропускания рассеивающих взвесей, эмульсий и коллоидных растворов в проходящем свете.
Колориметр применяется на предприятиях водоснабжения, в металлургической, химической, пищевой промышленности, в сельском хозяйстве, в медицине и других областях народного хозяйства. Нормальными условиями работы колориметра являются: температура окружающей среды (20+5)°С, относительная влажность воздуха 45-80%, напряжение питания сети (220+4,4) В, 50 Гц.
Устройство и работа фотоэлектроколориметра КФК-2
Принцип действия. Принцип измерения коэффициента пропускания состоит в том, что на фотоприемник направляются поочередно световые потоки: полный Fo и прошедший через исследуемую среду F и определяется отношение этих потоков. Отношение потоков и есть коэффициент пропускания исследуемого раствора:
= ( F / Fo)100% (2)
На колориметре это отношение определяется следующим образом. Вначале в световой пучок помещают кювету с растворителем или контрольным раствором. Изменением чувствительности колориметра добиваются, чтобы отсчет по шкале коэффициентов пропускания колориметра n1 был равен 100 дел. Таким образом, полный световой поток F° условно принимается равным 100%. Затем в световой пучок помещают кювету с исследуемым раствором.. Полученный отсчет n2 по шкале коэффициентов пропускания будет соответствовать F. Следовательно, коэффициент пропускания исследуемого раствора в процентах будет равен n2, т.е. % = n2.
Оптическая плотность D определяется по формуле:
D = - lg(F / Fo) + - lg / 100 = 2 - lg (3)
Устройство колориметра. В КФК-2 есть два основных блока - оптический блок и блок питания. Общий вид КФК-2 представлен на рис. 1, 2 и 3.
В оптический блок входят: осветитель; оправа с оптикой, светофильтры, кюветное отделение; кюветодержатель, фотометрическое устройство с усилителем постоянного тока и элементами регулирования; регистрирующий прибор. Блок питания включает стабилизаторы напряжения и силовой трансформатор.
Общие указания по эксплуатации
При переключении светофильтров ручка «ЧУВСТВИТЕЛЬНОСТЬ» должна находиться в положении «1», а ручка 6 - «УСТАНОВКА 100 ГРУБО» - в крайнем левом положении (минимальная чувствительность). Этим предохраняется от перегрузки регистрирующий прибор и возможность его порчи.
2. При измерении со светофильтрами 315, 364, 400, 440, 490, 540 нм, отмеченными на лицевой панели колориметра красным цветом, ручку «ЧУВСТВИТЕЛЬНОСТЬ» устанавливать в одно из положений «1», «2», «3», отмеченных на лицевой панели колориметра также красным цветом.
3. Рабочие поверхности кювет должны перед каждым измерением тщательно протираться спирто-эфирной смесью. При установке кювет в кюветодержатель нельзя касаться рабочих участков поверхностей (ниже уровня жидкости в кювете).
4. Наличие загрязнений или капель раствора на рабочих поверхностях кюветы приводит к получению неверных результатов измерений.
5. Наливать жидкость до метки на боковой стенке кюветы. Не наклонять кювету с жидкостью при установке в кюветодержатель.
6. После смены светофильтра и при выдержке колориметра при открытой крышке кюветного отделения в течение длительного времени (более 5 минут) измерения начинать после пятиминутной засветки фотоприемника.
Указания мер безопасности.
1.Работа на колориметре должна производиться в чистом помещении, свободном от пыли, паров, кислот и щелочей.
Вблизи колориметра не должны располагаться громоздкие изделия, создающие неудобства в работе оператора.
Все регулировочные работы, связанные с проникновением за постоянные ограждения к токоведущим частям колориметра, смена ламп, замена неисправных деталей должны производиться после отсоединения колориметра от электросети.
При эксплуатации колориметр должен быть надежно заземлен.
Подготовка к работе.
Колориметр включить в сеть за 15 минут до начала измерений. Во время прогрева кюветное отделение должно быть открыто (при этом шторка перед фотоприемниками перекрывает световой пучок).
Ввести необходимый по роду измерений цветной светофильтр.
Установить минимальную чувствительность колориметра. Для этого ручку «ЧУВСТВИТЕЛЬНОСТЬ» установить в положение «1», ручку «УСТАНОВКА 100 ГРУБО» - в крайнее левое положение.
Перед измерением и при переключении фотоприемников проверить установку стрелки колориметра на «0» по шкале коэффициентов пропускания Т при открытом кюветном отделении. При смещении стрелки от нулевого положения, ее подводят к нулю с помощью потенциометра «НУЛЬ», выведенного под шлиц.
Измерение коэффициента пропускания
В световой пучок поместить кювету с растворителем или контрольным раствором, по отношению к которому производятся измерения.
Закрыть крышку кюветного отделении.
Ручками «ЧУВСТВИТЕЛЬНОСТЬ» и «УСТАНОВКА 100 ГРУБО» и «ТОЧНО» установить отсчет 100 по шкале колориметра. Ручка «ЧУВСТВИТЕЛЬНОСТЬ» МОЖЕТ НАХОДИТЬСЯ В ОДНОМ ИЗ ТРЕХ ПОЛОЖЕНИЙ: «1», «2», «3».
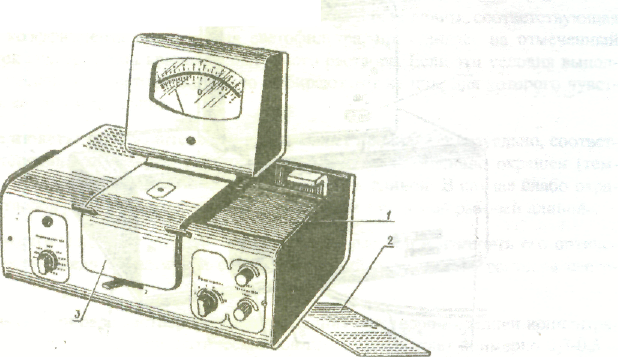
Рис. 1
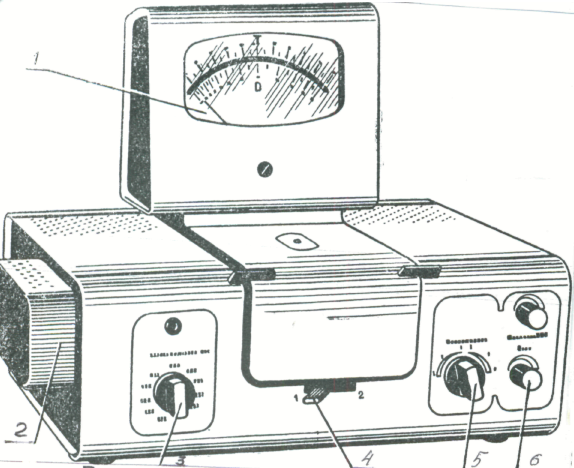
Рис. 2
Вид сзади колориметра
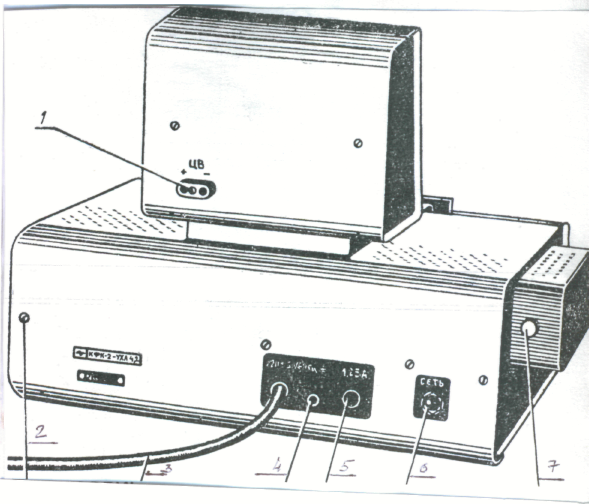
Рис. 3
4.3атем поворотом ручки 4 (рис.3) кювету с растворителем или контрольным раствором заменить кюветой с исследуемым раствором.
5.Снять отсчет по шкале колориметра, соответствующий коэффициенту пропускания исследуемого раствора в процентах или по шкале D в единицах оптической плотности.
6.Измерение проводить 3-5 раз и окончательное значение измеренной величины определить как среднее арифметическое из полученных значений.
Определение концентрации вещества в растворе
При определении концентрации вещества в растворе следует соблюдать следующую последовательность в работе:
выбор светофильтр;
выбор кюветы;
построение градуировочного графика для данного вещества,
измерение оптической плотности исследуемого раствора и определение концентрации вещества в растворе.
Выбор светофильтра. Наличие в колориметре узла светофильтров и набора кювет позволяет подобрать такое их сочетание, при котором погрешность в определении концентрации будет наименьшей.
Выбор светофильтра проводят следующим образом. Наливают раствор в кювету (о выборе размера кювет см. ниже) и определяют оптическую плотность для всех светофильтров. По полученным данным строят кривую, откладывая по горизонтальной оси длины волн, соответствующие максимуму коэффициентов пропускания светофильтров, а по вертикальной оси - соответствующие значения оптической плотности раствора. Отмечают тот участок кривой, для которой выполняются следующие условия: - оптическая плотность имеет максимальную величину;
- ход кривой примерно параллелен горизонтальной оси, т.е. оптическая плотность мало зависит от длины волны.
Светофильтр для работы выбирается так, чтобы длина волны, соответствующая максимуму коэффициента пропускания светофильтра, приходилась на отмеченный выше участок спектральной кривой испытуемого раствора. Если эти условия выполняются для нескольких светофильтров, то выбирают тот из них, для которого чувствительность колориметра выше.
Выбор кюветы. Предварительный выбор кювет проводится визуально, соответственно интенсивности окраски раствора. Если раствор интенсивно окрашен (темный), следует пользоваться кюветами с малой рабочей длиной. В случае слабо окрашенных растворов рекомендуется работать с кюветами с большой рабочей длиной.
В предварительно подобранную кювету налить раствор и измерить его оптическую плотность, введя в ход лучей соответствующий для данного раствора светофильтр.
При измерении ряда растворов кювету заполнить раствором средней концентрации. Если полученное значение оптической плотности составляет примерно 0,3-0,5 - выбрать данную кювету для работы с этим раствором. В том случае, когда эго условие не выполняется, следует испробовать другую кювету. Если величина оптической плотности больше 0,5-0,6, берут кювету меньшей рабочей длины, если величина оптической плотности меньше 0,3-0,2, следует выбрать кювету с большей рабочей длиной.
Построение градуировочного графика проводят следующим образом. Готовят ряд растворов данного вещества с известными концентрациями, охватывающими область возможных изменений концентраций этого вещества в исследуемом растворе. Измеряют оптические плотности всех растворов и строят градуировочный график, откладывая по горизонтальной оси известные концентрации, а по вертикальной - соответствующие им значения оптической плотности.
Определение концентрации вещества в раствор. По градуировочному графику в дальнейшем можно определить неизвестную концентрацию вещества в исследуемых растворах. Для этого раствор налить в ту же кювету, для которой построен градуировочный график, и, включив тот же светофильтр, определить оптическую плотность раствора. Затем по градуировочной кривой найти концентрацию, соответствующую измеренному значению оптической плотности.
Выполнение работы. Ознакомиться с устройством, принципом и порядком работы на КФК-2. По предложенным преподавателем данным построить градуировочные графики и по известному значению оптической плотности для исследуемого раствора определить по градуировочному графику концентрацию исследуемого компонента в растворе.
Отчет. Отчет по данной лабораторной работе состоит в устном собеседовании с преподавателем.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Какой закон лежит в основе спектрофотометрического и фотоколориметрического методов анализа природных вод?
2.Почему фотоколориметрический метод анализа широко используется в гидрохимических исследованиях?
3.Какие компоненты природных вод можно определить с помощью фотоколориметрического метода анализа?
4. Каков принцип действия, устройство КФК-2?
Как выбрать светофильтр для определения веществ?
Как подобрать кюветы для колориметрирования?
Как и для чего строится калибровочный график?
Какие меры предосторожности необходимо соблюдать при работе на КФК-2?
Изложите последовательность работы на КФК-2?
ЛАБОРАТОРНАЯ РАБОТА № 3.
