
TMS / Лекция_9
.pdf9 ВОССТАНОВЛЕНИЕ ОКСИДОВ МЕТАЛЛОВ УГЛЕРОДОМ
9.1Общая характеристика реакций восстановления оксидов углеродом
В научно-технической литературе восстановление оксидов углеродом принято называть прямым восстановлением, а восстановление оксидом углеро-
да – косвенным или не прямым восстановлением.
В связи с несовершенством контакта между кусковыми материалами воз-
можность непосредственного взаимодействия между углеродом и твердыми ок-
сидами ограничена. Поэтому реакции прямого восстановления протекают пре-
имущественно с участием газовой фазы и представляют собой результат после-
довательного протекания реакций косвенного восстановления
MeO + |
CO |
= |
Me |
+ CO2 |
(9.1) |
и взаимодействия углекислого газа с углеродом |
|
||||
CO2 |
+ |
C |
= |
2CO . |
(9.2) |
Результат последовательного протекания реакций (9.1) и (9.2) можно описать уравнением
|
|
MeO |
+ C |
= |
Me + |
CO . |
(9.3) |
Согласно закону Гесса |
|
|
|
|
|
||
ΔH o |
= ΔH o |
+ |
ΔH o |
= |
ΔH o |
+ 172130 Дж/моль. |
|
9.3 |
9.1 |
|
9.2 |
|
9.1 |
|
|
Изменение энтальпии реакции (9.1) может быть как отрицательной, так и поло-
жительной величиной. В первом случае оно обычно не велико и не превышает
172130 Дж/моль. Поэтому реакции прямого восстановления обычно являются эндотермическими.
При низких температурах восстановление оксидов углеродом может так-
же протекать по реакции
2MeO + C = 2Me + CO2 . |
(9.4) |
2
Однако при температурах более 950 – 1000оС углекислый газ взаимодействует с углеродом по реакции (9.2) и практически полностью превращается в СО.
9.2 Температура начала восстановления оксида
Система, в которой протекают реакции (9.1) и (9.2) состоит из пяти ве-
ществ, связанных между собой двумя уравнениями реакций. Следовательно,
количество независимых компонентов системы k = 3. При отсутствии растворов количество находящихся в равновесии фаз f = 4, а число степеней свободы сис-
темы
C = k + n – f = 3 + 2 – 4 = 1.
Это означает, что однозначно охарактеризовать систему можно, указав темпе-
ратуру или давление.
При постоянном давлении количество степеней свободы системы стано-
вится равным нулю. Это означает, что система из чистых металла, оксида, уг-
лерода, СО и СО2 может находиться в состоянии равновесия только при одной температуре, которая определяется составом газовой фазы.
Сказанное выше показано на рисунке 9.1. Из рисунка видно, что при по-
стоянном давлении реакции (9.1) и (9.2) могут одновременно находиться в рав-
новесном состоянии только при одной температуре Тр.
Рассмотрим процессы, которые протекают в системе при температурах отличных от Тр.
Из рисунка 9.1 видно, что при Т > Тр в системе нет газовой фазы, которая удовлетворяла бы условиям равновесия реакций (9.1) и (9.2) одновременно.
Допустим, что при температуре Т1 реакция (9.1) находится в состоянии равновесия. При этом состав равновесной газовой фазы для реакции (9.1) отве-
чает точке б. Но газовая смесь такого состава не является равновесной по от-
ношению к углероду, так как содержание СО2 в газовой фазе выше равновесно-
го для реакции (9.2), которое соответствует точке в на рисунке.

3
В этих условиях реакция (9.2) протекает в направлении образования до-
полнительного количества оксида углерода и (%СО) в общей для двух реакций газовой фазе увеличивается. При этом газовая фаза перестанет отвечать усло-
виям равновесия реакции косвенного восстановления, которая будет протекать в направлении восстановления оксида и образования дополнительного количе-
ства СО2. Результатом одновременного протекания реакций (9.1) и (9.2) будет процесс, который описывается уравнением реакции прямого восстановления
(9.3).
Сказанное выше можно представить следующей схемой
При наличии в исходном состоянии избытка углерода оксид металла бу-
дет полностью восстановлен и часть углерода останется не использованной.
При этом равновесие в системе будет достигнуто, когда состав газовой фазы будет соответствовать точке в на рисунке 9.1.
При умеренных температурах в составе равновесного газа может нахо-
диться существенное количество СО2. Это означает, что восстановление оксида протекает как по реакции (9.3), так и по реакции (9.4).
При недостатке углерода он будет полностью израсходован и часть окси-
да останется не восстановленной. При этом равновесие в системе будет достиг-
нуто, когда состав газовой будет соответствовать точке б.
При Т < Тр в системе также нет газовой фазы, которая одновременно удовлетворяла бы условиям равновесия реакций (9.1) и (9.2).
Допустим, что при температуре Т2 реакция (9.1) находится в состоянии равновесия. При этом состав равновесной газовой фазы для реакции (9.1) отве-
чает точке г. Но газовая смесь такого состава не является равновесной по отно-

4
шению к углероду, так как содержание СО в газовой фазе выше равновесного для реакции (9.2), которое соответствует точке д на рисунке 9.1.
В этих условиях реакция (9.2) протекает в направлении разложения окси-
да углерода на углекислый газ и углерод. При этом (%СО2) в общей для двух реакций газовой фазе увеличивается, и она становится окислительной по отно-
шению к металлу.
Протекающие при этом процессы можно представить следующей схемой
Таким образом, в присутствии углерода при Т < Тр оксид углерода по от-
ношению к металлу может выступать в роли окислителя. Но окисление проте-
кает не в результате непосредственного взаимодействия металла с СО, а при взаимодействии с СО2, который образуется в результате распада СО при нали-
чии в системе углерода.
Если в исходном состоянии над металлом будет избыток газа, произойдет полное окисление металла. При этом состав равновесной газовой фазы будет соответствовать точке д.
Из рассмотренных примеров следует, что при постоянном давлении в системе возможны следующие процессы:
1.Равновесие при одной единственной температуре Тр характерной для каж-
дого оксида.
2.Восстановление оксидов при температурах выше Тр, в связи с чем эту тем-
пературу называют также температурой начала восстановления.
3.Распад оксида углерода и окисление металла при температурах ниже Тр.
5
9.3 Особенности реакций прямого восстановления различных оксидов
Для оценки температур начала восстановления различных оксидов вос-
пользуемся диаграммой на рисунке 9.2.
Из рисунка видно, что для легковосстановимых оксидов температурные зависимости состава равновесной газовой фазы для реакций (9.1) и (9.2) вообще не пересекаются или пересекаются в области низких температур. Следователь-
но, с точки зрения термодинамики прямое восстановление оксидов этой группы возможно при любых металлургических температурах и малом содержании СО
в газовой фазе.
Для оксидов второй группы температуры начала восстановления нахо-
дятся в области умеренных температур. Например, при давлении в системе равном 100 кПа температура начала восстановления оксида FeO составляет около 700оС.
Для трудно восстановимых оксидов температурные зависимости состава равновесной газовой фазы для реакций (9.1) и (9.2) пересекаются в области вы-
соких температур при содержании СО в газовой фазе близком к 100%.
Особое внимание необходимо обратить на следующее. Прямое восста-
новление оксидов становится возможным при Т > Тр, при которой пересекают-
ся температурные зависимости состава равновесной газовой фазы для реакций
(9.1) и (9.2). Реакции косвенного восстановления трудно восстановимых окси-
дов являются эндотермическими. Они с большей полнотой протекают при вы-
соких температурах. Поэтому при повышении температуры в равновесной для реакции (9.1) газовой фазе уменьшается (%СО) и увеличивается (%СО2). Реак-
ция взаимодействия углерода с углекислым газом также является эндотермиче-
ской. При повышении температуры в равновесной для реакции (9.2) газовой фазе (%СО) увеличивается. Поэтому при высокой достаточно высокой темпе-
ратуре кривые, которые описывают зависимость состава равновесной для реак-
ций (9.1) и (9.2) газовой фазы от температуры, неизбежно пересекутся.

6
Из сказанного выше следует, что углерод является универсальным вос-
становителем. С его помощью при достаточно высокой температуре можно восстанавливать самые прочные оксиды. В качестве примера в таблице 9.1 при-
ведены примерные значения температур начала восстановления чистых окси-
дов с получением чистых элементов при давлении в системе 100кПа.
Таблица 9.1 – Температуры начала восстановления оксидов при давлении
100 кПа.
Оксид |
Продукт |
Температура начала |
восстановления |
восстановления, оС |
|
FeOт |
Feт |
700 |
Cr2O3т |
Crт |
1230 |
MnOт |
Mnт |
1420 |
SiO2т |
Siж |
1540 |
TiO2т |
Tiт |
1700 |
MgOт |
Mgг |
1880 |
Al2O3т |
Alж |
2050 |
CaOт |
Caг |
2140 |
|
|
|
Реакции (9.3) и (9.4) протекают с увеличением объема взаимодействую-
щих веществ. Поэтому при высоких давлениях температура начала восстанов-
ления оксида увеличивается. Например, для реакции
FeOт + C = Feт + CO
при повышении давления в системе от 100 до 1000 кПа температура начала восстановления увеличивается от 700 до 840оС.
7
9.4 Восстановление при наличии растворов
Восстановление оксидов из раствора. Проанализируем изменение усло-
вий восстановления при переходе оксида в раствор на примере реакции восста-
новления FeO.
Реакцию косвенного восстановления растворенного в шлаке оксида мож-
но описать уравнением
|
|
(FeO) |
|
+ |
CO |
= Fe + CO2 . |
|
|
|
(9.5) |
||||||||
Если в результате реакции (9.5) образуется чистое железо |
|
|
|
|
||||||||||||||
|
|
|
a |
Fe |
× P |
|
|
|
(%CO2 ) |
|
1 |
|
|
|
||||
|
|
|
|
|
CO2 |
|
|
|
|
|
||||||||
K9.5 |
= |
|
|
|
|
|
|
= |
|
|
× |
|
|
|
|
. |
(9.6) |
|
|
a |
|
|
× P |
(%CO) |
γ |
FeO |
N |
|
|||||||||
|
|
|
(FeO) |
|
CO |
|
|
|
|
|
|
FeO |
|
|||||
Численное значение константы равновесия реакции, выраженной через активности взаимодействующих веществ, зависит только от температуры. При неизменной температуре константа равновесия реакции должна оставаться по-
стоянной величиной. Из уравнения (9.6) можно видеть, что понижение содер-
жания FeO в шлаке приводит к уменьшению отношения объемных концентра-
ций СО2 и СО в равновесной газовой фазе.
Увеличение содержание СО в равновесной газовой фазе означает, что при растворении оксида в шлаке и уменьшении его концентрации восстанавливать оксид становится труднее. Изменение состава равновесной газовой фазы для реакции (9.5) при растворении оксида в шлаке и понижении его концентрации показано семейством кривых на рисунке 9.3.
Из рисунка 9.3 видно также, что по мере уменьшения концентрации FeO
в шлаке повышается содержание СО в равновесной для реакции (9.5) газовой фазе и увеличивается температура начала восстановления оксида. Это означает,
что условия прямого восстановления оксида при этом также ухудшаются.
Переход восстановленного металла в раствор. Изменение условий вос-
становления оксида при переходе в раствор восстановленного металла проана-
лизируем на примере реакции восстановления Mn.
8
Если восстановленный марганец растворяется в металлическом расплаве,
реакцию косвенного восстановления оксида марганца можно описать уравне-
нием
|
|
MnO + |
CO = |
[Mn] + CO2 . |
(9.7) |
|||||||
Если реакция (9.7) протекает с участием чистого оксида марганца |
|
|||||||||||
|
|
|
a |
[Mn] |
× P |
|
(%CO2 ) |
|
||||
|
|
|
|
CO2 |
|
|
||||||
K9.7 |
= |
|
|
|
|
|
= |
|
|
×γ Mn N Mn . |
(9.8) |
|
|
a |
MnO |
× P |
(%CO) |
||||||||
|
|
|
|
|
CO |
|
|
|
|
|
||
Из уравнения (9.8) видно, что понижение содержания Mn в расплаве приводит к увеличению отношения объемных концентраций СО2 и СО в равновесной газо-
вой фазе.
Увеличение содержание СО2 в равновесной газовой фазе означает, что
при растворении восстановленного марганца в металле и уменьшении его кон-
центрации условия восстановления улучшаются. Изменение состава равновес-
ной для реакции (9.7) газовой фазы при растворении восстановленного марган-
ца в металле и понижении его концентрации показано семейством кривых на рисунке 9.4.
Из рисунка 9.4 можно видеть, что по мере уменьшения концентрации Mn
в металлическом расплаве увеличивается содержание СО2 в равновесной для
реакции (9.7) газовой фазе и понижается температура начала восстановления оксида. Это означает, что условия прямого восстановления оксида при этом также улучшаются.
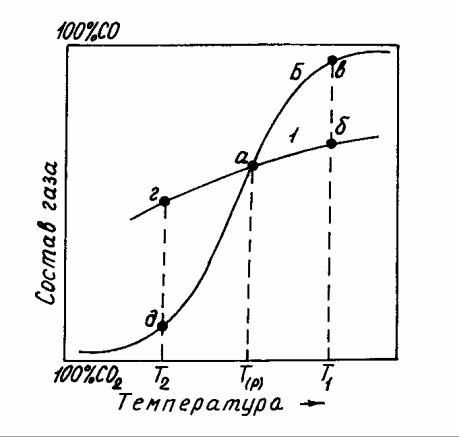
9
Рисунок 9.1 – Зависимость состава равновесной газовой фазы от температуры
для экзотермической реакции косвенного восстановления и реак-
ции С + СО2 = 2СО при постоянном давлении

10
Рисунок 9.2 - Зависимость состава равновесной газовой фазы от температуры для реакции С + СО2 = 2СО и реакций косвенного восстановле-
ния различных оксидов при давлении 100 кПа
