
TMS / Лекция_6
.pdf6 ОБЩАЯ ТЕРМОДИНАМИЧЕСКАЯ ХАРАКТЕРИСТИКА РЕАКЦИЙ ОБРАЗОВАНИЯ И ТЕРМИЧЕСКОЙ ДИССОЦИАЦИИ ОКСИДОВ
6.1 Упругость диссоциации оксидов
Оксиды образуются в результате взаимодействия различных веществ с газообразным кислородом по экзотермическим реакциям типа
Me + 0,5O2 |
= MeO . |
(6.1) |
Система состоит из трех веществ, связанных между собой одним уравне- нием реакции, следовательно k = 2. Если металл и оксид металла являются чис- тыми веществами, количество находящихся в равновесии фаз f = 3. Тогда в со- ответствии с правилом фаз Гиббса количество степеней свободы системы по- лучим равным
С = k + n – f = 2 +2 – 3 = 1.
Это означает, что, не нарушая фазового состояния системы, можно произволь- но изменять только один из ее параметров – температуру.
Согласно принципу Ле Шателье повышение температуры способствует протеканию экзотермической реакции (6.1) в направлении диссоциации оксида на металл и газообразный кислород. Поэтому с ростом температуры химиче- ское сродство окисляемых элементов к кислороду и прочность их оксидов уменьшаются.
Константа равновесия реакции (6.1) может быть записана в виде
K MeO |
= |
|
|
aMeO |
. |
(6.2) |
a |
Me |
× P 0,5 |
||||
|
|
|
O (MeO) |
|
|
|
|
|
|
|
2 |
|
|
Если металл и его оксид являются чистыми веществами, уравнение (6.2) можно записать в виде
P |
= |
|
1 |
. |
(6.3) |
|
|
||||
O2(MeO) |
|
K |
2 |
|
|
|
|
|
MeO |
|
|
2
Равновесное парциальное давление кислорода для реакций образования или термической диссоциации оксидов называется упругостью диссоциации оксида. Ее величина связана с константой равновесия реакции и, следователь- но, является функцией температуры. Если в системе отсутствуют растворы, уп- ругость диссоциации оксидов может быть использована для оценки химическо- го сродства элементов к кислороду и сравнительной прочности различных ок- сидов.
В каждом конкретном случае направление реакции (6.1) можно опреде- лить, исходя из величины изменения энергии Гиббса системы
|
G = RT ln X o − ln K |
MeO |
= |
|
|
|||
|
|
|
|
|
|
|
|
|
= |
|
|
|
− ln P |
|
|
|
|
0,5RT ln P |
|
|
. |
(6.4) |
||||
|
|
O (MeO) |
|
O (ф) |
|
|
||
|
|
|
2 |
|
2 |
|
|
|
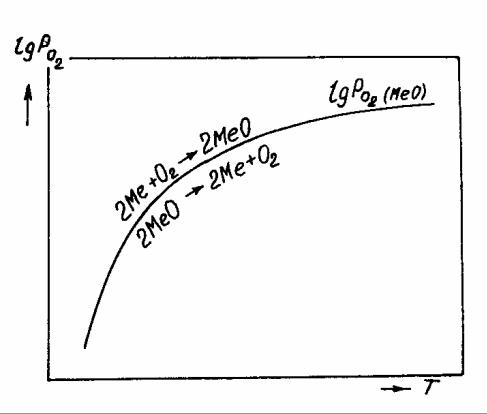
Из соотношения (6.4) видно, что направление реакции зависит от соот- ношения величин упругости диссоциации оксида и фактического парциального
давления кислорода в газовой фазе. Если |
P |
> P |
, реакция (6.1) |
|
O2(ф) |
O2(MeO) |
|
протекает в сторону окисления металла. На рисунке 6.1 таким неравновесным системам отвечает поле диаграммы выше равновесной кривой. Протекание ре- акции в направлении диссоциации оксида становится возможным в условиях,
когда P |
< P |
. Это условие выполняется в неравновесных систе- |
O2(ф) |
O2(MeO) |
|
мах, которые характеризует поле диаграммы, расположенное ниже равновесной кривой.
Сведения об изменении энергии Гиббса реакций образования некоторых оксидов, а также данные об упругости их диссоциации при различных темпера- турах представлены в таблице 6.1.
Анализ данных таблицы 6.1 свидетельствует о высоком химическом сродстве элементов к кислороду. Поэтому в атмосфере, содержащей даже очень малые концентрации кислорода, реакции необратимо протекают в направлении образования оксидов.

3
Таблица 6.1 – Влияние температуры на упругость диссоциации оксидов
|
|
ΔGo = |
A + BT |
|
|
|
Реакция образования |
Дж/моль |
lg P |
×10−5 , Па |
|||
|
|
|||||
оксида |
O2(MeO) |
|
||||
А |
В |
1000К |
|
1600К |
||
|
|
|
||||
|
|
|
|
|
|
|
2Cu + 0,5O2 |
= Cu2O |
–168519 |
71,3 |
–10,15 |
–3,33 |
|
Ni + 0,5O2 |
= NiO |
–234503 |
85,28 |
–15,58 |
–6,39 |
|
Fe + 0,5O2 |
= FeO |
–263182 |
64,22 |
–20,77 |
–10,46 |
|
Mn + 0,5O2 |
= MnO |
–385186 |
73,73 |
–32,52 |
–17,43 |
|
Si + O2 = SiO2 |
–906555 |
174,05 |
–38,24 |
–20,49 |
||
2Al + 1,5O2 = Al2O3 |
–1687909 |
325,15 |
–47,43 |
–25,39 |
||
Mg + 0,5O2 |
= MgO |
–609350 |
116,06 |
–51,51 |
–27,64 |
|
Ca + 0,5O2 |
= CaO |
–641836 |
110,20 |
–55,51 |
–30,28 |
|
В атмосфере воздуха термическая диссоциация большинства оксидов не осуществима, так как для этого потребуются температуры, которые нельзя по- лучить в обычных условиях. Например, температура начала разложения FeO
при P = 21000 Па составляет около 3500оС. Для оксидов марганца, кремния
O2
и других элементов эти температуры увеличиваются до 4000 – 5000оС и более. Поэтому в естественных условиях большинство металлов, кроме благородных, встречается в земной коре в окисленном состоянии.
При температурах металлургических процессов лишь высшие оксиды не- которых металлов в атмосфере воздуха могут подвергаться термической диссо- циации. Например, в реакциях
2Fe3O4 |
+ 0,5O2 |
= 3Fe2O3 , |
(6.5) |
2Mn3O4 |
+ 0,5O2 |
= 3Mn2O3 , |
(6.6) |
Mn2O3 |
+ 0,5O2 |
= 2MnO2 , |
(6.7) |
равновесное парциальное давление кислорода становится равным 21000 Па при температурах равных соответственно 1380, 940 и460оС. Поэтому нагрев этих оксидов до более высоких температур приводит к их термической диссоциации, которая протекает, например, в процессе агломерации.
4
6.2 Упругость диссоциации оксидов при образовании растворов
В реальных металлургических процессах взаимодействующие вещества обычно находятся в твердых или жидких растворах.
Если в качестве стандартных состояний при определении активностей участвующих в реакции веществ принять чистый металл и чистый его оксид, то при наличии ненасыщенных растворов их активности отличаются от единицы и определяются свойствами и составом раствора. В этом случае равновесная ве-
личина парциального давления кислорода в газовой фазе P' O2(MeO)
только от температуры, но и от активности компонентов в растворах. Для реакции
[Me] + 0,5{O2 } |
= (MeO) |
|
||||||
K = |
|
a(MeO) |
|
, |
||||
|
|
|
|
0,5 |
||||
|
a |
× P' |
|
|
||||
|
[Me] |
|
O (MeO) |
|
||||
|
|
|
2 |
|
|
|||
откуда |
|
|
|
|
|
|
|
|
|
|
|
|
|
a2 |
|
||
P' |
= |
|
|
(MeO) |
. |
|
||
O2(MeO) |
|
|
K 2 × a2 |
|
||||
|
|
|
|
|
[Me] |
|
||
зависит не
(6.8)
(6.9)
(6.10)
Величина 1/К2 численно равна упругости диссоциации оксида для реак- ции, протекающей с участием чистых веществ. Это позволяет записать соотно- шение (6.10) в виде
|
|
|
|
|
|
|
|
|
|
a2 |
|
|
|
|
|
|
|
|
P' |
|
= |
P |
|
|
|
× |
|
(MeO) |
. |
|
|
(6.11) |
|||
|
|
|
|
|
|
|
|
|
|||||||||
|
O2(MeO) |
|
O2 |
(MeO) |
|
|
a2 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
[Me] |
|
|
|
|||
Заменив активности металла и оксида их концентрациями, получим |
|
||||||||||||||||
|
|
|
|
|
|
|
|
γ |
|
|
|
N |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
MeO |
|
|
|
|
|||||
P' |
|
= |
P |
|
|
× |
|
|
|
MeO |
. |
(6.12) |
|||||
|
|
|
|
|
(γ |
|
|
|
|||||||||
O2(MeO) |
|
O2(MeO) |
|
|
|
Me |
N |
Me |
)2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
5
Анализ уравнения (6.12) позволяет сделать следующие выводы:
1.При переходе оксида металла в раствор и понижении его концентрации рав- новесное парциальное давление кислорода в газовой фазе уменьшается, что можно эквивалентно повышению прочности оксида.
2.При переходе окисляемого металла в раствор и понижении его концентра- ции равновесное парциальное давление кислорода в газовой фазе увеличива- ется.
6
Рисунок 6.1 – Зависимость упругости диссоциации оксида от температуры
