
TMS / Лекция_7
.pdf7 ТЕРМОДИНАМИЧЕСКИЕ ОСОБЕННОСТИ РЕАКЦИЙ ОБРАЗОВАНИЯ И ТЕРМИЧЕСКОЙ ДИССОЦИАЦИИ ОКСИДОВ ЖЕЛЕЗА
7.1 Физические свойства железа
В зависимости от температуры твердое железо может существовать в не- скольких структурных модификациях. При температурах менее 910оС устойчи- вым является α-Fe, которое имеет объемноцентрированную кубическую кри- сталлическую решетку. При температурах 910 – 1401оС железо существует в виде γ-Fe, для которого характерна гранецентрированная кубическая кристал- лическая решетка. При температурах 1401 – 1539оС устойчивым является δ-Fe, кристаллическая решетка которого является объемноцентрированной кубиче- ской.
Температура плавления химически чистого железа равна 1539оС. Техни- чески чистое железо, полученное путем окислительного рафинирования, пла- вится при температуре около 1530оС.
Теплота плавления железа составляет 15200 Дж/моль или 271,7 кДж/кг. Кипение железа происходит при температуре 2735оС, хотя авторами не-
которых исследований установлены значительно более высокие значения тем-
пературы кипения железа (3227 – 3230оС). |
|
|
||
Теплота испарения железа составляет 352,5 |
кДж/моль или 6300 кДж/кг. |
|||
Зависимость давления насыщенного пара железа (PFe, Па) от температу- |
||||
ры может быть описана уравнением |
|
|
|
|
lg PFe |
= |
−18400 |
+ 11,1 . |
(7.1) |
T |
||||
Расчеты по уравнению (7.1) свидетельствуют о том, что при 1600оС давление насыщенного пара железа составляет 13,3 Па; при 2200оС – около 10 кПа; при
2735оС – 100 кПа.
2
Плотность жидкого железа при 1550 – 1650оС равна 6700 – 6800 кг/м3, при температуре кристаллизации она увеличивается до 6850 кг/м3. Плотность твердого железа при температуре кристаллизации равна 7450 кг/м3, при ком- натной температуре – 7800 кг/м3.
7.2 Влияние температуры на упругость диссоциации оксидов железа
Обладая переменной валентностью, железо при взаимодействии с кисло- родом образует несколько оксидов по реакциям
|
|
|
|
Fe |
+ |
0,5O2 |
|
= FeO , |
|
(7.2) |
||
ΔGo |
|
|
|
= – 263182 + 64,22Т Дж/моль, |
(7.3) |
|||||||
FeO |
|
|
|
|
|
|
|
|
|
|||
|
3 FeO |
+ |
0,5O2 |
|
= Fe3O4 , |
(7.4) |
||||||
Go |
|
|
|
= – 318065 + 127,84Т Дж/моль, |
(7.5) |
|||||||
Fe O |
|
|
|
|
|
|
|
|
|
|||
3 |
4 |
|
|
|
|
|
|
|
|
|
||
|
|
2 |
Fe O |
+ |
1 |
O |
= Fe O , |
(7.6) |
||||
|
|
|
|
|||||||||
|
3 |
|
3 |
4 |
|
6 |
|
2 |
2 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
Go |
|
= – 97795 + 56,7Т Дж/моль. |
(7.7) |
|||||||||
Fe O |
|
|
|
|
|
|
|
|
||||
|
2 |
3 |
|
|
|
|
|
|
|
|
||
Результаты расчета равновесных парциальных давлений кислорода в ре- акциях (7.2), (7.4) и (7.6) при различных температурах показаны на рисунке 7.1.
Из рисунка видно, что равновесное парциальное давление кислорода в реакции (7.6) является высоким и достигает 100 кПа при температуре 1452оС. Это позволяет характеризовать реакцию (7.6) как обратимую в широком интер- вале температур. Равновесные парциальные давления кислорода в реакциях
(7.2) и (7.4) очень малы.
При анализе данных на рисунке 7.1 нужно обратить внимание на то, что
при низких температурах P |
< P |
. Это означает, что Fe3O4 яв- |
O2(Fe3O4 ) |
O2(FeO) |
|
ляется более прочным оксидом. Поэтому при низких температурах оксид FeO
3
не образуется. В этих условиях взаимодействие железа с кислородом протекает по реакции
|
|
|
|
|
3Fe + |
2O2 |
= Fe3O4 , |
(7.8) |
|
Go |
|
|
= – 1105608 + 307,31Т Дж/моль. |
(7.9) |
|||
|
|
Fe O |
|
|
|
|
||
|
|
|
3 |
4 |
|
|
|
|
Так как | |
H o |
|
| |
> | H o |
|, с ростом температуры упругость диссо- |
|||
|
Fe O |
|
|
FeO |
|
|
|
|
|
3 |
4 |
|
|
|
|
|
|
циации оксида Fe3O4 увеличивается быстрее упругости диссоциации оксида
FeO. При 570оС P |
= P |
, то есть прочность оксидов одинакова. |
|||
O2(FeO) |
O2(Fe3O4 ) |
|
|
|
|
При температурах выше 570оС P |
|
< |
P |
. Это означает, что при |
|
|
O2(FeO) |
|
O2(Fe3O4 ) |
|
|
высоких температурах наиболее устойчивым из оксидов железа является FeO. Из сказанного выше следует, что в зависимости от температуры окисле-
ние металлического железа до высшего его оксида может протекать по сле- дующим схемам:
1.При температурах менее 570оС металлическое железо при взаимодействии с кислородом образует оксид Fe3O4 по реакции (7.8), который затем превра-
щается в Fe2O3 по реакции (7.6).
2.При температурах выше 570оС в результате взаимодействия металлического железа с кислородом образуется оксид FeO по реакции (7.2), после чего про- текают реакции (7.4) и (7.6).
Вполе диаграммы на рисунке 7.1 можно выделить следующие области. Область I диаграммы является полем устойчивости оксида Fe2O3. В сис-
темах, состояние которых описывается точками в этом поле диаграммы, вы-
полняется условие P |
> P |
> P |
> P |
. При этом |
O2(ф) |
O2(Fe2O3 ) |
O2(Fe3O4 ) |
O2(FeO) |
|
металлическое железо, а также оксиды FeO и Fe3O4 должны быть окислены до
Fe2O3.
4
Область ΙΙ диаграммы является полем устойчивости оксида Fe3O4. В сис-
темах, состояние которых описывается точками в этом поле диаграммы, вы-
полняется условие P |
> P |
> P |
> P |
. При этом |
O2(Fe2O3 ) |
O2(ф) |
O2(Fe3O4 ) |
O2(FeO) |
|
оксид Fe2O3 подвергаются диссоциации по реакции (7.6), а металлическое же-
лезо и FeO окисляются до Fe3O4 по реакциям (7.2), (7.4) и (7.8).
Область ΙΙΙ диаграммы является полем устойчивости оксида FeO. В сис- темах, состояние которых описывается точками в этом поле диаграммы, вы-
полняется условие P |
> P |
> P |
> P |
. При этом |
O2(Fe2O3 ) |
O2(Fe3O4 ) |
O2(ф) |
O2(FeO) |
|
оксиды Fe2O3 и Fe3O4 подвергаются диссоциации по реакциям (7.6) и (7.4), а
металлическое железо окисляется до FeO по реакции (7.2).
Область ΙV диаграммы является полем устойчивости металлического же- леза. В системах, состояние которых описывается точками в этом поле диа-
граммы, окисление железа не происходит, |
так как выполняется условие |
|||
P |
> P |
> P |
> P |
. |
O2(Fe2O3 ) |
O2(Fe3O4 ) |
O2(FeO) |
O2(ф) |
|
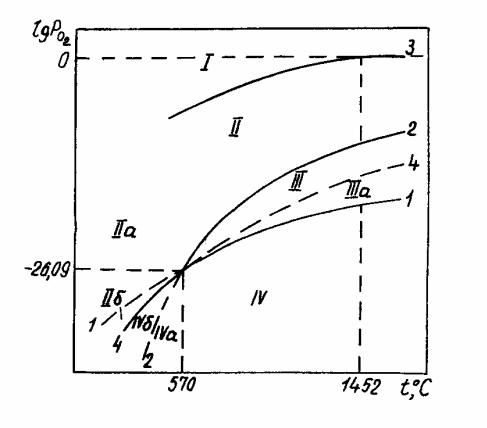
5
1 – для FeO в реакции (7.2); 2 – для Fe3O4 в реакции (7.4); 3 – для Fe2O3 в реакции (7.6); 4 – для Fe3O4 в реакции (7.8)
Рисунок 7.1 – Зависимость упругости диссоциации оксидов железа от темпера- туры
