
Приклади розв’язування задач
Задача
1.
В балоні
об’ємом 10 л знаходиться гелій під тиском
![]() при температурі
при температурі![]() .
Після того, як з балону взяли 10 г гелію,
температура в балоні знизилась до
.
Після того, як з балону взяли 10 г гелію,
температура в балоні знизилась до![]() .
Визначити тиск
.
Визначити тиск![]() гелію, що залишився в балоні.
гелію, що залишився в балоні.
Дано: Розв’язання
|
|
![]() ,
(1)
,
(1)
де
![]() – маса гелію в балоні в кінцевому стані;
– маса гелію в балоні в кінцевому стані;![]() – молекулярна маса гелію;
– молекулярна маса гелію;![]() – газова стала.
– газова стала.
Із рівняння (1) виразимо потрібний тиск:
![]() .
(2)
.
(2)
Масу
![]() виразимо через початкову масу
виразимо через початкову масу![]() та масу гелію, взятого з балона:
та масу гелію, взятого з балона:
![]() .
(3)
.
(3)
Масу
![]() знайдемо з рівняння Менделєєва-Клапейрона,
застосувавши його до початкового стану:
знайдемо з рівняння Менделєєва-Клапейрона,
застосувавши його до початкового стану:
![]() .
(4)
.
(4)
Підставивши
вираз для маси
![]() в (3), а вираз для
в (3), а вираз для![]() в (2), знайдемо:
в (2), знайдемо:
![]() або
або
![]() .
(5)
.
(5)
Проведемо обчислення за формулою (5):
![]() .
.
Задача
2. Балон
містить
![]() кисню та
кисню та![]() аргону. Тиск суміші1
МПа,
температура
аргону. Тиск суміші1
МПа,
температура
![]() .
Вважаючи газ ідеальним, визначити об’ємV
балона.
.
Вважаючи газ ідеальним, визначити об’ємV
балона.
Дано:
Розв’язання
За
законом Дальтона тиск суміші дорівнює
сумі парціальних тисків газів, що входять
до складу суміші. Згідно рівняння
Менделєєва-Клапейрона парціальні тиски
газів
![]() кисню та
кисню та![]() аргону
аргону
![]() ,
,
![]() .
.
Отже,
за законом Дальтона тиск суміші газів
![]() або
або![]() ,
,
звідки
об`єм балона
![]() . (1)
. (1)
Враховуючи,
що
![]() та
та![]() , (див. таблицю додатків), проведемо
обчислення:
, (див. таблицю додатків), проведемо
обчислення:
![]() .
.
Задача
3.
При
нагріванні ідеального газу на
![]() при постійному тиску об`єм його
збільшується на
при постійному тиску об`єм його
збільшується на![]() від початкового об’єму. Знайти початкову
температуру газу.
від початкового об’єму. Знайти початкову
температуру газу.
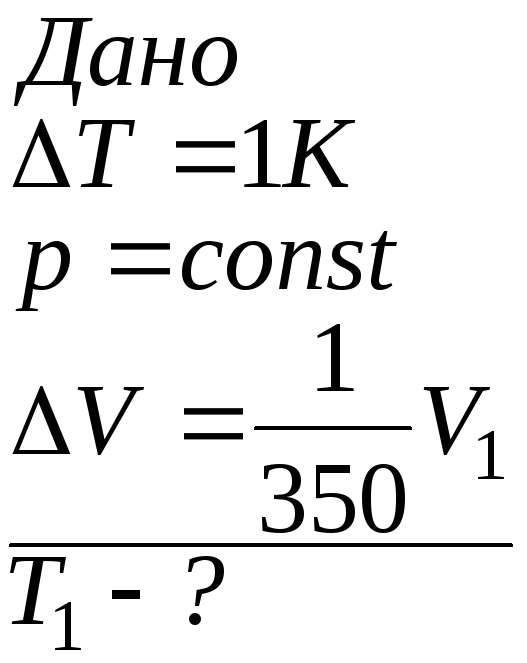
Розв’язання
Оскільки нагрівання газу проходить при постійному тиску, то стан газу можна описати за допомогою рівняння Бойля-Маріотта:
![]() ,
(1)
,
(1)
де
![]() –
параметри початкового стану газу,
–
параметри початкового стану газу,![]() –
кінцевого.
–
кінцевого.
Згідно
умові задачі, об’єм газу
![]() при нагріванні збільшується на
при нагріванні збільшується на![]() ,
отже
,
отже![]() ,
а температура
,
а температура![]() газу збільшується на
газу збільшується на![]() ,
тобто
,
тобто![]() .
.
Виходячи з цього, рівняння (1) можна записати у вигляді:
![]() .
(2)
.
(2)
Розв’язавши
рівняння (2) відносно
![]() ,
отримаємо:
,
отримаємо:
![]()
або
![]() ,
звідки
,
звідки![]() .
.
Обчислюємо:

Задача
4.
Суміш
азоту та гелію при температурі
![]() С
знаходиться під тиском
С
знаходиться під тиском![]() .
Маса азоту складає 70 % від загальної
маси суміші. Знайти концентрацію молекул
кожного з газів.
.
Маса азоту складає 70 % від загальної
маси суміші. Знайти концентрацію молекул
кожного з газів.
Дано: Розв’язання
П ри
даному тиску газ можна вважати ідеальним,
отже він може бути описаний основним
рівнянням молекулярно-кінетичної
теорії:
ри
даному тиску газ можна вважати ідеальним,
отже він може бути описаний основним
рівнянням молекулярно-кінетичної
теорії:
![]() ,
(1)
,
(1)
де
![]() концентрація
молекул,
концентрація
молекул,![]() стала
Больцмана,
стала
Больцмана,![]() термодинамічна
температура.
термодинамічна
температура.
Тиск ідеального газу, як видно з рівняння (1), не залежить від виду газу. Воно дозволить знайти концентрацію молекул суміші і, за відомим процентним складом, – концентрацію кожного газу. Процентний склад газів задано за масою. Отже маса кожного з них:
![]() ;
;
![]() ;
(2)
;
(2)
де
![]() і
і![]() відсотковий
склад відповідно азоту і гелію;
відсотковий
склад відповідно азоту і гелію;![]() маса суміші.
маса суміші.
З іншого боку, маса кожного з газів
![]() ;
;
![]() ,
(3)
,
(3)
де
![]() об`єм
газу;
об`єм
газу;![]() молекулярна
маса;
молекулярна
маса;![]() стала
Авогадро (
стала
Авогадро (![]() маса
молекули.)
маса
молекули.)
Порівнявши праві частини рівнянь (2) і (3), отримаємо:
![]() ;
;
![]() ,
,
звідки
![]() .
.
Оскільки
![]() ,
то
,
то![]() ,
,
![]() .
.
Задача
5.
Знайти
середньоквадратичну швидкість, середню
кінетичну енергію поступального руху
і середню повну енергію молекул гелію
і азоту при температурі
![]() .
Визначити повну енергію всіх молекул
100 г кожного з газів.
.
Визначити повну енергію всіх молекул
100 г кожного з газів.
Дано:
Р озв’язання
озв’язання
Середня кінетична енергія поступального руху молекул будь-якого газу визначається за термодинамічною температурою:
![]() ,
(1)
,
(1)
де
![]() стала
Больцмана,
стала
Больцмана,
![]()
Як бачимо, середні енергії поступального руху однієї молекули і гелію, і азоту однакові.
Середньоквадратична швидкість молекул газу залежить від маси його молекул:
![]() ,
(2)
,
(2)
де
![]() маса
однієї молекули.
маса
однієї молекули.
Для
розрахунку
![]() рівняння (2) можна замінити, якщо помножити
чисельник і знаменник на
рівняння (2) можна замінити, якщо помножити
чисельник і знаменник на![]() Тоді
Тоді
![]() ,
де
,
де
![]() .
.
Для
гелію
![]() ,
для азоту
,
для азоту![]()
Середня повна енергія молекули залежить не тільки від температури, а й від будови молекул – від числа ступенів свободи і:
![]() .
(3)
.
(3)
Гелій
– одноатомний газ, звідки
![]() тоді
тоді
![]() .
.
Азот
– двохатомний газ, отже,
![]() а
а
![]() .
.
Повну
кінетичну енергію всіх молекул, яка
дорівнює для ідеального газу його
внутрішній енергії, можна знайти, як
добуток
![]() на число N усіх молекул
на число N усіх молекул
![]() .
(4)
.
(4)
В
свою чергу,
![]() , (5)
, (5)
де
![]() маса
всього газу; відношення
маса
всього газу; відношення![]() число
молів;
число
молів;![]() число Авогадро.
число Авогадро.
Повна енергія всіх молекул після підстановки рівнянь (3) і (5) в (4) має вигляд:
![]()
Для
гелію число
![]() для
азоту
для
азоту
![]()
Задача
6. Знайти
середню кінетичну енергію
![]() обертального руху однієї молекули кисню
при температуріТ
=
286
К,
а також кінетичну енергію
обертального руху однієї молекули кисню
при температуріТ
=
286
К,
а також кінетичну енергію
![]() обертального руху всіх молекул цього
газу, якщо його
обертального руху всіх молекул цього
газу, якщо його![]() .
.
Розв’язання
На
кожну ступінь вільності молекули газу
припадає однакова середня енергія,
виражена формулою
![]() .
Оскільки молекула кисню двохатомна, і
відповідно, володіє двома обертальними
ступенями вільності, то середня кінетична
енергія обертального руху молекули
кисню:
.
Оскільки молекула кисню двохатомна, і
відповідно, володіє двома обертальними
ступенями вільності, то середня кінетична
енергія обертального руху молекули
кисню:
![]()
Підставивши в цю формулу значення k і Т та обчисливши, отримаємо:
![]()
Середня кінетична енергія обертального руху всіх молекул газу виражається відношенням:
![]() (1)
(1)
Якщо
врахувати, що число молекул системи
дорівнює добутку сталої Авогадро на
кількість речовини
![]() ,
тобто:
,
тобто:
![]() ,
,
то рівняння (1) можна переписати у вигляді:
![]() .
.
Підставивши значення величин, отримаємо:
![]() .
.
Задача
7.
Вирахувати
середню довжину вільного пробігу молекул
азоту і в’язкість при тиску
![]() і температурі
і температурі![]() .
Як зміняться знайдені величини, якщо
об’єм газу збільшити удвічі: а) при
постійному тиску; б) при постійній
температурі? Ефективний діаметр молекул
азоту
.
Як зміняться знайдені величини, якщо
об’єм газу збільшити удвічі: а) при
постійному тиску; б) при постійній
температурі? Ефективний діаметр молекул
азоту![]()
Дано:
Р озв’язання
озв’язання
Середню
довжину вільного пробігу
![]() і коефіцієнти переносу можна вирахувати
за формулами:
і коефіцієнти переносу можна вирахувати
за формулами:
![]() (1)
(1)
![]() (2)
(2)
![]() (3)
(3)
Тут
![]() концентрація
молекул газу;
концентрація
молекул газу;![]() середня
швидкість молекул;
середня
швидкість молекул;![]() маса
однієї молекули.
маса
однієї молекули.
Концентрацію молекул можна визначити з основного рівняння молекулярно-кінетичної теорії:
![]() (4)
(4)
Рівняння (1)-(3) мають зміст, якщо довжина вільного пробігу, обчислена за формулою (1), набагато менша від лінійних розмірів посудини. Оскільки початковий тиск газу – атмосферний, можна стверджувати, що ця умова буде виконана.
Якщо виразити концентрацію з рівняння (4) і підставити її в (1), то отримаємо:
![]()
Для
підрахунку
![]() підставимо у вираз (3) формулу (1):
підставимо у вираз (3) формулу (1):
![]() (5)
(5)
де
![]() .
Отже,
.
Отже,
![]() .
.
Як бачимо з виразу (1), довжина вільного пробігу залежить тільки від концентрації молекул. Якщо об’єм її збільшити удвічі, то концентрація удвічі зменшиться. Отже,
![]() .
.
Індекси “1” і “2” відповідають стану газу до і після розширення.
В рівняння для коефіцієнта дифузії входить не тільки довжина вільного пробігу, а й середня швидкість. Отже:
![]() ,
,
При постійному тиску об’єм прямо пропорційний термодинамічній температурі:
![]() ,
тому
,
тому
![]()
При сталій температурі
![]() .
.
Як видно з виразу (5), в’язкість залежить тільки від швидкості молекул, тобто від температури (всі інші величини сталі):
![]() ,
,
а
це означає, що при постійному тиску
![]() .
.
При
постійній температурі коефіцієнт
![]() не змінюється.
не змінюється.
Задача
8.
Температура окису азоту NO
![]() Визначити частку
молекул,
швидкість яких лежить в інтервалі від
Визначити частку
молекул,
швидкість яких лежить в інтервалі від
![]() до
до![]()
|
Дано: T=300 K
––––––––––––– N/N – ? |
Газ,
який ми розглядаємо, знаходиться в стані
рівноваги і, згідно з розподілом
Максвелла, відносне число молекул,
швидкість яких знаходиться в інтервалі
від
![]() до
до![]() ,
,
![]()
де
![]() функція
Максвелла;
функція
Максвелла;![]() настільки
малий діапазон швидкостей, що в його
межах
настільки
малий діапазон швидкостей, що в його
межах![]()
В
умові задачі потрібно визначити частку
молекул, швидкість яких лежить в діапазоні
![]()
![]()
Якщо в цьому інтервалі функцію Максвелла можна вважати достатньою постійною, то величину, яку ми шукали, можна обчислювати за наближеною формулою:
![]() (1)
(1)
Таке
наближення відповідає тому, що на мал.
3 заштриховану площу можна прирівняти
до площі прямокутника з основою
![]() і висотою
і висотою![]() .
.
Отже,
спочатку потрібно знайти значення
функції Максвелла при
![]() ,
,![]() і визначити, яку похибку дає використання
рівняння (1).
і визначити, яку похибку дає використання
рівняння (1).
Функція Максвелла має вигляд:
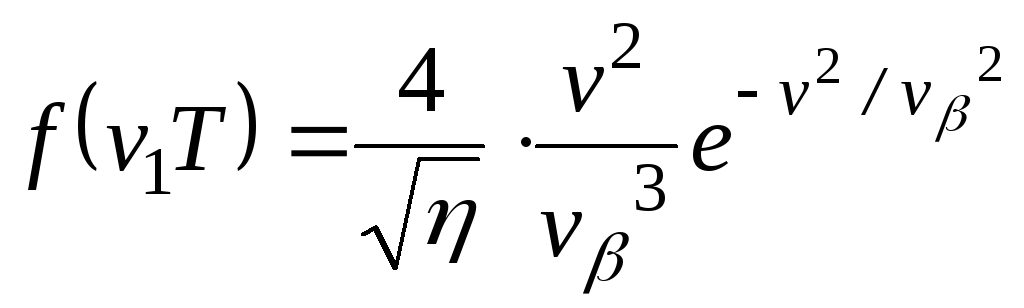 ,
(2)
,
(2)
де
![]() найбільш
імовірна швидкість молекул,
найбільш
імовірна швидкість молекул,
![]() (3)
(3)
Для того, щоб спростити підрахунки спочатку знайдемо найбільш імовірну швидкість з рівняння (3):
![]() .
.
Тоді
![]() ;
;![]()
Це означає, що при використанні виразу (1) ми допустили відносну похибку
 тобто
7%.
тобто
7%.
Отже, рівність (1) можна використовувати з вказаною точністю. Тоді частка молекул, швидкість яких лежить в даному інтервалі
![]() тобто
0,4%.
тобто
0,4%.
Задача
9. Середня
довжина вільного пробігу молекули
вуглекислого газу
![]() за нормальних умов дорівнює 40 км.
Визначити середню арифметичну швидкість
за нормальних умов дорівнює 40 км.
Визначити середню арифметичну швидкість![]() молекули і число зіткнень, які має
молекула за 1с.
молекули і число зіткнень, які має
молекула за 1с.
Дано:
Р озв’язання
озв’язання
Середня арифметична швидкість молекул визначається за формулою:
![]() ,
,
де
![]() – молекулярна маса речовини. Підставимо
числові дані і отримаємо:
– молекулярна маса речовини. Підставимо
числові дані і отримаємо:
![]() ,
,
де
![]()
Отже,
![]() .
.
Середнє
число
![]() зіткнень молекул за 1с визначається
відношенням середньої швидкості
зіткнень молекул за 1с визначається
відношенням середньої швидкості![]() молекули до середньої довжини її
вільного пробігу
молекули до середньої довжини її
вільного пробігу![]()
![]()
Підставивши
в цю формулу значення
![]() і
і![]() отримаємо
отримаємо![]()
Задача
10.
Обчислити
питомі теплоємності при постійному
об’ємі
![]() та постійному тиску
та постійному тиску![]() неону та водню, якщо вважати ці гази
ідеальними.
неону та водню, якщо вважати ці гази
ідеальними.
Розв’язання
Питомі теплоємності ідеальних газів виражаються формулами:
![]() ,
(1)
,
(1)
![]() ,
(2)
,
(2)
де
і
–
число ступенів вільності молекул газу;
М
–
молярна маса. Для неону (одноатомний
газ) і
=
3;
![]() .
.
Тоді
![]() ,
,
![]() .
.
Для
водню (двоатомний газ) і
=
5;
![]() .
.
Тоді
![]() ,
,
![]() .
.
Задача
11.
Певний
газ за нормальних фізичних умов має
густину
![]() .
Визначити його питомі теплоємності
.
Визначити його питомі теплоємності![]() і
і![]() ,
а також, який це газ?
,
а також, який це газ?
Розв’язання
Нормальні
фізичні умови:
![]()
Для
визначення виду газу знайдемо його
молярну масу
![]() ,
скориставшись рівнянням Менделєєва-Клапейрона:
,
скориставшись рівнянням Менделєєва-Клапейрона:
![]() ,
,
звідки
![]() ,
але
,
але![]() густина
газу. Тоді
густина
газу. Тоді![]()
Обчислимо
![]() .
.
Це значення молярної маси водню. Отже, цей газ – водень.
Для
водню
![]() число ступенів вільностіі
=
5.
число ступенів вільностіі
=
5.
Тоді
![]() ,
,
![]() .
.
Задача
12.
Визначити
кількість теплоти, що поглинається
воднем масою
![]() при його нагріванні від температури
при його нагріванні від температури![]() до температури
до температури![]() при постійному тиску. Знайти також зміну
внутрішньої енергії газу та виконану
роботу.
при постійному тиску. Знайти також зміну
внутрішньої енергії газу та виконану
роботу.
Дано:

Кількість
теплоти
![]() ,
що поглинається воднем при ізобарному
нагріванні визначається за формулою :
,
що поглинається воднем при ізобарному
нагріванні визначається за формулою :
![]() (1)
(1)
де
![]() маса
газу;
маса
газу;![]() його
питома теплоємність при постійному
тиску;
його
питома теплоємність при постійному
тиску;![]() зміна
температури газу.
зміна
температури газу.
Як
відомо,
![]() .
Підставивши цей вираз
.
Підставивши цей вираз![]() у формулу (1), отримаємо:
у формулу (1), отримаємо:
![]() ,
,
![]()
Внутрішня
енергія
![]() ,
отже, зміна внутрішньої енергії
,
отже, зміна внутрішньої енергії![]() .
.
Підставимо
значення:
![]() .
.
Роботу розширення газу визначимо за формулою І-го закону термодинаміки:
![]() ,
,
звідки
![]() .
.
Обчислимо: А=291 кДж – 208 кДж = 83кДж.
Задача
13.
Холодильна
машина працює за оборотним циклом Карно
в інтервалі температур
![]() і
і![]() .
Робоче тіло – азот, маса якогоm
= 0,2 кг. Знайти кількість теплоти, що
відбирається від охолодженого тіла та
роботу зовнішніх сил за цикл, якщо
відношення максимального об’єму до
мінімального дорівнює b
= 5.
.
Робоче тіло – азот, маса якогоm
= 0,2 кг. Знайти кількість теплоти, що
відбирається від охолодженого тіла та
роботу зовнішніх сил за цикл, якщо
відношення максимального об’єму до
мінімального дорівнює b
= 5.
Дано: Розв’язання
Я кщо
холодильна машина працює за циклом
Карно, то ізотермічне стиснення робочого
тіла, що супроводжується роботою
зовнішніх сил, відбувається при більш
високій температурі
кщо
холодильна машина працює за циклом
Карно, то ізотермічне стиснення робочого
тіла, що супроводжується роботою
зовнішніх сил, відбувається при більш
високій температурі![]() (дільниця 1–2). При цьому робоче тіло
віддає в навколишнє середовище, що
виконує роль термостата, кількість
теплоти
(дільниця 1–2). При цьому робоче тіло
віддає в навколишнє середовище, що
виконує роль термостата, кількість
теплоти![]() .
На дільниці 3–4 при більш низькій
температурі
.
На дільниці 3–4 при більш низькій
температурі![]() відбувається ізотермічне розширення
робочого тіла, при цьому від тіла, що
охолоджується, віднімається кількість
теплоти
відбувається ізотермічне розширення
робочого тіла, при цьому від тіла, що
охолоджується, віднімається кількість
теплоти![]() .
.
Згідно з першим законом термодинаміки робота за цикл дорівнює повній кількості теплоти, що отримується та віддається за цикл:
![]()
Як бачимо із графіка, робота газу за цикл у вказаному напрямку від’ємна . Робота зовнішніх сил за цикл:
![]() .
(1)
.
(1)
При ізотермічному розширенні
![]() .
(2)
.
(2)
Як
бачимо із графіка, мінімальний об’єм
за цикл
![]() ,
максимальний –
,
максимальний –![]() ,
а
,
а
![]() .
(3)
.
(3)
Другий
та третій стан лежать на одній адіабаті,
проведеній в інтервалі температур від
![]() до
до![]() .
Отже ,
.
Отже ,
 або
або
 .
(4)
.
(4)
Перемноживши почленно рівняння (3) та (4) , отримаємо:
 (5)
(5)
Підставимо вираз (5) у (2)
![]() .
.
Азот
– газ двохатомний, отже коефіцієнт
Пуассона
![]() тоді
тоді![]() .
.
Для оборотного циклу справедливе співвідношення:
![]() або
або
![]() .
(6)
.
(6)
Щоб знайти роботу зовнішніх сил за цикл, виразимо Q1 з рівняння (6) та підставимо в рівняння (1):
![]() .
.
Задача 14. Капілярну трубку з дуже тонкими стінками прикріпили до коромисла ваги, після чого вага була врівноважена. До нижнього кінця капіляра торкнулись поверхнею води і при цьому для врівноваження
капіляра
довелось добавити вантаж
![]() .
Визначити радіус капіляра.
.
Визначити радіус капіляра.
Дано: Розв’язання
С или
поверхневого натягу діють на внутрішню
та зовнішню поверхні трубки. Враховуючи
невелику товщину стінок трубки, можна
вважати радіуси кривини поверхонь
рідини біля стінок капіляра однаковими
за величиною всередині та ззовні трубки.
или
поверхневого натягу діють на внутрішню
та зовнішню поверхні трубки. Враховуючи
невелику товщину стінок трубки, можна
вважати радіуси кривини поверхонь
рідини біля стінок капіляра однаковими
за величиною всередині та ззовні трубки.
Отже, однаковими можна вважати і сили, що діють на внутрішню та зовнішню поверхні трубки.
Сила, що діє на внутрішню поверхню, дорівнює вазі води, яка піднялась в капілярі під дією сил поверхневого натягу, а зміна ваги капіляра дорівнює подвійній вазі цієї води, тобто:
![]() .
.
Коефіцієнт поверхневого натягу води:
![]() ,
,
де
![]() .
Звідси:
.
Звідси:
![]() ,
,
отже,
![]() .
.
Задача 15. Знайти додатковий тиск в мильній бульбашці діаметромd= 10 мм . Визначити також роботуA, яку треба виконати щоб надути цю бульбашку .
Дано:
Розв’язання
П лівка
мильної бульбашки має дві сферичні
поверхні – зовнішню та внутрішню. Обидві
поверхні тиснуть на повітря, що знаходиться
всередині бульбашки. Оскільки товщина
плівки дуже мала, то діаметри обох
поверхонь практично однакові. Тому
додатковий тиск
лівка
мильної бульбашки має дві сферичні
поверхні – зовнішню та внутрішню. Обидві
поверхні тиснуть на повітря, що знаходиться
всередині бульбашки. Оскільки товщина
плівки дуже мала, то діаметри обох
поверхонь практично однакові. Тому
додатковий тиск![]() ,
,
де r – радіус бульбашки.
Оскільки
![]() ,
то
,
то
![]() .
.
Підставивши
в цю формулу значення
![]() таd,
отримаємо:
таd,
отримаємо:
![]() .
.
Тоді
робота
![]() .
.
КОНТРОЛЬНА РОБОТА № 2
ЛІТЕРАТУРА
для підготовки до виконання контрольної роботи № 2
1. Молекулярна фізика: 1. p.13-15; 2. p.3. §§ 1.1-1.5. 3. §§ 8.3-8.4,
§§ 10.1-10.12; 4. §§ 43-48; 5. §§ 79-103.
2. Термодинаміка: 1. p.16. 2. p.2 , гл.1,4. 3. §§ 9.1-9.6, §§ 11.1-11.5
4. §§ 50-59, 66- 69; 5. §§ 104-109.
1. І.М.Кучерук, І.Т.Горбачук, П.П.Луцик. Загальний курс фізики, ч.1. Київ: Техніка, 1999.
2. І.Г.Богацька, Д.В. Головко, А.А. Маляренко, Ю.Л. Ментковський. Загальні основи фізики. Київ: Либідь, 1998.
3. А.А.Детлаф, Б.М.Яворский. Курс физики. М.:Высшая школа, 1989.
4. Т.И.Трофимова. Курс физики. М.: Высшая школа, 1990.
5. И.В.Савельев. Курс общей физики. т.1. М.: Наука, 1982.
ТАБЛИЦЯ ВАРІАНТІВ ДО КОНТРОЛЬНОЇ РОБОТИ №2
(Номер варіанту відповідає останній цифрі номера залікової книжки)
|
Варіант |
Номери задач | |||||||
|
0 |
2.03 |
2.11 |
2.29 |
2.39 |
2.48 |
2.57 |
2.66 |
2.78 |
|
1 |
2.04 |
2.13 |
2.20 |
2.38 |
2.41 |
2.58 |
2.67 |
2.70 |
|
2 |
2.02 |
2.18 |
2.27 |
2.34 |
2.46 |
2.59 |
2.63 |
2.73 |
|
3 |
2.01 |
2.14 |
2.22 |
2.31 |
2.43 |
2.52 |
2.65 |
2.71 |
|
4 |
2.00 |
2.15 |
2.25 |
2.35 |
2.45 |
2.54 |
2.62 |
2.72 |
|
5 |
2.07 |
2.10 |
2.21 |
2.30 |
2.42 |
2.50 |
2.64 |
2.74 |
|
6 |
2.05 |
2.12 |
2.24 |
2.33 |
2.47 |
2.55 |
2.61 |
2.75 |
|
7 |
2.06 |
2.16 |
2.23 |
2.36 |
2.44 |
2.51 |
2.68 |
2.76 |
|
8 |
2.09 |
2.17 |
2.26 |
2.32 |
2.49 |
2.53 |
2.60 |
2.79 |
|
9 |
2.08 |
2.19 |
2.28 |
2.37 |
2.40 |
2.56 |
2.69 |
2.77 |

