
- •Р.Б. Николаева, с.В. Сайкова
- •Часть 2.
- •Учебное пособие
- •Список принятых сокращений и условных обозначений1
- •Введение
- •Водород
- •Свойства и применение
- •Распространенность и получение водорода. Водородная энергетика
- •Галогены
- •Общая характеристика. Получение
- •Простые вещества
- •Галогениды водорода
- •Кислородосодержащие соединения фтора
- •Кислородосодержащие соединения аналогов фтора
- •Галиды галогенов
- •Галид-оксиды галогенов
- •Халькогены
- •Общая характеристика
- •Простые вещества
- •Халькогениды водорода
- •Перхалькогениды
- •Кислородосодержащие соединения
- •Галиды и оксид-галиды
- •Экологический аспект переработки сульфидных руд
- •Подгруппа азота
- •Общая характеристика
- •Простые вещества
- •Соединения с водородом
- •Гидразин и гидроксиламин
- •Кислородосодержащие соединения
- •Удобрения. Проблема связывания азота
- •Сульфиды
- •Галиды и оксогалиды
- •Группа p-элементов
- •Нахождение в природе, получение
- •Простые вещества
- •Соединения с водородом
- •Соединения с металлами
- •Кислородосодержащие соединения
- •Углекислый газ. Использование и проблемы
- •Силикатное стекло
- •Сульфиды
- •Азотсодержащие соединения р-элементов IV группы
- •III-группа p-элементов
- •Общая характеристика
- •Нахождение в природе и получение простых веществ
- •Физические свойства простых веществ
- •Производство алюминия. Сплавы
- •Химические свойства простых веществ
- •Соединения с водородом
- •Кислородосодержащие соединения
- •Соединения бора с азотом
- •S-элементы
- •Общая характеристика. Простые вещества
- •Соединения s-элементов
- •12000С ⎧→ CaSiO3(цемент)
- •Благородные газы
- •Некоторые закономерности периодической системы
- •D-элементы
- •Общая характеристика
- •Нахождение в природе
- •Получение d-металлов
- •Физические свойства
- •Химические свойства простых веществ
- •Кислородосодержащие соединения
- •Соли d-элементов
- •Комплексные соединения
- •F-элементы
- •Лантаноиды
- •Актиноиды
- •Заключение
- •Литература Основная
- •Дополнительная
- •Содержание
- •IV группа p-элементов.................................................................................................................................................52
- •III-группа p-элементов................................................................................................................................................68
Некоторые закономерности периодической системы
Периодическая система Д.И. Менделеева – путеводная звезда для исследователей не только в химии.
Н. Бор
В предыдущих разделах рассматривались закономерности в изменении свойств s- и p-элементов и их соединений в подгруппах. А теперь кратко остановимся на их изменении впериодах.
При движении в последних слева направо за счет роста Z и снижения r значения Э.О.элементовувеличиваются, поэтому, как правило, наблюдается следующее:
1). В химических связях простых веществ снижается доля металличности за счет роста ковалентности, причем во втором и третьем периодах доподгруппыуглеродаэтоповышаетпрочностькристаллических решеток, а правее – наоборот. И не только за счет все большего числа НЭП в атомах элементов, но главное, из-за все меньшейкоординированностиатомов решетки простого вещества. Так, значение к.ч. к VII группе (Г2 ) снижается до 1, а у БГ – до нуля.
2). Восстановительныесвойства веществ, содержащих Э в любой (кроме высшей)одинаковойст.ок. (в том числе и в нулевой)снижаются, аокислительныев любой ст.ок. (кроме низшей)растут.
3). Усиливаютсякислотныесвойства соединений (сравним диссоциацию в воде NaOH и ClOH, т.е. HClO). И не только гидроксидов и оксидов, но и других бинарных веществ: сульфидов, галидов и т.п. Поскольку в связях: Э− O, Э− S, Э− Г и т.д., - из-за уменьшения разности Э.О. элементов снижается доляионностиза счет ростаковалентности. Поэтому становится все более обусловленным существование Э не в виде катиона (оснóвные свойства), как в случае соединений ЩМ и ЩЗМ, а ванионнойформе, включающей данный Э в качестве ц.а. (AsS ,33− IF4− и т.п.), что указывает на кислотные свойства исходных бинарных соединений (As2S3 , IF3 и т.п.). И в случае соединений Э с водородом тоже наблюдается изменение свойств от оснóвных (гидриды ЩМ и ЩЗМ) до кислотных (HГ ); отметим, что при этом меняетсязнакполяризацииH, поскольку он имеет среднее значение Э.О. среди элементов главных подгрупп.
В основном, те же закономерности наблюдаются при движении по периодам и для d- и f-элементов (см. следующие разделы).
А завершая рассмотрение химии s- и p-элементов, подчеркнем наличие сходствав их свойствах не только вподгруппах(за счет одинакового числа валентныхэлектронов), но и впериодах(вследствие равенства количествауровнейв атомах элементов, а значит одинакового эффекта ЭЯНЭУ, и равенства числаподуровнейна валентном уровне). Это проявляется в следующем:
а) в способности существовать в одинаковых валентныхсостояниях;
б) в особом сродстве элементов 2-го периода к водороду(из-за их малого
радиуса); а 3-го периода к кислородуифтору(π(p-d)-стабилизация);
в) в сравнительно малой устойчивости элементов четныхпериодов в высшей
степени окисления (эффекты p-, d- и f-сжатий);
г) в стремлении элементов 5-го периода к октаэдрическойкоординации (большой
радиус и большие валентные возможности).
Кроме того, за счет снижения электроотрицательности элементов в периодической таблице как справа налево, так и сверху вниз наблюдается диагональное сходствов кислотно-основных и окислительно-восстановительных свойствах соответствующих веществ, т.е.функциональные аналогии.
Так, примерно одинаковы окислительныесвойства хлора и кислорода; а сходствобораикремниязаключается:
а) в близких значениях I1(8,3 и 8,2 эВ);
б) в непрочности соединений с водородом;
в) в особой устойчивости их фторидных комплексов, а также соединений с
кислородом;
г) в способности оксидов этих элементов легко переходить при нагревании в
стеклообразное состояние;
д) в кислотном характере их гидроксидов;
е) в большом разнообразии состава и структур боратов и силикатов.
Диагональное сходство бериллияиалюминияпроявляется:
a) в способности их простых веществ взаимодействовать со щелочами с
выделением водорода;
б) в пассивирующем действии оксидной пленки на поверхности металлов по отношению к воде и кислороду воздуха; в свойстве этой пленки растворяться в щелочах и кислотах, но утолщаться при действии азотной кислоты;
в) в нелетучести их оксидов и в том, что после прокаливания, они теряют свойство
растворяться в кислотах и в растворах щелочей;
г) в способности их солей в значительной степени подвергаться гидролизу, который сопровождается процессами оляции (в случае Ве до образования ионов
[Be3(OH)3 ⋅ 6H2O]3+со структурой, подобной бензолу);
д) в склонности образовывать анионные комплексы (Na2[BeF4 ] и Na3[AlF ]6 ) и
двойные соли (Na2Be(SO4 )2и NaAl(SO4 )2 );
е) в том, что их хлориды и гидриды состоят из полимеров, например:
⎡ Cl Cl⎤
⎢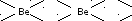 ⎥
n,
⎥
n,
⎢⎥
⎢⎣ Cl Cl⎥⎦
и растворимы в органических жидкостях.
Сходство литияимагниязаключается в следующем:
а) их соединения окрашивают пламя в одинаковый (красный) цвет;
б) оксиды этих элементов реагируют с водой обратимо;
в) их фосфаты, фториды и карбонаты мало растворимы, в отличие от
соответствующих кислых солей; их растворимые соли гигроскопичны;
г) в способности образовывать металлоорганические соединения;
Диагональное сходство проявляется также в существовании границы, включающей элементы: H − Be− Al− Ge− Sb− Po, - выше которой в длиннопериодном варианте таблицы располагаются неметаллы, а ниже – металлы. Последние составляют 4/5 из 105 элементов (внесенных в таблицу Менделеева) в том числе все d- и f-металлы, которые называютпереходными.(Посколькучерезd – элементы, начиная с 4-го периода, а с 6го – ичерезf-Э, осуществляетсяпереходот s- к р-элементам.)
