
- •Лекція № 11. Методи молекулярної біології
- •Гель-електрофорез
- •Створення та скринінг геномних бібліотек
- •Полімеразна ланцюгова реакція
- •Секвенування днк
- •Біоінформатика
- •Експресія рекомбінантних білків
- •Аналіз експресії геному
- •5.Методи дослідження днк-білкових взаємодій.
- •Гель-електрофорез білково-нуклеїнових комплексів
- •Футпринтинг
- •Імунопреципітація хроматину
- •Методи дослідження протеому
- •Рентгеноструктурний аналіз
- •Дослідження структури макромолекул у розчині
- •Методи дослідження одиничних макромолекул
- •Контрольні запитання
- •Рекомендована література
Футпринтинг
Іншим підходом, який використовують для точної локалізації білка на фрагменті ДНК, є футпринтинг ДНК (DNA footprinting). Принцип методу схематично зображено на рис. 16. Кінець одного з ланцюгів мітять радіоактивною міткою. Зазвичай 32Р у складі фосфатного залишку приєднується до попередньо дефосфорильованих 5′-кінців полінуклеотидкіназою, після чого один із кінців фрагмента відрізається рестриктазою (аналогічно відповідному етапу процедури на рис. 12).
Якщо внести в цю ДНК обмежену кількість одноланцюгових розрізів (наприклад, один розріз на фрагмент у середньому), отримаємо випадковий набір мічених фрагментів різної довжини, який можна розділити за допомогою гель-електрофорезу в денатуруючих умовах.
Як агенти, що вносять розриви, найчастіше використовують ДНК-азу І або гідроксилрадикали: обидва агенти розрізають один з ланцюгів ДНК через маленький жолобок. У випадку, коли з фрагментом ДНК взаємодіє білок, ДНК виявляється захищеною в сайті взаємодії: на гелі після електрофорезу можна побачити зону, де відсутні смуги ДНК, або інтенсивність смуг є нижчою порівняно з контрольним результатом деградації вільної ДНК. Довжини верхньої та нижньої смуг, які оточують цю зону, є межами сайта взаємодії відносно мітки.
Аналогічний підхід у комбінації з блот-гібридизацією (так зване непряме кінцеве мічення) дозволяє встановити ступінь захищеності ДНК білками в конкретних геномних зонах. Першим етапом процедури є обмежена деградація ДНК нуклеазою у клітинних ядрах. Після цього виділяють сумарну ДНК і обробляють її рестриктазою: у результаті препарат містить фрагменти ДНК від рестриктного сайта до місця розрізу нуклеазою. Усі ці фрагменти розділюють шляхом електрофорезу, здійснюють блотинг і обробляють нітроцелюлозний фільтр радіоактивно міченим зондом до певної ділянки генома. На авторадіограмі візуалізуються (або ні, якщо ДНК захищена білком) фрагменти ДНК з цієї зони.
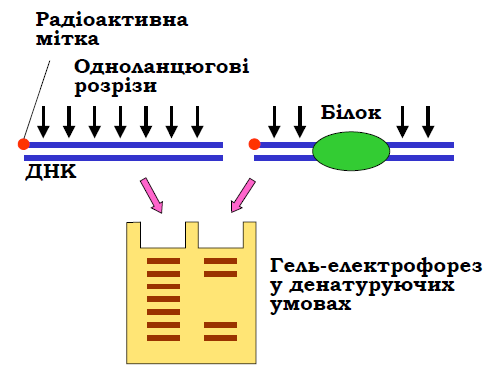
Рис. 16. Футпринтинг ДНК у складі білковонуклеїнового комплексу.
Імунопреципітація хроматину
Метод імунопреципітації (ChIP – Chromatin ImmunoPrecipitation) є потужним засобом установлення наявності білка на певній ділянці ДНК in vivo (рис. 17). Для цього клітини обробляють формальдегідом із метою ковалентного пришивання всіх білків до ДНК. Далі здійснюють лізис клітин, виділяють ДНК і частково її фрагментують. Ковалентні ДНК-білкові комплекси осаджують антитілами, специфічними до конкретного білка (або пропускають через колонку, на якій іммобілізовані антитіла). Отримані комплекси руйнують, видаляючи зшивку хімічним шляхом, і аналізують ДНК, яка була зв’язаною у клітині з даним білком.
Одним із варіантів аналізу може бути ампліфікація ДНК за допомогою ПЛР і наступне секвенування або гібридизація з міченим зондом.
Якщо, наприклад, зробити зшивання в різні моменти після регуляторного сигналу, то можна встановити послідовність зв’язування білків з регуляторними ділянками промотора певного гена.

Рис. 17. Імунопреципітація хроматину.
Якщо білок має численні сайти взаємодії в геномі, до всіх отриманих фрагментів ДНК пришивають промотор РНК-полімерази бактеріофага Т7 і за допомогою полімерази здійснюють транскрипцію in vitro – синтез РНК-копій фрагментів. Далі використовують ці РНК як матриці для зворотної транскрипції у присутності флуоресцентного аналога одного з NTP і отримані флуоресцентно мічені кДНК гібридизують з ДНК-мікроареєм, з’ясовуючи рівень присутності білка в різних ділянках геному.
