
- •Лекція № 11. Методи молекулярної біології
- •Гель-електрофорез
- •Створення та скринінг геномних бібліотек
- •Полімеразна ланцюгова реакція
- •Секвенування днк
- •Біоінформатика
- •Експресія рекомбінантних білків
- •Аналіз експресії геному
- •5.Методи дослідження днк-білкових взаємодій.
- •Гель-електрофорез білково-нуклеїнових комплексів
- •Футпринтинг
- •Імунопреципітація хроматину
- •Методи дослідження протеому
- •Рентгеноструктурний аналіз
- •Дослідження структури макромолекул у розчині
- •Методи дослідження одиничних макромолекул
- •Контрольні запитання
- •Рекомендована література
Лекція № 11. Методи молекулярної біології
-
Клонування, ампліфікація і секвенування ДНК.
-
Клонування ДНК.
-
Гель-електрофорез.
-
Створення та скринінг геномних бібліотек.
-
Полімеразна ланцюгова реакція.
-
Секвенування ДНК.
-
-
Біоінформатика.
-
Експресія рекомбінантних білків.
-
Методи аналізу структури й експресії генів і геномів.
-
Блот-гібридизація.
-
Визначення стартових і кінцевих точок та рівня активності транскрипції.
-
Аналіз експресії геному.
-
-
Методи дослідження ДНК-білкових взаємодій.
-
Гель-електрофорез білково-нуклеїнових комплексів.
-
Футпринтинг.
-
Імунопреципітація хроматину.
-
-
Методи дослідження протеому.
-
Фізичні методи дослідження структури й активності біомакромолекул.
-
Методи безпосереднього спостереження.
-
Рентгеноструктурний аналіз.
-
Дослідження структури макромолекул у розчині.
-
Методи дослідження одиночних макромолекул.
-
Клонування, ампліфікація і секвенування ДНК
Клонування ДНК
Перша проблема, котра постає перед дослідником, – це отримання в достатній кількості предмета свого дослідження. Ефективним підходом, що дозволяє розмножити будь-який конкретний фрагмент ДНК, є техніка клонування цієї ДНК у бактеріальних клітинах: фрагмент, що цікавить, вбудовується у ДНК-вектор з утворенням рекомбінантної молекули ДНК, яка вводиться у клітину (так звана трансформація). Далі залишається зачекати зростання бактеріальної культури – бактерія використовується як своєрідний біореактор.
Як вектор часто використовують бактеріальні плазміни – порівняно невеликі циркулярні молекули ДНК, що існують у клітині незалежно від бактеріальної хромосоми. Основними вимогами до плазміди як вектора є наявність у її складі ориджина реплікації, унікального (одного на плазміду) сайта, що впізнається певною рестриктазою, і гена стійкості до одного з антибіотиків (рис. 1).
Рестриктази – специфічні до невеликих елементів послідовності ендонуклеази, що здійснюють розрізання обох ланцюгів ДНК. Назви рестриктаз (існує кілька сотень таких ферментів) утворюють за таким принципом: перша велика літера позначає рід мікроорганізму, дві маленькі – вид, римські цифри та іноді великі літери – порядковий номер рестриктази серед інших рестриктаз даної бактерії. Наприклад, EcoRI – рестриктаза RI із Escherichia coli. Сайтом рестрикції, що впізнається рестриктазою, є невеликі (чотири, шість, іноді трохи більше пар основ) паліндромні послідовності (див., наприклад, сайт EcoRI на рис. 2). Залежно від типу рестриктази, два розрізи, які вона здійснює, можуть бути розташованими точно один напроти одного у двох ланцюгах, що приводить до утворення так званих тупих (blunt) кінців. Частіше рестриктази залишають взаємно комплементарні 5′-кінцеві (а іноді 3′-кінцеві) одноланцюгові вирости (як на рис. 2) – липкі (sticky) кінці.
Із метою створення рекомбінантної ДНК очищену плазміду, яка містить єдиний сайт певної рестриктази, обробляють цією рестриктазою і отримують лінійний вектор з липкими кінцями (рис. 2).
Далі додають фрагмент ДНК, який було вилучено за допомогою тієї самої рестриктази. За рахунок комплементарної взаємодії між липкими кінцями фрагмента й вектора утворюється циркулярний нековалентний комплекс двох молекул ДНК. Завдяки використанню іншого ключового ферменту рекомбінантної технології – ДНК-лігази – полінуклеотидні ланцюги зшиваються. Найзручнішими є плазмідні вектори, які містять так званий полілінкер – ділянку з певним набором унікальних рестриктних сайтів, що дозволяє підібрати одну з рестриктаз, найпридатнішу для кожного випадку.

Рис. 1. Схема організації плазмідного вектора (Ori – ориджин реплікації,
ampr – ген стійкості до ампіциліну).

Рис. 2. Виготовлення рекомбінантної ДНК на основі плазмідного вектора.
Фрагменти ДНК із тупими кінцями також можна вбудувати у вектор за допомогою лігази, хоча така реакція є на порядок менш ефективною. За допомогою термінальної нуклеотидилтрансферази (фермент, який без участі матриці приєднує нуклеотиди до 3′ кінця) до 3′-кінців фрагмента ДНК можна приєднати, наприклад, одноланцюговий poly(dA)-хвіст, а до 3′-кінців лінійного вектора – poly(dT). При змішуванні між комплементарними одноланцюговими кінцями відбудеться спарювання, остаточне зшивання завершує ДНК-лігаза.
Можна також утворити тупі кінці на фрагментах із липкими кінцями. Для цього або здійснюють видалення одноланцюгових виростів за допомогою нуклеази S1 (нуклеаза, що гідролізує тільки одно ланцюгову ДНК), або липкі кінці забудовують за допомогою фрагмента Кленова ДНК-полімерази І E. coli. Утворений фрагмент із тупими кінцями вбудовують у вектор за щойно описаною процедурою.
Трансформація бактеріальних клітин рекомбінантною плазмідою здійснюється зазвичай у розчині CaCl2 або шляхом електропорації (через суспензію клітин проводиться короткий імпульс електричного струму). В обох випадках підвищується проникність клітинної стінки і рекомбінантна плазміда потрапляє всередину. Зрозуміло, що далеко не всі бактерії отримують плазміду при трансформації. І тут стає в нагоді ген стійкості до антибіотика: достатньо обробити бактеріальну культуру цим антибіотиком, щоб залишити тільки трансформовані клітини. Далі відбувається автономна реплікація плазміди та розмноження самих клітин, що призводить до значного зростання загальної кількості плазмід (рис. 3). Клоновані плазміди виділяють із бактеріальної культури, а обробка їх тією самою рестриктазою, що була використана при виготовленні рекомбінантної молекули, дозволяє вирізати з вектора клонований фрагмент ДНК.
Трансформація бактерій плазмідами є тим ефективнішою, чим меншою за розміром є плазміда. Відповідно, існує обмеження в розмірі фрагментів, що їх можна клонувати описаним шляхом – до 10 тис. пар основ. Альтернативною, але цілком аналогічною технікою, що дозволяє працювати з фрагментами довжиною ~20 тис. пар основ, є клонування ДНК із використання векторів на основі бактеріофага λ. За допомогою рестриктази фрагмент ДНК вбудовується у фагову ДНК, додаються порожні фагові оболонки, і здійснюється збирання фагових частинок in vitro. Рекомбінантними бактеріофагами заражають бактеріальну культуру, де відбувається їхнє розмноження.
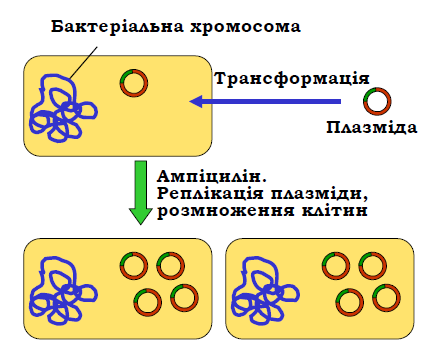
Рис. 3. Розмноження рекомбінантної плазміди в бактеріальних клітинах.
Використовуючи вектори на основі космід, можна клонувати фрагменти ДНК до 40 тис. пар основ. Косміда є плазмідою, яка крім ориджину, сайтів рестрикції та генів стійкості до антибіотиків містить два cos-сайти: липкі кінці лінійної молекули ДНК бактеріофага λ. Саме за рахунок cos-сайтів лінійна молекула фагової ДНК циркуляризується після її проникнення в бактеріальну клітину. У лінійну косміду з такими липкими кінцями вбудовується фрагмент ДНК, який бажано клонувати. Рекомбінантна косміда упаковується in vitro у фагові частинки, якими обробляють бактеріальну культуру. У цьому випадку бактеріофаг використовується як ефективний засіб трансформації: лінійна косміда проникає у клітину, де циркуляризується за рахунок cos-сайтів і бактеріальної лігази. Далі циркулярна косміда розмножується як звичайна плазміда (див. схему на рис. 3).
Для клонування фрагментів ДНК від 100 тис. пар основ використовують спеціально сконструйовані вектори ВАС (Bacterial Artificial Chromosome) і YAC (Yeast Artificial Chromosome). BAC-вектори створено на основі F-плазмід бактерій, YAC-вектор являє собою штучну дріжджову мініхромосому, яка містить центромеру, теломери й точку початку реплікації. У такий вектор можна ввести чужорідний фрагмент ДНК розміром понад 100 тис. пар основ. Така мініхромосома, уведена в дріжджову клітину, буде реплікуватися й поводити себе аналогічно іншим дріжджовим хромосомам при мітотичному поділі. Більшість сучасних векторних систем є поліфункціональними – придатними не тільки для клонування ДНК, а й для експресії рекомбінантних білків, про що йтиметься нижче.
