
- •Лекція № 11. Методи молекулярної біології
- •Гель-електрофорез
- •Створення та скринінг геномних бібліотек
- •Полімеразна ланцюгова реакція
- •Секвенування днк
- •Біоінформатика
- •Експресія рекомбінантних білків
- •Аналіз експресії геному
- •5.Методи дослідження днк-білкових взаємодій.
- •Гель-електрофорез білково-нуклеїнових комплексів
- •Футпринтинг
- •Імунопреципітація хроматину
- •Методи дослідження протеому
- •Рентгеноструктурний аналіз
- •Дослідження структури макромолекул у розчині
- •Методи дослідження одиничних макромолекул
- •Контрольні запитання
- •Рекомендована література
Аналіз експресії геному
Проаналізувати повну програму транскрипції організму чи клітин певного типу за певних фізіологічних умов або у процесі розвитку, а також вирішувати інші завдання, пов’язані з вивченням функціонування цілого геному, дозволяють методи, що базуються на використанні так званих ДНК-мікроареїв (DNA-microarrays) або ДНК-чіпів (DNA-microchips).
Фрагмент ДНК довжиною до 1 тис. пар основ, для якого відомо його розташування в геномі, ампліфікується, і одноланцюгові продукти ампліфікації пришивають до невеликої зони на поверхні предметного скла мікроскопа. Скло розміром 2 × 2 см – ДНК-мікроарей – покрито сіткою ~6 тис. таких мікроплям, кожна з яких містить ДНК певної геномної ділянки. На поверхні ДНК-чіпів синтезуються короткі (до 20 нуклеотидів) олігонуклеотиди: кілька олігонуклеотидів, які походять із однієї ділянки геному, синтезуються поряд.
Таким чином, невелика зона містить ДНК, комплементарну індивідуальній геномній ділянці.
Одну з типових схем використання мікроарея зображено на рис. 14. Сумарна мРНК, отримана з клітин певного типу, використовується як матриця в реакції зворотної транскрипції. Поряд зі звичайними, до реакційної суміші додається флуоресцентний аналог одного з NTP.

Рис. 14. Аналіз сумарної мРНК за допомогою ДНК-мікроарея.
У результаті отримують препарат флуоресцентно міченої кДНК. Після гібридизації з цією кДНК мікроарей аналізують за допомогою флуоресцентного мікроскопа: наявність флуоресцентної плями свідчить про активність певного гена, інтенсивність флуоресценції – про рівень цієї активності.
Експерименти такого типу дозволяють з’ясувати зміни загальної програми експресії генів при змінах зовнішніх умов, активність різних генів у різних тканинах багатоклітинного організму, зміни активності груп генів у процесі диференціювання клітин. Техніка ДНК-мікроареїв широко використовується також у дослідженнях ДНК-білкових взаємодій.
5.Методи дослідження днк-білкових взаємодій.
Вивчення тонких механізмів білково-нуклеїнових взаємодії є здебільшого доступним для різноманітних фізичних методів (див. нижче). Ми розглянемо підходи, що дозволяють встановити сам факт взаємодії та з’ясувати локалізацію певного білка на ДНК in vitro та in vivo.
Гель-електрофорез білково-нуклеїнових комплексів
Оскільки рухливість макромолекул при електрофорезі залежить від їхньої маси та форми, факт зв’язування певного білка з певним фрагментом ДНК легко встановити за допомогою шифт-тесту (shift-assay). Принцип методу є дуже простим: ДНК-білковий комплекс (якщо він утворюється) суттєво гальмується в гелі порівняно з вільною ДНК, що приводить, як правило, до наявності двох смуг ДНК після електрофорезу (рис. 15, а).
При цьому, якщо білок, як це часто буває, вигинає ДНК у сайті взаємодії, рухливість комплексу буде залежати від позиції білка на фрагменті ДНК: максимальну рухливість мають комплекси, у складі яких білок розташований на одному з кінців фрагмента, мінімальну – ті, де білок займає центральну позицію (рис. 15, б). Причиною цієї закономірності є те, що довші (і тому рухливіші) кінцеві ділянки вільної ДНК легше проходять через пори гелю. Відповідно, це дозволяє оцінити локалізацію білка відносно кінців фрагмента ДНК або розділити комплекси, що розрізняють за такою локалізацією.
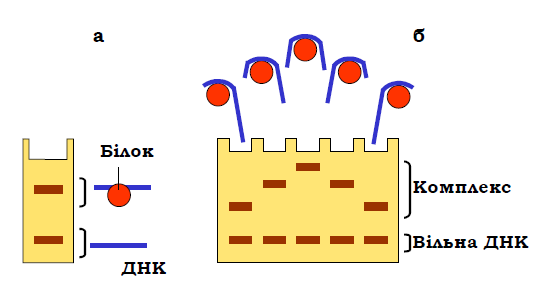
Рис. 15. Гальмування рухливості ДНК-білкового комплексу при гель-електрофорезі (а) та залежність ступеня гальмування від позиції білка на ДНК у випадку вигину ДНК на поверхні білка (б).
