
- •Часть 6. Химический состав живых организмов. Потребности в веществах и энергии
- •Глава 6.1. Элементный состав
- •Супероксиддисмутаза
- •Каталаза
- •Глутатионпероксидаза
- •Витамин е
- •Витамин с
- •Витамин а
- •Биофлавоноиды
- •6.1.7. Щелочноземельные металлы
- •Глава 6.2. Потребность живых организмов в углеводах, липидах, белках и нуклеиновых кислотах
- •Простагландины
- •Лейкотриены
- •Глава 6.3. Витамины
- •Библиографический список
- •Физиологическая химия
Глава 6.2. Потребность живых организмов в углеводах, липидах, белках и нуклеиновых кислотах
Для обеспечения нормальной жизнедеятельности организма необходимо постоянное поступление извне углеводов, липидов, белков, нуклеиновых кислот и веществ, называемых незаменимыми факторами питания. Пища снабжает организм энергией для протекания метаболических реакций и строительным материалом для его воспроизводства. Перечень незаменимых факторов питания существенно различается у отдельных биологических видов и находится в полном соответствии с особенностями обменных процессов для каждого из них.
Часть веществ регулярно поступает с пищей и используется в качестве готовых строительных элементов при различных биосинтетических процессах. Ферментные системы, необходимые для биосинтеза этих веществ, постепенно утрачиваются, что превращает эти вещества в незаменимые (эссенциальные) факторы питания. Для человека такими факторами питания являются незаменимые аминокислоты, эссенциальные жирные кислоты, минеральные вещества и микроэлементы, витамины.
6.2.1. Незаменимые и условно заменимые аминокислоты. Потребность организма в азоте и аминокислотах удовлетворяется за счет потребления пищевого белка, который подвергается в органах пищеварения гидролизу до отдельных аминокислот, поступающих в кровоток. Для синтеза белков организму необходим весь набор аминокислот.
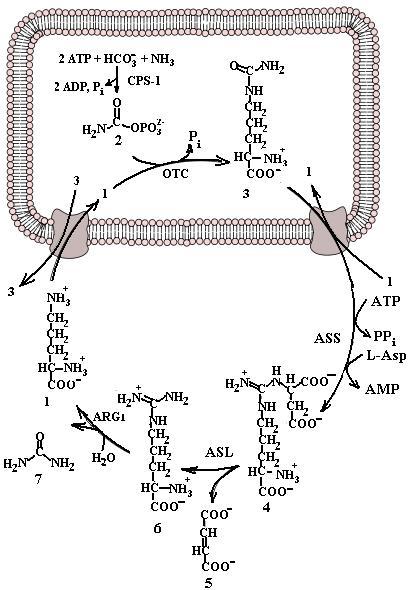
Рис. 6.37. Синтез аргинина в цикле мочевины: 1 – орнитин; 2 – карбамоилфосфат; 3 – цитруллин; 4 – аргининосукцинат; 5 – фумарат; 6 – аргинин; 7 – мочевина; CPS-1 – карбамоилфосфатсинтетаза 1; OTC – орнитин-транскарбамилаза; ASS − аргининосукцинатсинтетаза; ASL − аргининосукцинатлиаза; ARG1 – аргиназа 1 (согласно [17])
У человека синтез восьми аминокислот отсутствует. Эти аминокислоты, поступаемые с пищей, получили наименование незаменимые: валин, лейцин, изолейцин, метионин, фенилаланин, лизин, треонин, триптофан. Цистеин и тирозин образуются из незаменимых аминокислот метионина и фенилаланина, поэтому их называют условно заменимыми аминокислотами. Если метионина и фенилаланина недостаточно в пище, то и цистеин с тирозином становятся незаменимыми аминокислотами. Две другие условно заменимые аминокислоты − аргинин и гистидин − являются незаменимыми для детей младшего возраста, у которых еще недостаточно развиты ферментные системы, осуществляющие синтез этих аминокислот.
Синтез аргинина происходит у человека в печени в цикле мочевины. Как видно из рис. 6.37, часть реакций цикла протекает в митохондриях, часть − в цитоплазме. Для бесперебойного функционирования цикла мочевины необходимо наличие орнитина и аспартата, запасы которых пополняются в результате анаплеротических реакций: орнитин синтезируется из глутаминовой кислоты, а аспартат – путем превращения фумарата в цикле трикарбоновых кислот и переаминирования образовавшегося оксалоацетата. Цистеин в организме образуется из метионина (первичный источник атома серы) и серина (источник углеродного скелета). Сначала метионин превращается в гомоцистеин с образованием на промежуточных стадиях S-аденозилметионина, S-аденозилгомоцистеина. Гомоцистеин, взаимодействуя с серином, дает цистатионин, расщепляющийся далее на цистеин и α-кетобутират (схема (64)).
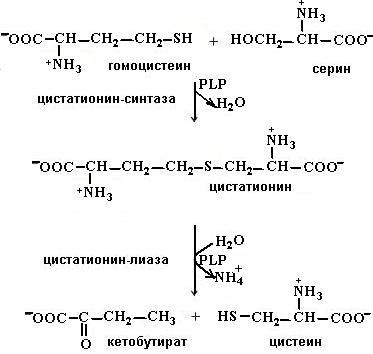 (64)
(64)
Цистатионин-β-синтаза и цистатион-γ-лиаза, ферменты, катализирующие синтез и распад цистатионина, содержат в качестве кофермента пиридоксальфосфат (PLP).
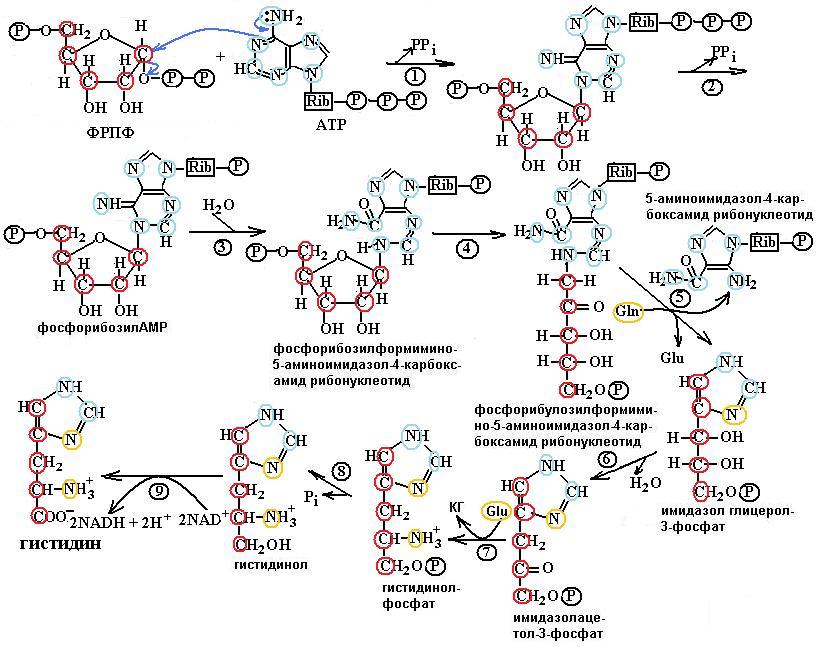
Рис. 6.38. Синтез гистидина. Атомы гистидина, происходящие из 5-фосфорибозил-1-пирофосфата (ФРПФ) и АТР, изображены красным и голубым цветом, атомы азота Gln или Glu – оранжевым. Ферменты, участвующие в синтезе His: 1 – АТР-фосфорибозилтрансфераза; 2 – пирофосфогидролаза; 3 – фосфорибозил-АМР циклогидролаза; 4 – фосфорибозилформимино-5-аминоимидазол-4-карбоксамидрибонуклеотидизомераза; 5 – глутаминамидотрансфераза; 6 – имидазолглицерол-3-фосфатдегидратаза; 7 – гистидинолфосфатаминотрансфераза; 8 – гистидинолфосфатфосфатаза; 9 – гистидинолдегидрогеназа; КГ – α-кетоглутарат
Цистеин используется для синтеза белков, в образовании третичной структуры которых играет главную роль, в синтезе трипептида-антиоксиданта глутатиона, таурина (2-аминоэтилсульфоната), важной составной части желчных кислот, кофермента А и т. д.
Биосинтез гистидина, второй условно заменимой аминокислоты, начинается с 5-фосфорибозил-1-пирофосфата (ФРПФ) с использованием фрагмента аденинового кольца АТР и атома азота глутамина (рис. 6.38). Гистидин, содержащий пять углеродных атомов, катаболизируется до α-кетоглутарата. Промежуточными соединениями этого превращения являются урокановая кислота, 4-имидазолон-5-пропионат, N-формиминоглутамат и глутаминовая кислота (рис. 6.39).
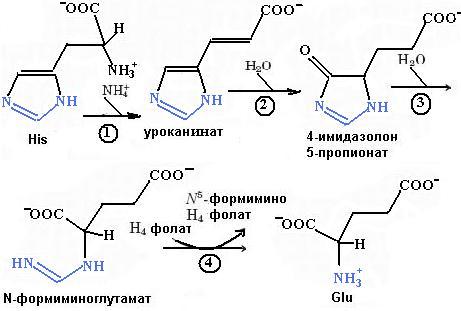
Рис. 6.39. Распад гистидина. Ферменты, катализирующие отдельные стадии этого превращения: 1 – гистидинаммиаклиаза (гистидиназа); 2 – уроканатгидратаза; 3 – имидазолонпропионаза; 4 – глутаматформиминотрансфераза
При декарбоксилировании гистидина в тучных клетках соединительной ткани образуется гистамин, играющий роль нейромедиатора. Это соединение также участвует в развитии иммунных, аллергических и воспалительных реакций, вызывая покраснение кожи и отечность тканей. Гистамин появляется в кровотоке при повреждениях тканей в результате ожога, удара, выполняет функцию пищеварительного гормона, стимулируя секрецию желудочного сока (см. ч. 5 п. 5.1.1), повышает проницаемость капилляров, сокращает гладкую мускулатуру легких, вызывая удушье. Это соединение ответственно за болевой синдром.
Тирозин образуется в результате реакции гидроксилирования фенилаланина, катализируемой монооксигеназой – фенилаланингидроксилазой (рис. 6.40). Коферментом в этой реакции служит 5,6,7,8-тетрагидробиоптерин, атом уходит в молекулу воды, второй внедряется в виде гидроксильной группы в n-положение фенилаланина. Окисленная форма 7,8-дигидробиоптерин восстанавливается с помощью NADH и дигидробиоптеринредуктазы.
В случае пониженной активности фермента фенилаланингидроксилазы происходит переаминирование фенилаланина с образованиием фенилпирувата и продуктов его дальнейшего превращения: фениллактата, фенилацетата, фенилацетилглутамина. Все названные соединения, токсичные для мозговых клеток, выделяются с мочой. Это заболевание называется фенилкетонурией. Чаще всего это наследственное заболевание, обусловленное мутациями в гене фенилаланингидроксилазы, приводящее к снижению активности фермента или полной его инактивации. Большие концентрации фенилаланина препятствуют синтезу из тирозина нейромедиаторов − дофамина, норадреналина.
Распад тирозина до фумарата и ацетоацетата происходит в печени. Сначала тирозин вступает в реакцию трансаминирования с α-кетоглутаратом с образованием n-гидроксифенилпирувата и глутаминовой кислоты. Реакцию катализирует пиридоксаль-зависимый фермент тирозинаминотрансфераза. При окислении n-гидроксифе-нилпирувата с помощью n-гидроксифенилпируватдиоксигеназы имеет место декарбоксилирование, гидроксилирование ароматического ядра и миграция боковой цепи, что приводит к образованию гомогентизиновой кислоты. Кофакторами в этой реакции являются витамин С и ион Fe2+. Под действием диоксигеназы гомогентизиновой кислоты, содержащей ион Fe2+, происходит расщепление ароматического кольца с образованием малеилацетоацетата, изомеризующегося в фумарилацетоацетат, гидролиз которого с помощью фумарилацетоацетатгидролазы приводит к высвобождению фумарата и ацетоацетата (схема (65)). Оба конечных продукта могут окисляться в ЦТК до СО2 и Н2О.
Рис. 6.40
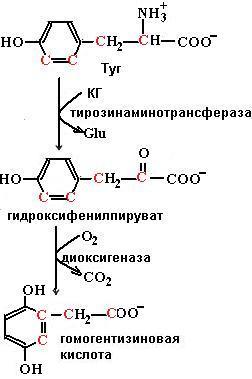
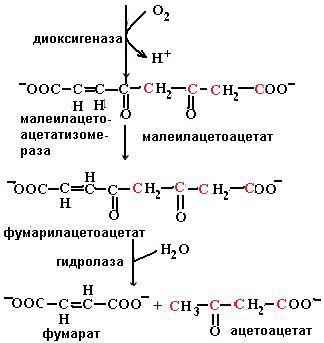 (65)
(65)
В щитовидной железе из тирозина синтезируются гормоны: тироксин и трийодтиронин (см. п. 6.1.9.4). В меланоцитах тирозин превращается в пигменты меланины. Это сложный многоступенчатый процесс, начинающийся с превращения тирозина в диоксифенилаланин (ДОФА) под действием тирозиназы, использующей в качестве кофактора ионы Cu+. Аналогичная реакция протекает в надпочечниках и нервной ткани при синтезе катехоламинов. Фермент, катализирующий эту реакцию в надпочечниках и в нервной ткани, отличается от тирозиназы, является зависимым от ионов Fe2+. Аналогично фенилаланингидроксилазе для протекания этой реакции в качестве кофактора необходим тетрагидробиоптерин (синтез катехоламинов будет подробно рассмотрен в ч. 7).
6.2.2. Полиеновые жирные кислоты. В организме важную роль играют липиды, основная масса которых представлена триацилглицеролами, являющимися в сущности формой депонирования энергии. В состав липидов входят насыщенные и ненасыщенные жирные кислоты. В организме человека это в основном жирные кислоты с четным числом атомов углерода, а по конфигурации двойных связей в ненасыщенных жирных кислотах это цис-изомеры (т. е. ацильные фрагменты находятся по одну сторону двойной связи), что делает алифатическую цепь жирной кислоты изогнутой и приводит к снижению температуры плавления (рис. 6.41). Жирные кислоты с транс-конфигурацией двойной связи, обнаруживаемые, например, в маргаринах, могут поступать в организм человека с пищей. У них отсутствует излом, они имеют более высокую температуру плавления и более твердые по консистенции.
Большинство жирных кислот синтезируется в организме, но есть и незаменимые (эссенциальные) жирные кислоты, синтез которых в организме отсутствует. Это линолевая и α-линоленовая кислоты. Они должны поступать с пищей.
Длинные жирные кислоты синтезируются в эндоплазматическом ретикулуме в основном из стеариновой кислоты путем удлинения ее с помощью малонилСоА. Процесс протекает аналогично синтезу пальмитиновой кислоты: перенос двууглеродного фрагмента от малонилСоА на стеарилСоА, восстановление кетогруппы до гидроксильного остатка с помощью NADPH, дегидратация и восстановление двойной связи с образованием насыщенной жирной кислоты,

Рис. 6.41. Пространственная структура мононенасыщенной олеиновой кислоты с цис-конфигурацией двойной связи между атомами углерода 9 и 10
удлиненной на двууглеродный фрагмент. Отличие лишь в том, что остаток стеарила связан не с ацил-переносящим белком синтазы жирных кислот, а с СоА.
 (66)
(66)
Процесс введения двойных связей в жирные кислоты называется десатурацией. Этот процесс происходит в эндоплазматическом ретикулуме в присутствии молекулярного кислорода, NADH, цитохрома b5 и FAD-зависимой цитохром b5-редуктазы. Атомы водорода, отщепляемые от жирной кислоты, восстанавливают один из атомов молекулярного кислорода с образованием молекулы воды (схема (66)). Электроны для восстановления второго атома, а также выделения в виде воды поставляет цитохром b5, ион Fe2+ которого окисляется до Fe3+. Восстановление окисленной формы цитохрома b5 происходит под действием NADH и FAD-зависимой цитохром b5- редуктазы.
В основном у человека образуются пальмитоолеиновая (С16:1Δ9) и олеиновая (С18:1Δ9) кислоты. Десатуразы жирных кислот человека не способны создавать двойные связи в жирных кислотах далее девятого атома углерода от карбоксильного конца, поэтому полиненасыщенные жирные кислоты семейств ω-3 (двойная связь за три углеродных атома от концевой метильной группы) и ω-6 (двойная связь располагается за шесть углеродных атомов от концевой метильной группы) не синтезируются в организме человека и должны присутствовать в пище. Представителями семейства кислот ω-3 являются α-линоленовая (С18:3Δ9,12,15), эйкозапентаеновая жирные кислоты (С20:5Δ5,8,11,14,17), а семейства кислот ω-6 – линолевая (С18:2Δ9,12), эйкозатриеновая (С20:3Δ8,11,14) жирные кислоты.
На схеме (67) приведена последовательность реакций элонгации
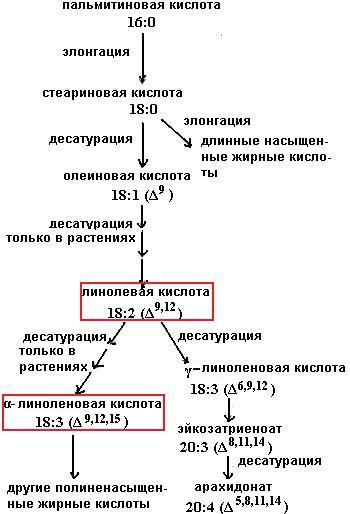 (67)
(67)
и десатурации, в результате которой происходит синтез длинноцепочечных насыщенных и полиненасыщенных жирных кислот. Линолевая и α-линоленовая кислоты образуются только в растениях, ферментные системы которых способны к вводу двойных связей вблизи концевой (ω) метильной группы.
Полиненасыщенные жирные кислоты входят в состав фосфолипидов клеточных мембран и мембран органелл, делая их текучими и подвижными. Эти соединения являются предшественниками эйкозаноидов, регуляторов клеточных функций.
6.2.2.1. Эйкозаноиды. К этому классу соединений, синтезируемых из длинных полиеновых жирных кислот (более двадцати углеродных атомов, от греч. эйкоза − «двадцать») относятся простагландины, тромбоксаны и лейкотриены. Эти вещества с коротким временем жизни оказывают на продуцирующую их клетку действие по аутокринному механизму, аналогичное гормональному, на соседние клетки – по паракринному механизму. Поэтому их называют также местными гормонами, действующими на уровне клетки.
При повреждениях тканей и инфекциях эйкозаноиды вызывают развитие воспалительного процесса (они ответственны за такие признаки воспаления, как отек, боль, лихорадка), регулируют секрецию воды и ионов натрия в почках, участвуют в образовании тромбов,влияют на тонус бронхов, кишечника и матки. При избыточной секреции эйкозаноидов развиваются аллергические реакции, в том числе бронхиальная астма.
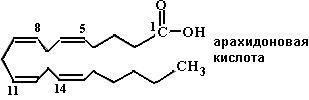
Предшественником эйкозаноидов является в основном ω-6-кислота – арахидоновая кислота (С20:4Δ5,8,11,14), которая в организме человека синтезируется, согласно схеме (67), из эссенциальной линолевой кислоты.
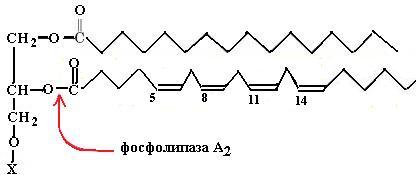 (68)
(68)
Арахидоновая кислота входит в состав глицерофосфолипидов мембран, при востребованности эйкозаноидов она высвобождается из фосфолипида гидролизом с помощью мембрансвязанной фосфолипазы А2 (схема (68)).
