
- •Часть 6. Химический состав живых организмов. Потребности в веществах и энергии
- •Глава 6.1. Элементный состав
- •Супероксиддисмутаза
- •Каталаза
- •Глутатионпероксидаза
- •Витамин е
- •Витамин с
- •Витамин а
- •Биофлавоноиды
- •6.1.7. Щелочноземельные металлы
- •Глава 6.2. Потребность живых организмов в углеводах, липидах, белках и нуклеиновых кислотах
- •Простагландины
- •Лейкотриены
- •Глава 6.3. Витамины
- •Библиографический список
- •Физиологическая химия
Глутатионпероксидаза
Огромное значение для инактивации активных форм кислорода имеет глутатионпероксидаза (К.Ф. 1.11.1.9), катализирующая восстановление пероксида водорода и липидных гидропероксидов с помощью глутатиона − γ-глутамилцистеинилглицина (GSH). Сульфгидрильная группа GSH окисляется до дисульфидной формы, отдавая электроны пероксиду водорода или гидропероксиду липида:
2 Н2О2 + GSH → 2 Н2О + G-S−S-G. (17)
Окисленный глутатион восстанавливается под действием глутатионредуктазы (К.Ф. 1.6.4.2):
G-S−S-G + NADPH + H+ → 2 GSH + NADP+. (18)
В организме животных в зависимости от органа и ткани обнаружено несколько форм глутатионпероксидаз. Глутатионпероксидаза чаще всего представляет собой гомотетрамер. В активном центре большинства из них присутствует остаток селеноцистеина, необходимого для протекания ферментативной реакции.
На рис. 6.3 приведена схема реакции, катализируемой глутатионпероксидазой. На первой стадии реакции остаток селеноцистеина, ионизованная форма которого стабилизируется остатками Trp148 и Gln70 (нумерация аминокислотных остатков приведена для фермента из бычьих эритроцитов, но оба остатка, являясь консервативными, присутствуют практически во всех глутатионпероксидазах), окисляется под действием пероксидов до селенильной кислоты RSeOH. Следующие две стадии реакции заключаются в регенерации селеноцистеина с помощью двух молекул глутатиона с образованием промежуточного продукта селененилсульфида (EnzSeSG).
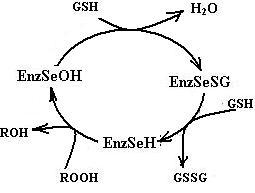

Рис. 6.3. Схема реакции, катализируемой глутатионпероксидазой. Ионизованная форма остатка селеноцистеина в активном центре фермента стабилизируется остатками Trp148 и Gln70 (схема справа). Под действием пероксидов происходит окисление селеноцистеина до селенильной кислоты (схема слева), которая восстанавливается обратно в селеноцистеин двумя молекулами GSH с образованием промежуточного соединения селенилсульфида (EnzSeSG) (согласно [23])
Таким образом, недостаток селена в организме приводит к увеличению активных форм кислорода в клетках, что, в свою очередь, проявляется в ослаблении иммунной системы организма и возникновению заболеваний, связанных с многочисленными изменениями в структуре и функциях биополимеров (белков, нуклеиновых кислот и липидов).
Восстановление дисульфидной формы глутатиона (G-S−S-G) происходит в организме с помощью флавопротеина глутатионредуктазы, представляющей собой гомодимер и состоящей из нескольких доменов: FAD- и NADPH-связывающих, домена для взаимодействия мономеров при образовании димера. FAD-связывающий домен располагается на N-конце молекулы фермента, как видно из рис. 6.4. Восстановление димерной формы глутатиона происходит за счет передачи электронов от NADPH (NADH) через FADH2 к G-S−S-G (схема (12)).
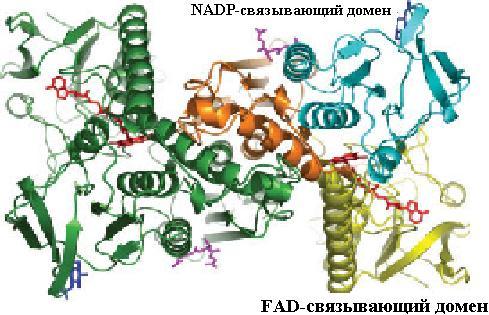
Рис. 6.4. Пространственная структура гомодимерных белков, входящих в семейство глутатионредуктазы. Домены фермента выделены цветом: FAD-связывающий − желтым, NADP-связывающий − бирюзовым, домен, связывающий мономеры друг с другом, − оранжевым (согласно [32])
