
- •Южно-Российский Государственный Технический Университет
- •Введение
- •Общие правила работы в лаборатории
- •Структура отчёта о лабораторных работах
- •Лабораторная работа №1 определение молярной массы эквивалента (эквивалентной массы) металла по объему вытесненного водорода
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №2 зависимость свойств элементов от их положения в периодической системе д.И. Менделеева
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №3 определение тепловых эффектов химических процессов
- •Методика выполнения работы
- •Результаты измерений
- •Результаты измерений
- •Контрольные вопросы
- •Лабораторная работа №4 приготовление растворов
- •Методика выполнения работы
- •Соотношения массовых долей и плотностей раствора hCl (20єС)
- •Результаты расчетов
- •Плотность водного раствора сульфата никеля при температуре 18 °с
- •Результаты расчетов
- •Контрольные вопросы
- •Лабораторная работа №5 определение молекулярной массы вещества криоскопическим методом
- •Методика выполнения работы
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №6 скорость химических реакций и химическое равновесие
- •Методика выполнения работы
- •Результаты опыта
- •1/3 2/3 1,0 С, моль/л
- •Результаты опыта
- •Результаты опыта
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №7 водородный показатель среды. Гидролиз солей
- •Методика выполнения
- •Результаты опыта
- •Контрольные вопросы
- •Контрольные вопросы
- •Лабораторная работа № 9 получение и изучение свойств комплексных соединений
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 10 окислительно-восстановительные реакции
- •Методика выполнения Окислители и восстановители, окислительно-восстановительная двойственность
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций
- •Контрольные вопросы
- •Лабораторная работа № 11 гальванический элемент
- •Методика выполнения
- •Результаты опытов
- •Контрольные вопросы
- •Лабораторная работа № 12 коррозия металлов и защита от неё
- •Методика выполнения
- •Контрольные вопросы
- •Лабораторная работа № 13 электролиз растворов электролитов
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №14 способы водоподготовки
- •Методика выполнения Умягчение воды
- •Контрольные вопросы
- •Лабораторная работа №15 органические вещества и полимеры
- •Методика выполнения Получение и свойства алифатических углеводородов
- •Характерные реакции кислородсодержащих органических соединений
- •Получение полимеров
- •Контрольные вопросы
- •Содержание
- •Шалимов Владимир Николаевич,
Контрольные вопросы
1. Назовите типы коррозии металлов.
2. В каких условиях протекает электрохимическая коррозия?
3. Как влияют примеси металлов на скорость атмосферной коррозии железа?
4. Изменяется ли скорость коррозии металлов, находящихся в воде, если прилить раствор кислоты?
5. На поверхности железной пластинки имеется капля воды. Почему после её высыхания пятно ржавчины находится в центре капли?
6. Перечислите наиболее распространённые методы борьбы с коррозией?
7. Каков механизм протекторной защиты металлов от коррозии?
8. Какие вещества называют ингибиторами коррозии?
Лабораторная работа № 13 электролиз растворов электролитов
Ц е л ь р а б о т ы: ознакомимся с процессами, протекающими под действием электрического тока на электродах в электролитах различного состава.
О б о р у д о в а н и е и м а т е р и а л ы: выпрямитель переменного тока ВСА-5К, реостат, U-образные трубки, графитовые электроды, 0,5 М растворы сульфата натрия, йодида калия, хлорида олова, 5 М раствор NaOH, 2 М раствор Н2SO4, кристаллические NiS04 и NH4Cl, никелевая и медная пластинки, фенолфталеин, лакмус.
Методика выполнения работы
Все опыты проводятся в электролизере, представленном на рис. 13.1.
рис.13.1
рис9.9.1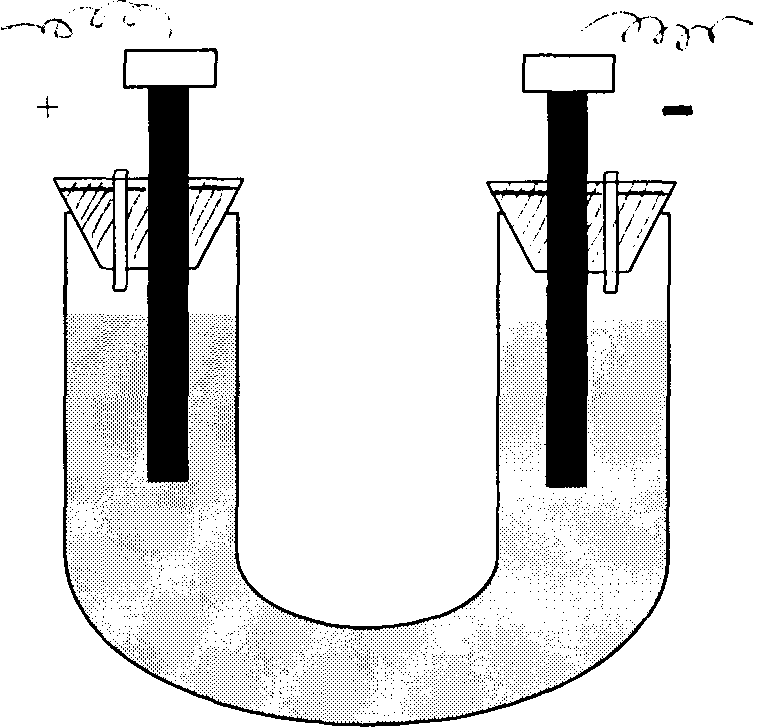
Заполнить электролизер 0,5 М раствором двухвалентного олова. В оба колена электролизера опустить угольные электроды и соединить их с медными проводами через реостат с выпрямителем переменного тока. Электролиз ведут при напряжении 4–5 В и силе тока 0,5 А. На катоде наблюдают появление серебристых кристаллов металлического олова.
Окисление или восстановление происходит на катоде? Написать уравнение катодного и анодного процессов. Доказать образование свободного хлора на аноде, для чего через 5 мин. пропускания электрического тока выключить выпрямитель, вынуть анод из электролизера и прибавить в анодное пространство по 3–4 капли растворoв йодида калия и крахмала. Наблюдать появление синего окрашивания. Описать наблюдаемые явления и ответить на поставленные по ходу работы вопросы.
Опыт №2. Электролиз раствора йодида калия
В коническую колбу налить примерно 20–25 см3 0,5 М раствора йодида калия и добавить по 5–6 капель фенолфталеина и раствора крахмала. Раствор перемешать и заполнить им электролизер. Опустить в него угольные электроды и присоединить их к источнику постоянного тока. Электролиз ведут при напряжении 8–10 В и силе тока 1–1,5 А в течение 5 мин.
Отметить изменение цвета раствора около анода и катода. Написать уравнение анодного и катодного процессов. Почему окрасились растворы в катодном и анодном пространствах? Окисление или восстановление йода произошло на аноде?
По окончании опыта анод промыть тиосульфатом натрия для более полного удаления йода с его поверхности и дистиллированной водой.
Опыт №3. Электролиз раствора сульфата натрия
Налить в электролизер 0,5 М раствор сульфата натрия. В анодное пространство внести 2–3 капли метилоранжа, а в катодное – 2–3 капли фенолфталеина. Погрузить угольные электроды и соединить с источником постоянного тока. Электролиз проводят при напряжении 5-6 В и силе тока 0,5 А в течение 5–10 мин. Наблюдать выделение пузырьков газа на электродах и изменение окраски раствора в анодном и катодном пространствах. Написать уравнения анодного и катодного процессов, протекающих при электролизе сульфата натрия. Какие вещества выделяются на аноде и катоде? Объяснить изменение окраски фенолфталеина в катодном пространстве и метилоранжа в анодном. Что окисляется и что восстанавливается?
Опыт №4. Никелирование медной пластинки
а). Подготовка предметов к покрытию их металлами. Механическая обработка. Полоску меди длиной 3–4 см, шириной 1 см с прикреплённой к одному концу медной проволокой тщательно очистить наждачной бумагой.
б). Обезжиривание. Очищенную пластинку опустить на 1–2 мин. в стаканчик с 5 М раствором NaOH, после чего промыть её водой из промывалки, держа за конец, к которому прикреплён проводник. Не касаться руками пластинки.
в). Травление. Обезжиренную пластинку опустить на 1–2 мин. в 2 М раствор серной кислоты с целью освободить поверхность металла от оксида. Снова промыть пластинку водой из промывалки и положить на кусочек фильтровальной бумаги.
г).
Никелирование. В стакан ёмкостью 50 см3
налить на
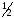 его объёма заготовленный заранее
электролит никелирования (50 г сульфата
никеля и 25 г хлорида аммония в 1 л воды)
и опустить в него никелевую и медную
пластинки. Соединить их с источником
постоянного тока так, чтобы медная
пластинка была катодом, а никелевая
анодом. Через несколько минут наблюдать
покрытие никелем той части медной
пластинки, которая была погружена в
раствор электролита.
его объёма заготовленный заранее
электролит никелирования (50 г сульфата
никеля и 25 г хлорида аммония в 1 л воды)
и опустить в него никелевую и медную
пластинки. Соединить их с источником
постоянного тока так, чтобы медная
пластинка была катодом, а никелевая
анодом. Через несколько минут наблюдать
покрытие никелем той части медной
пластинки, которая была погружена в
раствор электролита.
Написать уравнения катодного и анодного процессов. Объяснить наблюдаемое явление.
