
- •Южно-Российский Государственный Технический Университет
- •Введение
- •Общие правила работы в лаборатории
- •Структура отчёта о лабораторных работах
- •Лабораторная работа №1 определение молярной массы эквивалента (эквивалентной массы) металла по объему вытесненного водорода
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №2 зависимость свойств элементов от их положения в периодической системе д.И. Менделеева
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №3 определение тепловых эффектов химических процессов
- •Методика выполнения работы
- •Результаты измерений
- •Результаты измерений
- •Контрольные вопросы
- •Лабораторная работа №4 приготовление растворов
- •Методика выполнения работы
- •Соотношения массовых долей и плотностей раствора hCl (20єС)
- •Результаты расчетов
- •Плотность водного раствора сульфата никеля при температуре 18 °с
- •Результаты расчетов
- •Контрольные вопросы
- •Лабораторная работа №5 определение молекулярной массы вещества криоскопическим методом
- •Методика выполнения работы
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №6 скорость химических реакций и химическое равновесие
- •Методика выполнения работы
- •Результаты опыта
- •1/3 2/3 1,0 С, моль/л
- •Результаты опыта
- •Результаты опыта
- •Результаты опыта
- •Контрольные вопросы
- •Лабораторная работа №7 водородный показатель среды. Гидролиз солей
- •Методика выполнения
- •Результаты опыта
- •Контрольные вопросы
- •Контрольные вопросы
- •Лабораторная работа № 9 получение и изучение свойств комплексных соединений
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 10 окислительно-восстановительные реакции
- •Методика выполнения Окислители и восстановители, окислительно-восстановительная двойственность
- •Типы окислительно-восстановительных реакций
- •Направление окислительно-восстановительных реакций
- •Контрольные вопросы
- •Лабораторная работа № 11 гальванический элемент
- •Методика выполнения
- •Результаты опытов
- •Контрольные вопросы
- •Лабораторная работа № 12 коррозия металлов и защита от неё
- •Методика выполнения
- •Контрольные вопросы
- •Лабораторная работа № 13 электролиз растворов электролитов
- •Методика выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №14 способы водоподготовки
- •Методика выполнения Умягчение воды
- •Контрольные вопросы
- •Лабораторная работа №15 органические вещества и полимеры
- •Методика выполнения Получение и свойства алифатических углеводородов
- •Характерные реакции кислородсодержащих органических соединений
- •Получение полимеров
- •Контрольные вопросы
- •Содержание
- •Шалимов Владимир Николаевич,
Методика выполнения
Опыт №1. Исследование активности металлов
В шесть пробирок внести по 5–6 см3 растворов следующих солей: 1 – сульфат цинка; 2 – сульфат железа (II); 3 – хлорид олова (II); 4 – нитрат или ацетат свинца; 5 – сульфат меди; 6 – нитрат серебра.
Во все пробирки опустить на 2–3 мин. по пластинке металлического цинка. Что происходит на поверхности цинка во всех пробирках? Написать в ионном виде уравнение реакции взаимодействия цинка с растворами взятых солей. Указать в каждом случае переход электронов.
Вынуть цинковые пластинки. Провести аналогичные опыты с полосками олова, железа, свинца и меди.
Наблюдать, в каких случаях происходит вытеснение металла из их солей.
На основании сделанных наблюдений составить табл. 11.1.
Таблица 11.1
Результаты опытов
|
Опускаемый металл |
Ионы металлов в растворе | |||||
|
Zn2+ |
Fe2+ |
Sn2+ |
Pb2+ |
Си2+ |
Ag+ | |
|
Zn |
|
|
|
|
|
|
|
Fe |
|
|
|
|
|
|
|
Sn |
|
|
|
|
|
|
|
Pb |
|
|
|
|
|
|
|
Си |
|
|
|
|
|
|
Заполнить таблицу данными своих наблюдений, поставив знак (+) под ионами металлов в тех случаях, когда эти металлы вытеснялись из их солей в свободном состоянии при действии тем или другим чистым металлом, и знак (-) в случаях, когда вытеснения не происходило.
Расположить исследованные металлы в порядке убывания их восстановительной активности, выписать их стандартные электродные потенциалы и сравнить соответствие экспериментально составленного вытеснительного ряда металлов ряду напряжений.
Опыт №2. Изготовление гальванического элемента
Из
цинковой и медной пластинок и растворов
солей этих металлов собрать гальванический
элемент по схеме: Zn/Zn2+//Cu2+/Cu.
В батарейный стакан «а» (рис.11.1.) до
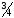 его
объёма налить 1 М раствор соли металла,
являющегося анодом, а в батарейный
стакан «б» – такой же объём 1 М раствора
соли металла, являющегося катодом. Оба
стакана соединить U_-
образной трубкой, заполненным насыщенным
раствором хлорида калия в смеси с
агар-агаром. В стакан «а» погрузить
анод, а в стакан «б» – катод.
его
объёма налить 1 М раствор соли металла,
являющегося анодом, а в батарейный
стакан «б» – такой же объём 1 М раствора
соли металла, являющегося катодом. Оба
стакана соединить U_-
образной трубкой, заполненным насыщенным
раствором хлорида калия в смеси с
агар-агаром. В стакан «а» погрузить
анод, а в стакан «б» – катод.

Рис.11.1
Смонтировать гальванический элемент и измерительные приборы по рис. 11.2.
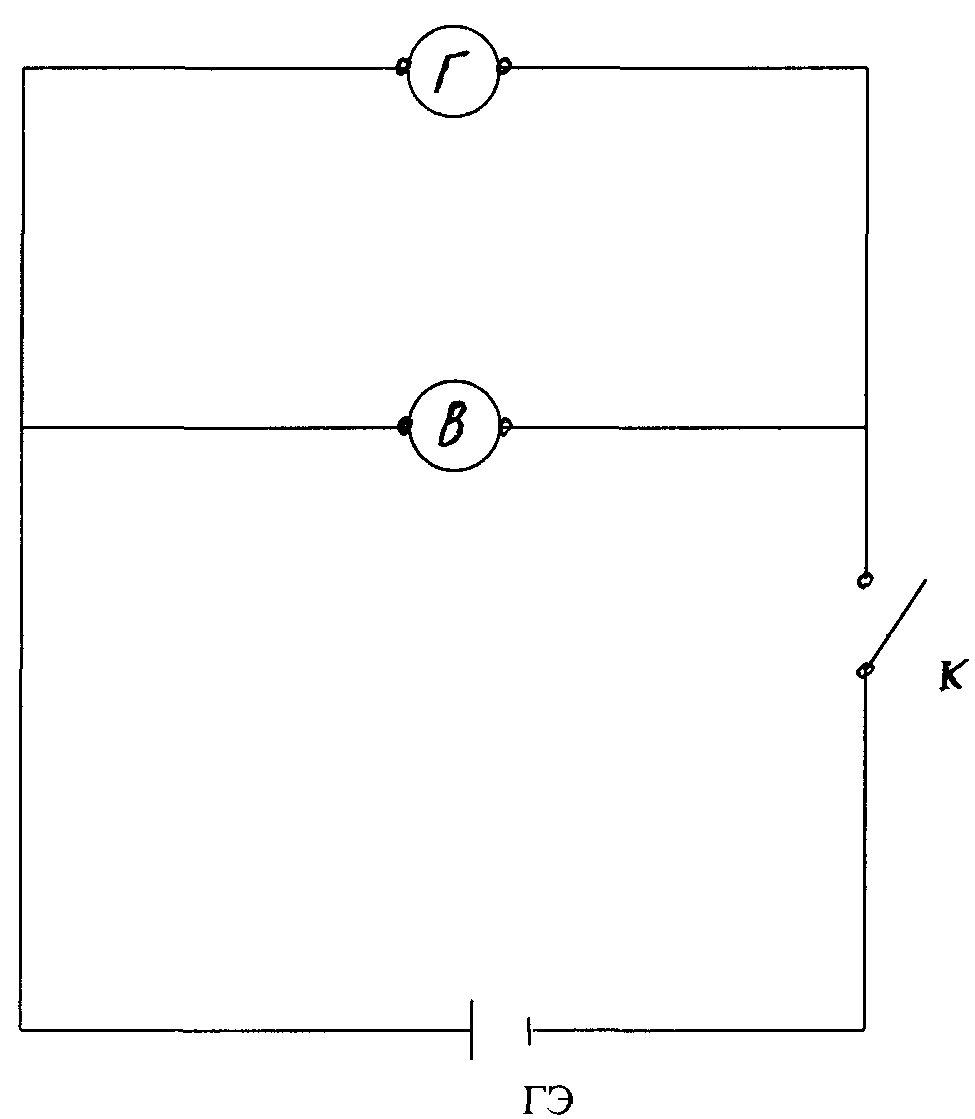
Рис.11.2
Замкнуть цепь и заметить по гальванометру направление тока. Через пять минут после замыкания цепи вольтметром измерить ЭДС работающего гальванического элемента, после чего разомкнуть цепь. Подсчитать теоретическую величину ЭДС элемента и определить перенапряжение.
Величина ЭДС работающего элемента Е всегда меньше, чем рассчитанная по формуле Нернста, вследствие того, что анодный процесс тормозится за счёт накопления на аноде ионов металла и потенциал анода становится более положительным, чем электродный потенциал данного металла; катодный процесс тормозится накоплением избыточных электронов, и потенциал катода становится более отрицательным.
Результаты работы записать в следующем порядке:
- схема гальванической цепи;
- уравнение процесса окисления на аноде;
- уравнение процесса восстановления на катоде;
- теоретическая величина ЭДС работающего элемента;
- суммарное уравнение реакции окисления-восстановления, протекающей
в гальваническом элементе.
Сделать вывод, является ли исследованный гальванический элемент практически поляризующимся.
Опыт №3. Гальванический элемент с водородной деполяризацией Собрать гальванический элемент: Zn/ZnSО4//H2SО4/H2(Cu)
В
батарейный стакан «а» налить до
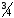 объёма 1 М раствора сульфата цинка и
погрузить анод, а в стакан «б» налить
такой же объём 1 М раствора серной кислоты
и погрузить в него катод. Оба стакана
соединить электролитическим ключом
(U-образным сифоном). Смонтировать
гальванический элемент и приборы по
рис. 11.2. Замкнуть цепь и заметить по
гальванометру направление тока.
объёма 1 М раствора сульфата цинка и
погрузить анод, а в стакан «б» налить
такой же объём 1 М раствора серной кислоты
и погрузить в него катод. Оба стакана
соединить электролитическим ключом
(U-образным сифоном). Смонтировать
гальванический элемент и приборы по
рис. 11.2. Замкнуть цепь и заметить по
гальванометру направление тока.
Через пять минут измерить вольтметром ЭДС работающего гальванического элемента, разомкнуть цепь. Подсчитать теоретическую величину ЭДС элемента, имея в виду, что катодом является водородный электрод. Определить величину перенапряжения.
Результаты опыта записать по форме:
- схема гальванической цепи;
- уравнение процесса окисления на аноде;
- уравнение процесса восстановления на катоде;
- теоретическая величина ЭДС;
- ЭДС рабочего элемента;
- величина перенапряжения на катоде;
- суммарное уравнение реакции окисления-восстановления, протекающей в гальваническом элементе. Сделать вывод, является ли исследованный элемент поляризующимся?
