
- •Федеральное агентство по образованию
- •2.Тесты первого промежуточного контроля знаний по общей химии Контролируемые темы:
- •3.Тесты второго промежуточного контроля знаний по общей химии Контролируемые темы:
- •4.Тесты третьего промежуточного контроля знаний по общей химии Контролируемые темы:
- •5.Образец итогового экзаменационного теста.
3.Тесты второго промежуточного контроля знаний по общей химии Контролируемые темы:
Химическая термодинамика..
Химическая кинетика и равновесие
Растворы. Свойства растворов
Дисперсные системы
Органические полимерные материалы
А. Химическая термодинамика
ΔНореакции: CaO(к) + CO2(г) = CaCO3(к) составляет, кДж а) -177 б) -1,77 в) 177 г) -2237
При сгорании 1 г магния выделилось 25 кДж теплоты. На основании этих данных молярная теплота образования оксида магния (кДж/моль) равна:
а) 600 б) 1000 в) 1200 г) 2000
Стандартная энтальпия образования SO2равна -297 кДж/моль. Чему равно количество тепла, выделившееся при сгорании 16 г серы:
а) 74,25 кДж б) 148,5 кДж в) 297 кДж г) 594 кДж
По приведенным стандартным значениям изменения энтальпии и энтропии для химической реакции
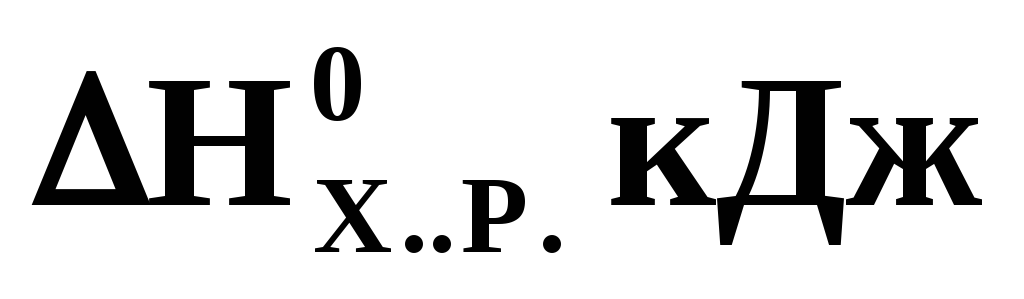 =+
173,
=+
173,
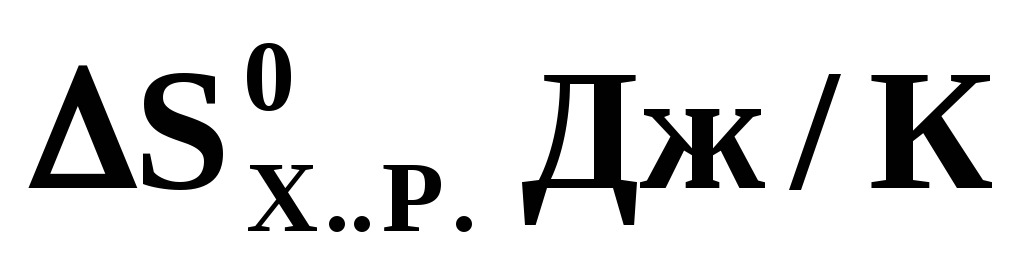 =
+176 рассчитайте температуру, при которой
равновероятны прямое и обратное
направления данной реакции:
=
+176 рассчитайте температуру, при которой
равновероятны прямое и обратное
направления данной реакции:
а) 0,98К б)9,8К в) 98К г) 980К
В изолированной системе реакция может протекать самопроизвольно, если:
а) изменение энтропии системы положительно б) изменение энтропии системы отрицательно в) изменение энтальпии системы положительно г) изменение энергии Гиббса системы отрицательно
В открытой системе реакция может протекать самопроизвольно, если:
а) изменение энтропии системы положительно б) изменение энтропии системы отрицательно в) изменение энтальпии системы положительно г) изменение энергии Гиббса системы отрицательно
Б. Химическая кинетика и равновесие
Единицей измерения скорости реакции может быть: а) моль/л·ч б) моль/ч в) г/моль·с г) м/моль·ч
От каких факторов не зависит константа скорости?
а )от природы б ) от растворителя в ) от t0Cг) от концентрации реагирующих веществ.
Применение катализатора преследует:
а) смещение равновесия б) снижение энергии активации в) снижение расхода реагентов г) увеличение выхода продуктов
Как изменится скорость прямой реакции 2СО (г)+О2(г)↔2СО2(г), при увеличении концентрации [СО] в 3 раза?
а) увеличится втрое б) увеличится в 9 раз в) не изменится г) уменьшится в 3 раза
Как нужно изменить давление, чтобы увеличить скорость реакции получения аммиака в 16 раз?
а) в 9 раз б) в 2 раза в) в 4 раза г) не менять
Во сколько раз увеличится скорость прямой реакции 2H2+O2
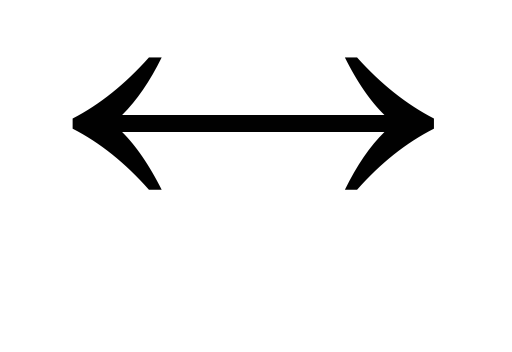 2H2Oпри увеличении давления в 3 раза?
а)
9 б)27 в)18 г)не изменится
2H2Oпри увеличении давления в 3 раза?
а)
9 б)27 в)18 г)не изменитсяЧему равен температурный коэффициент, если при охлаждении на 300С скорость реакции уменьшилась в 8 раз.
а ) 2 б) 3 в) 4 г) 8
Температурный коэффициент γ=2. На сколько градусов нужно нагреть реакционную смесь для увеличения скорости реакции в 16 раз?
а) на 100С б) на 300С в) на 400С г) на 200С
Чему равна Крреакции: Ат+ В г ↔ Сг+ Дт
а ) [С]/[В] б ) [В] / [С] в ) [С]·[Д] / А]·[В] г ) [А]В] / [С]·[Д]
Для реакции: N2+O2
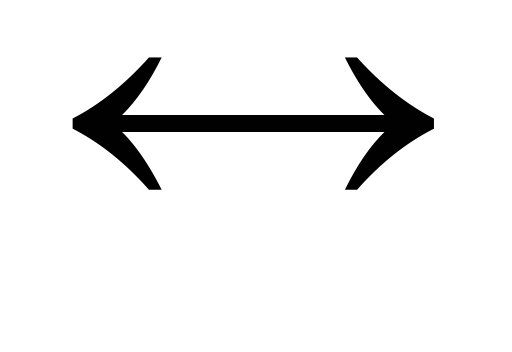 2NOправильным является
выражение константы химического
равновесия:
а )
2NOправильным является
выражение константы химического
равновесия:
а )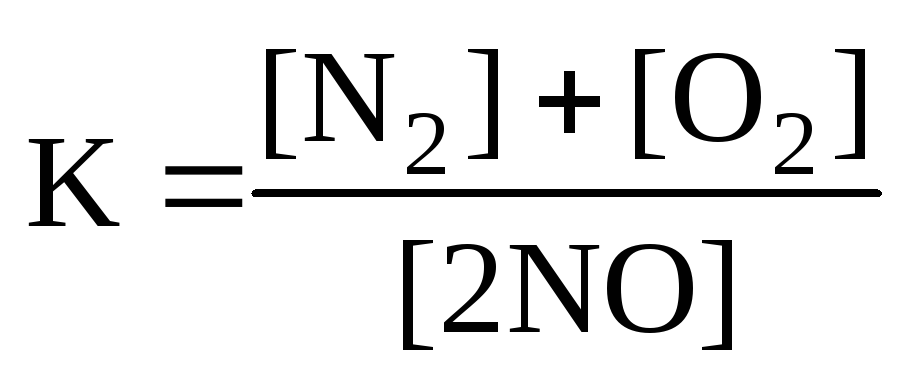 б)
б)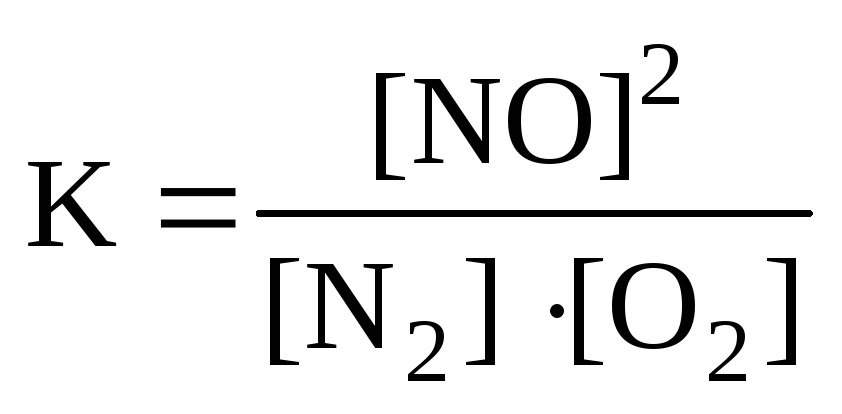 в)
в)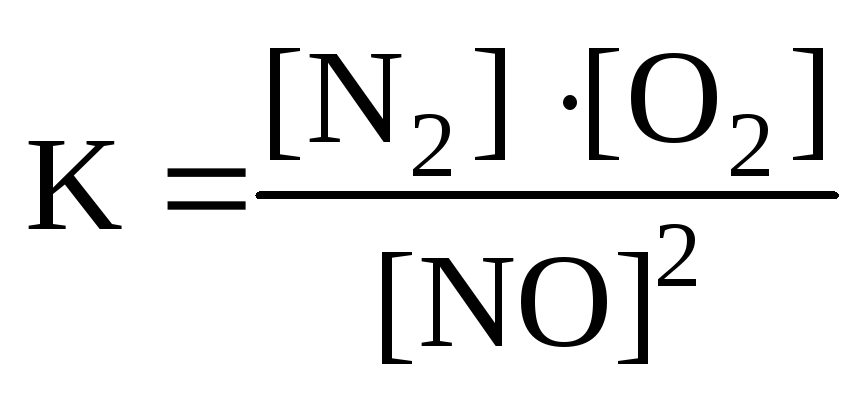 г)
г)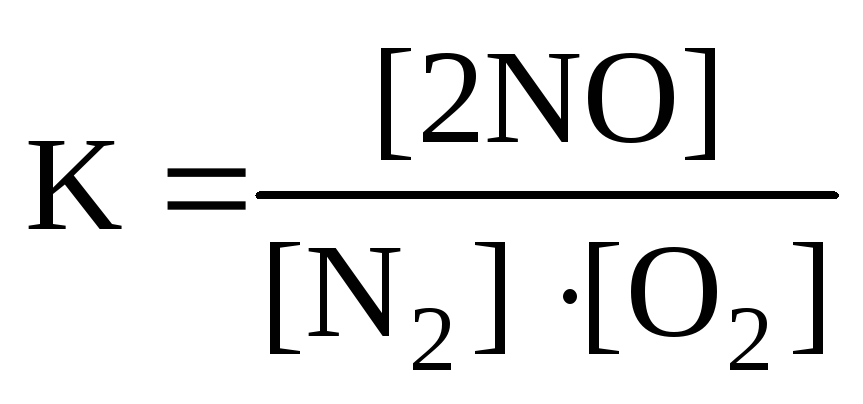
Для реакции Ag2S( к)+ 2HCl( г)↔H2S( г)+ 2AgCl( к)правильным является выражение константы химического равновесия: а )
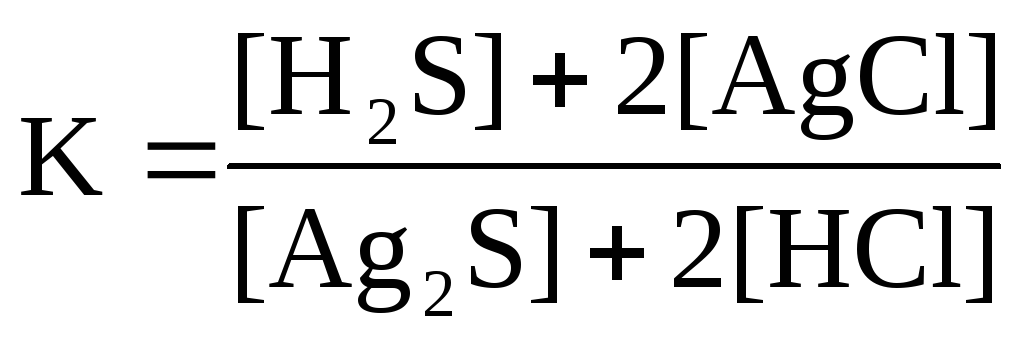 б)
б)
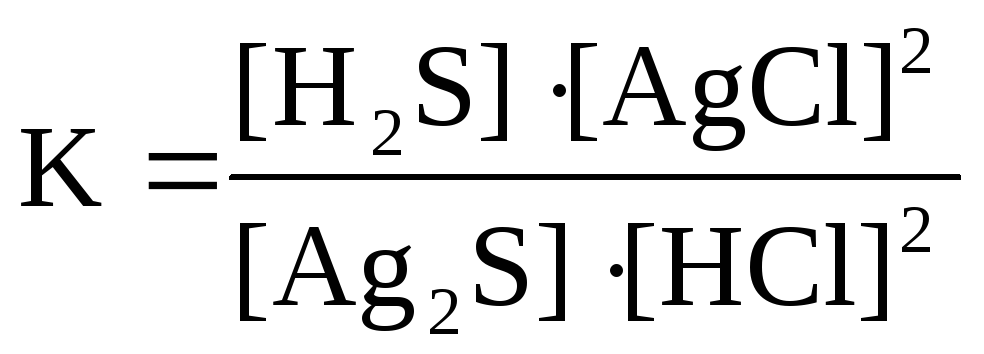 в)
в)
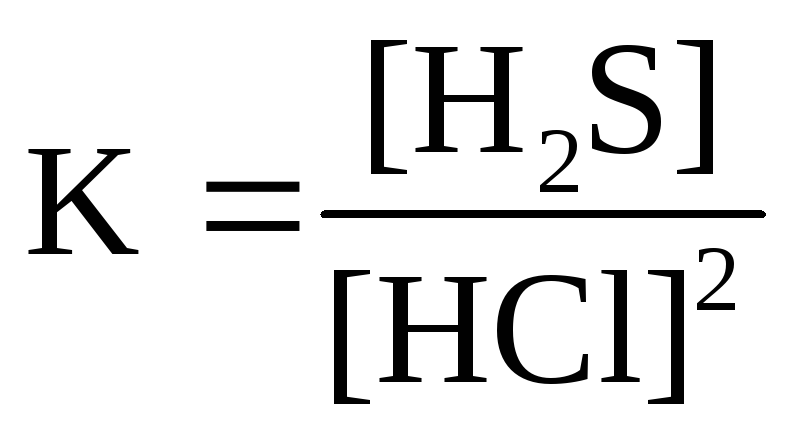 г)
г)
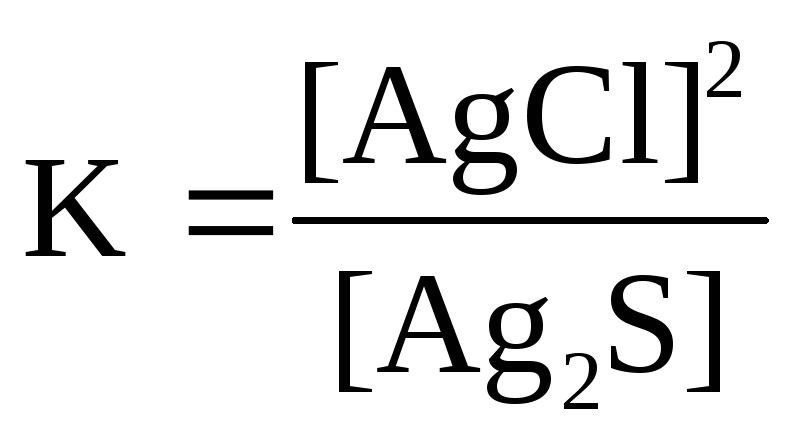
Константа равновесия N2O4↔ 2NO2при 25°С равна 10-1моль/л. При следующих концентрациях веществ (моль/л): С (NO2) = 0,1, С (N2O4) = 0,1 реакция протекает (указать направление): а) вправо б) влево в) система находится в равновесии
Куда сместится равновесие: Ст+ О2(г)↔СО2(г)при увеличении давления?
а) влево б) вправо в) не сместится г) в сторону угла
Куда сместится равновесие: PCl5(г)↔PCl3(г)+Cl2(г)при уменьшении температуры, если прямая реакция является эндотермической ?
а) влево б) вправо в) не сместится г) в сторону угла
В. Растворы. Свойства растворов
Какова процентная концентрация раствора, если в 200 г воды растворено 50 г вещества? ٱ 25%ٱ 50%ٱ 20%ٱ 40%
Сколько воды надо добавить к 200 мл 0,1 м раствором NaCI, чтобы получить 0,01 м раствор?
а) 1000 мл б) 1800 мл в) 2000 мл г) 1500 мл.
Смешали 200 г 20%-ного и 300г 10%-ного растворов глюкозы. Концентрация полученного раствора будет:
а) 15% б) 18% в) 16%г) 14%.
Масса навески натрия гидроксида, необходимая для приготовления 230 мл раствора с концентрацией 0,6 моль/л равна: а) 5,52 г б) 55,2 г в) 0,552 г г) 552 г
Объем 0,1 н раствора КОН, необходимый для нейтрализации 20 мл 0,15 н раствора НCl, равен, мл:
а) 20 б) 15 в) 45 г) 30.
При растворении 11,6 г вещества в 400 г воды температура кристаллизации раствора стала составлять 0,93°C. Молярная масса вещества равна, г/моль: а) 93 б) 58 в) 180 г) 342.
ЧЕМУ РАВЕН изотонический коэффициент для раствора электролита с концентрацией растворенного вещества 0,2М, если известно, что в 1 дм3этого раствора содержится 2,18·1023частиц (молекул и ионов) растворенного вещества: а) 1,81 б) 0,55 в) 0,35 г) 2,39.
10% водный раствор какого вещества кипит при более высокой температуре
ٱС12Н22О11(М = 342 г/моль)ٱ С6Н12О6(М = 180 г/моль) С3Н8О2(М = 76 г/моль)ٱ С2Н5ОН (М = 46 г/моль)
Какой из растворов закипит при более высокой температуре?
а) глюкоза б )Na2SO4в ) СН3СООNaг ) К3PO4
Какой из растворов замерзает при более низкой температуре, если молярные концентрации равны?
а) KIб)CuCI2в)NaCIг) С12Н22О11
Необходимые условия осмоса:
а) разница концентрацииб) разница концентраций и наличие полупроницаемой мембраныв) наличие полупроницаемой мембраныг) броуновское движение
Какой раствор изотоничен крови?
а ) имеющий равные концентрации ионов К+иNa+
б) имеющий равные значения рН
г) с рН=7,0 и рСО2=35 мм. рт.ст.
Осмотическое давление 0,1 м раствора К2СО3равно 2,63 атм. При 00С. Рассчитать «i«.
а) 1,17 б) 2 в) 2,2 г) 1,5
В каком из растворов осмотическое давление будет минимальным при t=200C.
а )1м С6Н12О6б) 1мNaCIв) 1м СН3СООNaг) 1мK3PO4
Осмотическое давление в растворе глюкозы рассчитывается по формуле:
а) СэRTб) СмRTв) С%RTг)PV=CRT
В каких случаях оба иона не могут находиться вместе в растворе в значительных количествах? а) Cu2+,Cl-б)Mg2+,PO43-в)Na+,OH-г)K+, S2-
К растворам указанных солей прилили раствор кислоты. В каких случаях наблюдается выделение газа?
а ) Na2SO4б )CuSO4в )Na2Sг )HgS
Указать уравнение реакции, практически осуществимой в растворе:
а) Ва(NО3)2+ NaOH→
б) Fe2(SO4)3 + НNO3→
в) Na NO3+ НCl →
г) CuSO4+ NaOH →
Раствор, в 500 мл которого растворено 1,825 г НCl, имеет рН, равный:
а) 1 б) 4 в) 7 г) 13
рН раствора =6, [ОН-]=?
а) 10-6б ) 10-8в ) 10-4 г ) 10-14
рН 1 М С6Н12О6=?
а ) 0 б ) 5,0 в ) 14 г ) 7
Вычислите рН 0,0005 М раствора H2SO4а ) 3,3 б ) -3,3 в ) 3 г) 4,3
Щелочным является раствор, у которого: ٱ pH= 7ٱ [H+] = 10-9моль/лٱ [OH-] = 10-9моль/лٱ pOH= 10
pH=12, [H+]=?
а) 10-7моль/л б ) 10-12моль/л в ) 10-2моль/л г) 10-6 моль/л
Чему равно ионное произведение воды в 0,9% растворе NaCI?
а)9 б) 10-7в) 10-14г) 9·10-1
Чему равно ионное произведение воды в 0,1 м растворе NaOH?
а ) 10-1б) 10-13в) 10-14г) 10-7
Какая из указанных солей дает щелочную реакцию среды за счет гидролиза: а ) Na2CO3б)AlCl3в) (NH4)2SO4г)KNO3
Какая из солей подвергается гидролизу? а )AlCl3б)Na2SO4в)KNO3г)NaCl
Какие вещества нужно добавить к раствору AI2(SO4)3для
смещения равновесия реакции гидролиза вправо?
a)Na2SO4,б )NaCIв )HNO3г ) Н2О
Добавление какого вещества сдвигает равновесие реакции
гидролиза SnCI2влево?
а ) SnSO4б )K2SO4в )H2SO4г ) Н2О
В какой смеси веществ возможна химическая реакция?
а ) Bi(OH)3+NaOH↔ б )Bi(OH)3+HCI
в ) Bi2S3 + H2O↔ г ) Bi2S3 + HCI ↔разб.
Указать продукты гидролиза К2СО3по 1-ой ступени:
а ) КОН б ) КОН в ) КОН г ) не гидролизуется
КНСО3Н2СО3КНСО3рН=7
рН>7 pH>7pH<7
Продукты гидролиза по 1-ой ступени дихлорида цинка (ZnCI2)
a)ZnOHCIб)ZnOHCIв)Zn(OH)2г)ZnOHCI
HCIHCIHCIHCI
pH<7pH>7pH<7pH=7
ПРAgCI=1,8·10-13, ПРAgBr=0,5·10-13; ПРАgI=8·10-17, как изменяется растворимость веществAgCI-AgBr-AgI.
а) растет б) не изменяется в) уменьшается г) равна 0.
Наименее растворима в воде соль: а) BaCO3 б) CaSO4 в) CaC2O4
ПРAgCI=1,21·10-10. Рассчитать молярную растворимость:
а) 1,21·10-10моль/л б) 1,1·10-5моль/л в ) 2·10-5моль/л
г) 1,2·10-3моль/л
ПРCuS=9·10-36. Рассчитать молярную растворимостьCuS.
2·10-18моль/л б) 3·10-16моль/л в) 9·10-36моль/л г) 6·10-18моль/л
Растворимость BaCO3равна 1,7·10-3моль/л, рассчитать ПРBaCO3.
а)2,89·10-6б) 1,7·10-3в) 1,89·10-5г) 28,9·10-7
ПР (BaSO4) =1·10-10, ПР (CaSO4) =6·10-5ПР (PbSO4) =1, 8·10-8
Какой осадок при равных условиях образуется первым?
а) CaSO4б)BaSO4в) одновременно г) не образуется
Г. Дисперсные системы. Органические полимерные материалы
Дисперсной системой является: а)соляной раствор, б) молоко; в) сахар; г) минеральная вода
Коллоидные системы отличаются от истинных растворов: а)концентрациейб)плотностьюв)размерами частиц растворенного веществаг)способами приготовления
Согласно теории строения коллоидных растворов мицелла является : а)электронейтральной, б) отрицательно заряженной, ; в) положительно заряженной; г) радикалом
Для золя AgI, полученного по реакцииAgNO3+KI(изб) =AgI↓ + КNO3коагуляцию вызывают : а)катионы, б) анионы; в) катионы +анионы; г) нейтральные частицы
При растворении в воде ПАВ величина поверхностного натяжения: а)уменьшается, б) не изменяется, ; в) увеличивается; г) уменьшается, затем увеличивается.
Полиэтилен получают в результате реакции: а) вулканизации, б) сополимеризации; в)поликонденсации, г)полимеризации.
Макромолекулы природного каучука имеют : а) сетчатую структуру, б) разветвленную структуру; в) линейную структуру, г) беспорядочную структуру.
Полимер состава: (-СН2-С = СН – СН2-)n называют:
СН3а) полипропилен б) резина в)каучук г) пластмасса
O O // | |
Определите тип реакции: n NH2-(CH2)5-C → (-NH-(CH2)5-C-)n + nH2O \ OHа) полимеризация б) поликонденсация в) изомеризация г) гидратация
ВСЕГО 70 тестов
