
- •Таблица 20
- •Общий объем жидкости в норме в организме человека
- •Таблица 21
- •Содержание электролитов
- •Динамика водно-электролитпого баланса
- •Влияние анестезии на функцию почек
- •Нарушения функционального объема внеклеточной жидкости
- •Термин «олигурия»
- •Основные причины олигурии
- •Преренальная олигурия
- •Полиурия в предоперационном периоде
- •ГЛАВА 23
- •Функциональная анатомия мочевого пузыря
- •Патофизиология серповидно-клеточной болезни
- •Иммунная реакция
- •Клинические рекомендации для проведения анестезии
- •Таблица 29
- •Клинические и лабораторные признаки порфирии
- •АКУШЕРСТВО, ГИНЕКОЛОГИЯ И НЕОНАТОЛОГИЯ
- •Таблица 33
- •Осложнения, связанные с проведением анестезии
- •Клинико-физиологические изменения при управляемой гипотермии
- •Метаболизм
- •Классификация вирусов гепатита
- •Вирус гепатита А
- •Вирус гепатита В
- •Вирусы, вызывающие гепатит у человека
Гентамицпн [24] Тетрациклин (просроченного хранения) [25] Лития карбонат [26] Амфотерицин-В [27]
После устранения закупорки мочевыводящих путей [28] Прочие заболевания Артериальная гипертензия [29]
Цирроз печени [30] Алиментарное истощение [31] Психогенная анорексия [32] Серповидно-клеточная анемия [33] Амилоидоз [34]
Вторым основным типом несахарного диабета является нефрогенный несахарный диабет (табл. 25) [13]. У страдающих этим заболеванием нарушена реакция канальцев почки на нормальный уровень циркулирующего АДГ. Нефрогенный несахарный диабет как последствие применения метоксифлурана является наиболее подробно изученным полиурическим состоянием, связанным с наркозом. Поскольку выявить нефрогенный или центральный генез несахарного диабета обычно бывает легко, то ниже эти два состояния будут рассмотрены вместе. Дополнительные сведения по этой проблеме можно получить из превосходного обзора клинических аспектов нарушений концентрации и разведения мочи, опубликованного Hamngton, Cohen [3].
Полиурия в предоперационном периоде
При попытке выявить причину полиурии у хирургического больного полезно вначале определить срок появления полиурии по отношению к времени операции. Полиурия, сопровождающая заболевания, перечисленные в табл. 24, 25, может иметь место до операции. У многих больных этиологию полиурии легко установить на основании данных анамнеза, клинического осмотра больного и нескольких простых лабораторных исследований. Например, синдром полиурии, инфекции мочевых путей, снижения массы тела, поражения периферических сосудов, нейропатии и глюкозурии, вероятнее всего, является клиникой сахарного диабета, а сочетание полиурии, головной боли и нарушений зрения дает основания подозревать опухоль гипоталамической зоны [8, 18]. Однако в случаях, когда хронические заболевания почек, например пиелонефрит [21] и мочекаменная болезнь [16], или системные заболевания, например амилоидоз [34] и алиментарное истощение [31], вызывают полиурию, установить точную ее причину гораздо труднее. Во всех случаях полиурии необходимо подробно выяснить, какие лекарства принимал больной, чтобы обнаружить препараты, оказывающие прямое нефротоксическое действие, например карбонат лития [26], тетрациклин [25], гентамицин [24]. Кроме того, полиурия может быть результатом приема диуретиков, тогда ее можно расценивать как первичный лечебный эффект или же
как вторичное проявление токсичности при неадекватном восполнении потерь калия [15]. Следует приложить максимальные усилия для выявления причины и, если возможно, этиологического лечения полиурии. Обнаружить своевременно у больного, готовящегося к операции, полиурию важно с точки зрения планирования инфузионной терапии во время и после операции. Кроме того, тщательное предоперационное обследование может исключить ошибки в лечении, возникающие в ситуации, когда существовавшую ранее полиурию обнаруживают впервые только во время или после операции.
Полиурия во время операции
Вода и диуретики
Одной из наиболее частых причин полиурии у хирургических больных бывает парентеральное введение воды в чрезмерном количестве в предоперационном периоде. Больные с травмами или больные, подвергающиеся обширным оперативным вмешательствам, нередко нуждаются в переливании больших объемов жидкости для поддержания адекватного объема циркулирующей крови. Необходимый объем жидкости у этих больных определить довольно трудно, учитывая перемещение ее в больших количествах из внутрисосудистого пространства во внесосудистое, интерстициальное пространство, в так называемое «третье» пространство. При переливании большого количества кристаллоидных растворов оценка еще более усложняется, так как приблизительно 3/4 введенного объема быстро покидает сосудистое русло, проникая в интерстиций. В некоторых случаях выделение избытка жидкости начинается уже во время операции. Если больному вводили изотонические растворы, секреция АДГ уменьшается благодаря увеличению внутрисосудистого объема; при введении гипотонических растворов снижение осмоляльности плазмы дополнительно стимулирует снижение секреции АДГ. Однако чаще всего выделение секвестрированной воды почками начинается на 2—3-е сутки после операции.
Дополнительной причиной полиурии во время операции является осмодиурез в результате гипергликемии. Обычно проксимальные канальцы почки реабсорбируют всю отфильтрованную клубочками глюкозу, если уровень ее в плазме артериальной крови не превышает порога 180—200 мг%. Во время наркоза и операции этот порог может снижаться, возникает непереносимость глюкозы. Если концентрация глюкозы в артериальной крови превышает порог, механизмы транспорта глюкозы полностью насыщаются, она появляется в моче, усиливая осмотически экскрецию воды. Избыток глюкозы во время операции может возникать за счет парентерального введения жидкости, поскольку 1 л 5% раствора глюкозы содержит 50 г глюкозы. Значительной гипергликемии во время операции можно избежать, ограничив прием глюкозы во время операции в количестве не более 100 г сухого вещества. Полиурия во время операции может развиться после введения диуретинов. Их назначают для предотвращения и лечения хирургической почечной не-
достаточности, для снижения внутриглазного давления, для уменьшения размеров мозга. Среди осмодиуретиков наиболее широко используется маннитол, хотя раньше часто применяли мочевину и глюкозу. Кроме того, во время операции применяют мощные салуретики, фуросемид и этакриновую кислоту. Они безусловно показаны при лечении острой гиперволемии, их вводят вместе с маннитолом или вместо него для предотвращения или лечения хирургической почечной недостаточности.
Травма гипофиза при нейрохирургических вмешательствах
Хирургические манипуляции в супраоптической области и в зоне гипофиза могут вызывать полное или частичное отсутствие циркулирующего АДГ [8, 9]. У человека при физиологической концентрации эндогенного АДГ в крови его период полужизни составляет приблизительно 15 мин [35]. Однако даже при полном хирургическом разрушении гипофиза полиурия появляется не раньше чем через 12 ч после операции, а может не развиться вообще. Предполагают, что в телах нейронов сохраняются запасы АДГ, которые выделяются в области ножки гипофиза или в других местах и препятствуют немедленному развитию полиурии. Тем не менее при хирургических вмешательствах в области гипофиза всегда необходимо тщательно контролировать диурез.
Полиурия в послеоперационном периоде
Большая часть случаев полиурии у хирургических больных наблюдается после операции. Хотя существует целый ряд причин развития послеоперационной полиурии, одна из них наиболее четко связана с проведением наркоза. Это — нефропатпя неорганических фторидов, характерная для наркоза метокспфлураном в высоких дозах.
Нефротоксичностъ метоксифлурана
Crandell сообщил, что у 13 из 41 больного, которым проводили метоксифлурановый наркоз при брюшно-полостных вмешательствах, в послеоперационном периоде развилась полиурия [36]. Неспособность таких больных выделять концентрированную мочу, несмотря на ограничение жидкости и применение вазопрессина, предполагает почечный генез полиурии. У большинства больных нормальная концентрационная способность восстановилась через 10—20 дней, хотя у 3 больных аномалии сохранялись более года. Mazze расширил данные, полученные Crandell, проведя проспективное контролируемое исследование со случайной выборкой, в котором у всех больных, получавших наркоз метоксифлураном, обнаружил развитие почечной патологии [22, 37]. У больных с наиболее выраженными нарушениями почечной функции отмечались: АДГ-резистентная полиурия, значительное снижение массы тела, гипернатриемия, гиперосмоляльность плазмы, повы-
шение уровней азота мочевины и креатинина в плазме, повышение концентрации в плазме мочевой кислоты и снижение клиренса мочевой кислоты. Ни
уодного из больных контрольной группы, получавших наркоз галотаном, не развились признаки патологии почек.
Последующие клинические исследования [40] и опыты на крысах линии Фишер-344 [38, 39] обнаружили прямую связь между длительностью ингаляции метоксифлурана, концентрацией в плазме его метаболитов, неорганических фторидов и степенью послеоперационных нарушений почечной функции. У человека ингаляция метоксифлурана величиной 2 МАК/ч сопровождается пиком концентрации в плазме неорганических фторидов не более 40 мкмоль/л и не вызывает нефротоксичности. Ингаляция 2,5— 5,0 МАК/ч метоксифлурана вызывает повышение уровня неорганических фторидов плазмы до 50—80 мкмоль/л и сопровождается умеренным нарушением биохимических показателей почечной функции и замедленным восстановлением максимальной концентрационной функции, наблюдавшейся до операции. Более длительная ингаляция метоксифлурана сопровождается повышением уровня неорганических фторидов более 100 мкмоль/л с признаками выраженного нарушения функции почек. У больных, подвергшихся нефротоксическому действию метоксифлурана, в плазме и моче обнаруживается повышение уровня оксаловой кислоты, а в биопсийных пробах почечной ткани обнаруживаются кристаллы оксалатов [37, 41]. Однако основная часть полученных данных свидетельствует о том, что первичным нефротоксическим метаболитом метоксифлурана являются неорганические фториды, а не оксаловая кислота [39, 40].
Интересно также выяснить, какую роль в патогенезе этой формы нефропатии играет индукция ферментов? Эксперименты на крысах линии Фи- шер-344 показали, что предварительное введение им фенобарбитала, известного как индуктор печеночных микросомальных ферментов, увеличивает степень дефторирования метоксифлурана в организме и степень нефротоксичности для данной дозы анестетика [39]. Роль индукции ферментов в развитии явлений нефротоксичности у человека не установлена. Дополнительным фактором, способствующим развитию метоксифлурановой нефропатии, является взаимодействие анестетика с нефротоксическими антибиотиками. При наркозе метоксифлураном ва фоне лечения тетрациклином [42] или гентамицином усугубляется нефротоксическое поражение почек как
уживотных [24], так и у человека [43].
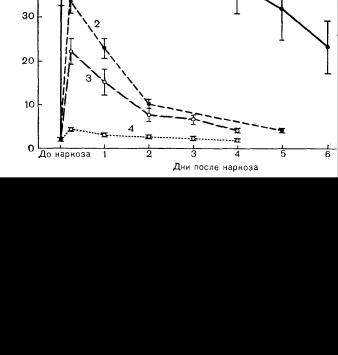
Рис. 66. Концентрация неорганических фторидов в плазме крови до и после наркоза метоксифлураном у 18 больных (1), энфлураном в высоких дозах у 11 обследуемых (2), эифлураном в малых дозах у 9 больных (3) и изофлураном у 9 больных (4).
После наркоза энфлураном пик концентрации фторидов наблюдался сразу после наркоза, достигая 22,2±2,8 мкмоль у пациентов и 33,6±2,8 мкмоль у обследуемых, через 4 ч после наркоза начиналось быстрое снижение уровня фторидов. При наркозе метоксифлураном пик уровня фторидов был выше (61 ±8 мкмоль) и снижался медленнее, после наркоза изофлураном «пик» концентрации фторидов составил лишь 4,4±0,4 мкмоль. На кривых показано стандартное отклонение.
Маловероятно, чтобы применение других фторсодержащих анестетиков вызывало нефротоксичность. Энфлуран биохимически более стабилен по сравнению с метоксифлураном, кроме того, его растворимость в жирах ниже; а именно с жирорастворимостью непосредственно связана длительность метаболизма анестетика после операции. У хирургических больных, получивших в среднем 2,9 МАК/ч энфлурана, пик уровня неорганических фторидов в плазме составил 22,2 мкмоль/л [44], а у здоровых обследуемых, получивших 9,7 МАК/ч энфлурана, пик концентрации фторидов в плазме достиг 33,6 мкмоль/л (рис. 66) [45]. У обследованных обеих групп не обнаружено послеоперационной полиурии, хотя у здоровых обследованных отмечено снижение на 26% по сравнению с данными до операции максимальной осмоляльности мочи в ответ на введение вазопрессина. Описаны 3 случая послеоперационной полиурической нефропатии у больных с исходно нарушенной функцией почек, которая может быть связана с метаболизмом энфлурана до неорганических фторидов [45]. Поврежденная почка, возможно, более чувст-
вительна к нефротоксическому действию неорганических фторидов; кроме того, у больных с заболеваниями почек в результате сниженной экскреции фторидор может поддерживаться более высокая концентрация их в плазме, Следовательно, у больных с нарушениями функции почек лучше избегать применения энфлурана. Изофлуран также метаболизируется до неорганических фторидов, но в меньшей степени, чем его изомер энфлуран [46]. У людей и животных, которым проводили наркоз изофлураном, уровень неорганических фторидов в плазме не превышал 10 мкмоль/л (ем. рис. 66) и не наблюдалось полиурии [46, 47]. Применение изофлурана не должно вызывать полиурической нефропатии даже у больных с исходной патологией почек.
Полиурия, сопровождающая почечную недостаточность
Нарушенная функция почек обычно возвращается к норме уже в течение нескольких часов после операции. Однако, иногда почечная функция быстро не восстанавливается, и у больного может развиться острая почечная недостаточность [48]. Причинами появления этого синдрома могут быть следующие: шок, артериальная гипотензия, неадекватное восполнение гиповолемии перед операцией, переливание несовместимой крови и сердечная недостаточность. Избранный врачом анестетик, исключая наркоз метоксифлураном в больших дозах, редко можно считать причиной острой почечной недостаточности. Хотя основным признаком этого синдрома считают олигурию, у некоторых больных развивается почечная недостаточность с нормальным или несколько повышенным диурезом [19, 20]. Это состояние, называемое неолигурической острой почечной недостаточностью, может сопровождаться значительными нарушениями биохимического состава крови, поскольку в моче содержится сравнительно мало (приблизительно 300 мосм/кг) растворенных веществ, а объем диуреза фиксировав и не увеличивается. Эту патологию все чаще обнаруживают в последние годы, по данным некоторых исследований последних лет, она составляет до 50% всех случаев острой почечной недостаточности (ОПН) [19, 20]. Клиническое течение неолигурической острой почечной недостаточности более доброкачественное, чем ее олигурического варианта. Сроки госпитализации больных с неолигурической ОПН меньше, у них реже встречаются сепсис, неврологические осложнения, желудочно-кишечные кровотечения, им реже требуется диализ, наконец, летальность у них ниже (26% по сравнению с 50% при олигурической ОПН) [20]. Вероятно, у больных с неолигурической ОПН сохраняется больше функционирующих нефронов, а следовательно, в большей степени сохраняется способность выделять воду, электролиты и метаболиты. Поставить вовремя диагноз неолигурической ОПН важно, иначе можно совершить грубые ошибки в лечении. Описаны смертные случаи при гипергидратации у больных с диурезом, фиксированным в нормальных пределах [19]. Больным с неолигурической ОПН опасно вводить электролиты, в частности калий.
Полиурия часто встречается на начальных этапах выздоровления при олигурической форме ОПН. В течение нескольких дней диурез возрастает в 2
раза, достигая 3—6 л/сут, а затем возвращается к норме. Приблизительно 1/4 всех смертельных исходов у больных с олигурической ОПН наблюдается в полиурической фазе, поэтому лечение и наблюдение должны быть в этот период такими же тщательными, как и во время олигурии [48].
СПИСОК ЛИТЕРАТУРЫ
1.Pitts R. F.: Physiology of the Kidney and Body Fluids, ed. 3. pp. 99—139. Chicago, Year Book Medical Publishers, 1974.
2.Marsh D. J.: Osmotic concentration and dilution of the urine. In RouiIIer C., and Muller A. F. (eds.): The Kidney: Morphology, Biochemistry, Physiology. vol.
3.pp. 71—127. New York, Academic Press, 1971.
3.Harrington J. Т., and Cohen J. J.; Clinical disorders of urine concentration and dilution. Arch. Intern. Med., 131 : 810, 1973.
4.Burg М. В., and Green N.: Function of the thick ascending limb of Henle's loop. Am. J. Physiol., 224 : 659, 1973.
5.Verney Е. В.: Croonian lecture: The antidiuretic hormone and the factors which determine its release. Proc. R. Soc. London (BioL), 135 : 25, 1947.
6.Orloff ]., and Handler J.: The role of adenosine 3' 5'-phosphate in the action of antidiuretic hormone. Am. J. Med.. 42 : 757, 1967.
7.Randall R. V., Clark Е. С., and Bahn R. C.: Classification of the causes of diabetes insipidus. Proc. Mayo Clin., 34 : 299, 1959.
8.Blotner H.: Primary of idiopathic diabetes insipidus: a systemic disease. Metabolism, 7 : 191, 1958.
9.Coggins C. H., and Leaf A.: Diabetes insipidus. Am. J. Med., 42 : 807, 1967.
10.Barlow Е. D., and Wardener H. Е.: Compulsive water drinking. Q. J. Med., 28
:235, 1959.
11.Miller L., Fisch L., and Kleeman C. R.: Relative potency of arginine-8-vaso- pressin and lysine-8-vasopressin in humans. J. Lab. Clin. Med., 69 : 270, 1967.
12.Earley L. Е., and Orloff J.: The mechanism of antidiuresis associated with the administration of hydrochorothiazide to patients with vasopressin resistant diabetes insipidus. J. Clin. Invest., 41 : 1988, 1962.
13.Miller М., and Moses A. М.: Urinary antidiuretic hormone in polyuric disorders and in inappropriate ADH syndrome. Ann. Intern. Med., 77 : 715. 1972.
14.Bode H. H., and Craw ford J. D.: Nephrogenic diabetes insipidus in North America: the Hopewell hypothesis. N. Engl. J. Med., 280 : 750, 1969.
15.Relman A. S., and Schwartz W. В.: The kidney in potassium depletion. Am. J. Med., 24 : 764, 1958.
16.Epstein F. H.: Calcium and the kidney. Am. J. Med., 45 : 700, 1968.
17.Mayock R. L., Bertrand P., and Morrison C. Е.: Manifestations of sarcoido-sis: analysis of 145 patients, with a review of nine series selected from the literature. Am. J. Med., 35 : 67, 1963.
18.Berliner R. W.: Outline of renal physiology. In Strauss М. В., and Welt L. G., (eds.): Diseases of the Kidney, ed. 2. pp. 31—88. Boston, Little Brown, 1971.
19.Vertel R. М., and Knochel J. P.: Nonoliguric acute renal failure. J. A. М. A.,
200: 598, 1967.
20.Anderson R. J.. Linas S. L., Berns A. S., et al.: Nonoliguric acute renal failure. N. Engl. J. Med., 296 : 1134, 1977.
21.Kaye D., and Rocha H.- Urinary concentrating ability in early experimental pyelonephritis. J. Clin. Invest, 49 : 1427, 1970.
22.Mazze R. I; Trudell J. R., and Cousins M. J.; Methoxyflurane metabolism and renal dysfunction. Anesthesiology, 35 : 247, 1971.
23.Roth H., Becker К. L., and Shalhoub R. J.: Nephrotoxicity of demethylchlorotetracycline hydrochloride: a prospective study. Arch. Intern. Med., 120 :
433, 1967.
24.Barr G. A., Mazze R. J., Cousins M. J., et al.: An animal model for combined methoxyflurane and gentamicin nephrotoxicity. Br. J. Anaesth. 45 : 306, 1973.
25.Frimpter G. W., Timpanelli A. E., Eisenmenger W. J., et al.: Reversible "Fanconi syndrome" caused by degraded tetracycline. J. A. M. A., 184 : 111, 1963.
26.Lee R. V.* Jampol L. M., and Brown W. V.: Nephrogenic diabetes insipidus and lithium intoxication: complications of lithium carbonate therapy. N. Engl. J. Med., 284 : 93, 1971.
27.Douglas J. В., and Healy J. K.: Nephrotoxic effects of amphotericin В including renal tubular acidosis. Am. J. Med., 46 : 154, 1969.
28.Witte M. H; Short F. A., and Hollander W., Jr.: Massive polyuria and naturesis following relief of urinary tract obstruction. Am. J. Med., 37 : 320, 1964.
29.Baldwin D. S., Combos E. A., and Chasis H.: Urinary concentrating mechanism in essential hypertension. Am. J. Med., 38 : 864, 1965.
30.Jick H., Kamm D. E., and Snyder J. G.: On the concentrating defect in cirrhosis of the liver. J. Clin. Invest., 43 : 258, 1964.
31.Klahr S., Tripathy К., and Garcia F. Т.: On the nature of the renal concentrating defect in malnutrition. Am. J. Med., 43 : 84,1967.
32.Russell G. F. M., and Bruce J. Т.: Impaired water diuresis in patients with anorexia nervosa. Am. J. Med., 40 : 38, 1966.
33.Levitt M. F., Hauser A. D., and Levy M. S.: The renal concentrating defect in sickle cell disease. Am. J. Med., 29 : 611, 1960.
34.Сагопе F. A., and Epstein F. H.: Nephrogenic diabetes insipidus caused by amyloid disease. A. J. Med., 29 : 539, 1960.
35.Lauson H. D.: Metabolism of antidiuretic hormones. Am. J. Med., 46 : 713, 1967.
36.Crandell W. В., Pappas S. G., and Macdonald A.: Nephrotoxicity associated with methoxyflurane anesthesia. Anesthesiology, 27 : 591, 1966.
37.Mazze R. I., Shv-e G. L., and Jackson S. H.: Renal dysfunction associated with methoxyflurane anesthesia: a randomized, prospective clinical evaluation. J. A. M. A., 216 : 278, 1971.
38.Mazze R. I., Cousins M. J., and Kosek J. C.: Doserelated methoxyflurane nephrotoxicity in rats: a biochemical and pathologic correlation. Anesthesiology, 36 : 571, 1972.
39.Cousins M. J., Mazze R. I., and Kosek J. C.: The etiology of methoxyflurane nephrotoxicity. J. Pharmacol. Exp. Ther., 190 : 523, 1974.
40.Cousins M. J., and Mazze R. I.: Methoxyflurane nephrotoxicity: a study of dose response in man. J. A. M. A., 225 : 1611, 1973.
41.Franscino J. A., Vanamee P., and Rosen P. P.: Renal oxalosis and axotemia after methoxyflurane anesthesia. N. Engl. J. Med., 283 : 676, 1970.
42.Kuzucu E. Y.: Methoxyflurane, tetracycline, and renal failure. J. A. M. A., 211 : 1162,1970.
43.Mazze R. I., and Cousins M. J.: Combined nephrotoxicity of gentamicin and methoxyflurane anaesthesia in man. Br. J. Anaesth., 45 : 394, 1973.
44.Cousins M. }., Greenstein L. R-, Hitt B. A., et al.: Metabolism and renal effects of enflurane in man. Anesthesiology, 44 : 44, 1976.
45.Mazze R. I., Calverley R. K., and Cmith N. Т.: Inorganic fluoride nephrotoxicity. Anesthosiology, 46 : 265, 1977. Лб. Hitt В. А., Mazze R. I; Cousins M. I., et al.: Metabolism of isoflurane in
Fischer 344 rats and man. Anesthesiology, 40 : 62, 1974.
47.Mazze R. I., Cousins M. J., and Barr G. A.: Renal effects and metabolism of isoflurane in man. Anesthesiology, 40 : 536, 1974.
48.Mazze R. I.: Critical care of the patient with acute renal failure.Anesthesiology, 47 : 138,1977.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Harrington J. Т., and Cohen J. J.: Clinical disorders of urine concentration and dilution. Arch. Intern. Med., 131 : 810, 1973.
Maffly Д. Я.: Diabetes insipidus. In Andreloi T. E., Grantham J. J., and Rector F. C., Jr. {eds.}: Disturbances in the Body Fluid Osmolaliiy. pp. 285— 307. Bethesda, American Physiological Society, 1977.
