
- •Лечение
- •Гемодинамическая и дыхательная поддержка
- •Лечебная стратегия
- •Длительная антикоагуляция и вторичная профилактика
- •Тромбоэмболия легочной артерии: алгоритмы диагностики и лечения
- •Патогенез тэла
- •Гемодинамические расстройства
- •Респираторные расстройства
- •Классификация тэла
- •Основные клинические синдромы при тромбоэмболии легочной артерии
- •Прямая локация тромба в легочной артерии
- •Общие диагностические стратегии
- •Лечебная тактика при тэла
- •Фибринолитическая терапия
- •Хирургическая эмболэктомия
- •Чрескожная эмболэктомия, катетерная фрагментация и тромбэктомия
- •Антикоагулянтная терапия
Антикоагулянтная терапия
Антикоагулянтная терапия служит основным методом лечения больных с ТЭЛА уже более 40 лет, со времени опубликования результатов исследования Barrit и Jordan (1960). Нефракционированный гепарин связывается с антитромбином III и повышает активность последнего, что предотвращает тромбообразование и способствует растворению уже сформировавшихся тромбов путем активации эндогенных фибринолитических механизмов. Таким образом, гепаринотерапия при ТЭЛА в основном направлена на источник тромбоэмболии, а не на тромбоэмбол в легочной артерии, а основной ее целью является профилактика повторных тромбозов и, таким образом, повторной эмболизации. Актуальность такой профилактики объясняется тем, что при отсутствии антикоагулянтной терапии у больных, перенесших эпизод ТЭЛА, вероятность повторной эмболии с летальным исходом колеблется от 18 до 30 %.
В рекомендациях Европейского общества кардиологов приведена схема введения нефракционированного гепарина при ТЭЛА (табл. 7).

У больных с массивной ТЭЛА рекомендуют для болюсного введения использовать дозу не менее 10 тыс. ед, а целевой уровень аЧТВ при инфузионной терапии должен составлять не менее 80 с. Гепаринотерапия должна проводиться в течение 7-10 дней, поскольку именно в эти сроки происходит лизис и/или организация тромба.

В последние годы для лечения больных с ТЭЛА успешно используются низкомолекулярные гепарины (НМГ). Они имеют ряд преимуществ перед НФГ. НМГ имеют также более предсказуемый антикоагулянтный эффект, так как в меньшей мере, чем НФГ, связываются с белками плазмы крови. НМГ назначаются на килограмм массы тела больного, и отсутствует необходимость лабораторного контроля.
В 2004 году был проведен метаанализ нескольких рандомизированных исследований, в которых проводилось сравнение безопасности и эффективности применения НФГ и НМГ у больных с ТЭЛА. Не было показано существенных различий между двумя видами терапии по частоте развития повторных симптоматических венозных тромбоэмболических осложнений и смерти как на момент прекращения лечения, так и по результатам 3-месячного наблюдения. Таким образом, применение НМГ как минимум столь же эффективно и безопасно для лечения немассивной ТЭЛА, как и прием НФГ.
Одновременно с применением гепарина больным с ТЭЛА назначают непрямые антикоагулянты, механизм действия которых заключается в нарушении нормального метаболизма витамина К в печени. Учитывая, что первые несколько дней приема непрямые антикоагулянты могут вызывать парадоксальное состояние гиперкоагуляции, исходя из необходимости 4-5-дневного периода до достижения адекватного антикоагулянтного эффекта, прием непрямых антикоагулянтов следует начинать уже с первых дней гепаринотерапии.
Из препаратов этой группы в Украине зарегистрированы варфарин, аценокумарол (синкумар) и фениндион (фенилин). Период полувыведения для варфарина составляет 42 часа, для аценокумарола - 9 часов, фениндиона - 5 часов. Длительность действия варфарина позволяет назначать препарат один раз в день и обеспечивает незначительные колебания его антикоагулянтного эффекта. Поэтому именно варфарин получил наиболее широкое распространение в мировой клинической практике и успешно используется на протяжении уже более 50 лет.
Существуют различные схемы насыщения варфарином, при этом наибольшее распространение получила схема, представленная в табл. 8.

На протяжении всего периода клинического применения непрямых антикоагулянтов основным методом контроля является определение протромбинового времени (ПВ). Единый показатель результатов определения ПВ получил название «Международное нормализующее отношение» (МНО). Для проверки уровня гипокоагуляции стали применяться референтные плазмы, как приготовленные искусственно, так и полученные из крови больных, принимающих непрямые антикоагулянты. Определенные в процессе стандартизации тромбопластинов калибровочные константы, так называемый Международный индекс чувствительности (МИЧ), дали возможность сравнивать результаты ПВ независимо от используемого тромбопластина. Как правило, в инструкции к тромбопластину сейчас указывается МИЧ, с помощью которого по формуле можно определить МНО:
МНО = (ПВ больного/ПВ донора)МИЧ.
После насыщения варфарином дальнейшая коррекция дозы осуществляется в зависимости от уровня МНО, которое должно оставаться на уровне 2,0-3,0.
Общая продолжительность лечения непрямыми антикоагулянтами должна составлять не менее 3 месяцев. В некоторых случаях, например у больных с отчетливо выраженным гиперкоагуляционным синдромом, непрямые антикоагулянты принимают в течение года и более. Схема проведения антикоагулянтной терапии у больных с ТЭЛА представлена на рис. 22

Рекомендации лечения ТЭЛА:
1. Для большинства пациентов с ТЭЛА не рекомендуется системная фибринолитическая терапия (степень 1A). Предлагается ограничить применение системного тромболизиса только для пациентов с нестабильной гемодинамикой (степень 2B), при дисфункции правого желудочка возможно введение тенектеплазы.
(В конце 2007 года начато проспективное рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование PEITHO (Pulmonary Embolism International Thrombolysis Study), в котором изучается эффективность терапии тенектеплазой у больных с субмассивной ТЭЛА. Результаты этого исследования позволят решить вопрос применения тенектеплазы у данной категории больных, результаты ожидаются к 2012 году).
2. Не использовать локальную чрескатетерную фибринолитическую терапию (степень 1C).
3. У пациентов с ТЭЛА, которые получают фибринолитическую терапию, предлагается отдавать предпочтение кратковременным фибринолитическим режимам (степень 2C).
4. У большинства пациентов с ТЭЛА не рекомендуется эмболэктомия из легочной артерии (степень 1C). У некоторых пациентов, находящихся в критическом состоянии, которое не оставляет достаточно времени для фибринолитической терапии, показана легочная эмболэктомия(степень 2C).
5. У пациентов с противопоказаниями или осложнениями антикоагулянтной терапии, а также с рецидивирующей тромбоэмболией, несмотря на адекватную антикоагулянтную терапию, рекомендуется установка нижнего кава-фильтра (степень 2C).
|
ОБЩАЯ ЧАСТЬ
Тромбоэмболия лёгочной артерии (ТЭЛА) — это закупорка (окклюзия) артериального русла лёгких (ствола, правой или левой лёгочной артерии и/или их ветвей) тромботическими массами различного калибра (рисунок 1), сформировавшимися в венах большого круга кровообращения (тромбоз глубоких вен (ТГВ) ног и илео-кавального сегмента, таза, т.е. в бассейне нижней полой вены, редко – в бассейне верхней полой вены), реже – в правом предсердии или в правом желудочке сердца.
Механическая закупорка ствола или ветвей легочной артерии тромбоэмболом сопровождается генерализованным спазмом лёгочных артериол, что приводит к резкому ограничению кровотока в лёгких.
Заболевание может протекать молниеносно, длиться часы, месяцы и даже годы, иметь неспецифическую клинику (признаки лёгочного сердца, болевой синдром, гипотония с синкопе и т.д.), протекать бессимптомно (при поражении артерий среднего, сегментарного и более мелкого калибра) или иметь транзиторные проявления с возможными исходами от летального до формирования хронического лёгочного сердца, посттромботического пневмофиброза и выздоровления.
При аргументированном подозрении на ТЭЛА требуется незамедлительное проведение антикоагулянтной терапии [51, 62].
Тромбоэмболия лёгочной артерии не является самостоятельным заболеванием органов грудной клетки, но представляет собой осложнение венозного тромбоза. Таким образом, тромбоз глубоких вен (ТГВ) и ТЭЛА являются составляющими единого патологического процесса, называемого венозным тромбоэмболизмом (ВТЭ) [1, 31, 41, 46, 63]. Между тем в МКБ-10 ТЭЛА определена как отдельная нозологическая форма («лёгочная эмболия» соответствует шифрам I26.0, I26.9). Этим документом она удостоена права самостоятельного главенствующего места в диагнозе [62].
Р исунок
1. Макропрепарат правого лёгкого,
фронтальный срез. Недавняя тромбоэмболия
в правую основную лёгочную артерию.
Тромбоэмбол распространяется на правую
верхнедолевую артерию, междолевую
артерию и в сегментарные ветви нижней
доли. В нижней латеральной области
заметно кровоизлияние [35].
исунок
1. Макропрепарат правого лёгкого,
фронтальный срез. Недавняя тромбоэмболия
в правую основную лёгочную артерию.
Тромбоэмбол распространяется на правую
верхнедолевую артерию, междолевую
артерию и в сегментарные ветви нижней
доли. В нижней латеральной области
заметно кровоизлияние [35].
ТЭЛА – самая частая нераспознаваемая причина смерти у госпитализированных больных, отвечающая за гибель сотен тысяч пациентов ежегодно. Необходимость в знании этой патологии тем более остра, что почти в 70% случаев правильный диагноз не устанавливается. Без лечения смертность при ТЭЛА составляет около 30%, в первую очередь в связи с рецидивирующими эмболиями. Однако постановка диагноза с проведением эффективной терапии сопровождается снижением смертности до 2-8%. Хотя даже при своевременно установленном диагнозе спасти жизнь пациента удаётся не всегда, смертность в 4-6 раз выше в случаях, когда ТЭЛА нераспознана. Таким образом, быстрая и точная диагностика ТЭЛА поистине спасает жизнь [20].
Эпидемиология ТЭЛА
Общие положения
В ряде исследований, проводившихся в основном на белом населении, заболеваемость венозным тромбоэмболизмом, стандартизированная по возрасту и полу, составила от 71 до 117 случаев на 100000 [37]. В европейских странах, в частности, во Франции, ТЭЛА регистрируется до 100000 случаев, в Англии и Шотландии с ТЭЛА госпитализируется 65000, а в Италии – 60000 пациентов ежегодно [1]. В США только среди белого населения в год выявляют до 250000 больных, переносящих венозный тромбоэмболизм (ВТЭ), а расчетная частота всех эпизодов ВТЭ (первичные, рецидивы, фатальные и нефатальные случаи) в США составляет 900000 в год [53].
По данным, приведенным в руководстве "Флебология" под редакцией академика В.Савельева, в 1999 г. в Минздраве России зарегистрировано 240000 тромбозов глубоких вен (ТГВ) и 100000 ТЭЛА. Учитывая, что 4 из 5 ТГВ протекают бессимптомно, истинное число ТГВ, вероятно, составляет не менее 1 млн случаев в год [45]. Существенное влияние на распространённость ТЭЛА оказывают такие факторы, как этническая принадлежность, возраст, пол, наличие факторов риска [37].
По данным исследования ICOPER общая летальность в течение 3 месяцев среди всех больных ТЭЛА составила 17,4%. Значимость проблемы иллюстрируется результатами крупных секционных исследований, в которых показано, что ТЭЛА как причина смерти или состояние, сопутствующее или участвующее в танатогенезе у стационарных больных, встречалась в 15% случаев (постоянный показатель на протяжении последних 40 лет). Частота прижизненной диагностики ТЭЛА за тот же период существенно не менялась – 30% [20].
В таблице 1 суммированы основные факторы, которые влияют на частоту ВТЭ.
Таблица
1. Эпидемиология ВТЭ (частота вновь
диагностированных случаев) [37]. ![]()
|
Показатель |
Данные |
|
Заболеваемость в общей популяции (предполагается, что 95% - белое население) |
≈ 70-113 случаев/100 000/год |
|
Возраст |
Существенно повышается с возрастом, особенно после 40 лет. |
|
- 25-35 лет |
≈ 30/100 000 |
|
- 70-79 лет |
≈ 350-500/100 000 |
|
Пол |
Не оказывает влияния |
|
Раса/этническая принадлежность |
Риск ВТЭ в 2,5-4 раза ниже у азиатов и жителей Океании по сравнению с белым населением |
|
Доля ТЭЛА и ТГВ |
- При отсутствии патологоанатомического подтверждения: 33% ТЭЛА; 66% ТГВ; - По данным вскрытий: 55% ТЭЛА; 45% ТГВ. |
|
Сезонность |
Возможно, частота выше в зимние месяцы и меньше летом. |
|
Факторы риска |
≈ 25-50% - идиопатический ВТЭ; ≈ 15-25% связано с онкологическими заболеваниями; ≈ 20% - после хирургических вмешательств (в течение 3 месяцев). |
|
Рецидивирующий ВТЭ |
Рецидив в течение полугода: ≈ 7%; частота выше при онкологических заболеваниях. ТЭЛА после состоявшейся ТЭЛА отмечается чаще, чем после изолированного ТГВ. |
|
Смертность в леченых случаях ВТЭ |
30-дневная летальность ≈ 6% после ТГВ 30-дневная летальность ≈ 12% после ТЭЛА. На летальность большое влияние оказывают возраст, сопутствующие онкологические и сердечно-сосудистые заболевания. |
|
|
|
Среди госпитализированных пациентов 70% приходится на долю терапевтических больных. По данным Фрамингемского исследования, ТЭЛА составляет 15,6% от всей внутригоспитальной летальности, причем на хирургических больных приходилось 18%, а 82% составили больные с терапевтической патологией. Planes A. с сотрудниками (1996) указывают, что ТЭЛА является причиной 5% летальных исходов после общехирургических и 23,7% – после ортопедических операций. Легочная эмболия занимает одно из ведущих мест в акушерской практике: в структуре материнской смертности это осложнение составляет 2,8–9,2% [1]. В ряде исследований, проводившихся в основном на белом населении, заболеваемость венозным тромбоэмболизмом, стандартизированная по возрасту и полу, составила от 71 до 117 случаев на 100000 [37].
Подобный разброс эпидемиологических данных обусловлен отсутствием точной статистики распространенности ТЭЛА, что объясняется следующими фактами:
Основываясь на секционных данных, можно утверждать, что 2/3 случаев ТЭЛА при жизни остаются нераспознанными [20].
Преобладают бессимптомные формы заболевания. H. Bounameaux (1999 г.) считает, что на 1000 венозных тромбозов только 100 имеют какие-либо клинические проявления; из них у 60 пациентов разовьется ТЭЛА, но только в 10 случаях она будет иметь клинические признаки) [46].
Клиническая симптоматика ТЭЛА во многих случаях схожа с заболеваниями легких и сердечно–сосудистой системы [1].
Инструментальные методы обследования больных с ТЭЛА, имеющие высокую диагностическую чувствительность и специфичность, доступны узкому кругу медицинских учреждений [1].
Существенное влияние на распространённость ТЭЛА оказывают такие факторы, как этническая принадлежность, возраст, пол, наличие факторов риска [37].
Частота вскрытий низка, и в большинстве случаев при аутопсии только тщательное исследование легочных артерий позволяет обнаружить тромбы или остаточные признаки перенесенной ТЭЛА [31].
Хотя определение общей частоты заболевания по указанным выше причинам затруднительно, можно установить распространённость среди больных с конкретными факторами риска (таблица 2).
Таблица
2. Заболеваемость ВТЭ по группам риска
[31]. ![]()
|
Группа риска |
Низкий риск |
Средний риск |
Высокий риск |
|
Общая хирургия |
- Возраст < 40 лет; - Продолжительность операции < 30 минут; - Отсутствие других факторов риска |
- Возраст > 40 лет; - Продолжительность операции > 30 минут; - Отсутствие других факторов риска |
- Возраст > 60 лет; - Продолжительность операции > 60 минут; - Наличие других факторов риска |
|
Ортопедия, травматология |
Лёгкие травмы |
Травмы, требующие наложения гипса на нижние конечности |
- Операции на тазобедренных и коленных суставах; - Перелом бедренной кости; - Множественные травмы |
|
Физиологические состояния и заболевания |
Беременность |
Сердечная недостаточность, инсульт, злокачественные опухоли |
Длительный постельный режим (иммобилизация) |
|
Заболеваемость % | |||
|
Дистальный ТГВ |
2 |
10 — 40 |
40 — 80 |
|
Проксимальный ТГВ |
0,4 |
6 — 8 |
10 — 15 |
|
ТЭЛА с клиническими проявлениями |
0,2 |
1 — 2 |
5 — 10 |
|
Фатальная ТЭЛА |
0.002 |
0.1 — 0.8 |
1 — 5 |
У больных хирургического профиля частота ВТЭ стремительно возрастает с возрастом, продолжительностью анестезии и наличием ВТЭ или онкологических заболеваний в анамнезе.
Самая высокая частота ТЭЛА наблюдается после экстренных операциий в травматологии (например, по поводу перелома бедренной кости) и после операцияй на органах таза. После больших операцияй на органах брюшной полости при отсутствии профилактики фатальные ТЭЛА развиваются в 0.5 — 0.8% случаев среди больных старше 40 лет. После тотального протезирования тазобедренного сустава ТЭЛА развивается у 1 из 20 пациентов, при этом в половине случаев — фатальная. Довольно высока частота ВТЭ в акушерстве, особенно при оперативном родоразрешении. Клинически значимые ТЭЛА развиваются как минимум в 3% после АКШ.
После операций больные находятся в группе повышенного риска ТЭЛА как минимум в течение месяца. Среди больных терапевтического профиля риск ТЭЛА наибольший при патологии сердечно-сосудистой и дыхательной систем (например, при застойной сердечной недостаточности, необратимых лёгочных заболеваниях), состояниях, при которых требуется длительный постельный режим (например, после инсульта других неврологических расстройств), при злокачественных опухолях. Приём оральных контрацептивов повышает общий риск ВТЭ примерно в 3 раза [31].
Локализация тромбоэмболов в лёгочном сосудистом русле
По данным различных авторов, эмболизация ствола и главных ветвей легочной артерии имеет место в 50%, долевых и сегментарных – в 22%, мелких ветвей – в 30% случаев.
Одновременное поражение артерий обоих легких достигает 65% из всех случаев ТЭЛА, в 20% – поражается только правое, в 10% – только левое легкое, нижние доли поражаются в 4 раза чаще, чем верхние доли [1].
Относительная частота ТЭЛА и ТГВ в структуре ВТЭ
Данные по относительному вкладу ТЭЛА и ТГВ в структуру ВТЭ разнятся в зависимости от того, в клинике или по данным аутопсии был поставлен диагноз.
В большинстве клинических исследований, в которых не предполагалось патологоанатомического подтверждения диагноза, частота ТГВ примерно вдвое превышает таковую ТЭЛА. Так, заболеваемость ТГВ составляет 48 на 100000, а ТЭЛА 23 на 100000 (то есть 32% всех случаев ВТЭ). На 51233 случаев изолированного ТГВ в стационарах Калифорнии за тот же период пришлось 21625 случаев ТЭЛА (30% от общего числа больных ВТЭ). В исследовании Longitudinal Investigation of Thromboembolism Etiology на ТЭЛА пришлось 28% случаев ВТЭ.
В эпидемиологических исследованиях, основанных на результатах вскрытий, частота ТЭЛА превышает частоту изолированного ТГВ. По данным аутопсий среди мужчин старше 50 лет распространённость ТЭЛА и ТГВ составляла 205 и 182 на 100000 соответственно в одном исследовании и 69 против 48 на 100000 - в другом.
Влияние расы и этнической принадлежности
Частота ВТЭ на 600 вскрытий в возрастной группе старше 40 лет в Бостоне (США) оказалась 15%, в то время как на острове Кюсю (Япония) – лишь 0,7%.
В многонациональной Калифорнии в 1996 году стандартизованные показатели заболеваемости идиопатическим ВТЭ составили: 86 на 100000 среди белого населения, 93 на 100000 среди афроамериканцев, 37 на 100000 среди латиноамериканцев и 19 на 100000 – среди выходцев из Азии и Океании.
Причины относительно низкой распространённости ВТЭ среди азиатов и испанцев неизвестны. Объяснением может служить меньшая распространённость в этих этнических группах предрасполагающих генетических факторов, таких как Лейденская мутация V фактора (0,5% в азиатской популяции против 5% среди белого населения). С другой стороны, среди афроамериканцев данная мутация встречается менее чем в 1% случаев, в то время как среди испанцев – в 2% [37].
Возраст и ВТЭ
С возрастом распространённость ВТЭ растёт в геометрической прогрессии: от 5 на 100000 среди детей моложе 15 лет до 600 на 100000 в возрастной группе старше 80 лет (рис. 2) [37]. Увеличение частоты ТЭЛА с возрастом может объясняться простым накоплением сопутствующих заболеваний, которые сами по себе являются факторами риска ТЭЛА [31].
Р исунок
2. Ежегодная заболеваемость ВТЭ в
зависимости от возраста и пола. Бросается
в глаза резкое увеличение заболеваемости
после 60 лет [37].
исунок
2. Ежегодная заболеваемость ВТЭ в
зависимости от возраста и пола. Бросается
в глаза резкое увеличение заболеваемости
после 60 лет [37].
Пол и ВТЭ
Хотя приём оральных контрацептивов и гормонзаместительная терапия в постменопаузе повышают частоту ВТЭ у женщин, согласно опубликованным данным существенной разницы в заболеваемости ВТЭ среди женщин и мужчин нет [37].
По другим данным, при стандартизации по возрасту распространённость ВТЭ выше среди мужчин (114 на 100000), чем среди женщин (105 на 100000); соотношение м:ж = 1.2:1. В детородном возрасте частота ВТЭ выше среди женщин, в то время как после 45 лет чаще болеют мужчины [53].
Время года и ВТЭ
Относительно изменения частоты ВТЭ в зависимости от времени года имеются противоречивые данные. Хотя в одном из исследований сезонных колебаний распространённости ВТЭ не было, в двух исследованиях показано, что зимой количество госпитализаций по поводу ВТЭ выше на 10-15%, а летом – на 10-15% ниже. Возможно, указанная закономерность связана с уменьшением двигательной активности зимой и повышением её летом, что отражает обратную зависимость между двигательной активностью и развитием ВТЭ.
Соотношение идиопатических и вторичных форм ВТЭ, первичный ВТЭ
По литературным данным на идиопатический ВТЭ приходится от 26 до 47% в зависимости от используемого определения термина «идиопатический». В остальных случаях имелись 1 и более известных факторов риска ВТЭ (злокачественные новообразования, хирургические операции в недавнем анамнезе, травмы, тяжёлая терапевтическая патология, иммобилизация) [37].
Серьёзным фактором риска ВТЭ являются тромбофилические состояния. Их частота среди больных ВТЭ значимо выше, чем в общей популяции (таблица 3).
Таблица
3. Наследственные тромбофилические
состояния (распространённость в %)
[26]. ![]()
|
Фактор |
Распространённость в общей популяции |
Распространённость среди больных ТГВ |
|
Дефицит протеина C |
0.1–0.3 |
2–5 |
|
Дефицит протеина S |
0.3 |
2 |
|
Дефицит антитромбина III |
0.5 |
1 |
|
Фактор V Лейдена |
4–6 |
20–25 |
|
Вариант гена протромбина G-A20210 |
2 |
8 |
|
↑ XI Фактора (> 90-го процентиля) |
10 |
19 |
|
↑ VIII фактора (> 1,500 МЕ/л) |
11 |
25 |
|
Гипергомоцистеинемия |
5 |
12 |
Рецидивирующий ВТЭ
Венозный тромбоэмболизм – хроническое заболевание, склонное к рецидивированию. По различным данным рецидивирование ВТЭ в течение полугода происходит в 6,4-8,6%, в течение 5 лет – 22% и в течение 10 лет – до 30,4% [37]. Наиболее опасные в этом отношении первые 6-12 месяцев после эпизода ВТЭ. Хотя профилактическое лечение антикоагулянтами эффективно в предотвращении рецидивов ВТЭ, продолжительность такой терапии никак не влияет на риск рецидива после её прекращения.
Независимыми предикторами рецидива являются мужской пол, возраст и индекс массы тела, неврологические заболевания с парезами нижних конечностей, а также текущие онкологические заболевания. Дополнительными факторами являются идиопатический ВТЭ, наличие в крови волчаночного антикоагулянта и антител к фосфолипидам, дефицит антитромбина, дефицит протеинов C и S, а также, возможно, персистирующее повышение уровня D-димера и остаточный венозный тромбоз [53].
Смертность
Как минимум в четверти случаев ТЭЛА единственным проявлением катастрофы является внезапная смерть. В США ежегодная ТЭЛА-ассоциированная летальность может превышать аналогичный показатель при инфаркте миокарда и инсультах [53].
Хотя в двух исследованиях, в которые вошли гемодинамически стабильные больные ТЭЛА, смертность составила от 1,8 до 4,1%, в проводившихся в то же время крупных исследованиях с включением гемодинамически нестабильных больных и больных с массивной ТЭЛА смертность была значительно выше. Так, по данным исследования ICOPER общая летальность в течение 3 месяцев среди всех больных ТЭЛА составила 17,4%. В исследовании MAPPET внутрибольничная летальность среди больных, поступавших с нестабильной гемодинамикой, составила 31% [20].
По данным Cushman с соавт. смертность в течение 28 дней после первого эпизода составляет 9,4% для ТГВ и 15,1% - для ТЭЛА. При первичном ВТЭ 28-дневная летальность составила 5,2 против 7,3% - при вторичном и 25,4% - среди больных раком. По данным Siddique с соавт. 30-дневная летальность после впервые диагностированной ТЭЛА у больных старше 65 лет составляет 16,1% для афроамериканцев и 12,9% – в белой популяции. Среди больных, у которых ТЭЛА диагностирована во время госпитализации по поводу других заболеваний, смертность выше (32,5%), чем среди поступивших с основным диагнозом ТЭЛА. Риск летального исхода существенно повышают такие факторы, как низкое систолическое АД, застойная сердечная недостаточность , рак, тахипноэ, гипокинез правого желудочка при эхокардиографии, ХОБЛ и возраст старше 70 лет [37].
Эпидемиология осложнений венозного тромбоэмболизма
Главные осложнение ВТЭ – постфлебитический синдром (вплоть до формирования кожных язв) и хроническая посттромбоэмболическая лёгочная гипертензия. Общая распространённость синдрома венозного стаза в США составляет 75,1 на 100000 в год, с венозным тромбоэмболизмом связано 12% всех случаев. Риск возникновения синдрома венозного стаза после ВТЭ повышается в 17 раз. В течение 20 лет после тромбоза проксимальных глубоких вен постфлебитический синдром развивается у 40% больных, варикозные язвы за тот же период формируются в 3,7% [53].
Предполагается, что в США ежегодно появляется 500-2500 новых больных хронической посттромбоэмболической лёгочной гипертензией [18].
Классификация ТЭЛА. Формулировка диагноза
Классификация ТЭЛА
Единой классификации ТЭЛА и венозного тромбоэмболизма (ВТЭ) не существует. Используются следующие критерии [63]:
Уровень эмболической окклюзии.
Степень нарушения перфузии лёгких.
Быстрота течения процесса.
Характер гемодинамических расстройств.
Классификация по объёму поражения сосудистого русла
В руководстве Европейского Общества Кардиологов (ЕОК) 2000 г. по диагностике и лечению ТЭЛА предложено различать массивную, субмассивную и немассивную ТЭЛА. Согласно этой классификации предлагается различать ТЭЛА по объёму поражения сосудистого русла [28, 62]:
Массивную — обструкция более 50% сосудистого русла лёгких с клиникой шока или с развитием артериальной гипотонии.
Субмассивную — окклюзия менее 50% объёма сосудистого русла лёгких без гипотонии, но с эхокардиографическими признаками дисфункции правого желудочка (гипокинез).
Немассивную — окклюзия менее 50% объёма сосудистого русла лёгких со стабильной гемодинамикой и отсутствием признаков дисфункции правого желудочка при ЭхоКГ.
Классификация по степени риска ранней смерти
Однако
калибр обтурированного сосуда не
является единственным фактором,
определяющим тяжесть клинической
картины. Возникающие нейрогуморальные
нарушения при ТЭЛА, сопутствующая
патология способствуют даже при поражении
мелких ветвей выраженному нарушению
лёгочной перфузии и развитию тяжёлых
клинических проявлений (см. «патогенез»
– «патологические изменения
сердечно-сосудистой системы при ТЭЛА»
– «лёгочная гипертензия» )[20,
51, 62, 63]. ![]()
Поэтому в новом руководстве ЕОК (2008 г. [41]) рекомендовано отказаться от используемых ранее терминов «массивная», «субмассивная» и «немассивная» ТЭЛА, которые могут неверно отражать прогноз, а под тяжестью ТЭЛА понимается риск ранней смерти (смерти в стационаре или в течение 30 суток после эмболии). Предлагается использовать старатификацию больных ТЭЛА на группы высокого и невысокого риска, а среди последних выделять подгруппы среднего и низкого риска (таблица 4). Оценка степени риска лежит в основе выбора тактики ведения больных ТЭЛА (см. « диагностический алгоритм при подозрении на ТЭЛА », « алгоритм лечения ТЭЛА »).
Таблица 4. Стратификация риска в соответствии с ожидаемой ранней летальностью вследствие ТЭЛА (ЕОК, 2008 г.) [41].
|
Группы риска ранней смерти (смерти в стационаре или в течение 30 суток после ТЭЛА) |
Факторы риска |
Тактика ведения | |||
|
Клинические (шок, гипотония) |
Дисфункция правого желудочка (хотя бы 1 признак) |
Повреждение миокарда (хотя бы 1 показатель) | |||
|
ВЫСОКОГО > 15% |
+ |
(+) a |
(+) a |
Тромболизис или эмболэктомия | |
|
НЕВЫСОКОГО |
Среднего 3-15% |
— |
+ |
+ |
Лечение в стационаре |
|
+ |
— | ||||
|
— |
+ | ||||
|
Низкого < 1% |
— |
— |
— |
Ранняя выписка или амбулаторное лечение | |
|
a Для стратификации риска при шоке и гипотонии нет необходимости в подтверждении дисфункции правого желудочка и повреждения миокарда – больные автоматически относятся к категории высокого риска. | |||||
Таким образом, уже при быстром обследовании у постели больного можно определить, относится пациент к группе высокого риска ранней смерти или нет. Такой подход позволяет в кратчайшие сроки определиться с тактикой ведения больных и своевременно назначить жизнеспасающее лечение больным высокого риска. При дальнейшем обследовании тех, у кого нет клинических признаков высокого риска (шока, артериальной гипотонии), следует оценить риск более точно (подробнее см. раздел «стратификация риска и прогноз») [41].
Классификация по течению заболевания
Кроме
того, немаловажна оценка ТЭЛА по течению
заболевания. Клинически различают
острейшее, острое, подострое и
рецидивирующее течение. ![]()
Острейшее (молниеносное) течение – смерть в течение нескольких минут [67].
Острое течение характеризуют следующие признаки: внезапность начала, загрудинная боль, одышка, падение АД, признаки острого лёгочного сердца.
При подостром течении ТЭЛА прогрессируют дыхательная и правожелудочковая недостаточность, появляются признаки инфарктной пневмонии, кровохарканье.
Рецидивирующее течение отличают повторные эпизоды одышки, обмороки, признаки пневмонии [62].
Классификация по наличию факторов риска
В зависимости от выявляемых факторов риска и потенциальных причин, ТЭЛА может быть разделена на вторичную, первичную и идиопатическую формы (подробнее см. раздел «этиология (факторы риска)» - «первичный, вторичный и идиопатический ВТЭ» ). Больные с вторичными тромбоэмболиями имеют один или более клинически определяемых (приобретённых) факторов риска, предрасполагающих к развитию ТГВ. В противоположность вторичному ВТЭ, при первичном заболевании факторы риска, приводящие к тромбофилии, являются наследственными. Даже после тщательного сбора анамнеза и обследования, у ряда пациентов не удаётся найти факторы риска. Эта форма ВТЭ называется идиопатической [20, 31, 47].
Другие классификации ТЭЛА
Предпринимаются попытки создания комбинированных классификаций, учитывающих несколько признаков (таблица 5) [31]:
Таблица 5. Комбинированная классификация ТЭЛА, учитывающая вариант течения и массивность поражения сосудистого русла [31].
|
Вариант ТЭЛА |
Анамнез |
Объём обструкции ЛА% |
Клиническая манифестация |
Типичное давление | |
|
PAP |
RAP | ||||
|
Острая немассивная |
Короткий, внезапное начало |
< 50 |
Одышка, возможно в сочетании с плевральными болями и кровохарканьем |
Нормальное |
Нормальное |
|
Острая Массивная |
Короткий, внезапное начало |
> 50 |
Правожелудочковая недостаточность, возможна нестабильность гемодинамики и потеря сознания |
45/20 |
12 |
|
Подострая массивная |
Несколько недель |
> 50 |
Одышка и правожелудочковая недостаточность |
70/35 |
8 |
|
PAP, давление в лёгочной артерии; RAP, среднее давление в правом предсердии, ЛА — лёгочная артерия. | |||||
Отсутствие единой систематизации обусловлено тем, что разные авторы придерживались разных особенностей ТЭЛА, возможностей оценки тяжести, как критериев диагноза. В каждой из множества бытующих классификаций ТЭЛА имеются свои положительные черты, удобные в той или иной мере для применения на практике. Так, в 1979 году предложен индекс объёма поражения в баллах по Миллеру (в основе — результаты ангиопульмонографии и сцинтигирафии), который широко распространён в хирургической клинике, особенно в специализированных отделениях и центрах. В. С. Савельев с соавторами (1990 г.) создали классификацию на основе этих методов обследования (локализация, калибр поражённого сосуда, градация перфузионного нарушения) с оценкой тяжести гемодинамики и осложнений [62]. В таблице 6 приведена классификация В. Б. Яковлева [63].
Таблица 6. Классификация ТЭЛА по степени нарушения перфузии лёгких [63].
|
Степень |
Ангиографический индекс, баллы |
Перфузионный индекс, % |
|
I. Лёгкая |
До 16 |
До 29 |
|
II. Средняя |
17-21 |
30-44 |
|
III. Тяжёлая |
22-26 |
45-59 |
|
IV. Крайне тяжёлая |
27 и более |
60 и более |
Другие классификации ориентированы на клинические аспекты ТЭЛА и более приемлемы для амбулаторной и стационарной практики хирурга и терапевта. В них отражён характер течения ТЭЛА с клиническими синдромами. В одной из таких классификаций путеводное значение автор (Золочевский П. М., 1978) отвёл синдрому тромбоэмболической ситуации (условия и факторы, способствующие ТЭЛА, предшествующая патология и клинический фон с выявлением первоисточника тромбоэмболии).
Классификация Ю. В. Аншелевич и Т. А. Сорокиной проста и сочетает в себе все необходимые клиницисту ориентиры для единой трактовки больных и тактики ведения (таблица 7).
Таблица 7. Клиническая классификация ТЭЛА (Ю. В. Аншелевич, Т. А. Сорокина, 1983 г.) [62].
|
Форма ТЭЛА |
Уровень поражения лёгочной артерии |
Течение заболевания |
|
Тяжёлая |
Лёгочный ствол, главные ветви |
Молниеносное (сверхострое) |
|
Среднетяжёлая |
Долевые, сегментарные ветви |
Острое |
|
Лёгкая |
Мелкие ветви |
Рецидивирующее |
Однако она тоже несовершенна: критерии течения и формы заболевания размытые, нечёткие. Так, подострое течение может наблюдаться как при эмболии в долевые и сегментарные артерии, так и при поражении мелких ветвей. Рецидивирующее течение выделяется как лёгкая форма, хотя оно часто является предвестником фатальной ТЭЛА.
По характеру течения авторы выделяют молниеносную форму, при которой развитие основных симптомов происходит за несколько минут; острую, при которой развитие заболевания наблюдается в течение часов, дней; и рецидивирующую форму, которая наиболее трудна для диагностики.
По степени тяжести течения ТЭЛА выделяют тяжёлую, среднетяжёлую и лёгкую формы.
Тяжёлая форма характеризуется глубокими расстройствами гемодинамики и дыхания. Тахикардия более 120 ударов в минуту, шок, резкая одышка с учащением дыхания более 40 дыхательных движений в минуту, цианоз, возможна потеря сознания. У 40-60% больных отмечается загрудинная боль, чувство беспокойства, страха.
Среднетяжёлая форма проявляется выраженными нарушениями гемодинамики и дыхания. Больным этой формой свойственны тахикардия 100-120 ударов в минуту, артериальная гипотензия, но без периферических симптомов шока, тахипноэ с числом дыханий 30 в минуту. Может быть кратковременная потеря сознания, а также плевральный болевой синдром, чувство страха, кашель, кровохарканье.
Лёгкая форма — гемодинамические сдвиги маловыраженные и быстропреходящие: пульс не превышает 90-100 ударов в минуту, нормотония. Одышка и гипервентиляция отсутствуют или слабо выражены и кратковременны. Изредка у больных лёгкой формой имеет место кашель, кровохарканье [62].
Код по МКБ-10 и формулировка диагноза
Диагноз «лёгочная эмболия» в МКБ-10 соответствует шифрам I26.0, I26.9.
При формулировании диагноза необходимо отразить:
1. Локализацию и уровень поражения.
2. Форму ТЭЛА (степень риска).
3. Характер течения заболевания.
4. Синдром тромбоэмболической ситуации.
5. Осложнения.
По мнению А. М. Бахирева и соавт. [62] ТЭЛА может фигурировать в качестве первого основного диагноза. Согласно другому подходу в основной диагноз идёт нозология, явившаяся причиной ВТЭ, ТЭЛА указывается как осложнение [98].
Примеры формулировки диагноза:
Тромбоэмболия ствола лёгочной артерии (массивная форма, высокий риск), молниеносное течение. Шок.
Тромбоэмболия мелких ветвей лёгочной артерии, средний риск, рецидивирующее течение. Инфаркт-пневмония S9,10 правого легкого, экссудативный плеврит. Посттромбоэмболический плевро- и пневмофиброз в нижней доле левого лёгкого. ДН II.
Тромбоэмболия мелких ветвей лёгочной артреии в нижней доле правого лёгкого, острое течение, средний риск. ИБС: постинфарктный кардиосклероз (передне-перегородочный инфаркт миокарда от 07.05.2005) с нарушнеием ритма сердца (постоянная форма мерцания предсердий). Осложнения: НК IIA, острое лёгочное сердце.
ТЭЛА, рецидивирующее течение (рецидивы от 15.07.2008, 10.08.2008), средний риск. Множественные двусторонние инфаркты в нижних долях лёгких. Инфаркт-пневмонии в S8,9,10 правого и в S10 левого лёгкого. Правосторонний экссудативный плеврит. Периферический рак правого лёгкого с метастазами в надпочечники и печень. Мигрирующий паранеопластический тромбофлебит нижних конечностей [62 с изменениями].
Тромбофлебит глубоких вен левой голени. Тромбоэмболия мелких ветвей лёгочной артерии. Острое лёгочное сердце [98].
Оценка клинической вероятности ТЭЛА
Хотя специфичность и чувствительность отдельных симптомов и данных физикального обследования при ТЭЛА не высоки, оценка их в совокупности позволяет ещё до выполнения анализов и инструментальных обследований разделить больных на категории клинической вероятности ТЭЛА.
В ряде крупных исследований показано, что разделение больных с подозрением на ТЭЛА по уровням клинической вероятности диагноза оправдано соответствующей частотой подтверждения (при низкой клиничесокй вероятности – 9%, при промежуточной – 30%, при высокой вероятности – 68%). Определение клинической вероятности ТЭЛА (наряду со стратификацией риска ) лежит в основе выборадиагностического алгоритма и комплексной оценки результатов диагностических процедур.
Врач может оценить клиническую вероятность ТЭЛА эмпирически (чисто субъективная оценка). Главным недостатком эмпирического метода является невозможность стандартизации и обучения. В связи с этим разработаны и валидизированы специальные диагностические шкалы. Наиболее распространёнными среди них являются канадская (Wells с соавт.) и пересмотренная женевская шкалы (G. le Gal с соавт.) (таблица 8).
Таблица
8. Клинические шкалы вероятности ТЭЛА:
шкала Wells и пересмотренная женевская
шкала [41]. ![]()
|
Пересмотренная женевская шкала (G. le Gal с соавт.) |
Канадская шкала (Wells с соавт.) | |||
|
Признаки |
Баллы |
Признаки |
Баллы | |
|
Предрасполагающие факторы: |
Предрасполагающие факторы: | |||
|
Возраст > 65 лет |
+1 |
ТГВ или ТЭЛА в анамнезе |
+1.5 | |
|
ТГВ или ТЭЛА в анамнезе |
+3 |
Недавние хирургические операции или иммобилизация |
+1.5 | |
|
Переломы или хирургические операции в течение месяца |
+2 |
Онкопроцесс |
+1 | |
|
Злокачественное новообразование |
+2 |
| ||
|
Симптомы: |
Симптомы: | |||
|
Боль в ноге (односторонняя) |
+3 |
Кровохарканье |
+1 | |
|
Кровохарканье |
+2 | |||
|
Физикальные данные: |
Физикальные данные: | |||
|
ЧСС 75-94 ударов/мин ≥ 95 ударов/мин |
+3 +5 |
ЧСС>100 ударов/мин |
+1.5 | |
|
Асимметричный отёк нижних конечностей и болезненность при пальпации по ходу вен |
+4 |
Клинические признаки ТГВ |
+3 | |
|
|
При проведении дифференциальной диагностики ТЭЛА наиболее вероятна |
+3 | ||
|
Клиническая вероятность |
Сумма баллов |
Клиническая вероятность (трёхуровневая схема) |
Сумма баллов | |
|
Низкая |
0-3 |
Низкая |
0-1 | |
|
Промежуточная |
4-10 |
Промежуточная |
2-6 | |
|
Высокая |
≥ 11 |
Высокая |
≥7 | |
|
|
|
|
| |
|
|
|
Клиническая вероятность (двухуровневая схема) |
Сумма баллов | |
|
|
|
ТЭЛА маловероятна |
0-4 | |
|
|
|
Вероятность высока |
>4 | |
Как видно из таблицы 8, при оценке клинической вероятности ТЭЛА необходимо не только проанализировать жалобы и данные физикального обследования: при сборе анамнеза особое внимание следует уделить выяснению факторов риска ВТЭ которые имеются у данного пациента.
Независимо от того, какое диагностическое правило используется, распространённость ТЭЛА составляет 10% среди больных с низкой клинической вероятностью, 30% - при промежуточной и 65% - среди больных с высокой клинической вероятностью ТЭЛА [41, 42, 44].
Классы рекомендаций относительно методов диагностики и лечения
Разделы, посвящённые диагностике и лечению ТЭЛА, базируются в первую очередь на материалах рекомендаций Европейского общества кардиологов (ЕОК) 2008 года [41]. Этот документ построен на принципах медицины, основанной на доказательствах, то есть в качестве основы принятия решений предполагает поиск, оценку и использование данных современных исследований. При таком подходе рекомендации разделяются по классам и уровням доказательности (таблицы 9 и 10).
Таблица 9. Классы рекомендаций относительно методов диагностики и лечения [41]
|
Класс I |
Эффективность и польза доказаны и/или общепризнанны. |
|
Класс II |
Данные об эффективности и пользе противоречивы и/или имеются разногласия в этом вопросе между экспертами. |
|
Класс IIa |
Больше доказательств/голосов «за» |
|
Класс IIb |
Больше доказательств/голосов «против» |
|
Класс III |
Доказана и/или общепризнанна бесполезность, а в ряде случаев – опасность. |
Таблица 10. Описание уровней доказательности [41]
|
Уровень доказательности A |
Доказательства основаны на результатах значительного количества рандомизированных клинических исследований а или мета-анализов. |
|
Уровень доказательности B |
Доказательства основаны на результатах одного рандомизированного клинического исследования а или крупных нерандомизированных исследований. |
|
Уровень доказательности C |
Заключение базируется на мнении экспертов и/или на результатах небольших исследований, ретроспективных анализов, регистров. |
|
а или на результатах больших, тщательно спланированных испытаний, когда речь идёт о методах диагностики. | |
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Общие положения
Наиболее часто причиной и источником эмболизации ветвей лёгочной артерии является тромб, возникший при флеботромбозе в бассейне нижней полой вены (90%) или в правых отделах сердца (при сердечной недостаточности с дилатацией правого желудочка, у больных мерцательной аритмией) (см. источники эмболии рис.5 ).
Состав и морфология венозных тромбов (потенциальных эмболов) меняется с течением времени. Вскоре после образования происходит ретракция кровяных сгустков: нити фибрина прочно оплетают сгусток и из него выжимается плазма. После такого отжимания и механической компрессии, сгустки теряют около 90% исходного содержания плазминогена и становятся резистентными к тромболитической терапии [20].
Нередко в лёгочном русле тромбоэмбол разделяется на более мелкие части, что сопровождается обтурацией множества лёгочных сосудов. Наиболее характерная локализация тромбоэмболов – нижние доли лёгких, особенно правого [62].
Попадание эмбола в лёгочную циркуляцию вызывает обструкцию сосуда, что приводит к гемодинамическим и респираторным нарушениям.
Патогенез ТЭЛА (изменения со стороны сердца, лёгочных сосудов, паренхимы лёгких, плевры) складывается из прямых последствий артериальной обструкции и комплекса запускаемых при этом клеточных, гуморальных и рефлекторных реакций. На реализацию тех или иных звеньев патогенеза в каждом конкретном случае оказывает влияние множество факторов (размер, происхождение и «возраст» тромбоэмбола, рецидивирование, резервы внутренней фибринолитической системы, исходное состояние лёгких и сердца, сопутствующие заболевания, лечебные мероприятия, прошедшее с момента эмболии время и др.) [20, 31]. Кроме того, совершенно необходимо понимать, что ТЭЛА – быстро развивающееся динамическое заболевание с непрерывно меняющимися функциональными, клиническими, радиологическими и лабораторными данными. Этим отчасти объясняются сложности диагностики. Интерпретация результатов диагностических тестов и принятие обоснованных решений невозможно без знания патогенеза и естественного течения лёгочной эмболии (рисунок 3) [20].
Рисунок 3. Патофизиология и варианты естественного течения ТЭЛА [20].

Этиология (факторы риска)
Выдающийся патологоанатом XIX в. Рудольф Вирхов первым показал, что кровяные сгустки в лёгочной артерии происходят из венозных тромбов. Он писал: «Более или менее крупные фрагменты, оторвавшиеся от мягких тромбов, с током крови заносятся в далеко расположенные сосуды. Так развивается очень частый процесс, который я назвал “эмболия”» [26].
Каскад свёртывания
Процесс тромбообразования представляет собой каскад ферментативных реакций, в результате которого образуются нити фибрина, являющиеся основой тромба. К системе гемостаза помимо факторов свёртывания относятся естественные антикоагулянты, препятствующие нецелесообразному тромбообразованию, и фибринолитическая система, обеспечивающая восстановление проходимости сосудов после формирования тромбов [22].
Подробнее ![]()
Источники эмболии
Тромбы, образующиеся в артериях и в венах, существенно различаются между собой. В то время как артериальные тромбы состоят в основном из тромбоцитов, венозные тромбы главным образом содержат фибрин и эритроциты. Венозные тромбозы обычно развиваются в мышечных венах голеней и на клапанах глубоких вен голени, характеризующихся медленным кровотоком [20].
Подробнее ![]()
Факторы риска венозного тромбоэмболизма (ВТЭ)
Обсуждение патогенеза тромбоза глубоких вен (ТГВ) всегда начинается с упоминания триады Вирхова [1, 26]:
Застой крови

Повышенная склонность к свёртыванию (гиперкоагуляция)

Повреждение сосудистой стенки

Поскольку развитию ТЭЛА предшествует ТГВ, факторы риска последнего (то есть факторы, реализующие триаду Вирхова) распространяются и на ТЭЛА [31]. В рекомендациях Европейского Общества Кардиологов (ЕОК) по диагностике и лечению ТЭЛА за 2008 приводятся следующие факторы, предрасполагающие к развитию ВТЭ (факторы риска – табл. 11). У большинства больных имеется более одного фактора риска.
Таблица
11. Факторы, предрасполагающие к венозному
тромбоэмболизму (ЕОК, 2008) [36, 41]. ![]()
|
Предрасполагающие факторы |
Связанные с состоянием пациента (достаточно длительно существующие) |
Ситуационно-обусловленные |
|
Сильные предрасполагающие факторы (относительный риск >10) | ||
|
Переломы нижних конечностей (костей голени, бедренной кости) |
|
√ |
|
Протезирование тазобедренных или коленных суставов |
|
√ |
|
Большие хирургические операции |
|
√ |
|
Тяжёлые травмы |
|
√ |
|
Повреждение спинного мозга |
|
√ |
|
| ||
|
Предрасполагающие факторы средней силы (относительные риск 2-9) | ||
|
Артроскопические операции на коленном суставе |
|
√ |
|
Венозные катетеры |
|
√ |
|
Химиотерапия |
|
√ |
|
Хроническая сердечная или дыхательная недостаточность |
√ |
|
|
Заместительная гормональная терапия |
√ |
|
|
Злокачественные новообразования |
√ |
|
|
Приём пероральных контрацептивов |
√ |
|
|
Инсульты с развитием параличей |
√ |
|
|
Послеродовый период |
|
√ |
|
Предшествующие эпизоды ВТЭ |
√ |
|
|
Наследственные тромбофилии |
√ |
|
|
| ||
|
Слабые предрасполагающие факторы (относительный риск < 1) | ||
|
Постельный режим более 3 дней |
|
√ |
|
Длительное пребывание в положении сидя (например, в самолёте, в машине) |
|
√ |
|
Возраст (с возрастом риск повышается) |
√ |
|
|
Лапароскопические операции (например, холецистэктомия) |
|
√ |
|
Ожирение |
√ |
|
|
Беременность |
√ |
|
|
Варикозная болезнь |
√ |
|
Факторы риска венозного тромбоэмболизма и триада Вирхова
Анализируя факторы риска тромбоза, легко убедиться, что каждый из них связан с одним или несколькими компонентами триады Вирхова (таблица 12).
Таблица 12. Соотнесение факторов риска ВТЭ с компонентами триады Вирхова [26]
|
Факторы риска |
Стаз |
Гиперкоагуляция |
Травма |
|
ТГВ в анамнезе |
|
√ |
|
|
Большие хирургические операции |
√ |
|
√ |
|
Рак |
√ |
√ |
|
|
Ожирение |
√ |
|
|
|
Травма |
|
|
√ |
|
Переломы (бедра или костей голени) |
√ |
|
√ |
|
Беременность |
√ |
√ |
|
|
Инфаркт миокарда |
√ |
|
|
|
Застойная сердечная недостаточность |
√ |
|
|
|
Инсульт |
√ |
|
|
|
Приём эстрогенов |
|
√ |
|
|
Длительная иммобилизация |
√ |
|
|
|
Ожоги |
√ |
|
|
Поиск факторов риска проводится не только с диагностической целью (их выявление важно при сборе анамнеза и учитывается при оценке клинической вероятности диагноза), но и для подбора адекватных профилактических мер (см. раздел « профилактика ВТЭ »). В ряде случаев необходимы повторные обследования [31].
Первичный, вторичный и идиопатический венозный тромбоэмболизм (ВТЭ)
В зависимости от выявляемых факторов риска и потенциальных причин, ТЭЛА может быть разделена на вторичную (наличие приобретённых факторов риска), первичную (наличие наследственных факторов риска) и идиопатическую (нет выявляемых факторов риска) формы [20].
Наследственные факторы риска (первичные).
Лейденская мутация фактора V.
Мутация гена протромбина G20210A.
Дефицит протеина S.
Дефицит протеина C.
Дефицит антитромбина III.
Дефицит гепарин-кофактора II.
Дефицит плазминогена.
Дефицит тканевого активатора плазминогена.
Повышение уровня ингибитора активатора плазминогена.
Повышение прокоагулятной активности фактора VIII.
Дисфибриногенемия.
Первичная гипергомоцистеинемия.
Приобретённые факторы риска (вторичные).
Травмы, длительная иммобилизация.
Оперативные вмешательства в течение последних трёх месяцев (в первую очередь большая абдоминальная хирургия, операции на печени, на органах таза и ортопедические операции на тазобедренном и коленном суставах).
Инсульт , параличи
 конечностей.
конечностей.ТГВ в анамнезе.
Злокачественные опухоли (особенно рак поджелудочной и предстательной желёз, метастазы опухолей).
Ожирение.
Курение табака.
Заболевания сердечно-сосудистой системы: пролапс митрального клапана, клапанные пороки сердца с преобладанием недостаточности, протезы клапанов, сердечная недостаточность , аортокоронарное шунтирование, операции на аорте,артериальная гипертония .
Лекарства: приём пероральных контрацептивов, гормон-заместительная терапия, андрогены.
Беременность, роды и послеродовый период.
Вторичная гипергомоцистеинемия.
Антифосфолипидный синдром («волчаночный антикоагулянт»).
Сахарный диабет.
Миелопролиферативные заболевания (эритремия, эссенциальный тромбоцитоз).
Острый промиелоцитарный лейкоз.
Выраженный лейкоцитоз при остром лейкозе.
Нефротический синдром.
Воспалительные заболевания кишечника.
Серповидно-клеточная анемия, талассемия, гипертриглицеридемия.
Инфекции, особенно сепсис, вызванный грамотрицательными бактериями.
Васкулиты.
Возраст старше 40 лет.
Вторичные тромбоэмболии лёгочной артерии (ТЭЛА)
Больные со вторичными тромбоэмболиями имеют один или более клинически определяемых (приобретённых) факторов риска, предрасполагающих к развитию тромбоза глубоких вен (ТГВ). Важно знать эти факторы, так как наличие одного или более из них увеличивает вероятность ТГВ и их необходимо учитывать при подозрении на ТЭЛА.
Приобретённые факторы, влияющие на гомеостаз, включают беременность и послеродовый период, приём оральных контрацептивов, гормон-заместительную терапию, злокачественные опухоли и антифосфолипидный синдром.
К другим важным факторам риска относятся:
Госпитализация.
Перенесённые хирургические операции или травмы.
Неврологические заболевания или параплегии
 после
инсульта.
после
инсульта.Пребывание в домах ухода.
Установка центрального венозного катетера или эндокардиального электрокардиостимулятора.
Перелёты на дальние расстояния.
Злокачественные опухоли и венозный тромбоэмболизм (ВТЭ)
Впервые взаимосвязь между злокачественными опухолями и ВТЭ была открыта Armand Trousseau у больных со скрыто протекающим раком. С патогенетических позиций это объяснимо склонностью онкологических больных к тромбофилии вследствие продукции веществ с прокоагулянтными свойствами, в частности тканевого фактора и ракового прокоагулянта.
Клинически явные ТЭЛА развиваются у 10% больных раком и являются второй по частоте причиной смерти. С другой стороны, примерно 20% больных с симптомами ТГВ имеют установленный до этого онкологический диагноз. У 75% больных, страдающих ВТЭ и раком, диагноз онкологического заболевания был установлен к моменту сосудистой катастрофы.
Однако ТЭЛА может предшествовать диагностике злокачественной опухоли за месяцы и даже годы. В одном исследовании, включившем 250 больных с клинически явным тромбозом, в процессе обследования онкологическое заболевание было диагностировано у 3,3% больных, не имеющих других факторов риска. Частота обнаружения онкологических заболевания в течение 2 лет в группе больных, исходно отнесённых к идиопатическому ТГВ, составила 8% против 2% в группе, имевшей другие факторы риска на момент поступления. Заболеваемость раком была существенно выше среди 35 пациентов с рецидивирующим «идиопатическим» ТГВ (17%). Наиболее часто тромботические осложнения развиваются при раке лёгких, поджелудочной железы, колоректальном раке, раке простаты и почек.
Первичные тромбоэмболии лёгочной артерии (ТЭЛА)
В противоположность вторичному ВТЭ, при первичном заболевании факторы риска, приводящие к тромбофилии, являются наследственными. Наследственные тромбофилии представляют собой группу генетических заболеваний, предрасполагающих к развитию тромбозов через влияние на ряд факторов, участвующих в каскаде свёртывания. Недавние открытия (фактор V Лейдена, протромбин G20210А, повышение концентрации VIII фактора) подчёркивают значимость наследственной предрасположенности в развитии тромбофилий.
Наследственные тромбофилии могут быть разделены на две группы: частые, ассоциированные со средним риском тромбоза (фактор V Лейдена и G20210A ген протромбина) и на нечастые, но связанные с высоким риском тромбозов (дефицит антикоагулянтных протеинов C и S).
Большинство наследственных тромбофилий ассоциированы с ВТЭ, а не с артериальными тромбозами. Резистентность к активированному протеину C –наследственная тромбофилия, ассоциированная с венозным тромбозом. Её причиной является точечная мутация гена V (пятого) фактора, которая определяет замену глутамина на аргинин в 506 положении, в одном из трех сайтов связывания с протеином C. Мутантный аллель фактора V (Q506) ассоциирован с 5-10-кратным возрастанием риска тромбоза и обнаруживается у 20-60% белокожих больных с тромбозами. Наибольшая распространённость этого аллеля (15%) отмечается в Скандинавском регионе, где высока заболеваемость тромбозами.
К другим частым наследственным аномалиям, предрасполагающим к тромбозу, относятся увеличение концентрации VIII фактора (более 1500 МЕ/л) и точечная мутация гена протромбина G20210A. Эта мутация отмечается у 2% здоровых людей и у 8% больных с тромбозами (это умеренный фактор риска).
К менее распространённым наследственным факторам риска тромбоза относятся гипергомоцистеинемия и дефицит тромбомодулина, протеина C, протеина S и антитромбина. Меньше данных имеется о повышении уровней факторов IX, X и XI. Такие дефекты имеют место в 1% у здоровых людей и все вместе не превышают 5% генетических дефектов, обнаруженных у больных тромбозами.
ВТЭ – ведущая причина заболеваемости и смертности среди беременных и в послеродовом периоде. Показано, что мутация генов протромбина или фактора V повышают риск ВТЭ у женщин во время беременности и в послеродовом периоде. Кроме того, риск при наличии обеих мутаций существенно выше, чем при единственной.
Идиопатическая форма ВТЭ
Даже после тщательного сбора анамнеза и обследования, у ряда пациентов не удаётся найти факторы риска. Эта форма ВТЭ называется идиопатической [20, 31, 47].
Основные звенья патогенеза ТЭЛА
Гемодинамические нарушения
Генерализованный спазм лёгочных сосудов; повышение лёгочного сосудистого сопротивления; острое развитие лёгочной гипертензии, острого лёгочного сердца (острая перегрузка и дилатация правых отделов сердца). Характерны: падение сердечного выброса, тахикардия, глубокая системная артериальная гипотензия; присоединение левожелудочковой недостаточности (массивная или рецидивирующая ТЭЛА) [62] – таблица 13.
Таблица
13. Гемодинамические нарушения при ТЭЛА
[28]. ![]()
|
Изменения гемодинамики |
Патофизиологические механизмы |
|
A. Изменения лёгочной гемодинамики. | |
|
Прекапиллярная гипертензия |
Редукция сосудистого ложа |
|
Бронхоконстрикция | |
|
Спазм артериол | |
|
Развитие сосудистых коллатералей |
Артериальные бронхо-лёгочные анастомозы |
|
Лёгочные артерио-венозные шунты | |
|
Изменения кровотока |
Перераспределение кровотока |
|
Реперфузия (вследствие лизиса эмболов) | |
|
B. Изменения системной гемодинамики и сердечной деятельности | |
|
Артериальная гипотензия |
Падение сердечного выброса |
|
Тахикардия |
Падение сердечного выброса |
|
Перегрузка и дилатация ПЖ |
Лёгочная гипертензия |
|
Повышение центрального венозного давления |
Повышение давления в правом предсердии |
|
Изменения геометрии левого желудочка |
Смещение межжелудочковой перегородки в полость левого желудочка |
|
C. Нарушения коронарного кровотока | |
|
Снижение транскоронарного градиента давления |
Снижение давления в аорте |
|
Повышение давления в правом желудочке | |
|
Ухудшение перфузии миокарда |
|
|
Относительная гипоперфузия субэндокардиальных отделов правого желудочка |
|
Респираторные нарушения
Шунтирование значительного объёма крови через артерио-венозные анастомозы (главный механизм нарушения газообмена), что приводит к выраженной гипоксемии.
Бронхоспазм (рефлекторный механизм, воздействие высвобождаемых из тромба медиаторов), углубление альвеолярной гиповентиляции, гипоксемии – формирование обструктивного синдрома (сопровождается нарушением распределения вентиляционно-перфузионных отношений в лёгких V/Q).
Влияние на юкстакапиллярные рецепторы – увеличение объёма альвеолярной вентиляции и резкое снижение PaCO 2 (гипокапния) → углубление бронхоспазма.
Гиперкапния (повышение PaCO 2 ) возможна в крайне тяжёлых случаях, вследствие отёка лёгких [62] – таблица 14.
Таблица
14. Респираторные нарушения при ТЭЛА
[28]. ![]()
|
Респираторные нарушения |
Патофизиологические механизмы |
|
A. Изменения динамики дыхания | |
|
Гипервентиляция |
Артериальная лёгочная гипертензия |
|
Снижение податливости лёгких | |
|
Ателектазы | |
|
Повышение бронхиального сопротивления |
Локальная гипокапния |
|
Действие медиаторов | |
|
B. Изменения альвеолярной вентиляции | |
|
Альвеолярная гипервентиляция (приводит к развитию гипокапнии и алкалоза) или относительная альвеолярная гиповентиляция. | |
|
C. Изменения механики дыхания | |
|
Снижение динамической податливости |
Уменьшение количества сурфактанта |
|
Ателектазы | |
|
Бронхоконстрикция | |
|
D. Изменения диффузионной способности лёгких | |
|
Уменьшение кровенаполнения капилляров |
Механическая обструкция и артериолоспазм |
|
Ухудшение проницаемости альвеоло-капиллярной мембраны |
Локальный отёк лёгких |
|
E. Нарушение вентиляционно-перфузионных отношений | |
В результате этих изменений при ТЭЛА развиваются синдромы острого лёгочного сердца и острой дыхательной недостаточности.
Узловые моменты патогенеза
Подавление выработки сурфактанта с локальными респираторными нарушениями в виде возникновения ателектаза или бронхоспазма с эмфиземой лёгких.
Несоовтетствие вентиляционно-перфузионных отношений: возникновение перфузионного дефицита с гипоксемией (в норме V/Q = 1, при ТЭЛА V/Q < 1), гипервентиляции с гипокапнией.
Гипертензия в системе лёгочной артерии на основе анатомической окклюзии сосуда, рефлекторных и гуморальных механизмов спазма артериол вследствие воздействия биологически активных веществ (медиаторов), выделяемых из тромбоэмбола, с развитием синдрома острого и подострого лёгочного сердца.
Уменьшение сердечного выброса с падением артериального давления в системе большого круга кровообращения при повышении общего периферического сосудистого сопротивления.
Развитие осложнений: инфаркта лёгкого, плеврита, пневмонии, сердечной недостаточности и других.
Формирование посттромбоэмболического пневмосклероза с синдромом хронического лёгочного сердца, дыхательной и сердечной недостаточности.
Основные факторы, влияющие на патогенез и естественное течение ТЭЛА
В малом круге кровообращения небольшие рыхлые эмболы быстро лизируются плазмином, и кровоток полностью восстанавливается. Иная картина наблюдается, если произошла эмболия лёгочных сосудов старыми, плотными тромбами, массивными тромботическими массами, быстрый лизис которых невозможен. Неизбежно возникает окклюзия лёгочной артерии тромбоэмболами, частично или полностью блокирующими кровоток в малом круге кровообращения.
Примерно треть больных, страдающих поражением мелких ветвей лёгочной артерии, переносят неблагоприятный вариант патогенеза – «подрастание» тромба. Оно происходит от периферии к центру. В процесс тромбирования вовлекаются как смежные ветви, так и первоначально поражённый участок артерии. Клинически это проявляется эпизодами повторных эмболий, заболевание приобретает рецидивирующий характер с формированием хронического лёгочного сердца [62].
Эндогенный фибринолиз
В исследованиях с применением рентгенографии, перфузионной сцинтиграфии лёгких и УЗИ показано, что во многих случаях перфузия поражённых областей лёгких быстро (в течение первых нескольких дней после эмболии) нормализуется. В одном исследовании с помощью вентиляцонно-перфузионной сцинтиграфии показано, что как минимум у трети больных отмечалось полное восстановление перфузии, причём скорость восстановления была максимальной в первые несколько дней, значительно снижаясь в последующие 2-3 недели. В другом исследовании при небольших эмболах полное восстановление перфузии через 10 дней отмечалось в 30%.
Эти клинические наблюдения подтверждены в ряде исследований на животных. При эксперементальной ТЭЛА на собаках показано значительное уменьшение размера тромбов в первые 2-4 дня. Подобно этому, в другом исследовании уменьшение размера тромба на 50% происходило за 3 часа и полное растворение за 48 ч. Столь быстрая динамика изменений может проявляться изменчивостью клинических проявлений и узким временным интервалом, в котором обследование информативно [20].
Рецидивирование
На изменчивость проявлений ТЭЛА оказывает влияние не только локальный лизис тромбов, но также множественность и рецидивирование тромбоэмболий. При ТЭЛА часто наряду с восстановлением перфузии в поражённых областях с течением времени отмечается её снижение в ранее интактных зонах. В одном исследовании появление новых зон снижения перфузии, связанное, вероятно, с повторными эмболиями, отмечалось у 22 из 63 пациентов. Интересно, что хотя частота появления новых дефектов накопления была выше у больных, не получавших лечения, они также наблюдались и в группе антикоагулянтной терапии. Таким образом, рецидивирование ТЭЛА может не полностью предотвращаться антикоагулянтами. Мало того: как это ни парадоксально, лечение само по себе может способствовать дезинтеграции и фрагментации более центрально расположенных, частично окклюзирующих тромбов, которые могут явиться источниками новых эмболов [20].
Влияние сопутствующей и фоновой патологии
На проявления ТЭЛА существенное влияние оказывает наличие или отсутствие сопутствующих заболеваний, в первую очередь сердечно-сосудистых и бронхо-лёгочных. Обычно жизнеугрожающую ТЭЛА связывают с массивной эмболией, определяемой, как обструкция 50% лёгочных сосудов или окклюзия двух и более долевых артерий. Однако массивная ТЭЛА ответственна лишь за половину смертельных исходов, остальные приходятся на субмассивные и повторные эмболии. Таким образом, исход ТЭЛА определяются не только размерами тромбов и площадью окклюзированного сосудистого русла, но также зависит от сопутствующих заболеваний. Показано, что массивные эмболии у больных с хорошим сердечно-лёгочным резервом компенсации и субмассивные эмболии у больных с предсуществующими сердечно-лёгочными заболеваниями манифестируют одинаковыми гемодинамическими изменениями и имеют сравнимые исходы. Таким образом, с целью прогнозирования исхода ТЭЛА целесообразно в совокупности рассматривать размер эмболов и функциональное состояние сердца и лёгких. С этих позиций, «большим» ТЭЛА будут соответствовать комбинации размера эмболов и функционального состояния сердца и лёгких, приводящие к значимому нарушению гемодинамики.
У больных, не страдавших сердечно-лёгочными заболеваниями до развития ТЭЛА, клиническая и патофизиологическая манифестация заболевания напрямую связаны с размером тромбов. Действительно, отмечается чёткая взаимосвязь между выраженностью обструкции по данным ангиографии и средним давлением в лёгочной артерии (mPAP), давлением в правом предсердии (RAP), PaO 2 и пульсом. Однако у больных с сопутствующими заболеваниями, уровень mPAP не соответствует степени обструкции по данным ангиографии, так что предсказательное значение PaO 2 и RAP для определения выраженности сосудистой обструкции весьма низкое. Кроме того, падение сердечного выброса у больных с сопутствующими сердечно-лёгочными заболеваниями не зависит от выраженности тромбоэмболической обструкции и выраженности лёгочной гипертензии. Таким образом, у больных, исходно страдающих сердечно-сосудистыми и бронхо-лёгочными заболеваниями, нет надёжной корреляции между степенью дисфункции правого желудочка и выраженностью эмболической обструкции [20].
Патологические изменения сердечно-сосудистой системы при ТЭЛА
Лёгочная гипертензия
У больных без фоновых лёгочных и сердечно-сосудистых заболеваний патофизиологические изменения и клиническая картина ТЭЛА напрямую связаны с объёмом эмболии. Среднее давление в лёгочной артерии, давление в правом предсердии, PaO2 и пульс хорошо коррелируют со степенью обструкции по данным ангиопульмонографии. Обычно единственным проявлением ТЭЛА при обструкции до 25% лёгочного сосудистого русла является артериальная гипоксемия. При увеличении объёма эмболии до 25-30% к артериальной гипоксемии присоединяется повышение давления в лёгочной артерии (нормальное значение среднего давления в лёгочной артерии mPAP = 20 мм рт. ст.). При обструкции 50% сосудистого ложа mPAP достигает 40 мм рт. ст. - максимальное давление, которое способен генерировать здоровый правый желудочек. Поддержание кровотока при массивной ТЭЛА или рецидивирующей с поражением 75% бассейна лёгочной артерии требует повышения mPAP более 40 мм рт. ст.; такая ТЭЛА сопровождается развитием правожелудочковой недостаточности и шока [20].
У больных с отягощённым по патологии сердечно-сосудистой и дыхательной систем анамнезом, жёсткой зависимости между mPAP и PaO 2 с одной стороны и выраженностью обструкции по данным ангиопульмонографии — с другой, нет [19, 20]. Гуморальные факторы (ФАТ, серотонин, катехоламины, аденозиндифосфат и др.), высвобождающиеся в момент эмболизации из входящих в состав тромба тромбоцитов, вызывают выраженный спазм сосудов. Поэтому при ТЭЛА жёсткой корреляции между объёмом эмбола и степенью повышения давления в лёгочной артерии может не быть. Даже при развитии небольшой по объёму эмболии у больных, до развития ТЭЛА страдавших серьёзной кардиореспираторной патологией, характерны высокие уровни лёгочной гипертензии [62].
Сердечная недостаточность
Сердечная недостаточность вследствие ТЭЛА — результат комбинации из повышенного напряжения стенки сердца и ишемии, что приводит к нарушению функции правого желудочка (ПЖ) и снижению выброса левого желудочка (ЛЖ). В экспериментах на животных и в клинических исследованиях чётко показано, что эмболия приводит к повышению постнагрузки на правый желудочек, в результате чего нарушается функция обоих желудочков. На степень повышения постнагрузки влияет сама по себе механическая обструкция и исходное состояние сердечно-лёгочной системы. Дополнительными факторами являются рефлекторная вазоконстрикция, высвобождение тромбоцитарных факторов (таких как серотонин и ФАТ), влияние компонентов плазмы (тромбин и вазоактивные пептиды С3а и С5а) и тканей (например, гистамина), а также системная артериальная гипоксемия [20].
Так как объём и продолжительность обструкции весьма вариабельны, разнообразны патофизиологические изменения и клинические проявления ТЭЛА. С точки зрения оценки изменений гемодинамики, ТЭЛА (исключая из рассмотрения хроническую посттромбоэмболическую лёгочную гипертензию) удобно подразделять на три главных функциональных типа: острая массивная, подострая массивная и острая немассивная (таблица 5) [31]. Напомним, что анатомический объём обструкции лёгочной артерии может не соответствовать функциональным последствиям из-за развития спазма лёгочных артериол, особенно при наличии сопутствующих сердечно-сосудистых и лёгочных заболеваний (см. раздел лёгочная гипертензия ).
Таблица
5. Комбинированная классификация ТЭЛА,
учитывающая вариант течения и массивность
поражения сосудистого русла [31]. ![]()
|
Вариант ТЭЛА |
Анамнез |
Объём обструкции ЛА% |
Клиническая манифестация |
Типичное давление | |
|
PAP |
RAP | ||||
|
Острая немассивная |
Короткий, внезапное начало |
< 50 |
Одышка, возможно в сочетании с плевральными болями и кровохарканьем |
Нормальное |
Нормальное |
|
Острая Массивная |
Короткий, внезапное начало |
> 50 |
Правожелудочковая недостаточность, возможна нестабильность гемодинамики и потеря сознания |
45/20 |
12 |
|
Подострая массивная |
Несколько недель |
> 50 |
Одышка и правожелудочковая недостаточность |
70/35 |
8 |
|
PAP, давление в лёгочной артерии; RAP, среднее давление в правом предсердии. | |||||
Острая массивная ТЭЛА

Подострая массивная ТЭЛА

Острая немассивная ТЭЛА

Шок
Под шоком понимают остро возникшую несостоятельность кровообращения с критическим расстройством тканевой перфузии, которое ведёт к дефициту кислорода в тканях, повреждению клеток и нарушению функции органов [92]. Отмечается нарушение гемодинамики с артериальной гипотонией в результате дисфункции сердца, что требует назначения вазопрессорных препаратов.
Развитие шока у больных ТЭЛА отражает недостаточность компенсаторных механизмов поддержания АД и/или перфузии тканей, что сопровождается повышением летальности в 3-7 раз. Таким образом, развитие шока позволяет быстро оценить прогноз для жизни (см. раздел « стратификация риска и прогноз », таблицу 4) [20].
Респираторные нарушения при ТЭЛА
Инфаркт лёгкого
Вирхов первым обратил внимание на то, что лёгочная эмболия может приводить к развитию инфаркта лёгкого, определяемого как некроз ткани лёгкого дистальнее области эмболической обструкции. Внезапная тромботическая окклюзия сосудов сопровождается повышением давления проксимальнее тромба и снижением или полным прекращением кровотока дистальнее. Это приводит к целому ряду последствий, включая уменьшение в альвеолах количества сурфактанта, повышение содержания белка и высвобождение провоспалительных медиаторов [20].
Инфаркт лёгкого развивается, если дистальные эмболии вызывают полную закупорку ветви ЛА малого калибра, в то же время проксимальная эмболия редко приводит к инфаркту. Последнее обстоятельство обусловлено тем, что паренхима лёгких обеспечена четырьмя источниками поступления кислорода: воздухоносные пути, лёгочные артерии, коллатеральные пути через бронхиальные артерии и обратная диффузия из венозного русла лёгких. Эти механизмы компенсации могут не функционировать у больных с патологией лёгких или имеющейся ко времени развития ТЭЛА сердечной недостаточностью. Такая ситуация предполагает даже при проксимальной эмболии развитие инфаркта лёгкого [62].
Инфаркт лёгкого у здоровых до развития ТЭЛА пациентов развивается в 10%, однако если в эмболизированной области исходно были нарушения оксигенации (заболевания лёгких или застой по малому кругу), частота инфаркта возрастает до 30% [31].
В случае развития инфаркта лёгкого через неделю отмечается полная некротизация ткани, которая отграничивается перифокальной инфильтрацией. Период рассасывания погибших масс продолжается две недели. Затем на их месте формируется пневмосклероз. В целом весь процесс, включая заключительную стадию (формирование пневмосклероза), занимает от двух до трёх месяцев. Инфаркт лёгкого может осложниться присоединением пневмонии , абсцессом, гангренизацией. При бронхогенном проникновении инфекции в зоне инфаркта или вокруг него развивается воспалительный процесс (инфаркт-пневмония), который может сопровождаться распадом лёгочной ткани. В таком случае в течение нескольких дней вследствие секвестрации некротического очага образуется полость значительных размеров [62].
Кровоизлияние в альвеолы (неполный инфаркт лёгкого)
Эмболическая окклюзия лёгочной артерии не обязательно ведёт к развитию инфаркта лёгкого. На самом деле, в отсутствие фонового заболевания сердца или лёгких истинный инфаркт (то есть некроз стенки альвеол) развивается не так уж часто. Неполный инфаркт лёгких впервые описали Hampton и Castleman, определив его как внутриальвеолярное кровоизлияние без некроза стенки альвеол [20]. Кровоизлияние происходит из-за градиента между низким давлением в лёгочных артериолах дистальнее эмбола и нормальным – в концевых ветвях бронхиальных артерий [64]. Неполный инфаркт развивается обычно у больных без сопутствующей патологии и разрешается в течение 1 недели, в то время как рентгенографические признаки полного инфаркта лёгких (с некрозом ткани) сохраняются более 2 недель (при формировании постинфарктного пневмосклероза – всю жизнь).
Кровоизлияние в альвеолы без развития некроза – наиболее частое событие в первые двое суток ТЭЛА. Рентгенографические признаки этого поражения полностью исчезают в течение 2-4 дней, что соответствует рассасыванию внутриальвеолярных кровоизлияний по секционным данным. При персистировании полной окклюзии обычно через 2 дня развивается некроз альвеолярной стенки (полный инфаркт лёгкого). Важность неполного инфаркта заключается в том, что он увеличивает вероятность постановки правильного диагноза, так как определяется при использовании визуализационных методик, таких как спиральная КТ или трансторакальная сонография [20].
Кровоизлияние при полном или неполном инфаркте лёгкого лежит в основе появления такого симптома ТЭЛА, как кровохарканье.
Бронхоспазм
Сразу после тромботической окклюзии ветви лёгочной артерии развивается бронхоконстрикция. В секционных исследованиях показано, что обструкции подвергаются в основном мелкие бронхи. Предполагается, что снижение объёма лёгких, уменьшение статической и динамической податливости у больных с ТЭЛА происходит вследствие констрикции мелких дыхательных путей. Принимая во внимание, что бронхоспазм можно предотвратить, назначив предварительно гепарин и блокаторы серотонина, можно считать, что уменьшение диаметра дыхательных путей, по крайней мере отчасти, связано с высвобождением бронхоконстрикторных медиаторов из тромбоцитов и воспалительных клеток (ФАТ, тромбоксан А 2 и др. - см. « роль воспаления в патогенезе ВТЭ »). Кроме того, другие медиаторы, высвобождаемые при ТЭЛА, такие как фактор активации тромбоцитов или тромбоксан, могут способствовать бронхоконстрикции [20].
Бронхоспазм может обусловить появление свистящих хрипов при аускультации больного ТЭЛА.
Отёк лёгких при острой ТЭЛА
Изредка при ТЭЛА рентгенографически определяются признаки отёка лёгких. Однако даже при использовании спиральной КТ, признаки отёка лёгких (гетерогенные области изменений по типу матового стекла, локализующиеся сегментарно или субсегментарно) выявляются менее чем в 10% случаев. Он развивается в результате повышения давления в лёгочных капиллярах интактных областей, а также увеличения проницаемости альволярно-капиллярной мембраны. Предполагается, что развитие отёка лёгких вносит вклад в нарушение вентиляционно-перфузионных отношений [20].
Отёк лёгких при хронической ТЭЛА
При хронической ТЭЛА отёк лёгких развивается чаще. В этом случае на КТ определяются участки повышенной плотности по типу матового стекла, чётко отграниченные от участков повышенной прозрачности, расположенных дистальнее окклюзированных артерий и, соответственно, лишенных притока крови. Наличие изменений по типу матового стекла тесным образом связано с расширением лёгочных артерий, что отмечается в 70% случаев при ТЭЛА. Таким образом, участки затемнения имеют смешанный генез: повышенная перфузия (гиперемия) и накопление жидкости в ткани перфузируемых областей. Тесное соседство участков уплотнения и гипоперфузии создаёт хорошо узнаваемую картину «мозаичной олигемии» [20].
Реперфузионный отёк лёгких
Реперфузионный отёк лёгких представляет собой острый некардиогенный отёк, который развивается в 90-100% случаев после тромбэктомии по поводу массивной ТЭЛА или тромбоэндариэктомии в связи с формированием стенозов при хронической посттромбоэмболической лёгочной гипертензии. На рентгенограммах грудной клетки в течение первых 2 дней после операции выявляются гетерогенные участки уплотнения лёгочной ткани, главным образом дистальнее реканализованного сосуда. Реперфузионный отёк лёгких может развиваться также после частичного или полного тромболизиса. Основным патофизиологическим механизмом данного расстройства является быстрое повышение кровотока и кровяного давления в областях дистальнее реканализованной лёгочной артерии. Определённый вклад вносят и другие факторы: механический стресс вследствие хирургического вмешательства и биохоимические изменения (например, высвобождение радикалов кислорода нейтрофилами, нарушение синтеза сурфактанта) [20].
Нарушение состава фосфолипидов сурфактанта
Сурфактант представляет собой смесь фосфолипидов и белков, которая выстилает внутреннюю поверхность альвеол. Сурфактант снижает поверхностное натяжение и защищает альвеолы от спадения, особенно в конце выдоха. Сурфактант также способен снижать транссудацию жидкости в интерстициальное и альвеолярное пространство. Таким образом, внезапная закупорка лёгочной артерии тромбом приводит к повреждению системы сурфактанта. В результате развиваются ателектаз, транссудация жидкости и клеток в повреждённую ткань лёгких.
Вначале ТЭЛА приводит к повышению общего содержания фосфолипидов. Причина такого повышения неизвестна; она может быть связана или с повышенной продукцией или с повышенной секрецией из поврежденных клеточных мембран или с нарушением обратного захвата фосфолипидов альвеолоцитами II типа или макрофагами, подобно процессам при лёгочном альвеолярном протеинозе. Кроме того, гипервентиляция, характерный симптом ТЭЛА, может усиливать продукцию фосфолипидов через холинергический и/или бета-адренергический механизмы. Однако качественные изменения сурфактанта, состоящие в снижении содержания главным образом фосфатидилхолина и фосфатидилглицерола, могут свидетельствовать в пользу повреждения альвеолоцитов II типа, как основного патофизиологического механизма исходного повышения общего уровня фосфолипидов. По прошествии острой стадии ТЭЛА, общее содержание фосфолипидов в лёгких снижается, что опять же может отражать снижение секреторной способности повреждённых альвеолоцитов II типа. Другой возможный механизм снижения концентрации фосфолипидов — рассасывание тромба с последующей реперфузией ткани лёгкого [20].
Ателектаз
Ателектазы вследствие ТЭЛА — частая рентгенографическая находка, особенно при одновременном развитии инфаркта лёгкого. Причиной ателектазов являются как уменьшение количества сурфактанта, так и кровоизлияние в альвеолы. Указанные изменения могут запускаться эмболической обструкцией лёгочного сосуда, кровоснабжающего соответствующую часть лёгочной паренхимы, а также феноменом «воздушного шунта», когда регионарная гипокапния вследствие гипоперфузии приводит к бронхоспазму, что поддерживается высвобождаемыми из тромбоцитов медиаторами [20].
Нарушение газообмена в лёгких
Нарушения газообмена — одно из ключевых звеньев патогенеза ТЭЛА. Типично развитие гипоксемии и гипокапнии. Характер нарушений прямо или косвенно зависит от следующих факторов: размер и состав тромба; протяжённость окклюзии; фоновое состояние сердечно-сосудистой и дыхательной систем; время, прошедшее с момента эмболии.
Наиболее частый признак ТЭЛА — падение парциального напряжения кислорода в артериальной крови, что наблюдается уже при окклюзии 13% лёгочного сосудистого русла. Развитие гипоксемии связано с увеличением альвеолярного мёртвого пространства, право-левым сбросом крови, вентиляционно-перфузионным несоответствием и с низким уровнем кислорода в смешанной венозной крови.
Нарушение вентиляционно-перфузионных отношений развивается вследствие перераспределения кровотока в обход эмболизированных областей, что приводит к повышенной перфузии неэмболизированных участков лёгких, в том числе плохо вентилируемых (с исходно низким V/Q). Кроме того, ателектазы лёгких, образовавшиеся дистальнее обтурированного сосуда, сохраняются даже после растворения тромба и реперфузии (опять же перфузия невентилируемых областей) [20]. Этот процесс может стать особенно значимым спустя несколько дней после ТЭЛА. Повышение давления в правом предсердии при наличии открытого овального окна (у 25% здоровых не закрыто, но в обычных условиях не функционирует, так как прикрыто особой заслонкой со стороны левого предсердия) сопровождается право-левым сбросом на уровне предсердий [20, 31, 62]. Эти состояния следует заподозрить, если гипоксемия выражена сильнее, чем можно было ожидать, исходя из других клинческих признаков, а также при сопутствующей гиперкапнии и отсутствии эффекта от кислородотерапии [31]. Постэмболический отёк лёгких вносит свою лепту в развитие артериальной гипоксемии.
Наконец, у больных массивной ТЭЛА с циркуляторным коллапсом, увеличение сердечного выброса в результате лечебных мероприятий может привести к падения PaO 2 вследствие усиления физиологического шунта через плохо вентилируемые области (с исходно низким вентиляционно-префузионным отношением) [20].
Ещё одним фактором, способствующим развитию артериальной гипоксемии, является чрезвычайно низкая сатурация смешанной венозной крови вследствие сниженного сердечного выброса: такая кровь не успевает полностью насытиться кислородом, проходя через альвеолярные капилляры областей лёгких с повышенной перфузией [31].
В то же время, гипоксемия при ТЭЛА не может быть объяснена единственно механической обструкцией сосудистого ложа и шунтированием крови. Учитывая, что тяжёлые нарушения газоомбена отмечаются даже у пациентов с небольшими эмболиями, гипоксемия скорее всего связана ещё и с высвобождением медиаторов воспаления (см. « роль воспаления в патогенезе ВТЭ »), снижающих активность сурфактанта, изменяющих проницаемость сосудов и функциональные внутрилёгочные шунты [20].
Хотя при ТЭЛА элименация CO 2 затруднена, гиперкапния развивается редко вследствие компенсаторной гипервентиляции. Достаточная же для развития гиперкапнии степень обструкции сосудистого русла лёгких, приводит, как правило, к фатальной правожелудочковой недостаточности [31]. Скорее, наоборот: для ТЭЛА характерно развитие артериальной гипокапнии и алкалоза , хотя гипокапния встречается не так часто, как гипоксемия. Возможно, гипокапния связана с частым поверхностным дыханием, наблюдаемым при ТЭЛА. Учитывая, что гипоксемия редко достигает такой выраженности, чтобы объяснить гипервентиляцию активацией хеморецепторов, нужно думать о существовании других видов афферентной импульсации в дыхательный центр. Лежащий в основе такого типа дыхания механизм неизвестен, но, возможно, связан с активацией С-волокон (J-рецепторов) и ирритантных рецепторов при эмболической окклюзии [20].
Плевральный выпот при ТЭЛА
Предполагается, что плевральные боли при периферической ТЭЛА обусловлены воспалительным ответом париетальной плевры, примыкающей к поражённой области лёгких. Вовлечение плевры изначально приводит к локальному накоплению жидкости, в результате чего может развиться базальный плевральный выпот. Как правило, жидкость скапливается сразу после ТЭЛА. Однако выпот обычно небольшой и односторонний, достигает максимальной выраженности в течение первых 3 дней. Плевральный выпот определяется в 51% случаев ТЭЛА при рентгенографическом исследовании, в 57% - при КТ и в 70% - при трансторакальном УЗИ.
Однако частота плеврального выпота при ТЭЛА недооценивается: объём выпота зачастую настолько мал, что не распознаётся при обычной рентгенографии грудной клетки, а порой, даже не подумав о возможности ТЭЛА, больного не обследуют.
Согласно современным представлениям в патогенезе плеврального выпота участвуют два основных механизма. Первый — повышение проницаемости сосудов лёгочной паренхимы. Около 20% жидкости поступает в интерстиций. Как только объём жидкости превышает способность лимфатических сосудов дренировать её, развивается плевральный выпот. Это может быть вызвано ишемией ткани и/или высвобождением провоспалительных медиаторов. Второй механизм связан с повышением капиллярного давления в париетальной плевре. В связи с тем, что лимфа в конце концов впадает в венозную систему, повышение системного венозного давления препятствует лимфатической системе дренировать плевральную полость, в результате чего в ней скапливается жидкость.
Анализ плеврального выпота не позволяет сделать диагностического заключения, так как при ТЭЛА выпот может иметь характер как транссудата , так и экссудата , а явно геморрагическим бывает лишь в небольшом проценте случаев.
Плевральный выпот при ТЭЛА богат как клеточными элементами, так и биомолекулами. В некоторых случаях результаты анализа плеврального ТЭЛА-ассоциированного выпота соответствуют диагнозам «эмпиема» или «хилоторакс», чем в очередной раз подтверждается, что в образовании выпота в зависимости от конкретных респираторных и гемодинамических нарушений участвуют разные механизмы. Макроскопически он может быть прозрачным, жёлтыми, слегка подкрашенным кровью или геморрагическим. Когда отмечается очень высокий цитоз, концентрация глюкозы и pH бывают низкими. Среди лейкоцитов встречаются как нейтрофилы, так и мононуклеары. Также может повышаться содержание мезотелиальных клеток и эозинофилов (более 10% всех лейкоцитов). В общем, ТЭЛА является причиной 4% эозинофильных плевральных выпотов [20].
Роль воспаления в патогенезе ВТЭ
Тромбоз запускает воспалительно-прокоагулянтный каскад, что приводит к повреждению венозной стенки. Процесс рассасывания тромба аналогичен таковому при заживлении ран: лейкоцитарная инфильтрация с возможным исходом в фиброз венозной стенки.
Медиаторами этого процесса являются провоспалительные цитокины, такие как ФНО-α, ИЛ-1β (из клеток повреждённой вены и местных лейкоцитов), которые способствуют дальнейшей активации лейкоцитов, стимулируют высвобождение хемотаксических факторов, усиливают тромбоз и повышают экспрессию клеточных молекул адгезии. Кроме того, тромбин действует как провоспалительный медиатор, который не только усиливает коагуляционный каскад, но также стимулирует прокоагулянтный потенциал эндотелиальных клеток с повышением экспрессии молекул клеточной адгезии и высвобождением медиаторов.
Молекулы клеточной адгезии, Р- и Е- селектины и ICAM-1 – ключевые факторы, способствующие адгезии и миграции лейкоцитов соответственно. Эмиграция лейкоцитов в сосудистую стенку сопровождается высвобождением цитотоксических воспалительных медиаторов, которые повреждают сосуд.
Воспалительный процесс напрямую задействован в патогенезе ТЭЛА. Так, повышение проницаемости лёгочных капилляров является следствием воздействия воспалительных медиаторов. Воспаление также играет роль в нарушении газообмена и в развитии бронхоспазма.
Клетки воспаления
В нескольких исследованиях показано, что после ТЭЛА поражённые области инфильтрируются воспалительными клетками. Микроэмболия, индуцированная внутривенным введением тромбина, приводит к притоку нейтрофилов в лёгкие в течение 15 минут. Повышенное поступление нейтрофилов в лёгочную циркуляцию сопровождалось снижением общего цитоза крови. Лейкоциты могут аккумулироваться интраальвеолярно, а также инфильтрировать стенку лёгочных сосудов.
Взаимосвязь между венозным тромбозом и воспалением стенки вен (флебитом) была подтверждена в эксперименте на грызунах, когда тромбоз индуцировали венозным стазом. Позже клеточную инфильтрацию подтвердили в нескольких исследованиях на животных при экспериментальной ТЭЛА. У крыс в подобных исследованиях отмечалась выраженная нейтрофильная инфильтрация стенки лёгочной артерии. Она сохраняется более 8 дней после ТЭЛА, достигая максимума на 2-е сутки. Макрофагальная инфильтрация стенки лёгочной артерии максимальна в первые сутки. В другом исследовании на крысах при экспериментальном тромбозе нижней полой вены определяли особенности воспаления по гистопатологии и морфометрии лейкоцитов. Взятые вместе, эти исследования показывают, что тромбоз приводит к ранней (1-й день) инфильтрации венозной стенки нейтрофилами, затем моноцитами/макрофагами и лимфоцитами (на 3 и 6-е сутки).
Тромбин
Эксперименты как in vivo, так и in vitro продемонстрировали, что компоненты воспалительного и коагуляционного каскада взаимосвязаны. Например, тромбин играет центральную роль в свёртывании и воспалении. Эта сериновая протеаза (тромбин), образующаяся из протромбина при активации коагуляционного каскада, является важным стимулятором агрегации тромбоцитов и превращает фибриноген в фибрин (см. каскад свёртывания рис.4 ), контролируя конечный этап тромбообразования.
Тромбин также выполняет функции воспалительного медиатора через взаимодействие со специфическими клеточными рецепторами. Тромбин стимулирует экспрессию P-селектина (CD62E), а также продукцию простациклина (PGI 2 ), ФАТ и хемокинов эндотелиальными клетками. Он также активирует гладкомышечные клетки, моноциты и полиморфноядерные лимфоциты.
Высвобождение липидных медиаторов
В недавнем исследовании состава жидкости бронхоальвеолярного лаважа (БАЛ) показано повышение уровня белка у больных ТЭЛА, чем подтверждается нарушение альвеолокапиллярной проницаемости. Повышение проницаемости, в свою очередь, по-видимому, связано с высвобождением множества воспалительных медиаторов, таких как фактор активации тромбоцитов (ФАТ) и другие производные арахидоновой кислоты.
Вслед за развитием ТЭЛА, концентрация ФАТ значительно повышается в жидкости БАЛ. Фактор активации тромбоцитов — важный фосфолипидный медиатор воспалительных и аллергических реакций, участвует в острых, равно как в продолжительных физиологических и воспалительных лёгочных процессах. Клетки (эндотелиальные, эпителиальные, нейтрофилы, альвеолярные макрофаги) могут продуцировать фактор активации тромбоцитов при локальной гипоксемии. Снижение уровня фосфатидилглицерола, обладающего анти-ФАТ активностью, способствует усилению действия ФАТ в альвеолах.
Фактор активации тромбоцитов обладает плейотропной активностью. Он может участвовать в патогенезе гипоксемии, лёгочной гипертензии и повышения сопротивления дыхательных путей. В частности, ФАТ может способствовать развитию интерстициального отёка через повышение сосудистой проницаемости, стимуляцию синтеза ряда медиаторов воспаления, вызывая бронхоконстрикцию и провоцируя сокращение лёгочных вен, что влечёт за собой повышение давления в лёгочных капиллярах.
Более того, ФАТ стимулирует приток нейтрофилов и эозинофилов в лёгкие и в плевральный выпот. Наконец, ФАТ обладает способностью обеспечивать как прайминг, так и активацию клеток. У некоторых больных ТЭЛА в жидкости БАЛ определяется повышенный уровень ФАТ-ацетилгидролазы. Этот фермент модулирует концентрацию провоспалительных медиаторов, ФАТ и ФАТ-подобных продуктов окисления фосфолипидов в тканях и биологических жидкостях. ФАТ-ацетилгидролаза отчасти поступает из плазмы через альвеоло-капиллярную мембрану, отчасти высвобождается инфильтрирующими воспалительными клетками, такими как нейтрофилы. Альвеолоциты II типа и макрофаги — также потенциальные источники ФАТ-ацетилгидролазы в жидкости БАЛ.
При ТЭЛА могут определяться и другие синтезируемые de novo медиаторы. В экспериментах на животных микроэмболии лёгочной артерии, индуцированные тромбином, сопровождались повышением уровней LT-B4, моногидроксиэйкозотетраеновой кислоты (5-HETE и 15-HETE) в лимфе лёгких. Эти продукты липоксигеназного пути увеличивают продукцию радикалов кислорода полиморфноядерными нейтрофилами, в результате чего повышается сосудистая проницаемость. У кроликов ТЭЛА ассоциировалась со значительным транзиторным повышением уровня тромбоксана А 2 , в то время как уровень PGI 2 оставался неизменным. Тромбоксан А2 влияет на сосудистую проницаемость, а также вызывает бронхоконстрикцию.
Высвобождение цитокинов
Исследовалась роль многих цитокинов, потенциально вовлечённых в патогенез ТЭЛА (см. факторы риска ВТЭ ). Например, экспрессия хемотаксического белка моноцитов-1 (MCP-1) в стенке поражённой лёгочной артерии повышалась в первые 3 дня ТЭЛА. Этот хемокин оказывает сильное хемотаксическое действие на моноциты/макрофаги и участвует в ремоделировании лёгочной артерии.
После венозного тромбоза более 6 дней отмечается повышение уровня ENA-78 (эпителиально-нейтрофильный активирующий белок 78), ФНО-α, ИЛ-6 и MCP-1, в то время как макрофагальный воспалительный белок-1 (MIP-1) достигает максимума к третьему дню после тромбоза. Кроме того, в организующихся тромбах в эксперименте на крысах отмечается экспрессия VEGF (сосудистого эндотелиального фактора роста) и основного фактора роста фибробластов (bFGF), чем подтверждается их участие в разрешении тромботического процесса.
Иммуногистохимически определена локализация VEGF на моноцитах, эндотелиальных клетках и веретеновидных клетках в тромбах. Их обнаруживали во внеклеточном матриксе. Усиление экспрессии ангиогенных факторов роста может ускорять реканализацию тромбов, таким образом, уменьшая частоту поздних осложнений. Концентрация VEGF повышалась и в плевральном выпоте при ТЭЛА.
Известный также как фактор сосудистой проницаемости или васкулотропин, VEGF представляет собой цитокин плейотропного действия, который в дополнение к своим ангиогенным свойствам, повышает сосудистую проницаемость. В ряде случаев выпот в плевральную полость может быть связан именно с повышением его концентрации. Источник VEGF при ТЭЛА неизвестен, однако, возможно, он происходит из тромба самого по себе, ибо выделяется и при агрегации и при активации тромбоцитов.
Для установления роли различных цитокинов в патогенезе воспаления при ТЭЛА в эксперименте на крысах вводили антитела к различным цитокинам. Показано, что анти-ФНО лучше других предотвращали инфильтрацию венозной стенки нейтрофилами после индукции тромбоза. Кроме того, анти-ICAM-1 и анти-ФНО подавляли выход моноцитов/макрофагов. Эти данные подтверждают, что тромбоз вен связан со значительным воспалением венозной стенки и что воспалительные медиаторы и цитокины играют роль в процессах, следующих за ТЭЛА.
Некоторые цитокины оказывают противовоспалительный эффект и влияют на процессы фибринолиза. Так, нейтрализация противовоспалительного цитокина ИЛ-10 приводит к усилению локального воспаления, в то время как введение человеческого ИЛ-10 дозозависимо уменьшает не только перитромботическое воспаление, но и размер тромба. На другой модели введение провоспалительного и ангиогенного цитокина ИЛ-8 усиливало рассасывание тромба.
Роль молекул адгезии
Тромбин повышает экспрессию клеточных молекул адгезии. В ряде исследований, кроме того, показано, что тромбоэмболический процесс связан с экспрессией клеточных молекул адгезии, таких как P-селектин, ICAM-1 (CD54) и VCAM-1 (CD106).
В экспериментах на животных введение рекомбинантного гликопротеинового лиганда P-селектина приводило к подавлению тромбоза и уменьшало уровень ИЛ-8, тромбоцитарного фактора IV и MCP-1 в венозной стенке, не влияя при этом на лейкоцитарную инфильтрацию стенки сосуда. Уменьшалась выраженность её повреждения, снижался уровень D-димера.
Таким образом, молекулы адгезии участвуют как в развитии тромбоза, так и в последствиях ТЭЛА. Блокада молекул адгезии может представлять собой перспективный подход в лечении ВТЭ.
Естественное течение венозного тромбоэмболизма (ВТЭ)
Первые данные относительно естественного течения ВТЭ были опубликованы в 1960-х годах, в основу их легли материалы отделений ортопедической хирургии. Было показано, что ВТЭ начинается с тромбоза глубоких вен (ТГВ) уже во время оперативного вмешательства в 30% случаев. У трети больных в течение нескольких дней тромбы спонтанно лизируются, ещё в 40% они не прогрессируют. Однако у 25% больных образовавшиеся тромбы распространяются в проксимальные вены и обусловливают развитие ТЭЛА.
С тех пор представления о естественном течении ВТЭ изменились. Показано, что в общей хирургии ТГВ формируется реже, чем при ортопедических операциях. Риск его развития наиболее высок в первые две недели после оперативного вмешательства, хотя сохраняется в течение 2-3 месяцев. Антитромботическая профилактика значительно снижает частоту периоперационного ВТЭ: чем дольше проводится профилактика, тем меньше риск.
Хотя основные данные по естественному течению ТЭЛА получены при изучении материалов хирургических отделений, не следует забывать, что от 50 до 70% клинически явных эпизодов ВТЭ и 70-80% летальных ТЭЛА приходится на нехирургических больных [96].
Преобладают бессимптомные формы заболевания. H. Bounameaux (1999 г.) считает, что на 1000 венозных тромбозов только 100 имеют какие-либо клинические проявления; из них у 60 пациентов разовьется ТЭЛА, но только в 10 случаях она будет иметь клинические признаки) [46].
Клинически манифестное течение ТГВ обусловлено обычно проксимальными тромбами. В 40-50% таких случаев развивается ТЭЛА, часто бессимптомная. Бессимптомная ТЭЛА вообще не редкость в послеоперационном периоде, особенно при бессимптомном течении ТГВ у больных, которым не проводится профилактика.
ТЭЛА развивается через 3-7 дней после начала ТГВ. В 10% ТЭЛА заканчивается летально в течение часа от появления симптомов, в большинстве таких случаев клинический диагноз устанавливается неверно. Более 90% всех смертельных исходов приходится на больных, не получавших лечения. Нередко летальной ТЭЛА предшествуют «малые» эпизоды ТЭЛА, которые остаются нераспознанными. В целом анатомически большие эмболы представляют большую опасность, чем маленькие. В редких случаях, тем не менее, эмболия мелких периферических ветвей лёгочной артерии при проходимом главном русле может проявиться тяжёлой симптоматикой и даже привести к внезапной смерти. Любую ТЭЛА следует рассматривать как потенциально опасную, поскольку при этом состоянии возможно рецидивирование, какой бы ни была клиническая тяжесть первого эпизода.
Шок или гипотония в качестве первых признаков ТЭЛА отмечается в 5-10%. В 50% случаев больные остаются гемодинамически стабильны, однако отмечаются признаки дисфункции или повреждения правого желудочка, что ухудшает прогноз .
В подострой фазе ТЭЛА прогноз в значительной степени зависит от возможности лизиса сгустка и восстановления кровотока в лёгочной артерии и системе глубоких вен. Это определяется рядом факторов, таких как существующая сопутствующая тромбофилия, адекватность антикоагулянтной терапии, наличие постоянных факторов риска. Полное растворение тромбоэмболов в лёгочной артерии отмечается у 2/3 больных.
У некоторых пациентов, обследовавшихся по поводу одышки или хронической правожелудочковой недостаточности, была обнаружена тяжёлая лёгочная гипертензия, обусловленная бессимптомными повторными ТЭЛА. Такое течение хронической посстромбоэмболической лёгочной гипертензии отчётливо прослеживается после острой ТЭЛА у части больных и без лечения обычно приводит к смертельному исходу в течение 2-3 лет с момента первичной диагностики. При лечении ТЭЛА хроническая посттромбоэмболическая лёгочная гипертензия формируется в 0.5-5%.
Существует значительный риск повторной ТЭЛА, особенно в течение 4-6 недель. Этот риск значительно увеличивается при отсутствии антикоагулянтной терапии. Если не проводится антикоагулянтная профилактика, риск рецидива ВТЭ в течение 3 месяцев составляет 50%. Среди больных, принимающих профилактические дозы антикоагулянтов в течение 3-12 месяцев, при наблюдении в течение 4.5 лет риск фатальной ТЭЛА составлял ежегодно 0.2-0.4%. Частота рецидивирования ВТЭ не зависит от исходной его манифестации (ТГВ или ТЭЛА). При идиопатической форме распространённость рецидивов выше. Риск летальной ТЭЛА выше в случаях, когда первый эпизод ВТЭ проявился изолированным ТГВ [26, 28, 38, 41, 52].
КЛИНИКА И ОСЛОЖНЕНИЯ
Лёгочные эмболии даже весьма опытными клиницистами просматриваются более чем в половине случаев. Частично это объясняется скрытым течением тех патологических процессов, которые обычно являются основными источниками лёгочных эмболий (ТГВ, внутриполостные тромбы правого сердца) [65]. Трудности правильной прижизненной диагностики ТЭЛА обусловлены также многообразием клинических проявлений этого заболевания [67].
Клиническая картина тромбоза глубоких вен (ТГВ)
Источником эмболов при ТЭЛА почти всегда являются вены, особенно нижних конечностей. Заподозрить ТГВ можно при наличии следующей клинической симптоматики [51, 62, 63]:
Cпонтанная боль в стопе и голени, усиливающаяся при ходьбе.
Возникновение боли в икроножных мышцах, особенно при тыльном сгибании стопы (симптом Хоманса), при передне-заднем сжимании голени (икроножных мышц; симптом Мозеса).
Локальная болезненность вен.
Изменение цвета кожных покровов.
Болезненность по ходу сосудистого пучка.
Видимый отёк голени и стопы или обнаружение асимметрии окружности голени и бёдер (более 1,5 см). При подозрении на ТЭЛА с целью выявления асимметричного отёка обязательно производится измерение окружности голеней (на 10 см ниже коленных чашечек) и бёдер (на 15-20 см выше коленных чашечек).
Однако в половине случаев флеботромбозы бессимптомны [64]. Развитие клинической картины ТГВ зависит от протяжённости тромбоза, степени окклюзии и наличия воспаления. Большинство клинически явных венозных тромбозов начинается с тромбоза глубоких вен голени, но клиническая картина появляется только при распространении тромбоза на проксимальные вены [63]. В качестве причины бессимптомности флеботромбоза прежде всего следует отметить возможность неполной обтурации тромбированной вены. Другой причиной может быть несущественное влияние тромбированной вены на отток крови, например, при изолированном тромбозе глубокой вены берда. Наконец, возможно тромбирование одной из удвоенных поверхностных бедренных или подколенных вен (рисунок 6) [64].
Р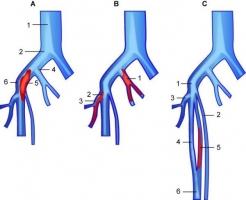 исунок
6. Причины бессимптомности течения ТГВ.
A. Бессимптомный тромбоз бедренной и
наружной подкожной вен: 1 – нижняя полая
вена; 2 – правая общая подвздошная вена;
3 – наружная подвздошная вена; 4 –
внутренняя подвздошная вена; 5 – тромб,
не обтурирующий просвета; 6 – бедренная
вена. B. Бессимптомный тромбоз внутренней
подвздошной и глубокой вены бедра: 1 –
тромб в просвете правой внутренней
подвздошной вены; 2 – тромб, флотирующий
в просвете глубокой вены правого бедра;
3 – глубокая вена правого бедра. C.
Бессимптомный тромбоз одной из удвоенных
бедренных вен: 1 – наружная подвздошная
вена; 2 – большая подкожная вена; 3 –
глубокая вена бедра; 4 – одна из удвоенных
бедренных вен; 5 – тромб в просвете одной
из удвоенных бедренных вен; 6 – подколенная
вена [64].
исунок
6. Причины бессимптомности течения ТГВ.
A. Бессимптомный тромбоз бедренной и
наружной подкожной вен: 1 – нижняя полая
вена; 2 – правая общая подвздошная вена;
3 – наружная подвздошная вена; 4 –
внутренняя подвздошная вена; 5 – тромб,
не обтурирующий просвета; 6 – бедренная
вена. B. Бессимптомный тромбоз внутренней
подвздошной и глубокой вены бедра: 1 –
тромб в просвете правой внутренней
подвздошной вены; 2 – тромб, флотирующий
в просвете глубокой вены правого бедра;
3 – глубокая вена правого бедра. C.
Бессимптомный тромбоз одной из удвоенных
бедренных вен: 1 – наружная подвздошная
вена; 2 – большая подкожная вена; 3 –
глубокая вена бедра; 4 – одна из удвоенных
бедренных вен; 5 – тромб в просвете одной
из удвоенных бедренных вен; 6 – подколенная
вена [64].
Клиническая картина тромбоэмболии лёгочной артерии (ТЭЛА)
Симптомы ТЭЛА
Опорными жалобами, заставляющими внести ТЭЛА в дифференциально-диагностический ряд, являются одышка, болевой синдром (боли в грудной клетке различного характера, а порой – абдоминальные), частое сердцебиение. Часто отмечается падение артериального давления (возможно, с потерей сознания). К другим симптомам относятся кашель, кровохарканье, субфебрилитет, симптомы нарушения мозгового кровоснабжения и полиорганной недостаточности.
Одышка

Артериальная гипотония

Тахикардия

Болевой синдром

Слабость

Кашель

Кровохарканье

Проявления полиорганной недостаточности

К сожалению, симптомы ТЭЛА не обладают ни высокой чувствительностью, ни специфичностью. В таблице 15 приведена распространённость наиболее характерных симптомов и данных физикального обследования у больных, поступивших с подозрением на ТЭЛА, в зависимости от заключительного диагноза. Очевидно, что ТЭЛА не является единственной возможной причиной перечисленных симптомов, и ни один симптом не встречается при ТЭЛА в 100% случаев.
Таблица 15. Частота симптомов и признаков у больных, поступивших с подозрением на ТЭЛА, в соответствии с заключительным диагнозом [41].
|
|
Диагноз ТЭЛА подтверждён (219 пациентов) |
ТЭЛА исключена (546 пациентов) |
|
Симптомы: | ||
|
Одышка |
80% |
59% |
|
Боль в грудной клетке (плевральная) |
52% |
43% |
|
Загрудинная боль |
12% |
8% |
|
Кашель |
20% |
25% |
|
Кровохарканье |
11% |
7% |
|
Потеря сознания |
19% |
11% |
|
|
|
|
|
Объективные признаки: | ||
|
Тахипноэ (ЧДД≥20/мин) |
70% |
68% |
|
Тахикардия (ЧСС>100/мин) |
26% |
23% |
|
Признаки ТГВ |
15% |
10% |
|
Лихорадка (> 38,5ºC) |
7% |
17% |
|
Цианоз |
11% |
9% |
Клинические формы ТЭЛА
Клинические проявления и физикальные данные при ТЭЛА определяются патофизиологическими последствиями обструкции лёгочных сосудов Нелишне напомнить, что анатомический объём обструкции лёгочной артерии может не соответствовать функциональным последствиям (особенно при наличии сопутствующих сердечно-сосудистых и лёгочных заболеваний) из-за развития спазма лёгочных артериол, (см. «патогенез» – «патологические изменения сердечно-сосудистой системы при ТЭЛА» - «лёгочная гипертензия» ). С этих позиций «большим» ТЭЛА будут соответствовать комбинации размера эмболов и функционального состояния сердца и лёгких, приводящие к значимому нарушению гемодинамики [20]. Так, эмболия мелких ветвей легочной артерии может протекать с клинически хорошо очерченными проявлениями инфаркта легкого, интенсивными плевральными болями, признаками дыхательной недостаточности и артериальной гипотонии, тогда как отдельные случаи массивной ТЭЛА могут проявляться только умеренно выраженной одышкой и тахикардией [51].
Таблица 5. Комбинированная классификация ТЭЛА, учитывающая вариант течения и массивность поражения сосудистого русла [31].
|
Вариант ТЭЛА |
Анамнез |
Объём обструкции ЛА% |
Клиническая манифестация |
Типичное давление | |
|
PAP |
RAP | ||||
|
Острая немассивная |
Короткий, внезапное начало |
< 50 |
Одышка, возможно в сочетании с плевральными болями и кровохарканьем |
Нормальное |
Нормальное |
|
Острая Массивная |
Короткий, внезапное начало |
> 50 |
Правожелудочковая недостаточность, возможна нестабильность гемодинамики и потеря сознания |
45/20 |
12 |
|
Подострая массивная |
Несколько недель |
> 50 |
Одышка и правожелудочковая недостаточность |
70/35 |
8 |
|
PAP, давление в лёгочной артерии; RAP, среднее давление в правом предсердии. | |||||
Острая массивная ТЭЛА
В соответствии с тяжёлыми расстройствами центральной и лёгочной гемодинамики (см. «патогенез» – «патологические изменения сердечно-сосудистой системы при ТЭЛА» – «сердечная недостаточность» ) состояние больных крайне тяжёлое, резко выражена одышка, возможны синкопе вследствие гипоксемии и низкого сердечного выброса. У половины больных с массивной ТЭЛА наблюдаются падение АД, коллапс и разнообразные церебральные расстройства (головокружения, кратковременная потеря сознания, выраженная адинамия или, наоборот, возбуждение, непроизвольное мочеиспускание или дефекация, судороги в конечностях и т.д.).
Сочетание гипотонии, гипоксемии и повышенной нагрузки на сердце может привести к появлению болей в грудной клетке. Они чаще локализуются за грудиной, напоминая ангинозные боли при инфаркте миокарда. Иногда боли носят характер острых плевральных, усиливающихся при дыхании, кашле и обусловленных развитием инфаркта легкого, инфарктной пневмонии или сухого плеврита (что для массивной ТЭЛА, в общем, не характерно).
Реже боли локализуются в правом подреберье и сопровождаются вздутием живота (парез кишечника) и упорной икотой, свидетельствуя, как правило, о поражении диафрагмальной плевры. У половины больных при этом возникает непродуктивный кашель. Только в случае инфаркта легкого появляется кровохарканье, обычно в виде прожилок крови в мокроте. Примерно в 45–50% случаев отмечается повышение температуры тела выше 37°С, которое обусловлено преимущественно развитием воспалительного процесса в легких и плевре [31, 51].
Физикальные данные отражают сниженный сердечный выброс — резко выраженная тахикардия, артериальная гипотония, холодные конечности, возможна спутанность сознания.
Массивная ТЭЛА сопровождается появлением цианоза, который часто сочетается с бледностью кожных покровов, обусловленной падением АД и нарушением периферического кровообращения (спазм периферических сосудов в ответ на резкое снижение сердечного выброса). Сочетание цианоза и бледности придает кожным покровам своеобразный пепельный оттенок. В некоторых случаях появляется выраженный “чугунный” цианоз лица, области шеи и верхней половины туловища.
При исследовании сердечно-сосудистой системы определяются тахикардия более 100 уд. в мин, акцент II тона на легочной артерии, отражающий развитие гипертензии малого круга кровообращения (этого признака может не быть, т.к. при острой ТЭЛА давление в лёгочной артерии не достигает очень высоких значений), расщепление второго тона вследствие сниженного выброса из правого желудочка, что, однако, определяется с трудом вследствие выраженной тахикардии. Характерно также снижение АД (у лиц, страдающих артериальной гипертензией давление может оставаться в пределах нормальных величин). В части случаев определяется парадоксальный пульс, отражающий возникновение острой правожелудочковой недостаточности (острого легочного сердца). При выраженной систолической дисфункции ПЖ и повышении центрального венозного давления (ЦВД) определяются набухание шейных вен, абдоминально-югулярный рефлюкс. Возможно увеличение печени.
При развитии острого легочного сердца в V межреберье по левому краю грудины выслушивается патологический III тон (правожелудочковый протодиастолический ритм галопа), систолический шум над мечевидным отростком или в IV межреберье (указывает на относительную недостаточность трёхстворчатого клапана). При перкуссии сердца в этих случаях можно выявить смещение вправо правой границы относительной тупости и умеренное расширение абсолютной тупости сердца [31, 51, 63, 66]. Аритмии сравнительно нечасто встречаются при остром лёгочном сердце. Они обычно бывают в виде правожелудочковых экстрасистол, реже наблюдается суправентрикулярная экстрасистолия и мерцание предсердий [66]. Возможно резкое пароксизмальное усиление одышки и цианоза при малейшем движении. Расширение лёгочной артерии и полостей правого сердца может обусловить изменение позиции сердца. Правый желудочек при этом составляет всю переднюю стенку сердца; появляется так называемый инфундибуло-пульмональный синдром Мак-Джин-Уайта (видимая и пальпируемая пульсация лёгочной артерии с резким акцентом II тона, систолический шум) и «кошачье мурлыканье» Литтена там же. Возможна болезненность при пальпации в месте проекции лёгочной артерии, которая исчезает при компенсации острого лёгочного сердца. Иногда может выслушиваться шум трения перикарда (по Уайту и Кролю – трение расширенной лёгочной артерии о перикард) [68].
Острая
гипертония малого круга приводит к
нарастающей асфиктической одышке и
цианозу, при этом в лёгких нет физикальных
признаков, могущих объяснить их [68]
(клинический случай 2). ![]()
При развитии инфарктной пневмонии или инфаркта лёгкого в лёгких определяются ослабленное дыхание, мелкопузырчатые влажные хрипы или крепитация. Нередко при поражении плевры можно выслушать шум трения плевры [51]. Иногда в лёгких прослушиваются сухие хрипы, как во время приступа бронхиальной астмы (см. «патогенез» - «респираторные нарушения при ТЭЛА» - «бронхоспазм» ) [67].
Подострая массивная ТЭЛА
Клиника находится в соответствии с патофизиологическими последствиями (см. «патогенез» - «патологические изменения сердечно-сосудистой системы при ТЭЛА» - «сердечная недостаточность» ).
Главными симптомами являются нарастающая одышка и снижение переносимости физических нагрузок. Часто отмечается сухой кашель. Одышка выражена диспропорционально другим данным, может отмечаться центральный цианоз. Артериальное давление и ЧСС нередко остаются в пределах нормы, т.к. поддерживается нормальный сердечный выброс.
Обычно венозное давление повышено, выслушивается третий тон в IV точке аускультации (у мечевидного отростка), более явно — на вдохе. Иногда отмечается усиление лёгочного компонента второго тона. Возможно появление преходящих симптомов инфаркта лёгкого вскоре после очередного рецидива.
В тяжёлых случаях сердечный выброс падает, что сопровождается появлением явной правожелудочковой недостаточности. В этом случае очередной эпизод ТЭЛА может дать картину, аналогичную таковой при массивной острой эмболии [31].
Острая немассивная ТЭЛА
Тромбоэмболия мелких ветвей легочной артерии в большинстве случаев протекает с менее выраженными симптомами или бессимптомно и нередко остается нераспознанной. Часто немассивная ТЭЛА протекает “под маской” других заболеваний и синдромов (В.Б. Яковлев): повторных “пневмоний” неясной этиологии, часть которых протекает как плевропневмония; быстропроходящих (в течение 2–3 суток) сухих плевритов ( клинический случай 1 ); экссудативных плевритов, в том числе геморрагических; повторных “необъяснимых” обмороков, коллапсов, нередко сопровождающихся ощущением нехватки воздуха и тахикардией; внезапно возникающего чувства сдавления в груди, затруднения дыхания и последующего повышения температуры тела; “беспричинной” лихорадки, не поддающейся антибактериальной терапии; появлением и/или прогрессированием сердечной недостаточности, резистентной к лечению; появлением и/или прогрессированием симптомов подострого или хронического легочного сердца при отсутствии указаний на хронические заболевания бронхолегочного аппарата [51].
При наличии клиники самым частым симптомом является одышка, сначала при нагрузке. Иногда, как проявление инфаркта лёгкого, отмечаются плевральные боли и кровохарканье. Страдает общее состояние, отмечается частое поверхностное дыхание, однако цианоза нет, так как нарушения газообмена выражены умеренно. Если удаётся выявить какие-либо отклонения при физикальном обследовании, то они связаны с инфарктом лёгкого: сочетание синдрома уплотнения лёгочной ткани и плеврального выпота, возможен шум трения плевры. Нередко отмечается лихорадка, что затрудняет дифференциальный диагноз с инфекционными плевритами. Лихорадка и боль приводят к появлению синусовой тахикардии. Среднее давление в лёгочной артерии редко превышает 25 мм рт. ст. В связи с тем, что функция правого желудочка при немассивных ТЭЛА не страдает, сердечный выброс сохранён, системное АД не падает, тоны сердца и венозное давление не отличаются от нормы. Представление о том, что для немассивной ТЭЛА характерно усиление лёгочного компонента второго тона ошибочно, так как давление в лёгочной артерии нормально либо повышается незначительно [31].
Клинические синдромы при ТЭЛА
Острейшее (молниеносное) течение
В
острейших или молниеносных случаях
смерть наступает в течение нескольких
минут. У послеоперационных больных это
происходит чаще всего после первого
вставания с постели, и обычно при этом
возникает полная закупорка основного
ствола лёгочной артерии [67]. Больные
громко вскрикивают, тут же теряют
сознание: прекращается дыхание и
сердечная деятельность [66]. Быстрота
течения заболевания не позволяет
произвести какие-либо дополнительные
исследования. Трудности диагностики
усугубляются ещё и тем, что больные чаще
всего погибают до осмотра врача и диагноз
устанавливается на основании опроса
дежурных сестёр или больных [67] (клинические
случаи 3 и 4). ![]()
(В статье Е. Б. Кривчикова [67] приводится описание следующих клинических наблюдений. Больной М., 78 лет, оперирован в урологическом отделении: двухсторонняя энуклеация паренхимы яичек по поводу рака предстательной железы. На второй день привстал с постели, потерял сознание и в течение 10 минут умер. На секции – тромбоэмболия главного ствола и ветвей лёгочной артерии. Больная К., 60 лет, находилась на обследовании в онкологическом отделении с предположительным диагнозом фибромиомы матки. В плане подготовки к операции была поставлена очистительная клизма. Во время этой процедуры больная внезапно потеряла сознание и через несколько минут умерла. На секции – аденокарцинома яичника с прорастанием в матку и карциноматозом брюшины, тромбоэмболия лёгочной артерии).
Острое течение
При остром течении наиболее частыми клиническими синдромами являются [66]:
Острая сосудистая (шок, коллапс) или острая сердечно-сосудистая (кардиогенный коллапс) недостаточность

Острая коронарная недостаточность

Острый асфиктический синдром

Синдром острых церебральных нарушений

Острая почечная недостаточность

А также могут наблюдаться:
Острый абдоминальный синдром

Инфаркт лёгкого, пневмония, плеврит

Иногда инфаркт лёгкого осложняется образованием каверны. Процессу распада способствуют предшествующее поражение лёгких и бронхолёгочная инфекция, большие размеры инфаркта. Обширная полость может образоваться всего за несколько дней. Иногда инфаркт лёгкого может осложниться абсцессом лёгкого, эмпиемой плевры, спонтанным пневмотораксом. При инфаркте лёгкого у половины больных развивается экссудативный плеврит [63]. Особенности плеврита: вовлечена висцеральная плевра (костодиафрагмальная и междолевая локализация), часто незначительный по объёму серозный или геморрагический экссудат (у больных с тяжёлой сердечной недостаточностью наблюдается больший плевральный выпот), склонен к адгезии, формированию после себя спаек (см. раздел «патогенез» - «респираторные нарушения при ТЭЛА» - «бронхоспазм») [62, 63].
Генез пневмонии – реактивное (плюс – возможно бронхогенное проникновение инфекции) воспаление перифокально некрозу (инфаркту) расположенной ткани лёгкого, чаще справа в базальных сегментах нижней доли, неоднородный инфильтрат, чаще субплевральной локализации, рассасывается в течение 1-2 недель [62].
Аллергический синдром

Подострое течение
При подостром течении наряду с перечисленными выше синдромами могут наблюдаться острое лёгочное сердце, инфаркты лёгких в сочетании с перифокальной пневмонией и выпотным плевритом или без них [66].
Рецидивирующее течение
Рецидивирующее течение ТЭЛА наблюдается у 9-35% больных ТЭЛА.
Чаще всего рецидив эмболии возникает на фоне сердечно-сосудистых заболеваний, протекающих с нарушением ритма с сердечной недостаточностью, при злокачественных новообразованиях, после операций на брюшной полости. ТЭЛА рецидивирующего течения очень часто протекает под маской других заболеваний. Её клиническая картина может проявляться повторяющимися эпизодами чувства сдавления в грудной клетке, эпизодами немотивированной одышки. Могут быть повторные «псеводплевропневмонии», сухие или экссудативные плевриты, особенно с геморрагическим выпотом, приступами одышки и тахикардии. Встречается и нарастание сердечной недостаточности, образование дисковидных ателектазов, обнаруживаемых при рентгенологическом исследовании [63].
ДИАГНОСТИКА
С практических и тактических позиций наиболее важным представляется, что на первом диагностическом этапе решающее значение имеют клиническая оценка вероятности и тяжести (стратификация риска) ТЭЛА, оценка характера и особенностей основного заболевания, что определяет объём обследования и тактику лечения [61, 62].
Основой диагноза тромбоэмболии лёгочной артерии является клиническая картина. Оценка вероятности ТЭЛА у конкретного пациента по клиническим проявлениям ( клинической вероятности ТЭЛА ) предельно важна в интерпретации результатов диагностических тестов и для выбора соответствующей диагностической стратегии [52].
Согласно рекомендациям Европейского общества кардиологов (ЕОК) 2008 г. по диагностике и лечению ТЭЛА [41, 50] выбор диагностического алгоритма, интерпретация результатов обследования и тактика лечения помимо оценки клинической вероятности предполагает проведение стратификации риска (оценку прогноза). Под тяжестью ТЭЛА понимается риск ранней смерти (смерти в стационаре или в течение 30 суток после эмболии). Предлагается использовать стратификацию больных на группы высокого и невысокого риска, а среди последних выделять подгруппы среднего и низкого риска (подробнее см. раздел «стратификация риска и прогноз при ТЭЛА» ).
Таблица
4. Стратификация риска в соответствии
с ожидаемой ранней летальностью
вследствие ТЭЛА [41]. ![]()
|
Группы риска ранней смерти (смерти в стационаре или в течение 30 суток после ТЭЛА) |
Факторы риска |
Тактика ведения | |||
|
Клинические (шок, гипотония) |
Дисфункция правого желудочка (хотя бы 1 признак) |
Повреждение миокарда (хотя бы 1 показатель) | |||
|
ВЫСОКОГО > 15% |
+ |
(+) a |
(+) a |
Тромболизис или эмболэктомия | |
|
НЕВЫСОКОГО |
Среднего 3-15% |
— |
+ |
+ |
Лечение в стационаре |
|
+ |
— | ||||
|
— |
+ | ||||
|
Низкого < 1% |
— |
— |
— |
Ранняя выписка или амбулаторное лечение | |
|
a Для стратификации риска при шоке и гипотонии нет необходимости в подтверждении дисфункции правого желудочка и повреждения миокарда – больные автоматически относятся к категории высокого риска. | |||||
Таким образом, уже при быстром обследовании у постели больного можно определить, относится пациент к группе высокого риска ранней смерти или нет.
В руководстве ЕОК 2008 г. по диагностике и лечению ТЭЛА с практической целью под термином «подтверждённая ТЭЛА» подразумевается высокая вероятность диагноза, при которой абсолютно показано ТЭЛА-специфическое лечение, а термином «исключённая ТЭЛА» обозначается настолько низкая её вероятность, что, несмотря на клиническое подозрение, можно с минимальным риском воздержаться от ТЭЛА-специфического лечения. Указанные термины не претендуют на 100% истинность суждения о наличии или отсутствии тромбоэмболов в лёгочных артериях [41].
Необходимо
помнить, что ТЭЛА – динамический процесс.
Этот факт существенно осложняет
диагностику и нередко приводит к
диагностическим ошибкам. ![]()
В связи с указанными особенностями течения заболевания необходимо понимать, что когда анамнез и клиническая картина позволяют заподозрить ТЭЛА, отказываться от диагноза на основании отрицательных результатов какого-то одного метода исследования (часто не обладающего ни высокой чувствительностью, ни специфичностью) ни в коем случае нельзя [20]! Достоверно подтвердить или исключить диагноз позволяет только полное обследование в соответствии с современными алгоритмами диагностики [8, 14, 15, 23, 24, 27, 41].
Анамнез и физикальные данные
В 90% случаев подозрение на ТЭЛА основывается на таких симптомах как одышка, боли в грудной клетке, потеря сознания, появляющихся изолированно или в различных сочетаниях.
Потеря сознания – нечастая, но клинически важная манифестация ТЭЛА, так как отражает критическое падение гемодинамики. В наиболее тяжёлых случаях отмечается артериальная гипотония вплоть до развития шока.
Плевральные боли (в сочетании с одышкой или самостоятельные) – один из самых частых симптомов ТЭЛА. Обычно они появляются при дистальных эмболиях и связаны с раздражением листков плевры вследствие кровоизлияния в альвеолы, которое иногда сопровождается кровохарканьем (синдром «инфаркта лёгкого»).
Изолированная внезапная одышка характерна для более центральных эмболий, при которых нарушения гемодинамики выражены в гораздо большей степени, чем при синдроме инфаркта лёгкого. Она может сопровождаться напоминающими стенокардию загрудинными болями, которые являются отражением ишемии правого желудочка. Изредка единственным проявлением ТЭЛА может стать нарастающая в течение нескольких недель одышка. В этих случаях диагноз ставится путём исключения других классических причин прогрессирующей одышки.
При развитии ТЭЛА на фоне сердечной недостаточности или лёгочных заболеваний, единственным проявлением может оказаться усиление одышки [41].
Отсутствие таких наиболее часто встречающихся при ТЭЛА симптомов, как боль в грудной клетке, одышка и тахикардия, ставят диагноз ТЭЛА под сомнение [63].
Большое значение в диагностике и предупреждении массивных лёгочных эмболий имеет выявление скрыто протекающих тромбофлебитов, а также изучение стёртых форм лёгочной эмболии, обусловленных микроэмболизацией (часто повторной) мелких разветвлений лёгочной артерии («сигнальные эмболии»), нередко предшествующей эмболии крупных её стволов. Такими продромальными симптомами нарастающей эмболии лёгочной артерии могут быть «беспричинные» повышения температуры (обычно до субфебрильных цифр), иногда сопровождающиеся нерезкими преходящими болями в ногах (скрытый ТГВ), лёгкие дизурические явления с небольшой эритроцитурией, боли в анальной области при дефекации, «ложные» позывы к дефекации (флеботромбоз околопростатического венозного сплетения или геморроидальных вен).
Следует
обращать внимание на внезапно возникающие
боли или чувство стеснения в груди
(особенно у лиц молодого возраста, не
страдающих коронарными нарушениями),
преходящую пароксизмальную одышку с
ощущением нехватки воздуха, немотивированную
приступообразно возникающую тахикардию.
Особенно подозрительно развитие
рецидивирующих, чаще двусторонних
плевритов неясной этиологии или
рецидивирующих «очаговых пневмоний».
Иногда первым указанием на повторные
микроэмболии малого круга является
появление на ЭКГ признаков повышения
активности правого сердца [65]. (клинический
случай 1) ![]()
В статье М. И. Теодори [65] приводится клиническое наблюдение. Больной К., 54 лет, избыточного питания, впервые поступил в стационар 4 апреля с явлениями левостороннего фибринозного плеврита (боли в левой половине грудной клетки, субфебрильная температура в течение нескольких дней, шум трения плевры по левой задней подмышечной линии). Этиология плеврита не установлена. После лечения пирамидоном состояние больного быстро улучшилось и 29 апреля он выписан. Через месяц, 4 июня, он проснулся ночью от острых болей в левой половине грудной клетки, сопровождавшихся чувством нехватки воздуха и усиливавшихся при дыхании, развилось коллаптоидное состояние, и больной после введения наркотических и вазотонических средств был доставлен машиной скорой помощи в госпиталь с диагнозом: «левосторонний спонтанный пневмоторакс». При поступлении: температура 37º, бледен, цианоз губ, шеи и груди, число дыханий 28 в минуту, слева в подмышечной области и под левой лопаткой дыхание ослаблено, сухие хрипы с обеих сторон, пульс 106 ударов в минуту, артериальное давление 115/85 мм рт. ст., тоны сердца приглушены. Рентгенологически выявлено: левый купол диафрагмы ограниченно подвижен, костодиафрагмальный угол слева затемнён. Анализ крови: лейкоцитов 8,5х10 9 /л, СОЭ 17 мм/ч. Диагноз: левосторонний сухой плеврит.
В последующие дни слева по задней подмышечной линии начал выслушиваться шум трения плевры, появился акцент II тона на лёгочной артерии. 13 июня состояние больного резко ухудшилось, появилось чувство стеснения за грудиной, усилилась одышка вплоть до удушья, усилился цианоз. Пульс 120 ударов в минуту, малый,ритм галопа слева в IV межреберье у края грудины. Несмотря на проводимую терапию 14 июня при явлениях нарастающего сердечно-сосудистого коллапса больной скончался. На ЭКГ отмечались изменения, характерные для эмболии лёгочной артерии.
Клинический диагноз: эмболия основного ствола или главной ветви лёгочной артерии; инфаркт нижней доли левого лёгкого; рефлекторная ишемия миокарда с возможным развитием инфаркта сердечной мышцы. Анатомический диагноз: флеботромбоз правой нижней конечности; нарастающая тромбоэмболия ветвей лёгочной артерии с полной обтурацией основного ствола и левой главной ветви; инфаркт нижней доли левого лёгкого; более свежая эмболия правой главной ветви лёгочной артерии; расширение полостей сердца; дистрофия мышцы сердца; ожирение; атеросклероз.
В приведённом случае у больного со скрыто протекающим ТГВ, развившимся на фоне ожирения, возникла многоэтапная нарастающая эмболия лёгочной артерии (сначала мелких её ветвей с развитием небольшого субплеврального инфаркта левого лёгкого, принятого за фибринозный плеврит, а затем левой главной ветви с развитием массивного инфаркта нижней доли левого лёгкого), завершившаяся обтурацией основного ствола и правой главной ветви со смертельным исходом.
Физикальные данные
При осмотре обращает на себя внимание диффузный цианоз, порой приобретающий чугунный оттенок, особенно в верхней половине туловища. Выраженная одышка (вплоть до удушья), хотя существенных изменений в лёгких (физикально) в первые часы-сутки нет. При развитии инфаркта лёгкого больной щадит больную половину грудной клетки при дыхании (плевральные боли), в соответствующей области может выслушиваться шум трения плевры, мелкопузырчатые влажные хрипы; возможно появление сухих хрипов, как проявление бронхообструктивного синдрома. При достаточной для формирования острого лёгочного сердца лёгочной гипертензии отмечается набухание и пульсация вен шеи, расширение границ сердца вправо, увеличение границ абсолютной сердечной тупости, систолический шум у мечевидного отростка, акцент II тона на лёгочной артерии. Характерна тахикардия. Застой по большому кругу кровообращения обусловливает увеличение размеров печени.
Клиническая
манифестация и течение ТЭЛА зависит от
многих факторов (рис. 7) ![]()
Для клинических проявлений ТЭЛА важны особенности патогенеза в каждом конкретном случае, в том числе состояние сердца и лёгких к моменту развития эмболии (см. раздел «основные факторы, влияющие на патогенез и естественное течение ТЭЛА»).
ТЭЛА – динамический процесс. Попавшие в лёгочную артерию эмболы могут довольно быстро растворяться, либо, наоборот, «подрастать» за счёт стимуляции тромбообразования in situ, возможно рецидивирование эмболий, развитие осложнений (например, инфаркта лёгкого, острого лёгочного сердца). В связи с этим понятно, что физикальные данные быстро изменяются и зависят от времени, прошедшего с момента эмболии. В самом начале почти все больные ТЭЛА поступают в стационар с синусовой тахикардией и признаками правожелудочковой недостаточности, в то время как эти симптомы наблюдаются реже у больных, поступивших спустя сутки после манифестации ТЭЛА. С течением времени выраженность сердечно-сосудистых нарушений также уменьшается. Таким образом, на проявления ТЭЛА оказывает влияние и время, прошедшее с момента развития катастрофы.

Рисунок 7. Факторы, оказывающие влияние на клиническую картину и течение ТЭЛА. Перевод по часовой стрелке, начиная с 12 ч: развитие инфаркта лёгких, приобретённые или наследственные факторы риска, острая или хроническая лёгочная гипертензия, сопутствующие заболевания, постинфарктная пневмония, повторные ТЭЛА, полный или частичный лизис тромбоэмбола, калибр и локализация поражённого сосуда. В центре – клиническая картина и течение ТЭЛА [20].
Очень часто ТЭЛА развивается на фоне других заболеваний и поэтому остаётся незамеченной врачами, а ухудшение состояния такого пациента рассматривается как декомпенсация имеющейся сердечно-лёгочной патологии. Это приводит к неадекватному и несвоевременному лечению [63]. При обструкции эмболом менее 50% лёгочного сосудистого ложа ТЭЛА часто протекает бессимптомно. При сцинтиграфии лёгких у больных тромбозом глубоких вен (ТГВ) бессимптомная ТЭЛА выявлялась в 40% случаев! [31].
Таким образом, диагностика лёгочной эмболии подчас представляет значительные трудности, ибо клинические проявления её весьма разнообразны и нередко симулируют картину других острых заболеваний (сердца, мозга, лёгких или брюшной полости). При всём многообразии клинической симптоматики массивной ТЭЛА всё же можно выделить определённые клинические синдромы, позволяющие не только заподозрить, но в значительной части случаев поставить уверенный диагноз [65, 66].
Лабораторные и инструментальные методы обследования больных с подозрением на ТЭЛА
Общие положения
К рутинным методам диагностики при подозрении на ТЭЛА относятся рентгенография грудной клетки, анализ газов крови и ЭКГ.
Хотя рентгенологические признаки ТЭЛА (дисковидные ателектазы, плевральный выпот, подъём половины диафрагмы) неспецифичны, рентгенография позволяет исключить другие причины одышки и болей в грудной клетке. ТЭЛА часто сопровождается гипоксемией, однако более чем в 20% случаев парциальное напряжение кислорода в артериальной крови (PaO2) нормально и не изменён альвеолярно-артериальный градиент кислорода [D(A-a)O2]. Диагностически полезны (особенно при рецидивах) электрокардиографические признаки перегрузки правого желудочка, такие как инверсия зубца Т в отведениях V1-V4, желудочковый комплекс типа QR в отведении V1, классический признак S1Q3T3 и полная или неполная блокада правой ножки пучка Гиса. Однако эти изменения появляются только при обширных эмболиях, а также определяются при перегрузке правого желудочка другой этиологии.
Таким образом, клинические признаки и результаты стандартных лабораторных и инструментальных методов диагностики ТЭЛА лишь повышают вероятность правильного диагноза, но не позволяют достоверно подтвердить или исключить его [41]. Рутинные методы диагностики используют не столько для подтверждения диагноза ТЭЛА, сколько для исключения других заболеваний, которые протекают со сходной клинической симптоматикой (инфаркта миокарда, плевритов, пневмонии, хронических обструктивных заболеваний лёгких, пневмоторакса – раздел «дифференциальная диагностика») [51].
Согласно рекомендациям ЕОК 2008 г. к чувствительным и специфичным методам диагностики ТЭЛА относятся определение уровня D-димера, ЭхоКГ, спиральная компьютерная томография с контрастным усилением (КТ-ангиография) грудной клетки, вентиляционно-перфузионная сцинтиграфия лёгких, ангиопульмонография, а также методы диагностики тромбоза глубоких вен нижних конечностей (УЗИ, КТ-венография) [41].
Электрокардиография (ЭКГ)
Наиболее доступный метод исследования. При ТЭЛА может выявить нарушения ритма, проводимости, вольтажа желудочковых комплексом и процесса реполяризации, признаки перегрузки правых отделов сердца [62].
Острая эмболия лёгочной артерии приводит к внезапному появлению лёгочной гипертензии и развитию острого лёгочного сердца, характерными электрокардиографическими признаками которого являются [70]:
Признак Q III -S I (QR III -RS I ).
Подъём сегмента ST в отведениях III, aVF, V 1,2 и дискордантное снижение сегмента ST в отведениях I, aVL, V 5,6 .
Появление отрицательных зубцов Т в отведениях III, aVF, V 1,2 .
Полная или неполная блокада правой ножки пучка Гиса.
Появление признаков перегрузки правого предсердия (P-pulmonale) в отведениях II, III, aVF.
Быстрая положительная динамика указанных изменения при улучшении состояния больного (рисунки 8-14, 44, 45, 50).
Указанные изменения ЭКГ встречаются всего в 15-40% случаев и чаще наблюдаются при закупорке просвета лёгочной артерии наполовину или более [71]. ЭКГ остаётся нормальной более чем в 27% случаев ТЭЛА. Фоновые заболевания сердца могут давать сходные с характерными для ТЭЛА изменения ЭКГ, ещё больше снижая специфичность метода.
Описанный ещё в 1935 году синдром S I Q III T III , который многие клиницисты считают патогномоничным для ТЭЛА, далеко не редко встречается и в отсутствие ТЭЛА [72].
Подробнее ![]()
Одним из основных признаков острого лёгочного сердца является электрокардиографический синдром Мак-Джин-Уайта (S I Q III T III): внезапное появление глубоких зубцов S I и Q III , отрицательного T III [62]. Эти изменения обусловлены резким поворотом сердца вокруг продольной оси по часовой стрелке и значительным преобладанием электрической активности правого желудочка и правой половины межжелудочковой перегородки [70]. В III стандартном отведении определяется выраженный зубец q(Q), иногда достаточно глубокий. Небольшой амплитуды зубец q нередко регистрируется также в отведении aVF. Во II стандартном отведении патологический зубец Q отсутствует. Зубцы q(Q) в отведениях III и aVF нередко сопровождаются подъёмом сегмента ST в виде монофазной кривой, когда сегмент ST сливается с положительным зубцом Т. В дальнейшем в III и aVF отведениях образуется отрицательный зубец Т. Выраженный зубец Q III сопровождается появлением заметного зубца S в I стандартном отведении. Выраженный зубец S определяется обычно и в отведении aVL. Сегмент ST в I, aVL, а иногда и во II отведении нередко расположен ниже изолинии (см. также «дифференциальная диагностика» - «инфаркт миокарда» - «электрокардиографическая дифференциальная диагностика») [71].
Нарушения ритма: выраженная синусовая тахикардия, а иногда и другие нарушения ритма - мерцание и трепетание предсердий, пароксизмальная тахикардия, эктопический ритм из атриовентрикулярного соединения, нарушение атриовентрикулярной проводимости и др.
Признаки острой перегрузки правых отделов сердца:
Отклонение электрической оси сердца вправо или тенденция к такому расположению. Например, до острой ситуации ЭОС была расположена горизонтально. При развитии эмболии лёгочной артерии ЭОС может стать нормальной или вертикальной.
Увеличивается амплитуда R во II, III и aVF отведениях.
Определяется электрическая ось сердца S I -S II -S III (признаки поворота сердца вокруг поперечной оси верхушкой кзади).
P pulmonale, указывающий на развитие перегрузки правого предсердия с высокими остроконечными зубцами P II,III,aVF .
Признаки гипертрофии или перегрузки правого желудочка в грудных отведениях:
Увеличение амплитуды или появление высокого зубца R в правых грудных отведениях V 1 , V 2 , V 3R . ЭКГ в этих отведениях может иметь вид R, Rs, qR, а иногда даже QR. В редких случаях в этих отведениях регистрируется комплекс QS. Это заставляет иногда проводить дифференциальный диагноз с инфарктом миокарда передне-септальной области.
Регистрация выраженного зубца S V5,6 .
Развитие признаков полной или неполной блокады правой ножки пучка Гиса с регистрацией ЭКГ типа rsR׳ в V 1,2 и с появлением уширенного зубца S V5,6 .
Снижение амплитуды зубца R V5,6 с уменьшением соотношения R/S в отведениях V 4 -V 6 .
Увеличение времени активации правого желудочка в отведениях V 1,2 .
Подъём или снижение сегмента ST в отведениях V 1,2 . Подъём сегмента ST в отведениях V 1,2 отмечается чаще при массивной эмболии сосудов малого круга, выпуклость сегмента ST обращена кверху. Депрессия сегмента ST обычно наблюдается при умеренном повышении давления в системе лёгочной артерии.
Снижение сегмента ST в отведениях V 4-6 .
Появление отрицательного зубца Т в отведениях V 1-3 . Иногда при эмболии лёгочной артерии отмечается отрицательный зубец Т не только в этих отведениях, а с V 1 по V 6 , что обусловлено ухудшением питания левого желудочка.
Регистрация позднего зубца R в отведении aVR.
Увеличение амплитуды зубца P в отведениях V 1-5 .
Смещение переходной зоны влево [70, 71].
Регистрируются изменения вольтажа желудочкового комплекса в прекардиальных отведениях (R V1 +S V6 > 10 мм), и возможны нарушения реполяризации (формирование отрицательного Т и депрессия сегмента ST в правых грудных отведениях) [62].
Придавая значение ЭКГ, необходимо помнить, что эти изменения могут быть транзиторными. Продолжительность выявления их в зависимости от тяжести варьируют от нескольких минут до нескольких часов. Такая ускользаемость или скоротечность информации, а также вообще её отсутствие ни в коем случае не должны служить обоснованием исключения ТЭЛА. Лишь обширные ТЭЛА, как правило, сопровождаются в той или иной степени характерными и более длительными ЭКГ изменениями. При ТЭЛА мелких ветвей ЭКГ малоинформативна: поворот электрической оси вправо, тахикардия, полная или неполная блокада правой ножки пучка Гиса, нарушение процессов реполяризации, атипичный высокий P-pulmonale в отведениях II, III, aVF появляется поздно и редко [62].
Хотя специфичность и чувствительность каждого ЭКГ-признака ТЭЛА невысоки, оценка их сочетания в клиническом контексте подозрения на ТЭЛА существенно повышает вероятность диагноза [49, 72]. ЭКГ должна выполняться в динамике и сравниваться с той, которая снималась до болезни. Тогда можно приблизиться к объективности выводов [62].

Рисунок
8. ЭКГ Больного 44 лет, массивная ТЭЛА. ![]()
Синусовая тахикардия. Электрокардиографический признак S I Q III T III . Отмечается также сглаженность T во всех грудных отведениях [73].
Рисунок
9. ЭКГ больного массивной ТЭЛА. Признак
перегрузки правого желудочка: симметричная
инверсия зубцов T в отведениях
V 1 -V 4 [72]. ![]()
Рисунки
10 и 11. ЭКГ больной 60 лет, страдающей
массивной ТЭЛА. ![]()
С инусовая
тахикардия. Гигантские заострённые
P-pulmonale (превышающие по амплитуде зубцы
R желудочкового комплекса) в отведениях
II, III, aVR, низкий вольтаж желудочкового
комплекса в стандартных отведениях.
Выраженные S С4 -С 6 (на
данной ЭКГ грудные отведения обозначены
буковой С вместо V) [74].
инусовая
тахикардия. Гигантские заострённые
P-pulmonale (превышающие по амплитуде зубцы
R желудочкового комплекса) в отведениях
II, III, aVR, низкий вольтаж желудочкового
комплекса в стандартных отведениях.
Выраженные S С4 -С 6 (на
данной ЭКГ грудные отведения обозначены
буковой С вместо V) [74].
Э КГ
той же больной (см. рисунок 10). Динамика
изменений зубца P во втором стандартном
отведении на фоне терапии альтеплазой
и эноксапарином. На серии ЭКГ (день 1 –
день 12) отмечается постепенно уменьшение
амплитуды зубца P, нормализация ЧСС
[74].
КГ
той же больной (см. рисунок 10). Динамика
изменений зубца P во втором стандартном
отведении на фоне терапии альтеплазой
и эноксапарином. На серии ЭКГ (день 1 –
день 12) отмечается постепенно уменьшение
амплитуды зубца P, нормализация ЧСС
[74].
Рисунки
12 и 13. ЭКГ больной 42 лет. ![]()
С инусовая
тахикардия 120 в минуту. Выраженная
элевация сегмента ST в отведениях
V1 -V 3 и
aVR, формирование глубокого зубца S и
депрессия ST в отведения I, aVL, V 4 -V 6 .
При обследовании инфаркта миокарда не
оказалось, изменения на ЭКГ обусловлены
массивной ТЭЛА [75].
инусовая
тахикардия 120 в минуту. Выраженная
элевация сегмента ST в отведениях
V1 -V 3 и
aVR, формирование глубокого зубца S и
депрессия ST в отведения I, aVL, V 4 -V 6 .
При обследовании инфаркта миокарда не
оказалось, изменения на ЭКГ обусловлены
массивной ТЭЛА [75].
Э КГ
той же больной (см. выше) через 1 час после
введения тромболитика. Имевшие место
изменения сегмента ST полностью разрешились
[75].
КГ
той же больной (см. выше) через 1 час после
введения тромболитика. Имевшие место
изменения сегмента ST полностью разрешились
[75].
Рисунок
14. ЭКГ больного 69 лет, массивная ТЭЛА. ![]()
( A)
Отмечается снижение вольтажа желудочкового
комплекса в стандартных отведениях,
неопределяемая электрическая ось
сердца, блокада правой ножки пучка Гиса
с формированием комлпекса rsR׳
в
отведениях с V 1 по
V 4 ,
уширенных S в отведениях V 5 ,
V 6 .
Эти признаки свидетельствуют об острой
перегрузке и дилатации правого желудочка
(что находится в соответствии с данными
ЭхоКГ у того же больного). (B) После
проведения тромболизиса отмечается
явная положительная динамика ЭКГ:
комплекс типа rSR׳
сохраняется
только в отведении V 1 (что
отражает уменьшение размеров правого
желудочка согласно ЭхоКГ); инверсия
зубцов Т в отведения с V 1 по
V 4 (признаки
уменьшившейся, но сохраняющейся
перегрузки правого желудочка) [76].
A)
Отмечается снижение вольтажа желудочкового
комплекса в стандартных отведениях,
неопределяемая электрическая ось
сердца, блокада правой ножки пучка Гиса
с формированием комлпекса rsR׳
в
отведениях с V 1 по
V 4 ,
уширенных S в отведениях V 5 ,
V 6 .
Эти признаки свидетельствуют об острой
перегрузке и дилатации правого желудочка
(что находится в соответствии с данными
ЭхоКГ у того же больного). (B) После
проведения тромболизиса отмечается
явная положительная динамика ЭКГ:
комплекс типа rSR׳
сохраняется
только в отведении V 1 (что
отражает уменьшение размеров правого
желудочка согласно ЭхоКГ); инверсия
зубцов Т в отведения с V 1 по
V 4 (признаки
уменьшившейся, но сохраняющейся
перегрузки правого желудочка) [76].
Рентгенография грудной клетки
Рентгенография грудной клетки – метод, обладающий невысокой чувствительностью и специфичностью в отношении диагностики ТЭЛА. По мнению большинства современных авторов, основная ценность бесконтрастной рентгенографии состоит в исключении других состояний, имеющих сходную с легочной эмболией клиническую картину (пневмоний, опухолей, пневмоторакса, отека легких и др.). Рентгенограммы могут оказать помощь в интерпретации перфузионных сцинтиграмм легких (рис. 16,17). В ряде случаев удается поставить диагноз по результатам бесконтрастной рентгенографии, однако отсутствие патологии ни в коей мере не исключает легочной эмболии, в том числе так называемой массивной [64, 77].
В большинстве случаев ТЭЛА сопровождается появлением на рентгенограмме малоспецифичных рентгенологических признаков: высокое стояние купола диафрагмы на стороне поражения; инфильтрация легочной ткани (спустя 12–36 ч от начала заболевания); выбухание конуса легочной артерии; увеличение правых отделов сердца; расширение верхней полой вены и др.
Эти признаки лишь с определенной степенью вероятности могут быть ассоциированы с возникновением ТЭЛА, причём только в тех случаях, когда они сочетаются с описанными клиническими симптомами эмболии (внезапно наступающей одышкой, болями в грудной клетке и т.д.).
Более специфичным, но относительно редким признаком ТЭЛА является симптом Вестермарка (рис. 16) – обеднение легочного рисунка в области поражения, что свидетельствует о массивной эмболии легочной артерии. Этот рентгенологический признак встречается не более чем у 5% больных ТЭЛА.
Довольно редко на рентгенограммах можно обнаружить классические признаки инфаркта легкого – треугольную тень в легочном поле, основанием обращенную к плевре (рис. 18)[51].
Схема рентенографических признаков ТЭЛА представлена на рисунке 15.
Р исунок
15. Рентгенологические признаки лёгочной
эмболии (схема Heinrich F., 1981 г): 1 – высокое
стояние купола диафрагмы; 2 – плевральный
выпот; 3 – инфаркт лёгкого; 4 – «обрыв»
контуров сосудов у корня лёгкого; 5 –
гиперемия контрлатерального лёгкого;
6 – дилатация правого желудочка; 7 –
дилатация непарной и верхней полой вен
[62].
исунок
15. Рентгенологические признаки лёгочной
эмболии (схема Heinrich F., 1981 г): 1 – высокое
стояние купола диафрагмы; 2 – плевральный
выпот; 3 – инфаркт лёгкого; 4 – «обрыв»
контуров сосудов у корня лёгкого; 5 –
гиперемия контрлатерального лёгкого;
6 – дилатация правого желудочка; 7 –
дилатация непарной и верхней полой вен
[62].
Подробнее ![]()
Выделяют следующие группы симптомов легочной эмболии:
Симптомы острого легочного сердца.
Симптомы нарушения кровотока в системе легочных артерий (изменения корней, легочного рисунка).
Симптомы инфаркта легкого.
Из перечисленных наиболее специфичны симптомы острого легочного сердца, к которым относятся указанные в порядке убывания чувствительности: расширение верхней полой вены, тени сердца, конуса легочной артерии.
Верхнюю полую вену считают расширенной при увеличенном более 3 см расстоянии между линией остистых отростков и правым контуром средостения. Расширение конуса легочной артерии проявляется сглаживанием талии сердца или (более отчетливо) проступанием второй дуги за левый контур.
Изменения корней легких могут выражаться в виде:
Расширения вследствие повышения давления в легочной артерии проксимальнее ее окклюзии.
Уменьшения длины ("ампутации") вследствие незаполнения ветвей легочной артерии дистальнее окклюзии.
При эмболии в одну из главных ветвей легочного ствола или в смежные долевые или сегментарные ветви в случае отсутствия выраженной фоновой легочной патологии может наблюдаться обеднение легочного рисунка или обрыв окклюдированного сосуда. Эти симптомы лучше выявляются на томограммах. Описаны и другие симптомы эмболии; “включенные” сосуды, очаговоподобные тени, "хаотический" легочный рисунок, однако эти симптомы имеют меньшее значение, так как первый из них наблюдается только при развитии инфаркта легкого, а последние два неспецифичны.
Диагностика легочной эмболии по рентгенологическим симптомам инфаркта легкого наиболее достоверна, но несвоевременна.
Хотя высокому стоянию купола диафрагмы и дисковидным ателектазам легочной ткани не всегда сопутствует развитие инфаркта легкого, патогенетическая связь этих симптомов с последним осложнением оправдывает их обсуждение в данном разделе.
Высокое стояние купола диафрагмы на стороне поражения (чаще справа), наиболее вероятно, обусловлено рефлекторным сморщиванием легкого в ответ на эмболию. Не исключено также участие в развитии этого симптома таких факторов, как поражение диафрагмальной плевры, уменьшенное кровенаполнение пораженного сегмента или доли, увеличение печени вследствие сердечной недостаточности, а также рефлекторное влияние на диафрагмальный и возвратный нервы.
Ателектаз легкого, в основном дисковидный, часто предшествует развитию инфаркта в данной зоне. В качестве патогенетического механизма развития этого симптома предполагают увеличение количества бронхиальной слизи, появление геморрагического секрета с обструкцией бронха, ишемическую потерю сурфактанта.
Рентгенологическая картина инфаркта легкого может ограничиваться признаками плеврального выпота с высоким стоянием купола диафрагмы на этой же стороне. Объем выпота может варьировать от нескольких миллилитров до 1 — 2 л. Небольшой выпот лучше виден в заднем рёберно-диафрагмальном синусе на боковых рентгенограммах. Эти симптомы хотя и часто наблюдаются при легочной эмболии, но не специфичны.
Типичную картину инфаркта легкого удается обнаружить не ранее 2-го дня заболевания и приблизительно лишь у 10% больных, перенесших легочную эмболию. Это осложнение чаще развивается после эмболии в дистальные отделы легочного русла.
Типичная картина инфаркта легкого включает достаточно четко очерченное затемнение треугольной формы с основанием, расположенным на плевральной поверхности,и усеченной или выпуклой вершиной, направленной в сторону ворот. Однако из-за инфильтрации окружающей зону инфаркта легочной ткани затемнение может принимать округлую или неправильную форму, что затрудняет дифференциальную диагностику с опухолевыми и воспалительными заболеваниями. Возможны и множественные атипичные инфаркты легких, дифференциальная диагностика которых наиболее затруднена. В большинстве случаев обратное развитие инфарктов легкого начинается с его основания и происходит в течение 2 — 4 недель. Иногда в исходе инфаркта легкого развивается линейный рубец или локальный пневмосклероз.
Причинами затруднений при диагностике легочной эмболии методом бесконтрастной рентгенографии являются [64]:
Отсутствие различий в способности задерживать рентгеновские лучи жидкой кровью и тромбоэмболом, что заставляет ориентироваться на косвенные симптомы нарушения легочного кровотока (острое легочное сердце, расширение корней).
Невысокая частота, нечеткость специфических изменений в рентгенологической картине сосудов малого круга, в частности отсутствие достаточной коррекции между калибром окклюдированного сосуда и выявляемым снижением кровенаполнения легких, трудность визуализации многофокусных участков сниженного кровенаполнения, часто отсутствие эталонных рентгенограмм, необходимых для оценки изменений корней легких.
Низкая специфичность наиболее частых рентгенологических симптомов легочной эмболии (высокое стояние купола диафрагмы, ателектазы, пневральный выпот).
Невысокая частота и позднее появление наиболее достоверных рентгенологических симптомов — признаков инфаркта легкого.
Атипичная картина осложненного инфаркта легкого.
Рисунки
16 и 17. Рентгенограмма грудной клетки
пациента 58 лет, обратившегося с жалобами
на одышку и повторные потери сознания. ![]()
Р исунок
16. Высокое стояние левого купола
диафрагмы. В правом лёгком визуализируется
область обеднённого кровотока (между
белыми стрелками) - симптом Вестермарка,
а также выбухание правой нисходящей
лёгочной артерии (чёрная стрелка) -
симптом Палла. При перфузионной
сцинтиграфии лёгких выявлены множественные
двусторонние дефекты наполнения (см.
рисунок 17), один из которых соответствует
зоне олигемии на рентгенограмме. Таким
образом, диагностирована ТЭЛА [78].
исунок
16. Высокое стояние левого купола
диафрагмы. В правом лёгком визуализируется
область обеднённого кровотока (между
белыми стрелками) - симптом Вестермарка,
а также выбухание правой нисходящей
лёгочной артерии (чёрная стрелка) -
симптом Палла. При перфузионной
сцинтиграфии лёгких выявлены множественные
двусторонние дефекты наполнения (см.
рисунок 17), один из которых соответствует
зоне олигемии на рентгенограмме. Таким
образом, диагностирована ТЭЛА [78].
Р исунок
17. Перфузионная сцинтграмма лёгких в
прямой проекции того же больного (см.
рисунок 16). Множественные дефекты
перфузии. Белой стрелкой показан дефект
перфузии, соответствующий области
обеднённого кровотока при рентгенографии
грудной клетки [78].
исунок
17. Перфузионная сцинтграмма лёгких в
прямой проекции того же больного (см.
рисунок 16). Множественные дефекты
перфузии. Белой стрелкой показан дефект
перфузии, соответствующий области
обеднённого кровотока при рентгенографии
грудной клетки [78].
Рисунок
18. Классическая рентгенографическая
картина инфаркта лёгкого. ![]()
К линовидная
тень в правом лёгочном поле, основанием
обращённая к плевре и верхушкой – к
корню лёгкого.
линовидная
тень в правом лёгочном поле, основанием
обращённая к плевре и верхушкой – к
корню лёгкого.
Лабораторные показатели
Среди лабораторных показателей в диагностике ТЭЛА существенное место занимает уровень D-димера . Интерпретации результатов этого анализа посвящён специальный раздел. Кроме того, для оценки прогноза ТЭЛА имеет значение определение концентрации сердечных тропонинов и мозгового натрийуретического пептида (см. раздел «стратификация риска и прогноз» ).
При анализе газового состава крови наиболее частый признак ТЭЛА — падение парциального напряжения кислорода в артериальной крови, что наблюдается уже при окклюзии 13% лёгочного сосудистого русла. Также свойственно развитие гипокапнии и респираторного алкалоза за счёт компенсаторной гипервентиляции [20]. Гиперкапния (повышение PaCO2) возможна в крайне тяжёлых случаях, вследствие отёка лёгких (см. раздел «нарушение газообмена в лёгких» ). Нормальные показатели газового состава крови не исключаеют диагноза ТЭЛА [62].
Все остальные лабораторные показатели при диагностике ТЭЛА являются вспомогательными. При развитии инфаркта лёгких может отмечаться умеренная гипербилирубинемия, лейкоцитоз и повышение СОЭ. Активность аминотрансфераз и креатинфосфокиназы обычно не изменяется, что имеет большое значение при дифференциальной диагностике ТЭЛА с инфарктом миокарда [63]. Возможно повышение уровней ЛДГ, ЩФ. Появление протеинурии и микрогематурии может быть обусловлено гипоксией и нарушенной почечной гемодинамикой [62].
D-Димер
D-димер является продуктом деградации фибрина. Его плазменный уровень повышается при тромбообразовании, так как всегда одновременно активируется фибринолитическая система ( рисунок 2 ). Таким образом, нормальный уровень D-димера делает диагноз ТЭЛА или тромбоза глубоких вен (ТГВ) маловероятным, то есть предсказательная ценность отрицательного результата высока.
С другой стороны, фибрин может образоваться при ряде других патологических состояний, таких как злокачественные опухоли, воспаление, некрозы, расслаивающая аневризма аорты и др., то есть повышение уровня D-димера неспецифично для ТЭЛА, и положительный результат обладает низкой предсказательной ценностью в её диагностике. Кроме того, специфичность повышения D-димера для ТЭЛА снижается при беременности и с возрастом, составляя < 10% у больных старше 80 лет.
Нормальный уровень D-димера у больных ТЭЛА невысокого риска при клинически высокой вероятности не позволяет надёжно исключить ТЭЛА, поэтому в данной группе больных проведение анализа на D-димер не рекомендуется. ТЭЛА высокого риска (то есть с развитием шока или артериальной гипотонии) – жизнеугрожающее состояние, требующее проведения экстренной дифференциальной диагностики и неотложного лечения; решающее значение при этом имеют спиральная КТ-ангиография грудной клетки и ЭхоКГ, а не измерение уровня D-димера.
Таким
образом, при подозрении на ТЭЛА определение
уровня D-димера показано в группе
невысокого риска при клинически низкой
или промежуточной вероятностях. В этих
категориях больных измерение D-димера
выполняет роль «сортировочного» метода
обследования: его повышение не дает
возможности подтвердить диагноз ТЭЛА,
однако нормальный уровень позволяет
достоверно исключить её и своевременно
направить диагностический поиск в
другом направлении (см. раздел алгоритмы
диагностики ТЭЛА ,
рис. 43, таблица 17) [50]. ![]()
На диагностическую значимость D-димера влияет чувствительность анализа (таблица 17). К высокочувствительным методам относится количественный твёрдофазный ИФА (ELISA). Количественные методы латексной агглютинации и методы, основанные на агглютинации эритроцитов в цельной крови, считаются умеренно чувствительными. Нормальный уровень D-димера, определённый высокочувствительным методом, надёжно исключает ТЭЛА в группе невысокого риска при клинически низкой или промежуточной вероятности, в то время как использование умеренно чувствительных методов позволяет исключить ТЭЛА только у больных с клинически низкой вероятностью. При использовании двухуровневой схемы оценки клинической вероятности по шкале Wells (табл. 8), в категории «ТЭЛА маловероятна» нормальный уровень D-димера надёжно исключает ТЭЛА независимо от чувствительности метода [41, 43].
Диагностика тромбоза глубоких вен (ТГВ) (УЗИ глубоких вен нижних конечностей с компрессионными пробами, КТ-венография, МР-венография)
В 90% случаев лёгочной эмболии источником являются тромбы в глубоких венах нижних конечностей. При венографии ТГВ у больных с подтверждённой ТЭЛА обнаруживался в 70% случаев [41]. Хотя «золотым стандартом» диагностики тромбоза глубоких вен по-прежнему считается венография (контрастная флебография, илеокаваграфия), это инвазивное и технически сложное исследование редко применяется на практике [62, 83].
Сегодня
дуплексное УЗИ (с компрессионными
пробами) глубоких вен нижних конечностей
практически вытеснило венографию.
Чувствительность УЗИ в диагностике
проксимального ТГВ превышает 90% при
специфичности около 95%. Среди больных
ТЭЛА ультразвуковые признаки ТГВ
выявляются у 30-50%. Обнаружение проксимального
тромбоза глубоких вен является достаточным
основанием для назначения антикоагулянтов
при подозрении на ТЭЛА. Единственным
надёжным УЗ-признаком тромбоза является
неполная сжимаемость вен (при компрессионных
пробах), в то время как воспроизводимость
характеристик кровотока (допплеровское
сканирование) не высока (рис. 19). ![]()
Диагностическая значимость УЗИ повышается при полном сканировании (как проксимальных, так и дистальных вен). По данным недавно проведённого исследования, полное сканирование в сравнении с УЗИ только проксимальных вен повышало процент выявления ТГВ у больных ТЭЛА с 22% до 43%. В то же время специфичность снижалась с 96% до 84%. В другом исследовании проксимальный ТГВ по данным УЗИ определялся в 39% случаев (чувствительность) подтверждённой при МСКТ ТЭЛА, специфичность УЗИ при этом составила 99%. При подозрении на ТЭЛА вероятность УЗ-обнаружения тромбов в проксимальных венах выше у больных с яркой клинической картиной ТГВ, чем при бессимптомном его течении [41, 63].
Недавно показано, что после однократной внутривенной инъекции контрастного вещества можно последовательно выполнить КТ грудной клетки и через 3-4 минуты КТ-венографию (непрямую). Чувствительность КТ грудной клетки при этом повышается с 83% до 90%, специфичность же не меняется (95%). Однако соответствующего повышения предсказательной ценности отрицательного результата не наблюдалось. Таким образом, КТ-венография незначительно повышает чувствительность при подозрении на ТЭЛА, однако существенно увеличивает лучевую нагрузку, что нужно учитывать, особенно у молодых женщин [41, 77].
Однако возможности УЗИ для визуализации подвздошных и нижней полой вен ограничены, также затруднения возникают при обследовании больных с ожирением или имеющих нестандартную анатомию венозной системы. При необходимости оценки кровотока по тазовым венам и венам брюшной полости, особенно для решения вопроса о постановке кава-фильтра, непрямая КТ-венография может дать очень ценную информацию (рис. 20 и 21). МР-венография (рис. 22) обладает высокой чувствительностью и специфичностью в диагностике тромбоза глубоких вен, однако это дорогостоящий метод исследования, быстрота его выполнения уступает УЗИ и КТ-венографии. МР-венография является методом выбора при наличии технических сложностей для УЗИ у больных с аллергией на йод-содержащие контрастные препараты или страдающих почечной недостаточностью [31, 77, 81].
Итак, место УЗИ глубоких вен нижних конечностей в диагностике ТЭЛА до сих пор обсуждается. Это исследование должно применяться в качестве «страховочного» метода для уменьшения частоты ложноотрицательных результатов, которые могут быть получены при проведении контрастной ОСКТ грудной клетки (см. алгоритмы диагностики, рис. 42, 43, табл. 17). Применение УЗИ глубоких вен также целесообразно при наличии противопоказаний к проведению КТ (нежелательность облучения, непереносимость контрастных препаратов).
Учитывая небольшую дополнительную диагностическую значимость при существенном повышении лучевой нагрузки, выполнение непрямой КТ-венография не рекомендуется в качестве дополнительного обследования к МСКТ грудной клетки [41].
Рисунок
19. Ультразвуковая допплерография вен
левой нижней конечности (поперечный
срез). ![]()
С верху
вниз – переход от кожи в глубину бедра.
На правом рисунке бедренные вена и
артерия обведены жёлтыми кружками
(диаметр вены больше). Поток, направленный
в сторону датчика, изображается красным
цветом, от датчика – синим. Наличие
красного и синего цвета в одном сосуде
говорит о турбулентном кровотоке. В
бедренной вене кровоток занимает около
20% просвета сосуда, остальные 80% окрашены
в чёрный цвет – отсутствие кровотока.
Кроме того, бедренная вена в этой области
несжимаема (компрессионная проба).
Данные соответствуют тромбозу бедренной
вены [83].
верху
вниз – переход от кожи в глубину бедра.
На правом рисунке бедренные вена и
артерия обведены жёлтыми кружками
(диаметр вены больше). Поток, направленный
в сторону датчика, изображается красным
цветом, от датчика – синим. Наличие
красного и синего цвета в одном сосуде
говорит о турбулентном кровотоке. В
бедренной вене кровоток занимает около
20% просвета сосуда, остальные 80% окрашены
в чёрный цвет – отсутствие кровотока.
Кроме того, бедренная вена в этой области
несжимаема (компрессионная проба).
Данные соответствуют тромбозу бедренной
вены [83].
Рисунки
20 и 21. КТ-исследования: женщина 31 года,
поступила с жалобами на остро возникший
отёк правой ноги и одышку. В анамнезе –
приём пероральных контрацептивов. ![]()
Р исунок
20. КТ таза с контрастным усилением,
венозная фаза исследования; тромбоз
дистальной части нижней полой вены
(стрелка) [81].
исунок
20. КТ таза с контрастным усилением,
венозная фаза исследования; тромбоз
дистальной части нижней полой вены
(стрелка) [81].
Р исунок
21. Тот же случай. (см. рис. 20). При
КТ-венографии выявляется тромбоз правой
подколенной вены (стрелка) [81].
исунок
21. Тот же случай. (см. рис. 20). При
КТ-венографии выявляется тромбоз правой
подколенной вены (стрелка) [81].
Рисунок
22. Магнитно-резонансная ангиография,
TOF, фронтальный срез. ![]()
О тсутствие
кровотока по левой общей подвздошной
вене (чёрный цвет – полная обструкция).
Правая общая подвздошная вена проходима
(белый цвет) [83].
тсутствие
кровотока по левой общей подвздошной
вене (чёрный цвет – полная обструкция).
Правая общая подвздошная вена проходима
(белый цвет) [83].
Вентиляционно-перфузионная сцинтиграфия (V/Q сканирование)
Вентиляционно-перфузионная сцинтиграфия – надёжный и безопасный (описано лишь несколько случаев аллергических реакций) метод диагностики при подозрении на ТЭЛА.
Перфузионная сцинтиграфия (пульмоносцинтиграфия) основана на внутривенном введении меченных изотопами 99m Tc макроагрегатов альбумина, которые накапливаются в капиллярном русле лёгких, делая возможной оценку тканевого кровотока. Изображение получают с помощью гамма-камеры в 6 стандартных проекциях (передняя, задняя, левая боковая, левая передняя косая, правая боковая, правая передняя косая). В случае окклюзии лёгочных артерий, в периферическое капиллярное русло частицы не поступают, что создаёт характерную картину дефекта перфузии - «холодную зону». Лучевая нагрузка при проведении исследования с меченными 99m Tc макроагрегатами альбумина составляет в среднем 1.1 мЗв, что значительно меньше, чем при проведении КТ (2-6 мЗв). Для сравнения, лучевая нагрузка при обычной ренгтенографии лёгких составляет 0,05 мЗв.
Метод
перфузионной сцинтиграфии даёт
возможность изучить региональную
легочную гемодинамику, что может быть
использовано для диагностики ТЭЛА. Он
отличается высокой чувствительностью,
но недостаточно специфичен, поскольку
многие патологические процессы в лёгких
сопровождаются региональным снижением
перфузии (опухоли лёгкого, пневмонии,
обструктивные заболевания лёгких,
пневмосклероз, ателектаз, эмфизема и
кисты лёгких, гидроторакс, гипоплазия
лёгочных сосудов, их артериит и т.д.)
[51, 52]. Следовательно, несмотря на высокую
чувствительность, диагностика
тромбоэмболии лёгочной артерии с помощью
перфузионной сцинтиграфии лёгких
возможна только в контексте клинической
картины и при учёте данных других методов
исследования [52]. ![]()
С целью повышения специфичности перфузионная сцинтиграфия может дополняться вентиляционным сканированием (пневмосцинтиграфией), которое подразумевает ингаляции различных агентов: воздушно-газовой смеси, содержащей 81 Kr с очень коротким периодом полураспада (13 с), ксенона 133 Xe, аэрозоля, меченного 99m Tc, или частиц угля, связанных с 99m Tc (технегаз). Предпочтение следует отдавать не газообразным, а меченным 99m Tc агентам, так как они дольше задерживаются в бронхо-альвеолярном дереве, поэтому позволяют выполнить исследование в нескольких проекциях и более чётко оценить вентиляционно-перфузионные отношения. Однако более продолжительный период их полураспада требует значительного интервала времени между проведением перфузионного и вентиляционного сканирования легких.
Вентиляционная
сцинтиграфия позволяет выявить зоны
гиповентиляции. Гиповентиляция приводит
к рефлекторной вазоконстрикции (рефлекс
Эйлера-Лильестранда), благодаря чему
поддерживается соответствие между
вентиляцией и перфузией. Следовательно
при локальной бронхиальной обструкции
области снижения активности при
перфузионной сцинтиграфии будут
соответствовать зонам пониженной
активности вентиляционной сцинтиграфии.
При ТЭЛА в большинстве своём вентиляционная
сцинтиграфия патологии выявлять не
должна, а на перфузионной имеются дефекты
(нарушение вентиляционно-перфузионных
отношений – рисунок 23, 24) [52]. ![]()
При оценке результатов вентиляционно-перфузионного сканирования часто используют четырёхуровневую классификацию из исследования PIOPED: норма, высокая вероятность ТЭЛА и недиагностические сканограммы (низкая и промежуточная вероятности). Под высокой вероятностью подразумевается выраженное несоответствие между значительно сниженной перфузией и нормальной или мало изменённой вентиляцией в двух и более сегментах лёгкого. Нормальные результаты вентиляционно-перфузионной сцинтиграфии лёгких надёжно исключают ТЭЛА; при высокой вероятности ТЭЛА по результатам V/Q сканирования диагноз считается подтверждённым. В то же время некоторые специалисты утверждают, что наличие вентиляционно-перфузионного несоответствия даже в 1 сегменте лёгкого достаточно для постановки диагноза.
В некоторых клиниках проводят только перфузионное сканирование, заменяя вентиляционную фазу обычной рентгенографией лёгких (рис. 16, 17). При нарушении перфузии такой подход нежелателен. Он приемлем только при нормальных результатах рентгенографии - в таких случаях любые дефекты перфузии должны рассматриваться как вентиляционно-перфузионное несоответствие.
Метод вентиляционно-перфузионной сцинтиграфии для диагностики ТЭЛА подвергается критике в связи с высокой частотой недиагностических результатов (с промежуточной вероятностью ТЭЛА), что требует дальнейшего обследования больного. Диагностическую ценность метода повышает оценка результатов в комплексе с определением клинической вероятности ТЭЛА (см. раздел «алгоритмы диагностики»). Недавно показано, что чувствительность метода повышается при регистрации изображения с помощью однофотонной эмиссионной компьютерной томографии.
Итак, отсутствие дефектов перфузии на перфузионной сцинтиграмме лёгких надёжно исключает ТЭЛА. Сочетание клинически низкой вероятности ТЭЛА и недиагностических результатов (низкая и промежуточная вероятность) V/Q сцинтиграфии – приемлемый критерий исключения диагноза (хотя и с меньшей доказательной базой). Высокая вероятность ТЭЛА при V/Q сцинтиграфии позволяет установить диагноз, однако в группе больных с клинически низкой вероятностью тромбоэмболии требуется дальнейшее обследование. При всех других сочетаниях клинической вероятности ТЭЛА и результатов вентиляционно-перфузионной сцинтиграфии необходимо дальнейшее обследование (см. алгоритмы диагностики, таблица 17) [41].
Рисунки
23 и 24. Вентиляционно-перфузионная
сцинтиграфия лёгких (вентиляционная –
с аэрозолем, меченным 99m Tc,
перфузионная – с меченными 99m Tc
макроагрегатами альбумина) больной 71
года с жалобами на внезапно возникшую
и нарастающую одышку. ![]()
Р исунок
23. Вентиляционная сцинтиграмма в передней
проекции (верхний рисунок) в норме. При
перфузионной сцинтиграфии (нижний
рисунок) отмечается практически полное
отсутствие перфузии правого лёгкого.
Массивная ТЭЛА (эмбол в правой лёгочной
артерии) [79].
исунок
23. Вентиляционная сцинтиграмма в передней
проекции (верхний рисунок) в норме. При
перфузионной сцинтиграфии (нижний
рисунок) отмечается практически полное
отсутствие перфузии правого лёгкого.
Массивная ТЭЛА (эмбол в правой лёгочной
артерии) [79].
Р исунок
24. Перфузионная сцинтиграмма лёгких в
прямой проекции той же больной (см. рис.
23) через 2 дня после катетерной эмолэктомии.
Отмечается восстановление перфузии
правого лёгкого. Остающийся небольшой
субсегментарный дефект накопления
может быть следствием дистальной
эмболизации из правой главной лёгочной
артерии [79].
исунок
24. Перфузионная сцинтиграмма лёгких в
прямой проекции той же больной (см. рис.
23) через 2 дня после катетерной эмолэктомии.
Отмечается восстановление перфузии
правого лёгкого. Остающийся небольшой
субсегментарный дефект накопления
может быть следствием дистальной
эмболизации из правой главной лёгочной
артерии [79].
Компьютерная томография грудной клетки с контрастным усилением (КТ-ангиография)
При подозрении на ТЭЛА компьютерная томография грудной клетки выполняется после введения контрастного препарата в периферическую вену (исследование с контрастным усилением, КТ-ангиография). КТ-ангиография в последнее время стала основным методом визуализации при подозрении на ТЭЛА [41]. По сравнению с ангиопульмонографией, которая считается золотым стандартом диагностики ТЭЛА, выполнение КТ проще, требует меньше времени и персонала, а по информативности КТ-ангиография как минимум не уступает селективной ангиопульмонографии [31, 41]. Для КТ-сканирования грудной клетки достаточно однократной задержки дыхания (рис. 25, 26).
При сравнении с вентиляционно-перфузионной сцинтиграфией КТ-ангиография представляется более объективным методом диагностики (меньше расхождений в интерпретации результатов разными врачами лучевой диагностики). Другим преимуществом КТ с контрастным усилением как по отношению к ангиопульмонографии, так и к вентиляционно-перфузионной сцинтиграфии, является визуализация средостения и лёгочной паренхимы и, следовательно, возможность постановки альтернативного диагноза (пневмония, опухоли лёгких, плевральный выпот, пневмоторакс, увеличение внутригрудных лимфоузлов, разрыв пищевода, расслоение аорты, переломы рёбер и костные метастазы) в отсутствие ТЭЛА. Кроме того, КТ-ангиография позволяет выявить дилатацию правого желудочка, что свидетельствует о тяжёлом течении заболевания (рис. 33) [31, 80]. После однократного введения контрастного препарата помимо КТ грудной клетки можно провести КТ-венографию (см. раздел «диагностика ТГВ» , рис. 20, 21).
Есть у КТ-ангиографии грудной клетки и свои недостатки. Могут возникать сложности с визуализацией не вертикально расположенных артерий (особенно язычковых сегментов и средней доли). Обструкция верхней полой вены, а также наличие внутрилёгочных и внутрисердечных шунтов могут приводить к ложноотрицательным результатам КТ-ангиографии. Признаки ТЭЛА порой симулируются слизистыми пробками в бронхах, периваскулярным отёком при левожелудочковой недостаточности, локальным повышением сосудистого сопротивления в области ателектазов или инфильтрации лёгких, анатомическими структурами – аксиальными срезами бифуркции сосудов, прикорневыми лимфоузлами; если между введением контраста и началом сканирования лёгких не прошёл некоторый промежуток времени, неполное заполнение сосудов контрастом иногда расценивается как дефект наполнения (ложноположительные результаты) [31, 80].
Прямыми признаками ТЭЛА при КТ-ангиографии являются [80]:
Полный дефект наполнения (просвет артерии дистальнее эмбола не конрастируется; возможно расширение артерии по сравнению с соседними проходимыми сосудами, рис. 27).
Частичный дефект наполнения: в просвете сосуда определяется очаг пониженной плотности, окружённый контрастом. На поперечном срезе сосуда такая картина обозначается как симптом «polo mint» - по названию кольцевидной конфеты (рис. 28, 29), на продольном срезе – «симптом железнодорожного пути» (“railway track” sign, рис. 30).
Пристеночный дефект наполнения, который образует с сосудистой стенкой острый угол (рис. 31).
К непрямым признакам относятся [81]:
Признаки инфаркта лёгкого или кровоизлияния в альвеолы (рис. 32).
Обеднение кровотока в поражённом сегменте.
Ателектазы.
Умеренный плевральный выпот.
Значимость
для диагностики ТЭЛА односпиральной
компьютерной томографии (ОСКТ) и
мультиспиральной компьютерной томографии
(МСКТ) следует рассматривать отдельно. ![]()
Чувствительность ОСКТ при ТЭЛА составляет около 70%, специфичность – 90%. Частота получения неинформативных томограмм (артефакты движения, недостаточное контрастирование лёгочных сосудов) составляет 5-8% (аналогична показателю при ангиопульмонографии). Таким образом, отсутствие признаков ТЭЛА при ОСКТ не позволяет исключить этот диагноз. Однако сочетание отрицательных результатов ОСКТ с отсутствием УЗ-признаков проксимального ТГВ надёжно исключает ТЭЛА (см. раздел алгоритмы диагностики, таблица 17).
С введением в клиническую практику мультиспиральных компьютерных томографов, МСКТ с контрастным усилением стала методом выбора для визуализации лёгочных сосудов при подозрении на ТЭЛА. При исследовании на четырёхспиральном компьютерном томографе чувствительность составляет 83%, специфичность – 96%. Следует подчеркнуть необходимость анализа результатов КТ в совокупности с оценкой клинической вероятности диагноза. У больных с низкой или промежуточной клинической вероятностью ТЭЛА (по шкале Wells), предсказательная ценность отрицательного результата МСКТ составляет 96% и 89% соответственно, резко снижаясь (до 60%) при высокой клинической вероятности. И наоборот, предсказательная ценность положительного результата МСКТ составила 92%-96% у больных с промежуточной и высокой клинической вероятностью, и лишь 58% - при низкой клинической вероятности ТЭЛА. В редких случаях подобного несоответствия результатов МСКТ и клинической вероятности ТЭЛА врач должен особенно внимательно подойти к диагнозу. Необходимый объём дополнительного обследования (УЗИ глубоких вен и/или вентиляционно-перфузионная сцинтиграфия или ангиопульмонография) при высокой клинической вероятности ТЭЛА, но отрицательных результатах МСКТ до сих пор остаётся предметом споров. Продолжение обследование может обсуждаться для части больных при низкой клинической вероятности, но положительной МСКТ [41].
Точность спиральной КТ при наличии тромбов в субсегментарных артериях явно ниже, чем при их локализации в главных, долевых и сегментарных артериях. Наличие нормальной спиральной КТ не исключает полностью ТЭЛА в субсегментарный сосуд [52]. При подозрении на ТЭЛА изолированное поражение субсегментарного сосуда с помощью МСКТ обнаруживается в 1-5%. В подобных случаях целесообразно выполнить УЗИ глубоких вен нижних конечностей: обнаружение ТГВ делает назначение терапии обоснованным; определённых рекомендаций при отсутствии ТГВ нет за неимением доказательной базы.
Таким образом, визуализация тромба в сегментарных и более крупных лёгочных артериях при ОСКТ и МСКТ в большинстве случаев позволяет поставить достоверный диагноз ТЭЛА, в то время как необходимость лечения при выявлении тромба в субсегментарном сосуде при отсутствии УЗ-признаков проксимального ТГВ дискутабельна. У больных с клинически невысокой вероятностью тромбоэмболии для исключения ТЭЛА отрицательный результат ОСКТ следует подкрепить отсутствием УЗ-признаков ТГВ; в тех же условиях негативный результат МСКТ достоверно исключает диагноз без дополнительного обследования. Показано ли продолжение обследования в редких случаях негативных результатов МСКТ при клинически высокой вероятности ТЭЛА, до сих пор не ясно (см. раздел алгоритмы диагностики, рис. 42, 43, таблица 17) [41].
Рисунки
25 и 26. КТ-ангиография грудной клетки
больного 44 лет, поступившего в
полуобморочном состоянии с жалобами
на выраженную одышку. ![]()
Р исунок
25. Определяется крупный эмбол в области
бифуркации ствола лёгочной артерии
(«седловидный» эмбол). Массивная ТЭЛА
[73].
исунок
25. Определяется крупный эмбол в области
бифуркации ствола лёгочной артерии
(«седловидный» эмбол). Массивная ТЭЛА
[73].
Р исунок
26. Тот же случай (см. рис. 25). Эмболы,
извлечённые при успешной эмболэктомии
из лёгочных артерий (больной выжил,
ближайший катамнез без существенных
проблем). V-образный эмбол извлечён из
бифуркации лёгочного ствола (см. рис.
25). Линейка внизу градуирована в дюймах
(1 дюйм = 2,54 см) [73].
исунок
26. Тот же случай (см. рис. 25). Эмболы,
извлечённые при успешной эмболэктомии
из лёгочных артерий (больной выжил,
ближайший катамнез без существенных
проблем). V-образный эмбол извлечён из
бифуркации лёгочного ствола (см. рис.
25). Линейка внизу градуирована в дюймах
(1 дюйм = 2,54 см) [73].
Рисунок
27. КТ-ангиограмма грудной клетки; женщина
32 лет, поступившая с жалобой на боли в
грудной клетки. ![]()
О пределяется
полностью окклюзирующий эмбол в артерии
задне-базального сегмента нижней доли
правого лёгкого (стрелка). Обращает на
себя внимание расширение поражённой
артерии по сравнению с контрастированными
соседними [80].
пределяется
полностью окклюзирующий эмбол в артерии
задне-базального сегмента нижней доли
правого лёгкого (стрелка). Обращает на
себя внимание расширение поражённой
артерии по сравнению с контрастированными
соседними [80].
Рисунок
28. КТ-ангиограмма грудной клетки, женщина
27 лет. ![]()
Ц ентрально
расположенный эмбол в артерии
задне-базального сегмента нижней доли
правого лёгкого (стрелка) с чётким краем,
полностью окружённый контрастным
веществом (кольцо контрастного препарата,
окружающее эмбол - симптом «polo mint»).
Тромбы также определяются в субсегментарных
артериях латерально-базального сегмента
нижней доли правого лёгкого и
задне-базального сегмента нижней доли
левого лёгкого [82].
ентрально
расположенный эмбол в артерии
задне-базального сегмента нижней доли
правого лёгкого (стрелка) с чётким краем,
полностью окружённый контрастным
веществом (кольцо контрастного препарата,
окружающее эмбол - симптом «polo mint»).
Тромбы также определяются в субсегментарных
артериях латерально-базального сегмента
нижней доли правого лёгкого и
задне-базального сегмента нижней доли
левого лёгкого [82].
Рисунок
29. КТ-ангиограмма грудной клетки,
реконструкция артерии задне-базального
сегмента нижней доли правого лёгкого
по серии срезов (см. рис. 28). ![]()
С трелка
указывает место поперечного, представленного
на рисунке 28. Показано, что центральный
дефект накопления (симптом «polo mint»)
возможен, только если тромбоэмбол
распространяется с более проксимальных
ветвей лёгочной артерии, либо фиксирован
в определённых точках к стенке артерии
[82].
трелка
указывает место поперечного, представленного
на рисунке 28. Показано, что центральный
дефект накопления (симптом «polo mint»)
возможен, только если тромбоэмбол
распространяется с более проксимальных
ветвей лёгочной артерии, либо фиксирован
в определённых точках к стенке артерии
[82].
Рисунок
30. КТ-ангиограмма грудной клетки; мужчина
66 лет, поступивший в стационар с жалобами
на одышку и боль в грудной клетке. ![]()
С трелка
– продольный срез сосуда, частичный
дефект наполнения, окружённый контрастным
веществом (“railway track” sign - «симптом
железнодорожного пути»). Короткая
стрелка – эмбол в левой главной лёгочной
артерии [80].
трелка
– продольный срез сосуда, частичный
дефект наполнения, окружённый контрастным
веществом (“railway track” sign - «симптом
железнодорожного пути»). Короткая
стрелка – эмбол в левой главной лёгочной
артерии [80].
Рисунок
31. КТ-ангиограмма грудной клетки; женщина
58 лет, поступившая с жалобами на боль в
грудной клетке и одышку. ![]()
В просвете артерии определяется эксцентрично
расположенный дефект наполнения,
образующий со стенкой сосуда острый
угол и окружённый контрастным препаратом.
Острая ТЭЛА [80].
просвете артерии определяется эксцентрично
расположенный дефект наполнения,
образующий со стенкой сосуда острый
угол и окружённый контрастным препаратом.
Острая ТЭЛА [80].
Рисунок
32. Дополнительные КТ-ангиографические
признаки ТЭЛА у больной 58 лет. ![]()
У частки
повышенной плотности клиновидной
(стрелка) и линейной (короткая стрелка)
формы, которые могут соответствовать
инфаркту лёгкого [80].
частки
повышенной плотности клиновидной
(стрелка) и линейной (короткая стрелка)
формы, которые могут соответствовать
инфаркту лёгкого [80].
Рисунок
33. ТЭЛА у пациента 42 лет, который поступил
в стационар с тяжёлой одышкой и жалобами
на боль в грудной клетке. ![]()
П ри
КТ-ангиографии грудной клетки выявлены
признаки перегрузки правого желудочка:
размер правого желудочка по короткой
оси (пунктирная линия) превосходит
размер левого желудочка (сплошная линия)
[80].
ри
КТ-ангиографии грудной клетки выявлены
признаки перегрузки правого желудочка:
размер правого желудочка по короткой
оси (пунктирная линия) превосходит
размер левого желудочка (сплошная линия)
[80].
Селективная ангиография лёгочной артерии (ангиопульмонография)
Селективная ангиопульмонография — это рентгенологический метод исследования сосудов легких и легочного кровотока, при котором контрастный препарат (уротраст, верографин, урографин и др.) вводится с помощью катетеров непосредственно в сосудистое русло лёгких. Для введения рентгеноконтрастного вещества в ствол легочной артерии, левую, правую или концевые (терминальные) ветви легочной артерии производят чрескожную катетеризацию бедренной вены по Сельдингеру и проводят катетер через правое предсердие и правый желудочек в легочную артерию и ее ветви [51]. Прямая ангиография позволяет визуализировать даже мелкие тромбы (1-2 мм в диаметре), хотя при субсегментарных эмболиях отмечаются расхождения в заключениях между врачами лучевой диагностики.
Диагностические критерии острой ТЭЛА разработаны более 40 лет назад. К прямым ангиографическим признакам относятся полная обструкция сосуда (его ампутация с вогнутым краем столба контрастного вещества) или дефект наполнения (рис. 34, 35, 36, 37). Косвенные признаки ТЭЛА включают медленное течение контраста, региональную гипоперфузию и замедление или уменьшение венозного кровотока. Однако наличие косвенных ангиографических признаков в отсутствие прямых не позволяет поставить диагноз ТЭЛА [41, 52].
Ангиопульмонография – инвазивный метод диагностики, её выполнение сопряжено с определённым риском. Смертность при ангиографии лёгочной артерии составляет 0,2% и в основном обусловлена проведением исследования у крайне тяжёлых больных с нестабильной гемодинамикой или острой дыхательной недостаточностью. Кроме того, если диагноз ТЭЛА поставлен с помощью ангиопульмонографии, и больному показан тромболизис, возрастает риск кровотечения из места введения катетера.
Хотя ангиопульмонография является «золотым стандартом» постановки или исключения диагноза ТЭЛА, в настоящее время её проводят редко в связи с широким внедрением в клиническую практику не уступающей (а то и превосходящей) по информативности неинвазивной компьютерной томографии грудной клетки с контрастным усилением .
Интерпретация результатов вентрикулографии правого желудочка сложна, этот метод оценки дисфункции ПЖ устарел и в повседневной клинической практике вытесняется эхокардиографией и определением уровня биомаркеров (см. раздел «стратификация риска и прогноз» ).
Таким образом, выполнение ангиопульомнографии, чувствительного и специфичного, но инвазивного метода диагностики, показано, если неинвазивные методы или неинформативны или недоступны. Другим показанием является тяжёлое и/или быстро ухудшающееся состояние больного с сомнительным диагнозом ТЭЛА, когда проведение неинвазивных методик приведёт к ненужной трате времени. Если ангиопульмонография всё же выполняется (см. раздел алгоритмы диагностики, табл. 17), необходимо провести прямое измерение гемодинамических показателей (давление в правых отделах сердца, в лёгочной артерии) [41, 52].
Рисунки
34 и 35. Селективное ангиопульмонографическое
и КТ-исследование мужчины 33 лет, который
поступил в стационар с жалобами на
внезапно появившуюся неделю назад и
прогрессивно нарастающую одышку. ![]()
Р исунок
34. Селективная ангиопульмонография.
Множественные двусторонние дефекты
перфузии (красные стрелки). Дефекты
наполнения в крупных ветвях лёгочной
артерии (зелёные стрелки) [85].
исунок
34. Селективная ангиопульмонография.
Множественные двусторонние дефекты
перфузии (красные стрелки). Дефекты
наполнения в крупных ветвях лёгочной
артерии (зелёные стрелки) [85].
Р исунок
35. КТ-ангиография грудной клетки, тот
же случай (см. рис. 34). Тромбы в главных
ветвях лёгочной артерии [85].
исунок
35. КТ-ангиография грудной клетки, тот
же случай (см. рис. 34). Тромбы в главных
ветвях лёгочной артерии [85].
Рисунок
36. Ангиопульмонограмма. ![]()
К рупные
дефект наполнения в правой лёгочной
артерии [84].
рупные
дефект наполнения в правой лёгочной
артерии [84].
Рисунок
37. Ангиопульмонограмма. ![]()
Д ефекты
наполнения в сегментарных и субсегментарных
артериях верхней доли правого лёгкого
(стрелки) [84].
ефекты
наполнения в сегментарных и субсегментарных
артериях верхней доли правого лёгкого
(стрелки) [84].
Эхокардиография
У 25% больных ТЭЛА при проведении эхокардиографии (ЭхоКГ) или КТ-ангиографии грудной клетки выявляется дилатация правого желудочка. Наличие изменений на ЭхоКГ используется при стратификации риска .
Эхокардиографические критерии диагностики ТЭЛА отличаются в разных исследованиях. В основе их обычно лежит оценка размеров правого желудочка (рис. 38) и скорости регургитационного потока на трёхстворчатом клапане (рис. 39). В виду того, что чувствительность данного метода составляет 60–70%, отрицательный результат не исключает диагноз ТЭЛА. В то же время признаки перегрузки правого желудочка или его дисфункции могут возникать вследствие сопутствующих заболеваний сердца или лёгких при отсутствии ТЭЛА [41].
Если пациент с подозрением на развитие ТЭЛА находится в критическом состоянии, ЭхоКГ у постели больного – метод, позволяющий быстро сориентироваться в ситуации и выработать концепцию дальнейшего обследования и лечения (см. алгоритмы диагностики, рис. 42). У больных в состоянии шока или при выраженной артериальной гипотензии (ТЭЛА высокого риска) отсутствие эхокардиографических признаков перегрузки или дисфункции правого желудочка практически исключает ТЭЛА, как причину нестабильной гемодинамики. В случаях ТЭЛА невысокого риска ЭхоКГ служит главным образом для уточнения категории риска (промежуточный или низкий) [41].
Подробнее ![]()
Критерии перегрузки ПЖ давлением (1 или более признаков [59, 60]):
Тромбы в правых отделах сердца (рис. 40, 41).
Дилатация правого желудочка (КДД ПЖ >30 мм или КДРПЖ/КДРЛЖ >1 в четырёхкамерной позиции, рис. 38).
Парадоксальное движение межжелудочковой перегородки (рис. 47).
Лёгочная гипертензия (время ускорения кровотока в стволе лёгочной артерии < 90 мс, или градиент давления ПЖ/ПП >30 мм рт. ст.).
При гипертрофии ПЖ (толщина свободной стенки более 7 мм) невозможно с уверенностью судить об остроте появления указанных признаков.
Дополнительные признаки перегрузки правого желудочка давлением необходимы для снижения числа ложноположительных (относительно диагностики ТЭЛА) результатов у больных с гипо-акинезом свободной стенки правого желудочка вследствие инфаркта.
Данных о специфичных эхокардиографических признаках ТЭЛА немного. В исследование Kurzyna M. с соавт [59] вошли 100 больных с яркой клинической картиной ТЭЛА, из которых 62-м требовалось лечение в отделение интенсивной терапии. Сравнивались три группы эхокардиографических критериев, которые могут использоваться для диагностики ТЭЛА (таблица 16). Критерии диагностики, которые основывались на нарушении выброса из правого желудочка (признак «60/60» - время ускорения кровотока в стволе лёгочной артерии ≤ 60 мс при градиенте давления на трикуспидальном клапане ≤ 60 мм рт. ст., рис. 39), либо на снижении сократительной способности свободной стенки правого желудочка в сравнении с его верхушкой (признак МакКоннелла) [58, 59], несмотря на сопутствующие сердечнососудистые и лёгочные заболевания, обладали более высокой прогностической ценностью, чем признаки перегрузки правого желудочка давлением.
Гипо- или акинезия свободной стенки правого желудочка (напоминающая признак МакКоннелла) может развиться вследствие его инфаркта. Во избежание ошибочной диагностики ТЭЛА в этих случаях следует обращать внимание на признаки перегрузки правого желудочка давлением. Сделаны попытки использовать в диагностике ТЭЛА тканевой допплер, однако данные на этот счёт ограничены.
Таблица 16. Диагностическая ценность трёх групп эхокардиографических признаков ТЭЛА у больных в зависимости от наличия сопутствующих заболеваний сердца и лёгких [41].
|
|
Больные без анамнеза заболеваний сердца и лёгких |
Больные с отягощённым анамнезом по заболеваниям сердца и лёгких | ||||
|
Критерии перегрузки ПЖ давлением |
Признак 60/60 |
Признак МакКоннелла |
Критерии перегрузки ПЖ давлением |
Признак 60/60 |
Признак МакКоннелла | |
|
Специфичность % |
78 |
100 |
100 |
21 |
89 |
100 |
|
Чувствительность% |
81 |
25 |
19 |
80 |
26 |
20 |
|
ПЦПР |
90 |
100 |
100 |
65 |
82 |
100 |
|
ПЦНР |
64 |
37 |
35 |
36 |
40 |
40 |
|
Критерии перегрузки ПЖ давлением (1 или более признаков [59, 60]):
При гипертрофии ПЖ (толщина свободной стенки более 7 мм) невозможно с уверенностью судить об остроте появления указанных признаков. Дополнительные признаки перегрузки правого желудочка давлением необходимы для снижения числа ложноположительных (относительно диагностики ТЭЛА) результатов у больных с гипо-акинезом свободной стенки правого желудочка вследствие инфаркта. ПЦПР — предсказательная ценность положительного результата. ПЦНР — предсказательная ценность отрицательного результата. ПЖ — правый желудочек. ПП — правое предсердие. ЛЖ — левый желудочек. КДР — конечно-диастолический размер. | ||||||
Итак, Эхо-КГ не является обязательным методом обследования у гемодинамически стабильных больных с подозрением на ТЭЛА. Данные ЭхоКГ в этих случаях служат в большей степени для уточнения степени риска: низкого или промежуточного. Так как унифицированных эхокардиографических критериев дисфункции правого желудочка нет, к категории больных низкого риска можно отнести только пациентов с абсолютно нормальными результатами. Отдельно стоит сказать о двух возможных ЭхоКГ находках, обнаружение которых удваивает риск смерти: тромбы в правых отделах сердца (рис. 40, 41) и право-левый шунт через открытое овальное окно.
У больных в состоянии шока или при выраженной артериальной гипотензии отсутствие эхокардиографических признаков перегрузки правого желудочка практически исключает ТЭЛА, как причину нарушенной гемодинамики. Одновременно в этих случаях ЭхоКГ помогает в проведении дифференциального диагноза, позволяя визуализировать тампонаду сердца, острую клапанную патологию, признаки инфаркта миокарда или гиповолемии. В то же время, наличие четких признаков перегрузки давлением или дисфункции правого желудочка у пациента с гемодинамическими нарушениями при подозрением на развитие ТЭЛА является показанием для проведения активных терапевтических мероприятий. Этот подход полностью оправдал себя в исследовании, в котором лечение назначали больным с высокой клинической вероятностью ТЭЛА, шоковым индексом (ЧСС/САД) ≥1 и ЭхоКГ-признаками дисфункции правого желудочка.
В отдельных клинических случаях можно рассмотреть вопрос о дополнительном обследовании: УЗИ глубоких вен (поиск признаков проксимального ТГВ) и чреспищеводной Эхо-КГ (для визуализации эмболов в легочных артериях). Действительно, часто гемодинамические нарушения связаны с двусторонней эмболией в магистральные лёгочные артерии, и в большинстве таких случаев чреспищеводная ЭхоКГ может подтвердить диагноз. Кроме того, обнаружение тромбов в правых отделах сердца с помощью стандартной трансторакальной ЭхоКГ (что при острой ТЭЛА имеет место в 4-18%) полностью обосновывает назначение терапии [41].
Рисунок
38. Трансторакальная ЭхоКГ при массивной
ТЭЛА, четырёхкамерная позиция. Больной
44 лет, поступивший в стационар с тяжёлой
одышкой в полуобморочном состоянии. ![]()
В ыраженная
дилатация правого предсердия (RA) и
правого желудочка (RV). LA обозначает левое
предсердие, LV – левый желудочек [73].
ыраженная
дилатация правого предсердия (RA) и
правого желудочка (RV). LA обозначает левое
предсердие, LV – левый желудочек [73].
Рисунок
39. Трансторакальная ЭхоКГ у больного
массивной ТЭЛА, признак «60/60». ![]()
Л евая
часть – оценка скорости кровотока в
лёгочной артерии - время ускорения
кровотока в стволе лёгочной артерии 57
мс (≤ 60 мс) – стрелка А. Правая часть –
градиент давления на трикуспидальном
клапане 45 мм рт ст. (≤ 60 мм рт. ст.) –
стрелка B, свидетельствует об умеренной
лёгочной гипертензии [59].
евая
часть – оценка скорости кровотока в
лёгочной артерии - время ускорения
кровотока в стволе лёгочной артерии 57
мс (≤ 60 мс) – стрелка А. Правая часть –
градиент давления на трикуспидальном
клапане 45 мм рт ст. (≤ 60 мм рт. ст.) –
стрелка B, свидетельствует об умеренной
лёгочной гипертензии [59].
Рисунки
40 и 41. Трансторакальная ЭхоКГ. Мужчина
71 года с диагностированным два дня назад
тромбозом глубоких вен; жалобы на
выраженную нарастающую одышку и боли
в ногах. ![]()
Р исунок
40. Трансторакальная ЭхоКГ. Определяется
расширение правых отделов сердца, в
которых визуализируется гигантский
тромб, свободно флотирующий из правого
предсердия в правый желудочек. Отмечалась
тяжёлая трикуспидальная регургитация
и лёгочная гипертензия (систолическое
давление в лёгочной артерии 65 мм рт.
ст.) [86].
исунок
40. Трансторакальная ЭхоКГ. Определяется
расширение правых отделов сердца, в
которых визуализируется гигантский
тромб, свободно флотирующий из правого
предсердия в правый желудочек. Отмечалась
тяжёлая трикуспидальная регургитация
и лёгочная гипертензия (систолическое
давление в лёгочной артерии 65 мм рт.
ст.) [86].
Р исунок
41. Трансторакальная ЭхоКГ. Тот же случай
(см. рис. 40). Правые отделы сердца.
Гигантский тромб, флотирующий через
трикуспидальный клапан [86].
исунок
41. Трансторакальная ЭхоКГ. Тот же случай
(см. рис. 40). Правые отделы сердца.
Гигантский тромб, флотирующий через
трикуспидальный клапан [86].
Алгоритмы диагностики при подозрении на ТЭЛА
Общие положения
Распространённость ТЭЛА среди пациентов с подозрением на её развитие по данным последних исследований составляет 10–35%. Ангиопульмонография – инвазивный и дорогостоящий метод, результаты которого подчас с трудом поддаются интерпретации. Поэтому в настоящее время предпочтение отдаётся неинвазивным методам в различных комбинациях [41]:
Определение клинической вероятности.
Измерение плазменной концентрации D-димера.
УЗИ вен нижних конечностей.
Вентиляционно-перфузионная сцинтиграфия легких.
КТ-ангиография грудной клетки.
ЭхоКГ.
В недавно опубликованном исследовании Roy PM и соавт. сравнили исходы после отказа от антикоагулянтной терапии при клиническом подозрении на ТЭЛА, но снятом диагнозе, в двух группах больных. В первой группе диагноз исключался путём обследования в строгом соответствии с разработанными на доказательной основе алгоритмами. В этой группе на протяжении 3-х месяцев частота рецидивов ВТЭ составила 1.2%, внезапной смерти - 0.7%. Во второй группе в процессе диагностики отмечались те или иные отклонения от алгоритмов, и частота рецидивов ВТЭ и внезапной смерти за тот же период оказалась существенно выше (7.7% и 5.7%) [61].
Таким образом, целесообразность применения алгоритмов диагностики не вызывает сомнений. Разумеется, алгоритмы могут претерпевать изменения в зависимости от доступности тех или иных диагностических средств в конкретной клинике.
Алгоритмы диагностики при подозрении на ТЭЛА высокого и невысокого риска следует рассматривать отдельно (рисунки 42, 43).
В таблице 17 приводятся доказательные данные о диагностической значимости отдельных методов у больных невысокого риска в зависимости от клинической вероятности диагноза.
Р исунок
42. Алгоритм диагностики при подозрении
на ТЭЛА высокого риска (т.е. при шоке или
артериальной гипотонии). *Тяжесть
состояния больного может явиться
препятствием для экстренной КТ. #В
значительном проценте случаев при ТЭЛА
с перегрузкой правого желудочка
чрезпищеводная ЭХО-КГ позволяет
обнаружить тромбы в лёгочных артериях;
непосредственно у постели больного
можно провести УЗИ глубоких вен, при
этом подтверждение ТГВ помогает в выборе
тактики лечения. КТ означает КТ с
контрастным усилением (КТ-ангиографию)
[41].
исунок
42. Алгоритм диагностики при подозрении
на ТЭЛА высокого риска (т.е. при шоке или
артериальной гипотонии). *Тяжесть
состояния больного может явиться
препятствием для экстренной КТ. #В
значительном проценте случаев при ТЭЛА
с перегрузкой правого желудочка
чрезпищеводная ЭХО-КГ позволяет
обнаружить тромбы в лёгочных артериях;
непосредственно у постели больного
можно провести УЗИ глубоких вен, при
этом подтверждение ТГВ помогает в выборе
тактики лечения. КТ означает КТ с
контрастным усилением (КТ-ангиографию)
[41].
Р исунок
43. Алгоритм диагностики при подозрении
на ТЭЛА невысокого риска (т.е. без шока
и артериальной гипотонии). Для клинической
оценки вероятности ТЭЛА можно использовать
трёхуровневую (вероятность низкая,
промежуточная, высокая) или двухуровневую
(«ТЭЛА маловероятна», «вероятность
высока») схемы. В группе больных с
клинически низкой вероятностью ТЭЛА
(или в категории «ТЭЛА маловероятна»)
для определения D-димера могут
использоваться умеренно чувствительные
методы, в то время как высокочувствительные
методы можно применять также у больных
с промежуточной вероятностью ТЭЛА. При
развитии ТЭЛА в стационарных условиях
оценка плазменного уровня D-димера имеет
ограниченное значение. * Антикоагулянтная
терапия. †КТ-ангиография считается
диагностически значимым методом при
проксимальном, как минимум, сегментарном
расположении тромбов. ‡ Если при ОСКТ
данных за ТЭЛА не получено, для надёжного
исключения ТЭЛА необходимо отсутствие
УЗ-признаков ТГВ. # Если у больного с
клинически высокой вероятностью данных
за ТЭЛА при МСКТ не получено, перед тем
как отказаться от специфического
лечения, следует обсудить возможность
дальнейшего обследования (см. в тексте)
[41].
исунок
43. Алгоритм диагностики при подозрении
на ТЭЛА невысокого риска (т.е. без шока
и артериальной гипотонии). Для клинической
оценки вероятности ТЭЛА можно использовать
трёхуровневую (вероятность низкая,
промежуточная, высокая) или двухуровневую
(«ТЭЛА маловероятна», «вероятность
высока») схемы. В группе больных с
клинически низкой вероятностью ТЭЛА
(или в категории «ТЭЛА маловероятна»)
для определения D-димера могут
использоваться умеренно чувствительные
методы, в то время как высокочувствительные
методы можно применять также у больных
с промежуточной вероятностью ТЭЛА. При
развитии ТЭЛА в стационарных условиях
оценка плазменного уровня D-димера имеет
ограниченное значение. * Антикоагулянтная
терапия. †КТ-ангиография считается
диагностически значимым методом при
проксимальном, как минимум, сегментарном
расположении тромбов. ‡ Если при ОСКТ
данных за ТЭЛА не получено, для надёжного
исключения ТЭЛА необходимо отсутствие
УЗ-признаков ТГВ. # Если у больного с
клинически высокой вероятностью данных
за ТЭЛА при МСКТ не получено, перед тем
как отказаться от специфического
лечения, следует обсудить возможность
дальнейшего обследования (см. в тексте)
[41].
Таблица 17. Доказательные диагностические критерии ТЭЛА невысокого риска (без шока и артериальной гипотонии) в соответствии с клинической вероятностью диагноза [41].
|
Диагностические критерии |
Клиническая вероятность ТЭЛА |
| |||
|
Низкая |
Промежуточная |
Высокая | |||
|
Надёжное исключение ТЭЛА |
| ||||
|
Нормальная ангиопульмонограмма |
+ |
+ |
+ | ||
|
D-димер |
| ||||
|
- уровень не повышен, высокочувствительный метод анализа |
+ |
+ |
— | ||
|
- уровень не повышен, умеренно чувствительный метод анализа |
+ |
— |
— | ||
|
Вентиляционно-перфузионная сцинтиграфия |
| ||||
|
- Нормальная сцинтиграмма |
+ |
+ |
+ | ||
|
- Недиагностическая сцинтиграмма |
+ |
— |
— | ||
|
- Недиагностическая сцинтиграмма в сочетании с отсутствием УЗ-признаков проксимального ТГВ. |
+ |
+ |
± | ||
|
КТ грудной клетки с контрастированием |
| ||||
|
- Нормальная ОСКТ в сочетании с отсутствием УЗ-признаков ТГВ. |
+ |
+ |
± | ||
|
- Нормальная МСКТ |
+ |
+ |
± | ||
|
|
| ||||
|
Надёжное подтверждение ТЭЛА |
| ||||
|
Данные за ТЭЛА при ангиопульмонографии |
+ |
+ |
+ | ||
|
Высокая вероятность при V/Q сканировании |
± |
+ |
+ | ||
|
УЗ-признаки проксимального ТГВ |
+ |
+ |
+ | ||
|
Контрастная КТ грудной клетки |
| ||||
|
При ОСКТ или МСКТ данные за ТЭЛА (поражение как минимум сегментарных артерий) |
± |
+ |
+ | ||
|
При ОСКТ или МСКТ данные за ТЭЛА (поражение субсегментарных артерий) |
± |
± |
± | ||
|
Обозначения: Надёжный критерий (дальнейшее обследование не требуется), +, зелёный цвет; Ненадёжный критерий (необходимо дальнейшее обследование), —, красный цвет; Критерий противоречивый (может потребоваться дальнейшее обследование), ±, жёлтый цвет. а Недиагностическая сканограмма лёгких в соответствии с классификацией в исследовании PIOPED – подробнее см. раздел«вентиляционно-перфузионная сцинтиграфия» . |
| ||||
Подозреваемая ТЭЛА высокого риска
ТЭЛА высокого риска – жизнеугрожающее состояние, при котором врач должен действовать быстро и чётко. Отмечается выраженная артериальная гипотония вплоть до шока, клиническая вероятность диагноза обычно высокая. В дифференциально-диагностическом ряду стоят кардиогенный шок, острая клапанная патология, тампонада сердца и аневризма аорты (см. раздел. «дифференциальная диагностика ТЭЛА»). Методом выбора для начала диагностики при этом будет трансторакальная ЭхоКГ, которая при ТЭЛА может выявить косвенные признаки острой лёгочной гипертензии и острого лёгочного сердца. Находкой могут также явиться тромбы («эмболы в пути») в правых отделах сердца. Если доступна транспищеводная ЭхоКГ, можно обнаружить эмболы непосредственно в лёгочных артериях. Однако если состояние больного крайне тяжёлое, в выборе дальнейшей тактики следует опираться на одни только результаты трансторакальной ЭхоКГ (см. рис. 42). Если удаётся стабилизировать состояние пациента, то можно рассмотреть вопрос о проведении дополнительного обследования. Поскольку к развитию ТЭЛА высокого риска обычно приводят эмболии крупных артерий, приемлемым методом диагностики является компьютерная томография с контрастным усилением (КТ-ангиография). Ангиопульмонографии следует избегать, поскольку эта манипуляция у тяжёлых больных сама по себе опасна и повышает вероятность кровотечений после тромболизиса.
Подозреваемая ТЭЛА невысокого риска
Стратегия, основанная на выполнении КТ-ангиографии
КТ-ангиография (КТ грудной клетки с контрастным усилением) в последнее время стала основным методом визуализации при подозрении на ТЭЛА. Вентиляционно-перфузионная сцинтиграфия не утратила своей актуальности, но применяется реже в связи с высокой частотой неоднозначных результатов. Однако в связи с тем, что в большинстве случаев под маской ТЭЛА скрывается другое заболевание, КТ не должна быть первым методом диагностики в группе больных невысокого риска. Определение плазменного уровня D-димера в сочетании с оценкой клинической вероятности диагноза позволяют исключить ТЭЛА у 30% больных (таблица 17), при этом риск тромбоэмболии в течение 3 месяцев у них составляет менее 1%. При высокой клинической вероятности ТЭЛА проводить анализ на D-димер не нужно, так как предсказательная ценность отрицательного результата в этих случаях незначительна (см. раздел, посвящённый определению D-димера). ОСКТ и МСКТ с высокой разрешающей способностью определяют эмболы в ветвях лёгочной артерии по крайней мере до сегментарного уровня. Отрицательные результаты МСКТ по данным ряда исследований позволяют безопасно исключить развитие ТЭЛА.
Для надёжного исключения ТЭЛА ОСКТ в связи с малой предсказательной ценностью отрицательного результата следует комбинировать с УЗИ вен нижних конечностей (таблица 17).
Имеются сообщения о ложноотрицательных результатах ОСКТ и МСКТ у больных с высокой клинической вероятностью ТЭЛА. Однако такие случаи редки, а риск тромбоэмболических событий в течение трёх месяцев у этой категории больных невысок. Единого мнения относительно необходимости и объёма дальнейшего обследования в таких случаях нет.
Значение УЗИ вен нижних конечностей
Место УЗИ вен нижних конечностей в диагностике ТЭЛА остаётся предметом споров. Это исследование показано в дополнение к ОСКТ, так как у части больных с отрицательными результатами компьютерной томографии выявляется тромбоз глубоких вен (таблица 17). Однако большинство европейских клиник в настоящее время оборудовано мультиспиральными компьютерными томографами, позволяющими надёжно исключать ТЭЛА как минимум в группе больных с невысокой клинической вероятностью. Как бы то ни было, УЗИ вен нижних конечностей не помешает и после МСКТ. У больных ТЭЛА тромбоз глубоких вен выявляется в 30-50% случаев. Обнаружение проксимального ТГВ при подозрении на ТЭЛА – достаточное основание для назначения антикоагулянтов без дополнительного обследования. Таким образом, обнаружив на УЗИ тромбоз проксимальных глубоких вен (специфичность дистального ТГВ для диагностики ТЭЛА существенно ниже), можно избежать выполнения КТ-ангиографии при наличии относительных противопоказаний (почечная недостаточность, аллергия на контрастные препараты). Наличие проксимального ТГВ повышает риск рецидивирования ВТЭ у больных ТЭЛА, поэтому УЗИ глубоких вен может использоваться для стратификации риска.
Значение вентиляционно-перфузионной сцинтиграфии
Если в клинике доступно быстрое выполнение вентиляционно-перфузионной сцинтиграфии, то этот метод целесообразно использоваться для диагностики ТЭЛА у больных с повышенным уровнем D-димера и наличием противопоказаний к проведению КТ (аллергия на йод-содержащие контрастные препараты, почечная недостаточность). Частота получения диагностических результатов (сцинтиграмма нормальная или имеется высокая вероятность ТЭЛА) при подозрении на ТЭЛА составляет 30-50%. Диагностическая ценность данного метода повышается при оценке в совокупности с клинической вероятностью ТЭЛА (таблица 17). На самом деле, среди больных с низкой клинической вероятностью и низкой вероятностью по результатам сцинтиграфии распространённость ТЭЛА совсем незначительна. Если при этом по данным УЗИ нет ТГВ нижних конечностей, то вероятность ТЭЛА ещё меньше. По данным Perrier et al. (1999) комплексное обследование, включающее оценку клинической вероятности, проведение вентиляционно-перфузионной сцинтиграфии, УЗИ вен нижних конечностей и определение уровня D-димера позволяет сделать определённое диагностическое заключение в 89% случаев. В другом исследовании (Anderson et al., 2007) показано, что в 99% случаев можно надёжно диагностировать ТЭЛА с помощью комбинации вентиляционно-перфузионной сцинтиграфии, оценки клинической вероятности и УЗИ вен нижних конечностей (УЗИ проводилось всем больным при поступлении и части по показаниям – через неделю), не прибегая к КТ-ангиографии или к ангиопульмонографии. Эпизоды ВТЭ за период наблюдения отмечались лишь в 1% случаев после исключения ТЭЛА, а признаки ТГВ при повторном УЗИ (через неделю) были обнаружены только у одного из 78 пациентов.
Значение ЭхоКГ
В обследовании больных с подозреваемой ТЭЛА невысокого риска роль ЭхоКГ невелика. Дело в том, что чувствительность метода у данной категории низкая (60-70%), и отрицательные результаты обследования не позволяют исключить ТЭЛА. В то же время специфичность признаков перегрузки правого желудочка у больных с промежуточной или высокой клинической вероятностью диагноза составляет примерно 90%, в совокупности этого вполне достаточно, чтобы считать диагноз подтверждённым. Однако в большинстве случаев для принятия решения о длительной антикоагулянтной терапии врачу нужны прямые признаки наличия тромбов в глубоких венах нижних конечностей или в лёгочных артериях. Так что основное значение ЭхоКГ в случаях ТЭЛА невысокого риска состоит в уточнении категории риска (промежуточный или низкий).
Нерешённые вопросы
Несмотря на существенный прогресс в области диагностики ТЭЛА, ряд вопросов ожидают своего решения. Диагностическая и клиническая значимость единичного субсегментарного дефекта, обнаруженного при МСКТ, до сих пор дискутируется. Решение о продолжении обследования, назначении или отказе от лечения в каждом подобном случае решается индивидуально. Также не определена тактика ведения больных с высокой клинической вероятностью ТЭЛА, но отрицательными результатами МСКТ (имеются сообщения о случаях гиподиагностики при таком сочетании). На современном этапе далеко не все признают ангиопульмонографию «золотым стандартом» диагностики ТЭЛА. Также необходимо уточнить значимость и экономическую целесообразность проведения УЗИ вен нижних конечностей при подозрении на ТЭЛА.
Резюме рекомендаций ЕОК (2008) по диагностике ТЭЛА с указанием класса рекомендаций и уровней доказательности для каждого положения
В таблице 18 приводится резюме основанных на принципах доказательной медицины рекомендаций ЕОК по диагностике ТЭЛА в остром периоде с указанием класса рекомендаций и уровней доказательности для каждого положения [41].
Таблица 18. Рекомендации ЕОК по диагностике ТЭЛА (2008) с указанием класса рекомендаций и уровней доказательности [41].
|
Рекомендации ЕОК по диагностике ТЭЛА (2008) |
Классa |
Уровеньb |
|
Подозрение на ТЭЛА высокого риска | ||
|
При ТЭЛА высокого риска (шок или артериальная гипотония) показана экстренная КТ-ангиография, либо (при невозможности выполнения КТ) ЭхоКГ у постели больного. |
I |
C |
|
Подозрение на ТЭЛА невысокого риска, общие рекомендации | ||
|
У больных с подозрением на ТЭЛА невысокого риска нужно оценить клиническую вероятность ТЭЛА или субъективно, или на основе доказательных диагностических шкал. |
I |
A |
|
Во избежание применения ненужных методов диагностики и неоправданного облучения больного, в отделении неотложной помощи следует определить уровень D-димера (желательно высокочувствительным методом). |
I |
A |
|
В ряде случаев целесообразно выполнение УЗИ глубоких вен нижних конечностей: подтверждение ТГВ избавит от необходимости дополнительных методов диагностики. |
IIb |
B |
|
Рутинное использование ЭхоКГ для диагностики ТЭЛА у больных со стабильной гемодинамикой и нормальным АД не рекомендуется. |
III |
C |
|
Показания к ангиопульмонографии выставляются при расхождении клинических данных и результатов неинвазивных методов визуализации. |
IIa |
C |
|
Рекомендуется использовать надёжные критерии диагноза ТЭЛА. Доказательные диагностические критерии в соответствии с клинической вероятностью ТЭЛА приводятся ниже (см. также табл. 7). |
I |
B |
|
Подозрение на ТЭЛА невысокого риска при клинически низкой вероятности | ||
|
Нормальный уровень D-димера (при использовании как высокочувствительного, так и умеренно чувствительного методов) исключает ТЭЛА. |
I |
A |
|
Нормальные результаты вентиляционно-перфузионной сцинтиграфии исключают ТЭЛА. |
I |
A |
|
Недиагностическая вентиляционно-перфузионная сцинтиграфия (низкая или промежуточная вероятность) может исключить ТЭЛА, особенно в сочетании с отсутствием УЗ-признаков проксимального ТГВ. |
IIa I |
B A |
|
Отрицательные результаты МСКТ надёжно исключают ТЭЛА. |
I |
A |
|
Отрицательные результаты ОСКТ исключают ТЭЛА только в сочетании с отсутствием УЗ-признаков проксимального ТГВ. |
|
|
|
Высокая вероятность ТЭЛА при вентиляционно-перфузионной сцинтиграфии может доказывать ТЭЛА, однако… у части больных для подтверждения диагноза требуются дальнейшее обследование. |
IIa IIb |
B B |
|
УЗ-картина проксимального ТГВ подтверждает ТЭЛА. |
I |
B |
|
При УЗ-картине дистального ТГВ для подтверждения ТЭЛА необходимо дальнейшее обследование. |
IIa |
B |
|
Визуализация сегментарных или более проксимальных тромбов при ОСКТ или МСКТ подтверждает ТЭЛА. |
I |
A |
|
При наличии данных за субсегментарные тромбы при ОСКТ или МСКТ требуется дальнейшее обследование. |
IIa |
B |
|
Подозрение на ТЭЛА невысокого риска при клинически промежуточной вероятности | ||
|
Нормальный уровень D-димера при анализе высокочувствительным методом исключает ТЭЛА. |
I |
A |
|
Нормальный уровень D-димера при менее чувствительных методах анализа не позволяет исключить ТЭЛА – необходимо продолжить обследование. |
IIa |
B |
|
Нормальные результаты вентиляционно-перфузионной сцинтиграфии исключают ТЭЛА. |
I |
A |
|
При недиагностических результатах вентиляционно-перфузионной сцинтиграфии рекомендуется продолжение обследования для подтверждения или исключения ТЭЛА. |
I |
B |
|
Отрицательные результаты МСКТ исключают ТЭЛА. |
I |
A |
|
Отрицательные результаты ОСКТ исключают ТЭЛА только в сочетании с отсутствием УЗ-признаков проксимального ТГВ. |
I |
A |
|
Высокая вероятность ТЭЛА при вентиляционно-перфузионной сцинтиграфии подтверждает ТЭЛА. |
I |
A |
|
УЗ-признаки проксимального ТГВ подтверждают ТЭЛА. |
I |
B |
|
При УЗ-картине дистального ТГВ для подтверждения ТЭЛА необходимо дальнейшее обследование. |
IIa |
B |
|
Визуализация сегментарных или более проксимальных тромбов при ОСКТ или МСКТ подтверждает ТЭЛА. |
I |
A |
|
При наличии данных за субсегментарные тромбы при ОСКТ или МСКТ может потребоваться дальнейшее обследование. |
IIb |
B |
|
Подозрение на ТЭЛА невысокого риска при клинически высокой вероятности | ||
|
Нормальный уровень D-димера, определяемого даже высокочувствительными методами, при клинически высокой вероятности не позволяет надёжно исключить ТЭЛА. Поэтому в данной группе больных проведение анализа на D-димер не рекомендуется. |
III |
C |
|
При отрицательных результатах КТ-ангиографии в ряде случаев требуется дополнительное обследование. |
IIa |
B |
|
Высокая вероятность ТЭЛА при вентиляционно-перфузионной сцинтиграфии подтверждает ТЭЛА. |
I |
A |
|
УЗ-признаки проксимального ТГВ подтверждают ТЭЛА. |
I |
B |
|
При УЗ-картине дистального ТГВ для подтверждения ТЭЛА необходимо дальнейшее обследование. |
IIb |
B |
|
Визуализация сегментарных или более проксимальных тромбов при ОСКТ или МСКТ подтверждает ТЭЛА. |
I |
A |
|
При наличии данных за субсегментарные тромбы при ОСКТ или МСКТ может потребоваться дальнейшее обследование. |
IIb |
B |
|
a Класс рекомендаций b Уровень доказательности | ||
Дифференциальная диагностика ТЭЛА
Общие положения
Как ни при каком другом заболевании при ТЭЛА исключительно важен дифференциально-диагностический поиск. Это обусловлено отсутствием специфических симптомов и синдромов: они встречаются при многих других нозологических формах. Зачастую у больного нет сочетания клинических признаков, а при поражении мелких ветвей лёгочной артерии их может не быть вообще.
Наиболее часто встречающиеся клинические маски ТЭЛА [62]:
Повторные пневмонии, чаще по типу плевропневмоний, но вначале боль, а через 1-2 дня появление лихорадки.
Быстро проходящие «сухие плевриты» - клиника течёт 2-3 дня, а не 2-3 недели, как при истинном плеврите.
Атипичные приступы стенокардии с последующим повышением температуры тела. На ЭКГ нет признаков коронарной недостаточности, но могут быть признаки перегрузки правого желудочка.
Повторные «немотивированные» обмороки.
Появление беспричинной лихорадки, не регрессирующей от антибиотиков или НПВП; Неожиданное появление и прогрессирование картины лёгочного сердца, которое нельзя объяснить анамнезом и характером предшествующего заболевания.
Наибольшие трудности представляет диагностика затяжных форм, возникающих, как правило, на фоне хронических заболеваний дыхательной и сердечно-сосудистой систем с нарушением кровообращения. Повторные более мелкие эмболии, предшествующие полной закупорке лёгочной артерии, и медленно нарастающий тромбоз на фоне общего тяжёлого состояния не дают демонстративной клиники, а инфаркты лёгких чаще всего диагностируются как пневмонии или экссудативные плевриты [67].
Таким образом, для улучшения диагностики ТЭЛА, помимо настороженности, выявления факторов риска и знания разнообразнойсимптоматики заболевания , необходимы тщательно собранный анамнез, учёт последовательности появления клинических симптомов, их всесторонняя оценка и проведение дифференциальной диагностики со сходными заболеваниями [62]. Во всех неясных случаях необходимо обследовать больного на предмет ТЭЛА в соответствии с представленными алгоритмами диагностики .
Дифференциальный диагноз необходимо проводить прежде всего:
С инфарктом миокарда.
С расслаивающей аневризмой аорты.
Со спонтанным пневмотораксом.
С бронхиальной астмой и обострением ХОБЛ.
С пневмонией и плевритом.
С хроническим лёгочным тромбозом.
С нетромботическими эмболиями лёгочной артерии.
Принимая во внимание многообразие клинических синдромов, ТЭЛА может включаться в дифференциально-диагностический поиск даже при «остром животе» и подозрении на ОНМК [62, 63, 65, 66, 68, 69].
Дифференциальная диагностика ТЭЛА и инфаркта миокарда
Общая схема
Острое лёгочное сердце – это остро развивающийся симптомокомплекс, характеризующийся тяжёлой лёгочной и сердечно-сосудистой недостаточностью, преимущественно по правожелудочковому типу, возникающей вследствие быстро развившейся гипертонии малого круга кровообращения [68]. Развитие острого лёгочного сердца чаще всего обусловлено тромбоэмболией основного ствола или крупных ветвей лёгочной артерии, но также возникает при остром отёке лёгких, массивных ателектазах, спонтанном пневмотораксе, спонтанной медиастинальной эмфиземе, злокачественной бронхиальной астме, пневмониях, раке лёгкого, сдавлении лёгочной артерии аневризмой, жидкостью в перикарде, при васкулитах и склерозе лёгочной артерии и её разветвлений, а также при пневмонэктомии [52, 68].
Клинически острое лёгочное сердце характеризуется в основном резкой болью в груди, резчайшей одышкой, цианозом, коллапсом, тахикардией [68].
Боли стенокардитического характера и ишемические изменения ЭКГ (клинические случаи 5, 8) обусловлены резким уменьшением кровенаполнения венечных артерий вследствие падения давления в аорте и притока крови к левому сердцу, а также в результате повышения давления в полостях правого сердца, что затрудняет доступ крови в систему правой венечной артерии и препятствует оттоку крови по тебезиевым и коронарным венам. Нарушения венечного кровообращения при лёгочной эмболии приводят к развитию в сердечной мышце ишемических, дистрофических и некротических изменений, преимущественно в субэндокардиальных зонах вплоть до возникновения мелкофокусного инфаркта миокарда. Загрудинные боли, по-видимому, могут обусловливаться и острым растяжением начального отдела лёгочной артерии с раздражением заложенных в её стенке нервных рецепторов, аналогично аорталгии при растяжении аорты [65, 66].
Таким образом, клиника острого лёгочного сердца слагается из симптомов, связанных с гипертонией малого круга, расширением полостей сердца, острой коронарной недостаточности, в основном правого желудочка, и гипотонией большого круга.
Всё сказанное свидетельствует о большой общности симптоматики (клинической и электрокардиографической) острого лёгочного сердца и острого инфаркта миокарда. Это сходство вполне обосновано, поскольку оба заболевания имеют общие патофизиологические черты и могут осложнять друг друга на разных этапах своего течения.
Поскольку тактика ведения таких больных, принципы лечения их неодинаковы, дифференциальная диагностика острого лёгочного сердца и инфаркта миокарда приобретает особую практическую ценность [68] (таблица 19).
Таблица
19. Дифференциальная диагностика ТЭЛА
и инфаркта миокарда [62 с изменениями] ![]()
|
ПРИЗНАК |
ТЭЛА |
ИНФАРКТ МИОАРДА |
|
Анамнез |
Тромбофлебит. Хирургическое пособие. Гиподинамия: продолжительный период иммобилизации, постельного режима и т.д. |
Стенокардия, нередко признаки нестабильности незадолго до инфаркта (учащение приступов, появление их при меньшей нагрузке, увеличение потребности в нитратах) |
|
Характеристика болевого синдрома |
Острая боль в грудной клетке без иррадиации, при лёгочно-плевральном варианте – сопряжённость боли с актом дыхания. |
Нарастание волнообразно, локализация (при «типичном» варианте) за грудиной, есть иррадиация и/или её смена (чаще в левую руку, челюсть, под левую лопатку), холодный липкий пот. Нехарактерна связь с дыханием. В 10-25% нет боли! |
|
Одышка |
Возникает сразу, чаще инспираторная (тихая), больные лежат |
Относительно постепенное развитие, облегчается в ортопноэ. |
|
Окраска кожи, слизистых |
Пепельный, смешанный цианоз, при обширном поражении - резкий чугунный цианоз верхней половины тела |
Преобладает акроцианоз. |
|
Показатели АД |
При массивной ТЭЛА глубокая гипотония, коллапс, шок, предшествующие болям; венозное давление повышается |
Нестабильность АД. Ангинозный статус сопровождается или сменяется гипотонией, кардиогенным шоком. |
|
Кровохарканье |
Возможно при инфаркте лёгкого |
Нехарактерно. |
|
Акцент II тона на ЛА |
Часто. |
Нехарактерно, редко. |
|
Шум трения плевры |
Часто. |
Нехарактерно, редко. |
|
Шум трения перикарда |
Возможен, нехарактерен. |
Нередко, преходящий. |
|
Рентгенологическая картина |
Симптом Вестермарка; «обрыв», деформация, укорочение корня; дисковидные ателектазы; инфаркт лёгкого; расширение правых отделов сердца; выбухание конуса ЛА |
Расширение корней; застой по малому кругу; отёк лёгких; кардиомегалия за счёт ЛЖ. |
|
ЭКГ |
Признаки острого лёгочного сердца с возвращением к норме (в течение минут-месяцев). |
Закономерная динамика и сроки. Признаки некроза мышцы сердца. Помнить о возможности инфаркта миокарда правого желудочка. |
|
ЭхоКГ |
Дилатация и перегрузка правых отделов сердца, лёгочная гипертензия. |
Гипо- или акинез стенки левого желудочка в области инфаркта. |
|
Биохимические маркеры |
Нормальный уровень D-димера делает диагноз ТЭЛА маловероятным; повышены альдолаза, ЛДГ3, КФК, АСТ (условная роль маркеров). |
Повышен уровень тропонинов I и T, КФК, КФК-МВ, ЛДГ-1, миоглобина, АСТ. |
|
Изменение картины гемограммы |
Наклонность к анемии синхронна с лейкоцитозом и повышением СОЭ. |
Наклонность к эритроцитозу, «ножницы» между лейкоцитозом и СОЭ (лейкоцитоз до 12-14x10 12 /л с первых часов до 3-6 суток, по мере снижения которого с 3-4 суток отмечается ускорение СОЭ, которая может оставаться повышенной до 1-2 недель). |
Если диагноз по-прежнему не ясен, верификация его производится согласно алгоритмам диагностики при подозрении на ТЭЛА (КТ-ангиография, вентиляционно-перфузионная сцинтиграфия и др.), выполняется коронарография.
Электрокардиографический дифференциальный диагноз
Так как чувствительность и специфичность ЭКГ при ТЭЛА не высока, могут возникнуть трудности с её интерпретацией. Классический признак S I Q III T III , который может сочетаться с элевацией сегмента ST в отведениях III и aVF, приходится дифференцировать в первую очередь от острого заднедиафрагмального инфаркта миокарда. При этом (помимо оценки ЭКГ-симптомов перегрузки правых отделов сердца, характерных для ТЭЛА) надо учитывать, что при ТЭЛА:
Отсутствует патологический зубец q II , который должен быть при заднедиафрагмальном инфаркте миокарда.
Зубец qaVF обычно мал по амплитуде; зубцы Q III и qaVF не превышают 0,03 с (отсутствие уширения и расщепления зубцов q).
Наряду с зубцами Q III и T III появляются отрицательные Т в правых грудных отведениях (от V 1 до V 3 , иногда до V 4 ); при заднем инфаркте миокарда они обычно положительные и нередко даже высокие.
Имеется выраженный зубец S I , который не характерен для неосложнённого инфаркта миокарда, а также углубление S в левых грудных отведениях (от V 4 до V 6 ).
Динамика ЭКГ со стороны сегмента ST и зубца Т в отведениях II, III и aVF происходит быстрее, чем при инфаркте миокарда [65, 71].
Иногда ТЭЛА симулирует инфаркт миокарда передне-перегородочной локализации (псевдоинфарктные изменения в отведениях V 1-V 4 ). В патогенезе таких изменений при ТЭЛА могут участвовать следующие механизмы: парадоксальная эмболия в коронарные артерии через открытое овальное окно (тогда появляется соответствующая картина при коронарографии); спазм и сдавление артериол вследствие острой перегрузки правого желудочка; выработка катехоламинов в связи с выраженной гипоксемией, что приводит к усиленной работе сердца и прогрессированию ишемии. Элевация сегмента ST также может быть связана с тяжёлым ацидозом (особенно при диабете), способствующим выходу калия в межклеточное пространство.
При гиперкалиемии элевация ST носит косонисходящий характер, что нужно учитывать в дифференциальной диагностике с повреждением миокарда, при котором отмечается горизонтальный или косовосходящий подъём ST. Для гиперкалиемии характерно также сочетание элевации ST с другими ЭКГ признаками (заострённые Т, уширение QRS, уменьшение амплитуды зубцов P).
Итак, даже при элевации сегманта ST на ЭКГ у больных с жалобами на загрудинные боли и одышку, необходимо помнить о том, что эти изменения могут быть обусловлены ТЭЛА [87].
Для иллюстрации подобных диагностических трудностей и тактики диагноза в этих случаях приводим клиническое наблюдение.
Клинический
случай 8 ![]()
В статье Wilson GT и Schaller FA [87] приводится следующее клиническое наблюдение.
Мужчина 57 лет, находясь дома, внезапно, без каких-либо предвестников потерял сознание. Он был один, сколько времени провёл в бессознательном состоянии сказать не может. После того, как пришёл в себя, почувствовал дискомфорт в области грудины и одышку. Ранее диагностировалась ИБС, однако теперь характер болевого синдрома отличался от обычного для пациента приступа стенокардии. Со слов больного, в течение последней недели он заметил повышенную утомляемость, было несколько приступов болей в грудной клетке и одышки, не связанных с физической нагрузкой.
Не курит, алкоголем не злоупотребляет, наркотики не принимает. В анамнезе ИБС, гиперлипидемия, артериальная гипертония, бронхиальная астма, почечная недостаточность. Около 3 лет назад проведено стентирование: два стента в передней межжелудочковой артерии и один – в правой коронарной артерии. Инфаркты миокарда, аритмии, инсульты отрицает. Постоянно принимает клопидогрель 75 мг/сут, аспирин 325 мг/сут, метопролол по 50 мг 2 раза в сутки, изосорбида мононитрат 60 мг/сут,лансопразол 30 мг в сутки (в связи с изжогой), амитриптилин 25 мг на ночь и циталопрам 20 мг/сут (по поводу депрессии),беклометазон дважды в день (ингяляции по поводу астмы).
Объективно: ЧСС = 116 в минуту, ритм правильный, АД 120/80 мм рт. ст., сатурация кислорода 96%. Вены шеи не расширены, ранний систолический шум умеренной интенсивности в первой точке аускультации, третий тон не выслушивается. ЧД = 22 в минуту, речевой одышки нет, трахея по средней линии, в лёгких везикулярное дыхание, проводится во все отделы, хрипов нет. Живот мягкий, безболезненный. Конечности тёплые, пульс на периферических артериях удовлетворительного наполнения, симметричный, отёков нет.
Клинический и биохимический анализы крови в норме, за исключением умеренного повышения уровня креатинина до 142 мкмоль/л. Тропонин I не поышался (0.03 нг/мл). Рентгенография грудной клетки без особенностей. На рисунке 44 представлена ЭКГ при поступлении. Отмечается синусовая тахикардия, блокада правой ножки пучка Гиса, инверсия зубца Т в правых грудных (V 1 -V 3 ) и нижних (III, aVF) отведениях. Также отмечались патологические зубцы Q в отведениях III и aVF, что расценено как признак перенесённого инфаркта миокарда нижней локализации неизвестной давности.
Р исунок
44. ЭКГ при поступлении в стационар
мужчины 57 лет с жалобами на боль в грудной
клетке и внезапную потерю сознание.
Синусовая тахикардия, блокада правой
ножки пучка Гиса, инверсия зубца Т в
правых грудных (V1 -V 3 )
и нижних (III, aVF) отведениях. Патологические
зубцы Q в отведениях III и aVF, что расценено
как признак перенесённого инфаркта
миокарда нижней локализации неизвестной
давности (заключительный диагноз –
ТЭЛА, клинический случай 8) [87].
исунок
44. ЭКГ при поступлении в стационар
мужчины 57 лет с жалобами на боль в грудной
клетке и внезапную потерю сознание.
Синусовая тахикардия, блокада правой
ножки пучка Гиса, инверсия зубца Т в
правых грудных (V1 -V 3 )
и нижних (III, aVF) отведениях. Патологические
зубцы Q в отведениях III и aVF, что расценено
как признак перенесённого инфаркта
миокарда нижней локализации неизвестной
давности (заключительный диагноз –
ТЭЛА, клинический случай 8) [87].
Диагностирована нестабильная стенокардия. Назначен гепарин 5000 ЕД болюсно с последующей инфузией 1000 ЕД в час.
Через несколько часов снова появились интенсивные загрудинные боли и одышка, аналогичные тем, что были при поступлении. После введении нитроглицерина отмечалось падение АД со 110/70 до 80/40 мм рт. ст., нитроглицерин отменён, назначена инфузионная терапия. На рисунке 45 представлена снятая в это время ЭКГ. Отмечалась элевация сегмента ST с формированием патологического зубца Q в отведениях V 1 -V 4 , а также умеренная элевация ST в отведениях III, aVF, что соответствует острой стадии инфаркта миокарда передне-перегородочной области (а также не исключает острых изменения в области рубцов по задней стенке). Уровень тропонина I вырос до 2,6 нг/мл, КФК-МВ - до 18,3 нг/мл.
Р исунок
45. Тот же случай (см. рис. 44), ЭКГ во время
болевого приступа. Элевация сегмента
ST в отведениях V1 -V 4 ,
III, aVF с формированием патологического
зубца Q в тех же отведениях, что
соответствует острой стадии Q-образующего
инфаркта миокарда передне-перегородочной
области; также нельзя исключить острые
изменения в области рубцов (по задней
стенке) (заключительный диагноз – ТЭЛА,
клинический случай 8) [87].
исунок
45. Тот же случай (см. рис. 44), ЭКГ во время
болевого приступа. Элевация сегмента
ST в отведениях V1 -V 4 ,
III, aVF с формированием патологического
зубца Q в тех же отведениях, что
соответствует острой стадии Q-образующего
инфаркта миокарда передне-перегородочной
области; также нельзя исключить острые
изменения в области рубцов (по задней
стенке) (заключительный диагноз – ТЭЛА,
клинический случай 8) [87].
Диагностирован острый инфаркт миокарда передне-перегородочной локализации. Однако при экстренной коронарографии (рис. 46) критических стенозов обнаружено не было. Все стенты оказались проходимы, отмечались умеренные стенозы передней межжелудочковой, огибающей и правой коронарной артерий.
Р исунок
46. Тот же случай (см. рис. 44). Коронарография,
выполненная на фоне боли в грудной
клетке и падения АД. Все коронарные
артерии проходимы, визуализируются
гемодинамически незначимые бляшки в
передней межжелудочковой (A), огибающей
(B) и правой коронарной (C) артериях
(заключительный диагноз ТЭЛА, клинический
случай 8) [87].
исунок
46. Тот же случай (см. рис. 44). Коронарография,
выполненная на фоне боли в грудной
клетке и падения АД. Все коронарные
артерии проходимы, визуализируются
гемодинамически незначимые бляшки в
передней межжелудочковой (A), огибающей
(B) и правой коронарной (C) артериях
(заключительный диагноз ТЭЛА, клинический
случай 8) [87].
Выполнена трансторакальная ЭхоКГ (рис. 47), при которой выявлено резкое расширение правого желудочка со смещением межжелудочковой перегородки в полость левого желудочка при сохранной глобальной систолической функции последнего и отсутствии зон гипо- и акинеза. В то же время отмечалось значительно повышение давления в правых отделах сердца, снижение сократимости правого желудочка (однако признака МакКонелла не было).
Р исунок
47. Трансторакальная ЭхоКГ больного 57
лет с клинико-электрокардиографическим
подозрением на острый Q-образующий
передне-перегородочный инфаркт миокарда,
выполненная после коронарографии, при
которой окклюзирующего поражения
коронарных артерий выявлено не было. В
двухкамерной позиции по короткой оси
(левая часть рисунка, А) определяется
дилатация правого желудочка со смещением
межжелудочковой перегородки в диастолу
влево. Компрессия левого желудочка
свидетельствует о повышении давления
в правых отделах сердца. По регургитационному
потоку на трикуспидальном клапане
(допплер-ЭхоКГ, правая часть рисунка,
B) определено повышение систолического
давления в правом желудочке до 41 мм рт.
ст. RV – правый желудочек, LV – левый
желудочек, IVS – межжелудочковая
перегородка (заключительный диагноз
ТЭЛА, клинический случай 8) [87].
исунок
47. Трансторакальная ЭхоКГ больного 57
лет с клинико-электрокардиографическим
подозрением на острый Q-образующий
передне-перегородочный инфаркт миокарда,
выполненная после коронарографии, при
которой окклюзирующего поражения
коронарных артерий выявлено не было. В
двухкамерной позиции по короткой оси
(левая часть рисунка, А) определяется
дилатация правого желудочка со смещением
межжелудочковой перегородки в диастолу
влево. Компрессия левого желудочка
свидетельствует о повышении давления
в правых отделах сердца. По регургитационному
потоку на трикуспидальном клапане
(допплер-ЭхоКГ, правая часть рисунка,
B) определено повышение систолического
давления в правом желудочке до 41 мм рт.
ст. RV – правый желудочек, LV – левый
желудочек, IVS – межжелудочковая
перегородка (заключительный диагноз
ТЭЛА, клинический случай 8) [87].
Заподозрена ТЭЛА. Учитывая почечную недостаточность, а также уже проведённое исследование с введением контрастного препарата (коронарография), от КТ-ангиографии грудной клетки было решено воздержаться. Для верификации диагноза выбрана вентиляционно-перфузионная сцинтиграфия (рис. 48), результаты которой свидетельствовали о высокой вероятности ТЭЛА: выраженное несоответствие между значительно сниженной перфузией (сегментарные и долевые дефекты перфузии) и нормальной вентиляцией с обеих сторон. Диагноз ТЭЛА был подтверждён.
Р исунок
48. Вентиляционно-перфузионная сцинтиграфия,
выполненная у мужчины 57 лет с жалобами
на боль в грудной клетке и внезапную
потерю сознания после того, как при
ЭхоКГ выявлены признаки перегрузки
правого желудочка. Множественные
двусторонние сегментарные и долевые
дефекты перфузии при перфузионной
сцинтиграфии (стрелки, левая часть
рисунка, А); на правой части рисунка (B)
представлены соответствующие нормальные
вентиляционные сцинтиграммы. Данные
свидетельствуют о высокой вероятности
ТЭЛА, диагноз подтверждён (заключительный
диагноз ТЭЛА, клинический случай 8) [87].
исунок
48. Вентиляционно-перфузионная сцинтиграфия,
выполненная у мужчины 57 лет с жалобами
на боль в грудной клетке и внезапную
потерю сознания после того, как при
ЭхоКГ выявлены признаки перегрузки
правого желудочка. Множественные
двусторонние сегментарные и долевые
дефекты перфузии при перфузионной
сцинтиграфии (стрелки, левая часть
рисунка, А); на правой части рисунка (B)
представлены соответствующие нормальные
вентиляционные сцинтиграммы. Данные
свидетельствуют о высокой вероятности
ТЭЛА, диагноз подтверждён (заключительный
диагноз ТЭЛА, клинический случай 8) [87].
Продолжены внутривенная инфузионная и гепаринотерапия, состояние больного стабилизировалось и больше не ухудшалось. Через три дня выполнена повторная ЭхоКГ (рис. 49), при которой определялась нормализация размера правого желудочка и снижение давления в лёгочной артерии.
Р исунок
49. Трансторакальная ЭхоКГ в динамике
(через 3 дня после постановки диагноза
ТЭЛА и соответствующего лечения по
сравнению с ЭхоКГ при поступлении –
рисунок 47). Двухкамерная позиция по
короткой оси (левая часть рисунка, A) –
нормализация размеров правого желудочка
с восстановлением округлой формы левого
желудочка. Систолическое давление в
правом желудочке (допплер-ЭхоКГ, правая
часть рисунка, B) снизилось до 34 мм рт.
ст. RV – правый желудочек, LV – левый
желудочек, IVS – межжелудочковая
перегородка (заключительный диагноз
ТЭЛА, клинический случай 8) [87].
исунок
49. Трансторакальная ЭхоКГ в динамике
(через 3 дня после постановки диагноза
ТЭЛА и соответствующего лечения по
сравнению с ЭхоКГ при поступлении –
рисунок 47). Двухкамерная позиция по
короткой оси (левая часть рисунка, A) –
нормализация размеров правого желудочка
с восстановлением округлой формы левого
желудочка. Систолическое давление в
правом желудочке (допплер-ЭхоКГ, правая
часть рисунка, B) снизилось до 34 мм рт.
ст. RV – правый желудочек, LV – левый
желудочек, IVS – межжелудочковая
перегородка (заключительный диагноз
ТЭЛА, клинический случай 8) [87].
На ЭКГ в динамике (рис. 50) отмечалось исчезновение «патологических» зубцов Q в передне-перегородочной области, возвращение сегмента ST на изолинию в правых грудных и нижних отведениях, нормализация проводимости. Также обращает внимание отчётливая положительная динамика зубцов Т в правых грудных отведениях. Уровень всех кардиоспецифических ферментов нормализовался.
Р исунок
50. ЭКГ через 3 дня после поступления на
фоне терапии (тот же случай, что на
рисунках 44 и 45). Отмечается исчезновение
«патологических» зубцов Q в
передне-перегородочной области, возврат
сегмента ST на изолинию в правых грудных
и нижних отведениях, нормализация
проводимости по правой ножке пучка
Гиса. Также обращает внимание отчётливая
положительная динамика зубцов Т в правых
грудных отведениях (изоэлектричны либо
двухфазны) (заключительный диагноз
ТЭЛА, клинический случай 8) [87].
исунок
50. ЭКГ через 3 дня после поступления на
фоне терапии (тот же случай, что на
рисунках 44 и 45). Отмечается исчезновение
«патологических» зубцов Q в
передне-перегородочной области, возврат
сегмента ST на изолинию в правых грудных
и нижних отведениях, нормализация
проводимости по правой ножке пучка
Гиса. Также обращает внимание отчётливая
положительная динамика зубцов Т в правых
грудных отведениях (изоэлектричны либо
двухфазны) (заключительный диагноз
ТЭЛА, клинический случай 8) [87].
Таким образом, на основании данных обследования и их динамики диагноз инфаркта миокарда исключён, подтверждено наличие ТЭЛА. Назначен варфарин 10 мг (при выписке доза варфарина составила 7,5 мг в сутки).
Учащение симптомов в течение недели и уменьшение толерантности к физической нагрузке (боли и одышка стали появляться в покое), что, по-видимому, было связано с повторными микроэмболиями, расценивалось у больного с ранее диагностированной ИБС как нестабильная стенокардия. Потеря сознания, боли в области сердца и одышка направили диагностический поиск в сторону острой коронарной патологии. В пользу этого диагноза на первый взгляд говорили изменения ЭКГ и повышение уровня кардиоспецифических ферментов. В то же время, при ретроспективном анализе исходной ЭКГ можно выявить признаки, характерные для ТЭЛА: S I Q III T III, неполная блокада правой ножки пучка Гиса, инверсия Т в правых грудных отведениях. Косонисходящий характер элевации ST на второй ЭКГ также отличается от типичного для инфаркта миокарда (косовосходящий или горизонтальный подъём). Быстрая положительная динамика ЭКГ одновременно с нормализацией размеров правого желудочка и давления в лёгочной артерии свидетельствуют в пользу связи формирования патологической ЭКГ с перегрузкой правого желудочка. Псевдоинфарктным изменениям в передне-перегородочной области также мог способствовать коронароспазм, наслоившийся на умеренные атеросклеротические изменения венечных артерий.
В пользу дисфункции правого желудочка свидетельствовала также выраженная гипотония в ответ на введение нитроглицерина. Для поддержания сердечного выброса, тем более в условиях повышенной постнагрузки, правому желудочку необходим адекватный венозный возврат (преднагрузка). Нитроглицерин расширяет вены, способствуя депонированию в них крови и уменьшению венозного возврата. Поэтому вместо ожидаемого улучшения гемодинамики (так как предполагались ишемические изменения на ЭКГ) у больного ТЭЛА нитроглицерин привёл к падению АД.
Выраженная острая перегрузка правого желудочка могла привести к ишемии и высвобождению тропонина, чем объясняется повышение его плазменного уровня.
Дифференциальная диагностика ТЭЛА и обострения ХОБЛ
Обострение ХОБЛ и немассивная ТЭЛА на фоне ХОБЛ проявляются общими неспецифичными симптомами: усилением одышки, тахикардией, возможны лихорадка, кашель, боли в грудной клетке (при обострении ХОБЛ могут быть обусловлены изнуряющим кашлем), что делает дифференциальную диагностику этих двух состояний весьма сложной. Длительное течение ХОБЛ нередко осложняется развитием хронического лёгочного сердца, декомпенсация которого вероятна как на фоне обострения ХОБЛ, так и на фоне ТЭЛА. Кроме того, ТЭЛА может наслаиваться на текущее обострение ХОБЛ [88]. По данным аутопсий у больных ХОБЛ признаки ТЭЛА обнаруживаются в 20-51% случаев. К факторам, предрасполагающим к развитию ТЭЛА у больных ХОБЛ, относятся: сor pulmonale с наличием муральных тромбов в правом желудочке, нарушения агрегации тромбоцитов и фибринолиза, полицитемия, снижение уровня физической активности, системная воспалительная реакция организма, приём кортикостероидов и курение [88, 89]. Согласно рекомендациям GOLD (глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких) при обострении ХОБЛ должна проводится профилактика тромбоза глубоких вен (механические устройства, гепарины и т.д.) при обездвиженности, полицитемии или дегидратации пациентов как при наличии, так и при отсутствии тромбоэмболий в анамнезе [90].
По данным нескольких исследований, у одного из четырёх больных с атипичным обострением ХОБЛ (усиление одышки без кашля, увеличения количества мокроты и лихорадки) причиной усиления одышки является ТЭЛА. Если принять во внимание, что при развитии ТЭЛА прогноз ХОБЛ существенно ухудшается, а оставленная без лечения ТЭЛА заканчивается летально в 25-30% случаев, важность дифференциальной диагностики обострения ХОБЛ и ТЭЛА становится очевидной (таблица 20).
При сборе анамнеза у больных с подозрением на ТЭЛА обращают внимание на возможные факторы риска; обострению ХОБЛ часто предшествует переохлаждение, ОРВИ, воздействие аэрополлютантов. Для типичного инфекционного обострения ХОБЛ характерно усиление кашля с увеличением количества мокроты и её «гнойности» (мокрота зелёного цвета), что отличает течение обострения от ТЭЛА.
Физикальные данные – небольшой помощник в дифференциации обострения ХОБЛ и ТЭЛА. Эмфизематозная грудная клетка, ослабленное дыхание при аускультации и коробочный перкуторный звук характерен для всех больных ХОБЛ независимо от причины нарастания одышки. Как обострение, так и ТЭЛА могут сопровождаться появлением различных хрипов (и сухих, и влажных). Хотя свистящее дыхание более характерно для обострения ХОБЛ, присоединение бронхоспазма и свистящих хрипов возможно и при ТЭЛА, особенно на отягощённом фоне. Усиление гиперинфляции лёгких при обострении ХОБЛ в 15% случаев сопровождается исчезновением сердечной тупости, что не характерно для ТЭЛА, однако интерпретация этого признака часто затруднена невозможностью сравнения с данными до ухудшения [88].
Ошибки в диагностике могут возникать даже при массивной ТЭЛА у больных, страдающих артериальной гипертензией, кардиальной патологией и ХОБЛ. Связывая усиление одышки с повышением АД, больные порой принимают высокие дозы гипотензивных препаратов, в результате чего артериальную гипотонию при поступлении врач расценивает, как медикаментозную. Стойкая гипотония, несмотря на проводимую инфузионную терапию, в сочетании с тяжёлой, резистентной к бронхолитикам и кортикостероидам одышкой могут быть проявлением ТЭЛА. В таких случаях игнорирование динамики клинической картины и отказ от пересмотра диагностической концепции фатальны для больного.
Рентгенография грудной клетки (в передней и боковой проекциях) применяется для выявления альтернативного диагноза (пневмония, пневмоторакс, плевральный выпот, отёк лёгких), который может обусловливать симптомы обострения. При том, что интерпретация анамнеза и физикальных данных часто затруднена, особенно если гиперинфляция лёгких скрывает сопутствующие симптомы сердечных заболеваний, многие проблемы могут быть разрешены с помощью рентгенографии грудной клетки и ЭКГ. ЭКГ помогает в диагностике гипертрофии правого желудочка, аритмий и эпизодов ишемии. Тромбоэмболию легочной артерии бывает очень трудно отличить от обострения ХОБЛ, особенно при тяжелых формах заболевания, так как гипертрофия правого желудочка и широкие ветви легочной артерии могут приводить к неправильной интерпретации результатов ЭКГ и рентгеновского исследования.
Лучшими
методами выявления тромбоэмболии
легочной артерии у больных ХОБЛ являются
спиральная КТ, ангиопульмонография и,
возможно, определение D-димера, в то
время как оценка вентиляционно-перфузионного
отношения не дает полезной информации.
Подозревать тромбоэмболию легочной
артерии следует также при низком
артериальном давлении и невозможности
увеличить РаO2 выше 8 кПа (60 мм рт. ст.),
несмотря на высокопоточную кислородотерапию
[90]. ![]()
Гипоксемия свойственная обоим состояниям. Парциальное напряжение кислорода в артериальной крови при обострении ХОБЛ зачастую повышается на фоне ингаляций кислорода. При массивной ТЭЛА вследствие открытия право-левых шунтов (внутрисердечных и внутрилёгочных) гипоксемия может оставаться рефрактерной к кислородотерапии. При тяжёлом обострении ХОБЛ возможно развитие гиперкапнии, в то время как для ТЭЛА более характерна тенденция к гипокапнии.
Наличие ХОБЛ у пациента не влияет на чувствительность и специфичность D-димера в диагностике ТЭЛА . Для изолированного обострения ХОБЛ повышение уровня D-димера не характерно, нормальное значение его при клинически низкой вероятности ТЭЛА исключает эмболию. В то же время, переоценивать положительные результаты анализа с учётом низкой специфичности D-димера не стоит. Оценка уровня D-димера у больных ХОБЛ должна проводится в соответствии с общим алгоритмом диагностики ТЭЛА в зависимости от клинической вероятности диагноза .
Уровень мозгового натрий-уретического пептида может повышаться как при обострении ХОБЛ, так и при ТЭЛА вследствие дисфункции правого желудочка, а также во всех случаях левожелудочковой недостаточности. Повышение уровня сердечных тропонинов для неосложнённого течения ХОБЛ нехарактерно, в таких случаях следует исключать инфаркт миокарда и ТЭЛА (см. раздел « стратификация риска и прогноз »).
Наличие у больного ХОБЛ с усилением одышки признаков ТГВ при дуплексном УЗИ глубоких вен с компрессионными пробами свидетельствует в пользу ТЭЛА и обосновывает назначение антикоагулянтов. Предлагается при подозрении на ТЭЛА у больных с неоднозначной клинической картиной проводить УЗИ глубоких вен в качестве первого метода исследования.
Качество визуализации при ЭхоКГ у больных ХОБЛ снижено за счёт гиперинфляции лёгких. Формирование лёгочного сердца обусловливает неспецифические изменения правых отделов как при обострении ХОБЛ, так и при ТЭЛА. Показательным может быть выявление гипо- акинеза левого желудочка (инфаркт миокарда в качестве альтернативного диагноза), а также выявление тромбов в правом желудочке (что будет свидетельствовать в пользу ТЭЛА).
При
наличии ХОБЛ информативность
вентиляционно-перфузионной сцинтиграфии
лёгких для диагностики ТЭЛА существенно
снижается. ![]()
Это связано с тем, что для больных ХОБЛ характерны нарушения вентиляции, затрудняющие интерпретацию выявляемого вентиляционно-перфузионного дисбаланса, поэтому получаемые сцинтиграммы часто не позволяют сделать определённое диагностическое заключение. Процент недиагностических результатов (промежуточная и низкая вероятность ТЭЛА) вентиляционно-перфузионного сканирования при ХОБЛ очень высок (90%) [91]. Вентиляционно-перфузионная сцинтиграфия сохраняет значение в группе больных, страдающих почечной недостаточностью (креатинин более 130 мкмоль/л, что соответствует 1.5 мг/дл), которым противопоказано введение рентгеноконтрастных препаратов. Высокая вероятность ТЭЛА по результатам V/Q сканирования подтверждает диагноз, другие результаты требуют дообследования [88]. В программе GOLD выполнение вентиляционно-перфузионной сцинтиграфии для дифференциальной диагностики обострений ХОБЛ не рекомендуется [90].
Золотым стандартом диагностики при подозрении на ТЭЛА у больных ХОБЛ, также как и в общей популяции, являются КТ-ангиография грудной клетки и ангиопульмонография, которые при отсутствии противопоказаний должны выполняться во всех неясных случаях.
Часто диагностике помогает лечение по программе обострения ХОБЛ ex juvantibus. Неэффективность массивной бронхолитической терапии (бета2-агонисты и холинолитики, метилксантины) в сочетании с кортикостероидами и антибиотиками должны направить диагностический поиск в сторону выяснения альтернативного диагноза [88].
Таблица
20. Дифференциальная диагностика
обострения ХОБЛ и ТЭЛА на фоне ХОБЛ. ![]()
|
Признак |
ТЭЛА на фоне ХОБЛ |
Обострение ХОБЛ |
|
Анамнез |
Факторы риска ТЭЛА: ТГВ в анамнезе, онкологические заболевания, большие операции, длительный постельный режим, гиподинамия и др. |
Переохлаждение, ОРВИ за 1-2 недели до обострения, воздействие атмосферных поллютантов. |
|
Клиника |
Продуктивный кашель и лихорадка не характерны («атипичное обострение») |
Характерно усиление кашля, увеличение количества и «гнойности» мокроты. |
|
Физикальные данные |
Возможен асимметричный отёк голеней. |
Возможно исчезновение сердечной тупости за счёт гиперинфляции лёгких. |
|
Артериальная гипотония |
Характерна для массивной ТЭЛА. |
Нехарактерна. |
|
Газы крови |
Гипоксемия, резистентная к кислородотерапии при включении право-левых шунтов; характерна гипокапния (особенно показательна при тенденции к гиперкапнии ранее). |
Гипоксемия с хорошим ответом на ингаляции кислорода; при тяжёлом обострении возможна гиперкапния. |
|
D-димер |
Повышение уровня (требуется комплексная оценка в совокупности с клинической вероятностью ТЭЛА) |
Нормальные значения при неосложнённом течении. |
|
Повышение уровня сердечных тропонинов |
Возможно (плохой прогностический признак), при этом необходимо исключение ТЭЛА и инфаркта миокарда. |
Для неосложнённого течения нехарактерно. |
|
Выявление ТГВ при дуплексном УЗИ глубоких вен с компрессионными пробами |
Свидетельствует в пользу ТЭЛА и достаточно для назначения антикоагулянтов. |
Для неосложнённого течения нехарактерно. |
|
V/Q сцинтиграфия (проведение обосновано при почечной недостаточности, которая является противопоказанием к проведению исследований с внутривенным введением контрастных препаратов). |
Только высокая вероятность ТЭЛА по данным V/Q сканирования в сочетании с клинически высокой вероятностью подтверждает диагноз. |
Неинформативный метод диагностики. |
|
КТ-ангиография грудной клетки, ангиопульмонография. |
Визуализируются тромбы в ветвях лёгочной артерии. |
Лёгочные артерии проходимы. |
|
Эффективность терапии обостренвия ХОБЛ ex juvantibus (бронхолитики, кортикостероиды, антибиотики) |
Небольшой эффект или его отсутствие. |
Терапия эффективна. |
Приводим клиническое наблюдение, иллюстрирующее сложности диагностики ТЭЛА у больных с сочетанной соматической патологией.
Клинический
случай 9 ![]()
В статье Stebbings и Lim [91] приводится следующее клинической наблюдение. Страдающий ХОБЛ 81-летний мужчина поступил в стационар с жалобами на усиление одышки и кашель с отхождением гнойной мокроты в течение 2 недель. Три года назад перенёс операцию – удаление верхней и средней долей правого лёгкого по поводу аденокарциномы лёгкого. Также имеются анамнестические указания на левожелудочковую недостаточность.
При осмотре: речевая одышка (говорит короткими предложениями). ЧСС = 88 в минуту, АД = 100/70 мм рт. ст., температура 37ºС, ЧДД = 30/мин. При аускультации лёгких дыхание диффузно ослаблено, в нижних отделах слева мелкопузырчатые хрипы. При объективном исследовании сердца, живота и нервной системы патологии не выявлено.
Лабораторные данные: клинический анализ крови без особенностей; газы крови: pH = 7.43, PaCO 2 = 38 мм рт. ст., PaO 2 = 42 мм рт. ст. Показатели функции почек и электролиты в норме. Рентгенография грудной клетки: лёгочные поля повышенной прозрачности, небольшой плевральный выпот слева. ЭКГ – признаки гипертрофии правого желудочка. Посев мокроты роста патогенов не дал.
Диагностировано обострение ХОБЛ. Назначены бронходилататоры, антибиотики, преднизолон per os. Достигнуто незначительно улучшение, которое заключалось только в уменьшении «гнойности» мокроты. Неделю спустя всё ещё сохранялась выраженная одышка, пароксизмально усиливавшаяся по ночам. Сохранялось тахипноэ 28 в минуту, артериальная гипотония 90/60 мм рт. ст., ЧСС = 88 в минуту. В лёгких ослабленное дыхание, однако хрипы в нижних отделах исчезли. Повторная рентгенография грудной клетки – без динамики. Газы крови при дыхании воздухом: : pH = 7.43, PaCO 2 = 36 мм рт. ст., PaO 2 = 51 мм рт. ст. (персистирующая гипоксемия).
Учитывая отсутствие эффекта от стандартной терапии обострения ХОБЛ, стойкую артериальную гипотонию и гипоксемию, заподозрена ТЭЛА. При КТ грудной клетки с контрастным усилением выявлен дефект наполнения в правой основной лёгочной артерии. Диагноз ТЭЛА подтверждён.
Дифференциальная диагностика ТЭЛА, пневмонии и плевритов
Наиболее часто в практике из поражений респираторной системы, имеющих подобную ТЭЛА клинику, встречаются пневмония и плеврит. Поэтому врач любой специальности обязан хорошо распознавать их. Так, при плеврите обращает на себя внимание длительная локальная боль, усиливающаяся при кашле и глубоком дыхании. Как правило, накануне развития пневмонии и/или плеврита больной перенёс ОРВИ и подвергся переохлаждению. Есть признаки интоксикации: слабость, потливость, снижение аппетита и жажда, лихорадка. При осмотре может отмечаться асимметричная экскурсия грудной клетки, усиление голосового дрожания на стороне поражения (при пневмонии; присоединение плеврального выпота приводит к ослаблению голосового дрожания). Притупление перкуторного звука над областью инфильтрации или жидкости. Аускультативно при пневмонии локально выслушивается бронхиальное дыхание, возможно появление крепитации и влажных хрипов. Документирует клинику рентгенологическая картина инфильтрации и/или плеврального выпота. При правильной антибиотикотерапии диагноз дополнительно подтверждается ex juvantibus регрессом клинических симптомов пневмонии [62].
Инфаркт-пневмония и плевральный выпот – возможные осложнения ТЭЛА, таким образом, пневмония и плеврит – частые её маски. Особенно подозрительно развитие рецидивирующих, чаще двусторонних плевритов неясной этиологии или рецидивирующих «очаговых пневмоний» [65] (клинические случаи 1, 2 , 7 ). Поэтому при наличии факторов риска ТЭЛА и высокой клинической вероятности для исключения ТЭЛА у больного с «пневмонией» или «плевритом» необходимо проводить обследование в соответствии с алгоритмами диагностики ТЭЛА .
Дифференциальная диагностика ТЭЛА, пневмоторакса и астматического статуса
Таблица 21. Дифференциальная диагностика ТЭЛА, астматического статуса и пневмоторакса [62 с изменениями].
|
Признаки |
ТЭЛА |
Астматический статус |
Пневмоторакс |
|
Клинический фон |
Флеботромбоз, хронический тромбофлебит, послеоперационный период, сердечно-сосудистая патология, онкологическое заболевание, длительный постельный режим, гиподинамия. |
Бронхиальная астма (БА) в анамнезе; передозировака бета-агноистов; неадекватная стероидная терапия или синдром отмены; экспозиция аллергена. |
Локальные изменения в лёгких после специфических и неспецифических воспалительных заболеваний, буллёзная эмфизема, травма, кистозная гипоплазия и т.д. Астеническая конституция. |
|
Характер морфологических изменений |
Окклюзия тромбом ветвей лёгочной артерии. |
Механизм: бронхообструктивный синдром. |
Дефекты плевры (разрыв). |
|
Положение больного |
Обычно горизонтальное. |
Сидячее, полусидячее. |
Сидячее, полусидячее. |
|
Боль в груди |
Часто |
Зачастую нет (возможно чувство стеснения в груди; мышечные боли) |
Всегда! |
|
Удушье |
Есть периодически; может нарастать; инспираторное. |
Есть экспираторное. |
Есть при напряжённом пневмотораксе. |
|
Цианоз |
Пепельный; при массивной ТЭЛА – чугунный цианоз верхней половины туловища и лица. |
Может быть тёплый, диффузный. |
Может быть. |
|
АД |
Снижено |
Норма или повышено |
Снижено |
|
Физикальные данные |
Признаки острого лёгочного сердца; со стороны лёгких в первые дни (до развития инфаркта лёгкого) зачастую нет никаких изменений. |
Эмфизематозная грудная клетка, участие в дыхании вспомогательной мускулатуры, коробочный перкуторный звук над лёгкими, свистящие хрипы (в крайне тяжёлых случаях – немое лёгкое). |
Ассимметрия грудной клетки (выбухание поражённой половины), ослабление голосового дрожания на стороне поражения, тимпатический перкуторный звук, ослабление дыхания. |
|
Рентгенологическая картина |
Выбухание лёгочного конуса, зоны олигемии, дисковидные ателектазы, фокусы уплотнения, реакция плевры. |
Острая эмфизема, низкое стояние купола диафрагмы с обеих сторон. |
Отсутствие лёгочного рисунка, коллабированное лёгкое, смещение средостения в противоположную сторону, уплощение купола диафрагмы на стороне поражения. |
Дифференциальная диагностика ТЭЛА, приступов сердечной и бронхиальной астмы
Таблица 22. Дифференциальная диагностика ТЭЛА, приступов сердечной и бронхиальной астмы [62 с изменениями].
|
Признак |
ТЭЛА |
Сердечная астма |
Бронхиальная астма |
|
Анамнез |
Тромбофлебит, гиподинамия и др. факторы риска ТЭЛА |
Болезни сердца, артериальная гипертензия, хроническая сердечная недостаточность |
Болезни лёгких, атопия, отягощённая по аллергическим заболеваниеям наследственность |
|
Внешний вид и окраска кожи |
Пепельный (или чугунный) цианоз. |
Акроцианоз, периферические отёки. |
Диффузный тёплый цианоз, гипогидратация тканей. |
|
Кисти и стопы. |
Холодные. |
Чаще холодные. |
Тёплые. |
|
Положение тела. |
Чаще сидя или лёжа. |
Только сидя (ортопноэ) |
Стоя или сидя с упором на руки. |
|
Одышка. |
Инспираторная. |
Инспираторная. |
Экспираторная. |
|
Аускультация |
Акцент и расщепление II тона над ЛА. |
Влажные хрипы. |
Выдох удлинён, свистящие хрипы. |
|
Мокрота. |
Изредка с кровью (в поздние сроки) |
Обильная розовая при развитии отёка лёгких |
Скудная, стекловидная, иногда жёлтая за счёт эозинофилов, отходит при улучшении состояния; спирали Куршмана, кристаллы Шарко-Лейдена при микроскопии. |
|
АД |
Снижается вплоть до шока в самом начале болезни. |
Бывает повышено. |
Часто повышено, особенно во время приступа удушья. |
|
Нитроглицерин |
Противопоказан. |
Улучшает состояние. |
Не влияет на характер дыхания, бронхообуструкцию и состояние. |
|
Рентгенография грудной клетки |
Выбухание лёгочного конуса, зоны олигемии, дисковидные ателектазы, фокусы уплотнения, реакция плевры. |
Кардиомегалия, застой по малому кругу. |
Возможна эмфизема либо без изменений. |
|
ЭКГ |
Признаки перегрузки правых отделов сердца. |
Характерна для заболевания, вызвавшего острую левожелудочковую недостаточность. |
Возможны признаки перегрузки правых отделов (при длительном анамнезе астмы). |
|
Функция внешнего дыхания |
Нет типичных изменений. |
Нет типичных изменений. |
Бронхообструкция. |
Дифференциальная диагностика ТЭЛА и тромбоза легочной артерии
Таблица 23. Дифференциальная диагностика ТЭЛА и тромбоза лёгочной артерии [62].
|
Критерии |
ТЭЛА |
Тромбоз лёгочной артерии |
|
Клинический фон |
ТГВ. Послеоперационный пероид, длительный постельный режим, гиподинамия, сердечно-сосудистая патология и др. факторы риска |
Тяжёлая сердечная декомпенсация; торакальные операции. Пневмония, вызванная палочками Фридлендера, ХОБЛ, (особенно при обострении, вызванном вазотропными вирусами). Системные гранулёматозы, некротизирующие васкулиты, узелковый полиартериит, гранулёматоз Вегенера. Болезнь Бюргера – рецидивирующий прогрессирующий тромбофлебит. Рецидивирующая ТЭЛА. |
|
Клиническое течение |
Острое, рецидивирующее. |
Вялое, подострое. |
|
Одышка |
Часто приступообразная |
Постоянная, нарастающая. |
|
Аускультация |
При развитии инфаркта - локальные изменения в соответствующей зоне, часто шум трения плевры. |
Выраженные изменения (за счёт предшествующей патологии). |
|
Изменения на рентгенограмме. |
Закономерная динамика |
Стабильность зоны поражения, преимущественно изменения корня лёгкого с одной стороны. |
|
Изменения на ЭКГ |
Регрессирующая динамика острого лёгочного сердца. |
Нарастание перегрузки правых отделов сердца. |
Дифференциальная диагностика ТЭЛА и расслаивающей аневризмы аорты
В случае встречи врача с клиникой расслаивающей аневризмы аорты надо помнить, что этому заболеванию больше всех подвергнуты гипертоники пожилого и старческого возраста, а также больные синдромом Марфана (пролапс митрального, аортального клапанов, миопия свыше 4 диоптрий, подвывихи хрустилика, гетерохромия радужки, астигматизм; паукообразные пальцы; дизрафический статус). Обращает на себя внимание длительная, очень интенсивная боль в области сердца, мигрирующая, она иррадиирует в межлопаточную область, и при этом на ЭКГ отсутствуют признаки инфаркта миокарда. Появляются симптомы острого кровотечения: прогрессирующее снижение показателей гемоглобина, эритроцитов и гематокрита. Уточнению диагноза способствуют рентгенография грудной клетки, ЭхоКГ, КТ и МРТ [52, 62].
Дифференциальная диагностика ТЭЛА и «острого живота»
Подобной клинике ТЭЛА может быть картина язвенной болезни желудка и/или двенадцатиперстной кишки (особенно осложнённых), панкреатита, холецистита ( клинический случай 6 ). Но хорошо собранный анамнез, выполнение рентгеноконтрастного или эндоскопического исследований при язвенной болезни, УЗИ, повышение амилазы в крови и диастазы в моче при панкреатите, прямого билирубина, ГГТП, ЩФ, воспалительные изменения клинического анализа крови – при холецистите позволяют отвергнуть ТЭЛА [62].
Дифференциальная диагностика ТЭЛА и нетромботических эмболий легочной артерии
Общие положения
При нетромботической эмболии нет стереотипной клинической картины. Эмболия может быть вызвана разными субстанциями (септические и жировые эмболы, воздух (или другой газ), инородные тела, тальк, околоплодные воды, раковые клетки и др.) и проявляется широким спектром клинических симптомов, поэтому диагноз установить трудно. Гемодинамические нарушения при нетромботической эмболии характеризуются средней степенью тяжести (кроме жировой, воздушной эмболии и эмболии околоплодными водами). Лечение - посиндромное, зависит от вида эмболии и тяжести течения.
Септическая эмболия
Септическая эмболия в малом круге кровообращения встречается довольно редко (рис. 51, 52). Чаще всего септические эмболы формируются при эндокардите трёхстворчатого клапана (главным образом у инъекционных наркоманов), инфицировании венозных катетеров и водителей ритма, у больных с периферическим септическим тромбофлебитом или после трансплантации органов. К типичным клиническим проявлениям относятся лихорадка, кашель и кровохарканье. Обычно эффективна антибиотикотерапия, но иногда необходимо хирургическое удаление источника эмболизации [41].
Рисунок
51. Рентгенограмма грудной клетки.
Септическая эмболия у 28-летнего
инъекционного наркомана, страдающего
ВИЧ. ![]()
В повторных посевах крови рост Nocardia.
Множество полостных образований в обоих
лёгких [77].
повторных посевах крови рост Nocardia.
Множество полостных образований в обоих
лёгких [77].
Рисунок
52. КТ грудной клетки (толщина среза 10
мм) того же больного см. рис. 51). ![]()
С осуды
впадают непосредственно в абсцессы
[77].
осуды
впадают непосредственно в абсцессы
[77].
Эмболия внутрисосудистыми инородными телами
К внутрисосудистым инородным телам, которые могут попадать в легочные артерии, относятся фрагменты венозных катетеров (рис. 53, 54) и проводников, кава-фильтры, реже – эмболизационные спирали и внурисосудистые стенты. В легочных артериях инородные тела обнаруживают чаще, чем в правых отделах сердца и в полых венах. Обычно с помощью специальных устройств инородные тела удаётся извлечь эндоваскулярно [41].
Рисунок
53. Фрагмент рентгенограммы грудной
клетки женщины 60 лет. ![]()
Э мболия
катетера в лёгочную артерию. В нижней
доле левого лёгкого определяется катетер
(стрелка) [77].
мболия
катетера в лёгочную артерию. В нижней
доле левого лёгкого определяется катетер
(стрелка) [77].
Рисунок
54. Тот же случай (см. рис. 53). КТ грудной
клетки (толщина среза 10 мм). ![]()
Ф рагмент
центрального венозного катетера в
нижней доле левого лёгкого [77].
рагмент
центрального венозного катетера в
нижней доле левого лёгкого [77].
Жировая эмболия
Среди нетромботических наиболее часто встречается жировая эмболия (поступление нейтрального жира в венозную кровь вследствие перелома крупных трубчатых костей, травматического повреждения жировой ткани, печени), приводящая к гибели большого процента больных (рис. 55, 56). Синдром жировой эмболии проявляется комплексом дыхательных, гематологических, неврологических и кожных симптомов, а также признаками, связанными с травмой и другими хирургическими или терапевтическими заболеваниями. Распространенность этого клинического синдрома не велика, в то же время при переломах длинных трубчатых костей жировая эмболия практически неизбежна. Возможно молниеносное течение с развитием правожелудочковой недостаточности и сердечно-сосудистого коллапса. Однако чаще клиническая картина разворачивается постепенно: через 12–36 часов после травмы появляются гипоксемия, неврологическая симптоматика, лихорадка. Могут развиться острые психические отклонения вплоть до делирия, коматозное состояние. Остальные клинические признаки аналогичны ТЭЛА (одышка, тахикардия и т.д.). Вследствие обструкции артерий малого калибра макроагрегатами жира развивается токсический васкулит (токсическое действие жирных кислот на стенки сосудов) с вторичным тромбозом – образуются фибрин-тромбоцитарные тромбы. Рентгенологические и физикальные данные укладываются в картину респираторного дистресс-синдром взрослых. Характерны анемия, тромбоцитопения, петехиальные высыпания – часто на коже грудной клетки и рук. Жировая эмболия возникает и вследствие других причин: липосакции, инфузии жировых эмульсий и пропофола, у пациентов с жировой дистрофией печени и печёночными некрозами.
Патогенез синдрома жировой эмболии еще до конца не выяснен. Лечение неспецифическое [41, 62].
Рисунки
55 и 56. Рентгенограмма и КТ грудной клетки
58-летней женщины, которой за несколько
дней до поступления была сделана
внутримышечная инъекция (в ягодицу)
жировой эмульсии. ![]()
Р исунок
55. Рентгенограмма грудной клетки.
Изменения на рентгенограмме связаны с
жировой эмболией лёгочной артерии. С
обеих сторон обширные зоны пониженной
прозрачности по типу матового стекла
[77].
исунок
55. Рентгенограмма грудной клетки.
Изменения на рентгенограмме связаны с
жировой эмболией лёгочной артерии. С
обеих сторон обширные зоны пониженной
прозрачности по типу матового стекла
[77].
Р исунок
56. КТ грудной клетки той же больной (см.
рис. 55). Множественные очаги пониженной
прозрачности по типу матового стекла,
уплотнения. Через 10 дней все изменения
редуцировались [77].
исунок
56. КТ грудной клетки той же больной (см.
рис. 55). Множественные очаги пониженной
прозрачности по типу матового стекла,
уплотнения. Через 10 дней все изменения
редуцировались [77].
Воздушная эмболия
Воздушная эмболия представляет собой проникновение воздуха (или экзогенных газов) из операционной раны или других ворот в венозное или артериальное сосудистое русло, приводящее к развитию системных нарушений (рис. 57). Заболеваемость и смертность вследствие воздушной эмболии напрямую зависят от скорости поступления и объёма воздуха. Для взрослого смертельный объем воздуха составляет 200–300 мл или 3–5 мл/кг при введении со скоростью 100 мл/с.
Основным звеном патогенеза воздушной эмболии является обструкция выходного тракта правого желудочка или лёгочных артериол смесью воздушных пузырьков и нитей фибрина, которые формируются в сердце. Клинически напоминает ТЭЛА остротой развития. Характерны анамнез, «шум мельничного колеса» над областью сердца, Развивается сердечно-сосудистая недостаточность. Целью лечения в таких случаях является предотвращение дальнейшего поступления воздуха, по возможности уменьшение объёма уже попавшего газа и гемодинамическая поддержка.
При подозрении на воздушную эмболию больного необходимо уложить на левый бок вниз головой – при таком положении отмечается быстрое улучшение состояния. Иногда большие пузыри воздуха удаётся аспирировать с помощью иглы. В ряде клинических случаев воздушной эмболии получен хороший эффект от гипербарической оксигенации, особенно при попадании газа в мозговые артерии [41, 62].
Рисунок
57. КТ грудной клетки с контрастным
усилением (толщина среза 5 мм). Мужчина
55 лет. Пациент не предъявлял жалоб. ![]()
С лучайной
находкой явились два пузырька воздуха
в стволе лёгочной артерии (стрелка)
[77].
лучайной
находкой явились два пузырька воздуха
в стволе лёгочной артерии (стрелка)
[77].
Эмболия околоплодными водами
Эмболия околоплодными водами - редкое, но крайне тяжелое осложнение беременности, встречается в одном случае на 8000–80000 беременностей (рис. 58, 59). Уровень материнской смертности и смертности плода - 80 и 40% соответственно. Клинические проявления колеблются от незначительных органных дисфункций до развития ДВС (амниотическая жидкость является мощным тромбопластическим фактором, что ведёт к тромбозам в различных участках сосудистого русла), шока и смерти.
Это осложнение развивается вследствие попадания околоплодных вод в кровоток через разрывы маточных вен во время физиологических родов или кесарева сечения. Внезапно появляются одышка, цианоз, развиваются отёк лёгких и шок. Патофизиология эмболии околоплодными водами многопланова и до конца не изучена. Диагноз устанавливается методом исключения, лечение симптоматическое [41, 62].
Рисунки
58 и 59. Рентгенограммы грудной клетки
женщины 40 лет. Вскоре после кесарева
сечения развился острый респираторный
дистресс-синдром взрослых. ![]()
Р исунок
58. Рентгенография грудной клетки.
Распространённая двусторонняя
инфильтрация, больная интубирована
(эмболия лёгочной артерии околоплодными
водами) [77].
исунок
58. Рентгенография грудной клетки.
Распространённая двусторонняя
инфильтрация, больная интубирована
(эмболия лёгочной артерии околоплодными
водами) [77].
Р исунок
59. Рентгенограмма грудной клетки. Тот
же случай (см. рис. 58) 3 дня спустя.
Выраженность инфильтрации уменьшилась.
В правой плевральной полости дренаж
[77].
исунок
59. Рентгенограмма грудной клетки. Тот
же случай (см. рис. 58) 3 дня спустя.
Выраженность инфильтрации уменьшилась.
В правой плевральной полости дренаж
[77].
Эмболия тальком
Такие вещества, как тальк, крахмал и целлюлоза, используются в качестве фильтров при производстве лекарств. Некоторые из этих препаратов, предназначенных для перорального применения (амфитамины, метилфенидат, гидроморфон, декстропропоксифен) наркоманы крошат, растворяют и вводят внутривенно. Маленькие их частицы попадают в легочные сосуды, вызывают тромбоз и формирование внутрисосудистой гранулемы [41] (рис. 60-63).
Рисунки
60-63. Рентгенограммы и КТ грудной клетки
женщина 26 лет с 4-летним анамнезом
внутривенного употребления героина и
метадона. ![]()
Р исунок
60. Фрагмент рентгенограммы грудной
клетки. Эмболия тальком. Множественные
мелкие очаги уплотнения [77].
исунок
60. Фрагмент рентгенограммы грудной
клетки. Эмболия тальком. Множественные
мелкие очаги уплотнения [77].
Р исунок
61. Тот же случай (см. рис. 60). КТ грудной
клетки. Множественные билатеральные
очаги повышенной плотности [77].
исунок
61. Тот же случай (см. рис. 60). КТ грудной
клетки. Множественные билатеральные
очаги повышенной плотности [77].
Р исунок
62. Тот же случай (см. рис. 60, 61). Рентгенограмма
грудной клетки 6 лет спустя. Сливные
участки повышенной плотности
(прогрессирующий фиброз) в средних
отделах лёгочных полей (стрелки).
Эмфизематозные изменения верхушки
правого лёгкого [77].
исунок
62. Тот же случай (см. рис. 60, 61). Рентгенограмма
грудной клетки 6 лет спустя. Сливные
участки повышенной плотности
(прогрессирующий фиброз) в средних
отделах лёгочных полей (стрелки).
Эмфизематозные изменения верхушки
правого лёгкого [77].
Р исунок
63. Тот же случай (см. рис. 60-62). КТ грудной
клетки, толщина среза 1.5 мм. В задних
отделах с обеих сторон определяются
сливные очаги повышенной плотности
(фиброз), содержащие включения ещё
большей плотности (стрелка) – тальк
[77].
исунок
63. Тот же случай (см. рис. 60-62). КТ грудной
клетки, толщина среза 1.5 мм. В задних
отделах с обеих сторон определяются
сливные очаги повышенной плотности
(фиброз), содержащие включения ещё
большей плотности (стрелка) – тальк
[77].
Эмболия опухолевыми клетками
В 26% случаев при вскрытии умерших от рака встречается эмболия лёгочной артерии опухолевыми клетками, однако при жизни это состояние диагностируется очень редко (рис. 64, 65). Рентгенологически картина напоминает пневмонию, туберкулез или интерстициональные заболевания легких. Внутрисердечные опухоли-источники эмболии доступны визуализации. Чаще всего опухолевые эмболии лёгочной артерии развиваются при опухолях простаты и молочных желёз, гепатоме, раке желудка и поджелудочной железы. К сожалению, вопросы лечения данного состояния не разрабатывались, так как чаще всего диагноз устанавливают посмертно. Есть данные об успешных результатах химиотерапии [41].
Рисунки
64 и 65. Опухолевая эмболия лёгочной
артерии при холангиокарциноме у мужчины
62 лет. ![]()
Р исунок
64. КТ грудной клетки (толщина среза 1.5
мм). Клиновидный очаг повышенной
плотности, основанием обращённый к
плевре (широкие стрелки) и множество
мелких очагов (тонкие стрелки) [77].
исунок
64. КТ грудной клетки (толщина среза 1.5
мм). Клиновидный очаг повышенной
плотности, основанием обращённый к
плевре (широкие стрелки) и множество
мелких очагов (тонкие стрелки) [77].
Р исунок
65. Тот же случай (см. рис. 64). Микрофотография
биоптата, полученного при торакоскопии
(окраска гематоксилин-эозин).
Внутрисосудистые опухолевые эмболы
(тонкая стрелка), окружённые инфарцированной
тканью лёгкого (толстые стрелки) [77].
исунок
65. Тот же случай (см. рис. 64). Микрофотография
биоптата, полученного при торакоскопии
(окраска гематоксилин-эозин).
Внутрисосудистые опухолевые эмболы
(тонкая стрелка), окружённые инфарцированной
тканью лёгкого (толстые стрелки) [77].
Редкие виды эмболии
К редким случаям нетромботической эмболии относятся: хлопковая, эхинококковая эмболии, эмболия йодированным маслом (используется при лимфангиографии, хемоэмболизации при гепатоцеллюлярной карциноме), цементная эмболия (полиметилметакрилатом – используется при чрескожной вертебропластике). Для этих эмболий характерна разнообразная симптоматика [41, 77].
ЛЕЧЕНИЕ
Общие положения, цели и задачи лечения
При подозрении на ТЭЛА всех пациентов госпитализируют в реанимационное отделение или по возможности в стационар, имеющий отделение сосудистой хирургии. Транспортировка лёжа на носилках с приподнятым головным концом, предпочтительно на реанимобиле [5]. В нескольких исследованиях обсуждалась возможность амбулаторного лечения ТЭЛА, однако ни в одном из них не проводилась рандомизация больных на группы лечения в стационаре или на дому. Надо полагать, такой подход возможен в отдельных случаях ТЭЛА низкого риска [41].
Цель лечебных мероприятий при ТЭЛА заключается в нормализации или улучшении префузии лёгких, предотвращении развития тяжёлой хронической лёгочной гипертензии.
Этого можно достичь:
Подавлением тромбообразования.
Активацией лизиса тромбоэмболов.
Предотвращением дальнейшего тромбообразования.
Посиндромным лечением [62].
Схема тактических мероприятий на острый период:
1. Строгий постельный режим для предупреждения рецидива ТЭЛА [62]

2. Катетеризация центральной вены для инфузий и определения ЦВД.
3. Немедленное болюсное введение гепарина для предотвращения дальнейшего тромбообразования (схемы – см. «антикоагулянтная терапия» ).
4. Ингаляция кислородно-воздушной смеси.
5. Борьба с шоком (гемодинамическая поддержка).
6. При наличии показаний проведение тромболизиса или эмболэктомии .
7. При осложнении инфаркт-пневмонией назначение антибиотикотерапии.
Задачи лечения ТЭЛА:
Нормализация гемодинамических показателей (инфузионная терапия, введение препаратов положительного инотропного действия).
Восстановление проходимости лёгочной артерии (тромболизис или эмболэктомия по показаниям).
Предотвращение рецидива заболевания ( вторичная профилактика ТЭЛА – борьба с модифицируемыми факторами риска, антикоагулянтная терапия, имплантация кава-фильтров) [2, 4, 25, 62].
Купирование болевого синдрома
Лечение
начинают с купирования болевого
синдрома. ![]()
Внутривенно:
Фентанил 1-2 мл 0.005% раствора с 1-2 мл 0.25% раствора дроперидола .
Или 0.5-1 мл 1% раствора морфина с 0.4-0.7 мл 0.1% раствора атропина .
Или другие аналгетики [62, 92].
Морфин 1% - 1 мл развести раствором 0,9% натрия хлорида до 20 мл (1 мл полученного раствора содержит 0,5 мг активного вещества) и вводить внутривенно (в/в) дробно по 4-10 мл (или 2-5 мг) каждые 5-15 мин до устранения болевого синдрома и одышки либо до появления побочных эффектов (гипотензии, угнетения дыхания, рвоты).
Нужно помнить, что наркотические анальгетики противопоказаны при острой боли в животе, судорожном синдроме, сердечной недостаточности вследствие хронических заболеваний легких.
При инфарктной пневмонии, когда боль в грудной клетке связана с дыханием, кашлем, положением тела, применяют ненаркотические анальгетики, например кеторолак в/м 30 мг (1 мл), дозу необходимо вводить не менее чем за 15 с [5].
Гемодинамическая и респираторная поддержка
Острая
правожелудочковая недостаточность,
ведущая к снижению сердечного выброса,
является главной причиной смерти от ТЭЛА
высокого риска .
Таким образом, поддерживающая терапия
— необходимый компонент лечения ТЭЛА. ![]()
У больных ТЭЛА со сниженным сердечным индексом, но при нормальном АД умеренные инфузии (500 мл реополиглюкина, декстрана) могут улучшать гемодинамику. Массивная инфузионная терапия может ухудшать функцию правого желудочка как за счёт механического перерастяжения, так и через рефлекторные механизмы [41, 62].
При
развитии артериальной гипотензии. ![]()
Вводят:
Дексаметазон (4-8 мг).
Реополиглюкин 400 мл со скоростью введения 20-25 мл/мин; необходима тщательная коррекция водного баланса и КОС [92].
Препараты положительного инотропного действия ( допамин , добутрекс); скорость введения допамина зависит от степени депрессии сердечно-сосудистой системы и составляет от 3 до 15 мкг/кг/мин [92]. Допамин вводят только в/в капельно (на уровне скорой помощи) или через инфузомат (в стационаре). Приготовление раствора непосредственно перед инфузией при необходимости введения по «скорой помощи»: 400 мг (2 ампулы по 5 мл с содержанием допамина 40 мг/мл) допамина добавляют к 250 мл 0,9% раствора хлорида натрия (образуется прозрачный и бесцветный раствор с концентрацией допамина 1600 мкг/мл). Начало терапевтического эффекта при в/в введении в течение 5 мин (скорость инфузии титруется по динамике АД; скорость 15 мкг/кг/мин для пациента с массой 70 кг при полученной концентрации раствора соответствует приблизительно 20 каплям в минуту). Капельную инфузию нельзя прекращать резко; необходимо постепенное снижение скорости введения. Противопоказания: феохромоцитома, фибрилляция желудочков. Допамин не следует смешивать с раствором натрия гидрокарбоната или другими растворами, имеющими щелочную реакцию, так как возможна инактивация вещества [5].
Если гипотония остаётся стойкой, возможно введение допамина с норадреналином (опасность аритмий!) [41, 62]. Содержимое 2 ампул (ампулы по 1 мл 0.2% раствора, следовательно, в двух ампулах содержится 4 мг норадреналина гидротартрата) разводят в 500 мл изотонического раствора натрия хлорида или 5% раствора глюкозы, что создаёт концентрацию норадреналина гидротартрата в полученном растворе 8 мкг/мл. Первоначальная скорость введения 0.5-1 мкг/мин методом титрования доводится до получения эффекта. Дозы 1-2 мкг/мин увеличивают сердечный выброс, выше 3 мкг/мин – оказывают вазоконстрикторное действие. При рефрактерном шоке доза может быть увеличена до 8-30 мкг/мин. Норадреналин вызывает значительное повышение периферического сосудистого сопротивления, приводит к выраженной ренальной и мезентериальной вазоконстрикции, снижает кровоток в кишечнике, почках и печени. Добавление малых доз дофамина (1 мкг/кг/мин) способствует сохранению почечного кровотока при введении норадреналина [92, 99].
Возможна альтернатива: вместо симпатомиметика введение ангиотензинамида [62]. В зависимости от скорости введения раствор препарата готовят в концентрации от 1 до 50 мкг в 1 мл (для медленного введения – низкие концентрации). Для приготовления концентрации 1 мкг/мл содержимое 1 флакона (1 мг) растворяют в 1000 мл растворителя (изотонический раствор натрия хлорида или 5% раствор глюкозы), а для концентрации 50 мкг/мл – в 20 мл растворителя. Соответственно готовят промежуточные концентрации. Концентрацию раствора и скорость инфузии надо подбирать таким образом, чтобы поддерживать систолическое давление на уровне 90-100 мм рт. ст. Обычно начинают с введения препарата из расчёта 5-20 мкг/мин. В отдельных тяжёлых случаях скорость инфузии составляет 50-60 мкг/мин. Когда систолическое давление достигает 90-100 мм рт. ст., скорость инфузии уменьшают до 1-3 мкг/мин [99].
Ингаляции
кислородно-воздушной смеси через
назальный катетер или маску; перевод
на ИВЛ при наличии показаний. ![]()
Классическими критериями перевода на ИВЛ являются PaO 2 <50 мм рт ст. ст. при оксигенотерапии, PaCO 2 >60 мм рт. ст. и pH крови < 7.3; при недоступности газового анализа показаниями к ИВЛ служат клинические признаки острых нарушений дыхания: выраженная одышка, цианоз, резкое тахипноэ или брадипноэ, участие вспомогательной дыхательной мускулатуры грудной клетки и передней брюшной стенки в акте дыхания, патологические ритмы дыхания; перевод больного на ИВЛ показан при дыхательной недостаточности, сопровождающейся возбуждением и, тем более, комой, землистым цветом кожных покровов, повышенной потливостью или изменением величины зрачков [92].
При
развитии бронхоспазма. ![]()
Ввести 10 мл 2.4% раствора аминофиллина ( эуфиллина ) в/в медленно. Возможна ингаляция сальбутамола 2,5 мг (1 небула) через небулайзер в течение 5-10 мин, при неудовлетворенном эффекте через 20 мин ингаляцию повторить.
Аминофиллин снижает общее периферическое сосудистое сопротивление и давление в малом круге кровообращения, повышает чувствительность дыхательного центра к стимулирующему влиянию углекислого газа. Частые побочные эффекты: тахикардия, тремор, повышенная возбудимость, тошнота и/или рвота. Известны случаи гипотензии и остановки сердца после быстрого введения. Передозировка сопровождается значительным риском смерти, обусловленной главным образом развитием аритмий сердца или судорог. Допустимо введение аминофиллина только при стабильном САД >100 мм рт.ст., исключении инфаркта миокарда, отсутствии эпилепсии, тяжелой артериальной гипертензии и пароксизмальной тахикардии.
Использование ингаляционных адреномиметиков (в т.ч. сальбутамола) особенно опасно на фоне электрической нестабильности миокарда [5, 62].
Подробнее. ![]()
Согласно экспериментальным данным, массивная инфузионная терапия может ухудшать функцию правого желудочка, как за счёт механического перерастяжения, так и через рефлекторные механизмы. В то же время, в одном небольшом исследовании было продемонстрировано повышение сердечного индекса с 1.6 до 2 после инфузии 500 мл декстрана у больного ТЭЛА с нормальным АД, но со сниженным сердечным выбросом. То есть у больных ТЭЛА со сниженным сердечным индексом, но при нормальном АД умеренные инфузии могут улучшать гемодинамику.
Изопротеренол — инотропный препарат. Он обладает также вазодилатирующим эффектом на сосуды лёгких, однако это преимущество нивелируется периферической вазодилатацией — падение АД ухудшает кровоснабжение правого желудочка, приводя к его ишемии.
Норадреналин теоретически напрямую оказывает положительный инотропный эффект на правый желудочек. Повышая АД за счёт стимуляции периферических альфа-адренорецепторов, он также должен улучшать кровоснабжение правого желудочка. Клинических исследований по применению норадреналина при ТЭЛА не проводилось. По-видимому, его использование должно ограничиваться больными с артериальной гипотонией.
На небольшой группе больных ТЭЛА, нуждавшихся в госпитализации в отделение интенсивной терапии, добутамин повышал сердечный выброс, улучшал оксигенацию тканей при постоянном артериальном напряжении кислорода. В другом исследовании на 10 пациентах инфузия добутамина в умеренных дозах приводила к увеличению сердечного индекса на 35% без значимых изменений ЧСС, системного и лёгочного АД. Соответственно, применение добутамини и/или допамина может быть целесообразным у больных ТЭЛА при сниженном сердечном индексе с нормальным АД. Не следует, однако, забывать, что повышение сердечного индекса более физиологических значений может усугублять вентиляционно-перфузионные несоответствия за счёт дальнейшего перераспределения кровотока с окклюзированных на проходимые сосуды. Адреналин сочетает в себе преимущества норадреналина и добутамина, не расширяя системные сосуды. При шоке у больных ТЭЛА применение адреналина может давать очень неплохие результаты.
Вазодилататоры снижают сопротивление и давление в лёгочной артерии в экспериментах на животных и, в меньшей степени, у больных ТЭЛА. Главная проблема этих препаратов — отсутствие специфичности в отношении лёгочного сосудистого русла при системном (внутривенном) введении. Один из путей преодоления этого ограничения — ингаляционное назначение препаратов. Согласно данным небольших исследований, ингаляции оксида азота позволяют улучшить гемодинамику и газообмен у больных ТЭЛА. Имеются данные относительно применения ингаляций аэрозоля простациклина при связанной с ТЭЛА лёгочной гипертензии.
Предварительные результаты экспериментальных исследований показывают, что левосимендан может улучшать функционирование правого желудочка за счёт улучшения его сократительной способности и лёгочной вазодилатации.
Возрастает интерес к примненеию при ТЭЛА антагонистов эндотелина и ингибиторов фосфодиэстеразы-5. В экспериментах показано, что анатагонисты эндотелина при массивной ТЭЛА существенно снижают выраженность лёгочной гипертензии. Аналогичные свойствами обладает силденафил .
При ТЭЛА нередки гипоксемия и гипокапния, обычно умеренно выраженные. Открытое овальное окно может усугублять гипоксемию за счёт право-левого шунта. Обычно преодолеть гипоксемию удаётся с помощью оксигенотерапии, ИВЛ требуется редко. Потребность в кислороде можно уменьшить, купируя лихорадку и возбуждение, а также переходя на ИВЛ при существенном увеличении работы дыхания. При переводе на ИВЛ следует избегать отрицательного влияния его на внутригрудную гемодинамику — повышение внутригрудного давления может уменьшать венозный возврат и усугублять правожелудочковую недостаточность у больных с массивной ТЭЛА. Поэтому положительное давление на выдохе следует использовать с осторожностью. Для поддержания в дыхательных путях давления плато в конце вдоха ниже 30 см вод. ст. необходимо использовать небольшой дыхательный объём (приблизительно 6 мл/кг безжировой массы тела) [41].
Тромболизис
Тромболитическая терапия является методом лечения первой линии у больных с кардиогенным шоком и постоянной артериальной гипотензией, то есть у больных ТЭЛА высокого риска . При этом количество абсолютных противопоказаний весьма ограничено. Так, противопоказания к тромболизису, которые считаются абсолютными при инфаркте миокарда (например, оперативные вмешательства в течение 3-х последних недель или желудочно-кишечное кровотечение давностью менее месяца), для больных жизнеугрожающей ТЭЛА рассматриваются как относительные (см. табл. 24, 25) [41].
Абсолютных противопоказаний к проведению тромболитической терапии только два: сильное внутреннее кровотечение или недавнее спонтанное внутричерепное кровотечение [52].
Таблица 24. Противопоказания к фибринолитической терапии при ОИМ с подъёмом сегмента ST (рекомендации ЕОК 2008) [57].
|
Абсолютные* |
Относительные |
|
Ранее перенесенный геморрагический инсульт или нарушение мозгового кровообращения неизвестной этиологии |
Транзиторная ишемическая атака в течение последних 6 месяцев |
|
Ишемический инсульт, перенесенный в течение последних 6 месяцев |
Приём антикоагулянтов непрямого действия |
|
Травмы и опухоли ЦНС |
Наличие стойкой плохо контролируемой артериальной гипертензии (систоличесоке АД > 180 мм рт.ст. и/или диастолическое АД > 110 мм рт.ст.) |
|
Подозрение на расслоение аорты |
Тяжёлые заболевания печени |
|
Склонность к кровоточивости (диагностированные геморрагические диатезы) |
Инфекционный эндокардит |
|
Перенесённые в течение последних 3 недель тяжёлая травма/ обширное оперативное вмешательство/ травмы головы |
Обострение язвенной болезни |
|
Желудочно-кишечное кровотечение в течение последнего месяца |
Безуспешная середчно-лёгочная реанимация |
|
Пункция не поддающихся прижатию анатомических структур (например, биопсия печени, люмбальная пункция) |
Беременность и первая неделя послеродового периода |
|
*Противопоказания, при инфаркте миокарда считающиеся абсолютными, при жизнеугрожающей ТЭЛА могут рассматриваться как относительные [41]. | |
Таблица
25. Противопоказания к фибринолитической
терапии у больных острым инфарктом
миокарда с подъемом сегмента ST
электрокардиограммы (Российские
рекомендации, ВНОК 2007) [56]. ![]()
|
Абсолютные |
Относительные |
|
ранее перенесенный геморрагический инсульт или нарушение мозгового кровообращения неизвестной этиологии |
устойчивая, высокая, плохо контролируемая АГ в анамнезе |
|
ишемический инсульт, перенесенный в течение последних 3 месяцев |
наличие плохо контролируемой АГ (в момент госпитализации – САД > 180 мм рт.ст., ДАД > 110 мм рт.ст.) |
|
опухоль мозга, первичная и метастазы |
ишемический инсульт давностью >3 месяцев |
|
подозрение на расслоение аорты |
деменция или внутричерепная патология, не указанная в разделе «абсолютные противопоказания» |
|
наличие признаков кровотечения или геморрагического диатеза (за исключением менструации) |
травматичная или длительная (>10 мин), сердечно-легочная реанимация или обширное оперативное вмешательство, перенесенное в течение последних 3 недель |
|
существенные закрытые травмы головы в последние 3 месяца |
недавнее (в течение предыдущих 2-4 недель) внутреннее кровотечение |
|
изменение структуры мозговых сосудов, например, артерио-венозная мальформация, артериальные аневризмы |
пункция сосуда, не поддающегося прижатию |
|
|
для стрептокиназы – введение стрептокиназы, в т.ч. модифицированной, более 5 суток назад или известная аллергия на нее |
|
|
Беременность |
|
|
обострение язвенной болезни |
|
|
прием антикоагулянтов непрямого действия (чем выше МНО, тем выше риск кровотечения) |
Рутинное использование тромболитиков в группе больных невысокого риска (см. раздел «стратификация риска и прогноз» ) нецелесообразно, но может применяться в отдельных случаях у больных ТЭЛА среднего риска (то есть при наличии признаков дисфункции правого желудочка и/или маркеров повреждения миокарда) при взвешенной оценке риска кровотечений. В настоящее время проводятся исследования, призванные уточнить подход к тромболитической терапии в этой группе пациентов. Больным ТЭЛА низкого риска тромболитическая терапия не показана.
Тромболитики ( стрептокиназа или урокиназа или рекомбинантный тканевой активатор плазминогена) вводятся внутривенно. Способ введения через катетер в лёгочную артерию не имеет преимуществ.
Наиболее явный эффект наблюдается при начале лечения в течение 48 часов с момента проявления симптомов, однако можно проводить тромболизис пациентам, у которых наличие симптомов отмечалось в течение 6–14 дней.
В таблице 26 приведены разрешённые к применению режимы тромболитической терапии стрептокиназой, урокиназой и рекомбинантным тканевым активатором плазминогена (альтеплазой).
Гепарин не следует вводить одновременно со стрептокиназой или урокиназой, однако при инфузии альтеплазы такое сочетание возможно.
Лечение тромболитиками сопряжено с высоким риском кровотечений, особенно при наличии сопутствующих предрасполагающих заболеваний. По обобщённым данным ряда рандомизированных исследований, частота больших кровотечений – внутричерепных кровоизлияний и фатальных кровотечений - составляет 13% и 1,8%. При использовании неинвазивных методов диагностики ТЭЛА частота тромболитик-ассоциированных кровотечений снижается. По-видимому, именно с этим связано снижение частоты данного осложнения по результатам исследований за последние 10 лет [11, 13, 41, 54].
Таблица
26. Утвержденные режимы тромболитической
терапии ТЭЛА [41]. ![]()
|
Препарат |
Режим введения |
|
Стрептокиназа |
250 тыс. ЕД в качестве нагрузочной дозы в течение 30 минут с последующим введением ее со скоростью 100 тыс. ЕД/ч в течение 12–24 часов. Режим быстрого введения: 1,5 млн ЕД в течение 2 часов. |
|
Урокиназа |
4400 ЕД/кг в качестве нагрузочной дозы в течение 10 минут с последующим введением 4400 ЕД/кг в час в течение 12–24 часов. Режим быстрого введения: 3 млн ЕД в течение 2 часов. |
|
Рекомбинантный тканевой активатор плазминогена |
100 мг в течение 2 часов или 0,6 мг/кг в течение 15 минут (максимальная доза — 50 мг). |
Подробнее. ![]()
В ряде рандомизированных исследований показано, что тромболитическая терапия способствует быстрому разрешению тромбоэмболической обструкции и существенно улучшает гемодинамические показатели. Через 72 часа после введения стрептокиназы отмечалось повышение сердечного индекса на 80% и 40% снижение давления в лёгочной артерии. В крупном исследовании (Plasminogen Activator Italian Multicenter Study 2) в конце двухчасового введения 100 мг рекомбинантного тканевого активатора плазминогена (rtPA) на серии ангиограмм отмечалось уменьшение обструкции сосудов на 12% (в группе монотерапии гепарином за тот же период времени изменений не было). Одновременно на 30% снижалось среднее давление в лёгочной артерии и на 15% возрастал сердечный индекс. В одном из крупнейших исследований продемонстрировано существенное умньшение площади правого желудочка в конце диастолы через 3 часа после введения rtPA.
Что касается сравнения разных тромболитиков, то в исследовании USPET инфузии стрептокиназы или урокиназы в течение 12-24 часов были равноэффективны. Введение 100 мг rtPA в течение 2 часов значительно быстрее улучшало гемодинамику и ангиографическую картину по сравнению с действием урокиназы, которую вводили со скоростью 4400 МЕ/кг/ч в течение 12-24 часов, хотя по окончании инфузии урокиназы разница нивелировалась. Точно так же введение rtPA в течение 2 часов значительно лучше влияет на состояние пациента, чем введение стрептокиназы в течение 12 часов (100 тыс. МЕ/ч), однако не отмечалось никакой разницы при введении стрептокиназы в течение 2 часов. В двух исследованиях сравнивалось действие двух режимов введения rtPA: 100 мг в течение 2 часов или 0,6 мг/кг за 15 минут. Наблюдались незначительные расхождения в результатах, и частота кровотечений была немного выше в первом случае.
Эффект при прямом введении rtPA с помощью катетера в легочную артерию (уменьшенная доза) значительно не отличался от такового при системном внутривенном введении. Введение тромболитиков непосредственно в лёгочную артерию применять не рекомендуется, так как он повышает риск кровотечения в месте прокола.
Неплохие результаты получены также при введении ретеплазы (две инфузии по 10 ЕД в течение 30 минут каждая). Имеются предварительные данные об эффективности тенектеплазы при острой ТЭЛА.
Согласно полученным клиническим данным и данным ЭхоКГ, в течение первых 36 часов приблизительно 92% пациентов чувствительны к проведению тромболизиса. Наиболее явный эффект наблюдается при начале лечения в течение 48 часов с момента проявления симптомов, однако можно проводить тромболизис пациентам, у которых наличие симптомов отмечалось в течение 6–14 дней.
Несмотря на быстрое наступление эффекта, преимущество лечения тромболитиками перед монотерапией гепарином сохраняется только в течение нескольких дней. Спустя неделю ни выраженность обструкции лёгочной артерии, ни степень разрешения правожелудочковой недостаточности при указанных схемах лечения не отличались. Однако лизис тромбоэмбола сохраняет жизнь больным ТЭЛА с развитием гипотонии и шока ( ТЭЛА высокого риска ).
На самом деле оценить общий эффект тромболизиса на исходы ТЭЛА достаточно сложно. За единственным исключением, в дизайне исследований по оценке эффективности тромболитиков не брались в расчёт клинические конечные точки. При оценке соотношения риск кровотечения/возможная польза от применения тромболитиков необходимо помнить о прогнозе и естественном течении ТЭЛА высокого, среднего и низкого риска. Так, противопоказания к тромболизису, которые считаются абсолютными при инфаркте миокарда (например, оперативные вмешательства в течение 3-х последних недель или желудочно-кишечное кровотечение давностью менее месяца), для больных жизнеугрожающей ТЭЛА рассматриваются как относительные (табл. 24, 25).
Эмболэктомия из легочных артерий
Первая успешная эмболэктомия из лёгочных артерий была выполнена в 1924 году, за несколько десятилетий до появления медикаментозных методов лечения.
Считается, что эмболэктомия показана больным ТЭЛА:
Которые нуждаются в сердечно-легочной реанимации.
При наличии противопоказаний к тромболизису, неэффективности тромболизиса.
Больным с открытым овальным окном и внутрисердечным тромбозом.
Есть сообщения о проведении эмболэктомии у больных без гипотензии. В критических случаях выиграть время для диагностики и в ожидании хирургического лечения могут помочь методы поддержки сердечно-лёгочной деятельности: аппараты для вспомогательного кровообращения и экстракорпоральная мембранная оксигенация.
В случаях острой ТЭЛА, когда в анамнезе имеются указания на длительную одышку и лёгочную гипертензию, нужно думать о хронической посттромбоэмболической лёгочной гипертензии. Этим больным выполнение эмболэктомии не показано, они нуждаются в проведении эндартериэктомии из лёгочной артерии [41].
Подробнее. ![]()
В кардиохирургических центрах эмболэктомия из лёгочной артерии не представляет сложностей. После быстрой индукции наркоза выполняется срединная стернотомия, и налаживается искусственное кровообращение в условиях нормотермии. Если нет внутрисердечных тромбов и открытого овального окна, то пережатия аорты и кардиоплегии следует избегать. Обычно эмболэктомию удаётся выполнить с помощью тупых инструментов через два разреза – главного ствола лёгочной артерии и правой лёгочной артерии. Необходимость в продолжении искусственного кровообращения может сохраняться до восстановления функции правого желудочка. При проведении эмболэктомии после тромболизиса в периоперационном периоде повышен риск кровотечения. Однако выполненный тромболизис не является противопоказанием к эмболэктомии. Однозначного мнения относительно периоперационной установки кава-фильтров (в нижнюю полую вену) нет.
До недавнего времени результаты эмболэктомии из лёгочной артерии нельзя было назвать удовлетворительными – ранняя послеоперационная летальность была высокой. С расширением показаний (операции стали выполняться больным с дисфункцией правого желудочка без признаков шока, т.е. больным ТЭЛА среднего риска) ранняя летальность снизилась до 6-8%.
Чрескожная катетерная эмболэктомия и фрагментация
У больных ТЭЛА высокого риска катетерную эмболэктомию и фрагментацию тромба в проксимальных отделах легочной артерии можно использовать как альтернативный хирургическому вмешательству метод лечения при наличии абсолютных противопоказаний к проведению тромболизиса или неэффективности последнего.
Чрескожное
вмешательство для открытия частично
закрытого легочного ствола или основных
ветвей легочной артерии в некоторых
критических ситуациях у пациентов с
ТЭЛА может спасти положение. Несмотря
на то, что информация о данной технике
ограничена, чрескожную катетерную
эмболэктомию можно использовать как
альтернативу тромболизису при наличии
абсолютных противопоказаний к нему,
как дополнительный метод лечения, если
тромболизис не улучшил гемодинамику,
или как альтернативу хирургическому
лечению, если невозможно осуществить
немедленный доступ. ![]()
Всасывающий эмболэктомический катетер Гринфилда был создан в 1969 году. Он остается единственным прибором, одобренным Управлением по контролю за качеством пищевых продуктов и лекарственных средств США (FDA). Для фрагментации и измельчения тромбов применяют также сердечные катетеры или специально сконструированные катетеры с ротационными или режущими приспособлениями. При использовании современных инструментов отмечаются положительные результаты, однако клинические исследования данного метода лечения не проводились.
Некоторые инструменты вводятся в легочные артерии с помощью катетера диаметром 6–11 F по шкале Шаррьера (1F = 1/3 мм), что требует определенной ловкости, особенно если нужно попасть в правую легочную артерию. Катетеры можно использовать для фрагментации тромбов только в магистральных сосудах: в лёгочном стволе, правой и левой главных лёгочных артериях. Введение катетера в более мелкие ветви чревато их повреждением и перфорацией при малой эффективности.
При успешной фрагментации тромбоэмбола весьма скромные положительные сдвиги на ангиограмме могут проявляться разительным улучшением гемодинамики. Как только отмечаются положительные гемодинамические сдвиги, манипуляцию следует прекратить, невзирая на ангиографические данные.
К осложнениям чрескожных манипуляций относятся: повреждения в месте прокола (обычно доступ осуществляется через бедренную вену), перфорация структур сердца, тампонада и аллергические реакции на контрастное вещество. Кровоток в подвздошных и нижней полой венах можно оценить с помощью ангиографии, эмболия оставшимися тромбами встречается редко [29, 41].
Антикоагулянтная терапия
Общие положения
Необходимость в назначении больным ТЭЛА антикоагулянтов не вызывает сомнений с 1960-х годов, когда было показано, что введение нефракционированного гепарина (НФГ) улучшает прогноз. Антикоагулянтную терапию (нефракционированным гепарином, низкомолекулярным гепарином или фондапаринуксом) следует начинать незамедлительно у пациентов с подтвержденным диагнозом ТЭЛА или при высокой клинической вероятности диагноза (до завершения всех диагностические процедур). Цель такого лечения - предотвращение летальных исходов и рецидивирования при допустимом риске геморрагических осложнений.
Быстрое наступление эффекта обеспечивает только парентеральное введение антикоагулянтов: в/в – для нефракционированного гепарина, п/к – для низкомолекулярного гепарина (НМГ) и фондапаринукса.
Предпочтение нефракционированному гепарину (НФГ) следует отдавать у больных с почечной недостаточностью (при клиренсе креатинина менее 30 мл/мин), так как почки не участвуют в выведении НФГ, а также при высоком риске кровотечений (антикоагулянтный эффект НФГ быстро обратим). Не рекомендуется назначение низкомолекулярных гепаринов больным ТЭЛА высокого риска с нестабильной гемодинамикой, так как эта группа пациентов не принимала участия в рандомизированных исследованиях безопасности и эффективности данных препаратов. Во всех остальных случаях острой ТЭЛА нефракционированный гепарин можно заменить на НМГ или фондапаринукс в соответствующей массе тела дозировке без мониторинга выраженности гипокоагуляции.
При назначении нефракционированного или низкомолекулярного гепарина следует постоянно контролировать количество тромбоцитов в связи с риском развития гепарин-индуцированной тромбоцитопении.
Лечение НФГ, НМГ или фондапаринуксом должно продолжаться не менее 5 суток. Согласно данным двух рандомизированных исследований эффективность 5-7 дневного курса терапии НФГ не отличается от 10-14-дневного.
Лечение
венозного тромбоэмболизма (ВТЭ) требует
длительной антикоагулянтной терапии. ![]()
Обычно по завершении курса прямых антикоагулянтов лечение продолжают пероральными антагонистами витамина K (АВК). Согласно данным рандомизированного исследования, частота рецидивов ВТЭ при исходной монотерапии АВК в 3-4 раза превышает аналогичный показатель в группе сочетанного лечения (АВК + гепарин). Антагонисты витамина К (АВК) необходимо назначать как можно раньше, желательно – в тот же день, что гепарин или фондапаринукс. Если на протяжении двух последовательных дней значение МНО находится в пределах 2.0-3.0, парентеральное введение антикоагулянтов следует прекратить [6, 7, 32, 41].
Лечение нефракционированным гепарином
При лечении нефракционированным гепарином режим дозирования по массе тела (80 ЕД/кг в/в струйно с последующей инфузией со скоростью 18 ЕД/кг/час) предпочтительнее режима болюсных инъекций в фиксированных дозировках. Дозировка НФГ регулируется по значению АЧТВ (активированного частичного тромбопластинового времени).
Цель лечения – быстрое достижение удлинения АЧТВ до уровня, в 1.5-2.5 раза превышающего норматив конкретной лаборатории.
Разработаны специальные алгоритмы-номограммы лечения НФГ (табл. 27). Первый раз АЧТВ следует определить через 4-6 часов после начала гепаринотерапии. В зависимости от результата производится коррекция скорости инфузии. Затем анализ на АЧТВ повторяют каждые 3 часа. Если в двух последовательных измерениях АЧТВ находится в «терапевтических» пределах, последующие определения можно выполнять 1 раз в сутки.
Таблица
27. Алгоритм-номограмма коррекции дозы
в/в введения НФГ в зависимости от уровня
АЧТВ [41]. ![]()
|
АЧТВ в секундах (и по отношению к верхней границе нормы в конкретной лаборатории) |
Коррекция дозы |
|
<35с (<1.2 верхней границы нормы) |
Струйно ввести 80 Ед/кг и увеличить скорость постоянной инфузии на 4 Ед/кг/час |
|
35-45 с (1,2-1,5) |
Струйно ввести 40 Ед/кг и увеличить скорость постоянной инфузии на 2 Ед/кг/час |
|
46-70 с (1.5-2.3) |
Без изменений |
|
71-90 с (2.3-3) |
Уменьшить скорость постоянной инфузии на 2 Ед/кг/час |
|
>90 c (>3 верхних границ нормы) |
Прекратить введение на 1 час, затем продолжить инфузию, уменьшив скорость на 3 Ед/кг/час |
Нужно отметить, что АЧТВ не является идеальным маркером степени антикоагулянтного действия гепарина. Поэтому нет необходимости повышать скорость инфузии более 1667 Ед/час (что соответствует 40 тыс. Ед/сутки), так как при этой дозе создаётся плазменная концентрация гепарина не менее 0,35 МЕ/мл (измеряется как анти-фактор Xa активность), даже если АЧТВ ниже терапевтического значения [41].
Лечение низкомолекулярными гепаринами или фондапаринуксом
В таблице 28 перечислены низкомолекулярные гепарины, одобренные для применения при острой форме ТЭЛА. Другие препараты низкомолекулярного гепарина (НМГ), разрешённые для лечения ТГВ, также иногда используются и при ТЭЛА.
Низкомолекулярные гепарины мало влияют на АЧТВ , их антикоагулянтная активность оценивается по анти-фактор Xa активности плазмы. Однако обычно контроль терапии не требуется. Мониторинг анти-фактор Xa активности плазмы показан только больным с тяжёлой почечной недостаточностью, беременным женщинам [41, 93] и при выраженном ожирении (масса тела более 150 кг, индекс массы тела более 50 кг/м2) [93]. Измерения проводят через 4 часа после утреннего введения препарата на пике его действия. Целевой уровень анти-фактор Xa активности плазмы составляет 0.6-1 МЕ/мл при введении НМГ дважды в день и 1-2 МЕ/мл – при однократном введении, хотя жёстких рекомендаций на этот счёт нет.
Достойную альтернативу НМГ представляет фондапаринукс (селективный ингибитор фактора Xa). Он вводится подкожно 1 раз в сутки (период полураспада 15-20 часов; табл. 28). Частота рецидивов ВТЭ и геморрагических осложнений при лечении фондапаринуксом (фиксированная доза с расчетом по массе тела) сопоставима с аналогичными показателями в группе терапии НФГ внутривенно. В связи с тем, что не было зафиксировано ни одного случая тромбоцитопении, спровоцированной фондапаринуксом, при лечении им нет необходимости в контроле числа тромбоцитов. Введение фондапаринукса противопоказано при тяжёлой почечной недостаточности с клиренсом креатинина < 20 мл/мин [41].
Таблица
28. Режимы п/к введения НМГ и фондапаринукса
при ТЭЛА [41]. ![]()
|
Препарат |
Доза |
Кратность введения |
|
Эноксапарин |
1 мг/кг |
Каждые 12 часов |
|
или 1.5 мг/кг а |
Один раз в сутки а | |
|
Тинзапарин |
175 Ед/кг |
Один раз в сутки |
|
Фондапаринукс |
5 мг (при массе тела <50 кг) |
Один раз в сутки |
|
7.5 мг (при массе тела 50-100 кг) | ||
|
10 мг (при массе тела>100 кг) | ||
|
При ТЭЛА или ТГВ у онкологических больных разрешено длительное применение дальтепарина п/к в дозе 200 Ед/кг (для получения более подробной информации см. аннотацию к препарату). а Режим введения эноксапарина 1 раз в сутки в дозе 1.5 мг/кг разрешён для лечения госпитализированных пациентов в США, а также в некоторых (но не во всех) европейских странах. | ||
Подключение к терапии непрямых антикоагулянтов (АВК)
Антагонисты витамина К (АВК) необходимо назначать как можно раньше, желательно – в тот же день, что гепарин или фондапаринукс. Стартовая доза варфарина не должна превышать 5.0-7.5 мг. Дальнейшая коррекция дозы направлена на поддержание целевого уровня МНО 2.5 (в пределах 2.0-3.0). Продолжительность такого лечения определяется подходами ко вторичной профилактике ТЭЛА .
Перспективы
В настоящее время испытываются быстро действующие пероральные антикоагулянты (в частности, ингибиторы факторов Ха и IIа), которые не требуют контроля терапии. В будущем они могут заменить парентеральные препараты при лечении ВТЭ [41].
Алгоритм лечения ТЭЛА
На рисунке 66 приведён алгоритм лечебных мероприятий в остром периоде ТЭЛА [22]. Тактика лечения отличается в зависимости от стратификации риска.
Рисунок
66. Алгоритм лечебных мероприятий в
остром периоде ТЭЛА [22].
Алгоритм лечения при ТЭЛА высокого риска
При ТЭЛА у пациентов в шоковом состоянии или с артериальной гипотензией (что соответствует используемому ранее понятию «клинически массивная ТЭЛА») риск летального исхода очень высок, особенно в первые часы после поступления. Фондапаринукс и низкомолекулярный гепарин (НМГ) в этой группе больных не испытывались, поэтому в качестве первого антикоагулянта следует выбрать нефракционированный гепарин (НФГ) (внутривенное введение).
В ряде испытаний показано, что у больных ТЭЛА высокого риска тромболизис существенно снижает смертность и частоту рецидивов ТЭЛА. Поэтому тромболитическая терапия показана всем больным этой категории, если нет абсолютных противопоказаний. Имеются данные о том, что тромболизис может представлять безопасную и эффективную альтернативу хирургическому вмешательству при флотирующих тромбах в правых отделах сердца.
У пациентов с абсолютными противопоказаниями к проведению тромболизиса, а также если последний не дал улучшения гемодинамики, манипуляцией выбора является эмболэктомия. Если ее в данный момент нельзя осуществить, проводят катетерную эмболэктомию или фрагментацию тромба.
Алгоритм лечения при ТЭЛА невысокого риска
У больных с нормальным АД при ТЭЛА невысокого риска краткосрочный прогноз благоприятен. В отсутствие тяжёлой почечной недостаточности антикоагулянтами выбора будут НМГ или фондапаринукс (вводятся подкожно в соответствующих массе тела дозировках, не требуют контроля степени гипокоагуляции). Согласно данным 6 исследований, в этой группе больных проведение тромболизиса не дает клинических преимуществ.
К группе ТЭЛА среднего риска относятся больные со стабильной гемодинамикой, но с признаками развития дисфункции правого желудочка и/или повреждения миокарда. Согласно имеющимся данным, в известном проценте таких случаев польза от проведения тромболизиса может превышать риск. В настоящее время проводится крупное исследование, результаты которого разрешат имеющиеся противоречия относительно стратегии лечения этой категории больных.
Диагноз ТЭЛА низкого риска устанавливают при отсутствии не только шока и гипотонии, но и признаков дисфункции правого желудочка и маркеров повреждения миокарда. Такой вариант ТЭЛА не требует длительной госпитализации: больных можно довольно быстро выписать, если на дому будут обеспечены надлежащий уход и антикоагулянтная терапия. Разумеется, подобное решение должно приниматься с учётом риска кровотечений и всего комплекса факторов в каждом конкретном случае [41].
Резюме рекомендаций ЕОК (2008) по лечению тромбоэмболии легочной артерии (ТЭЛА) с указанием класса рекомендаций и уроввней доказательности для каждого положения
В таблице 29 приводится резюме основанных на принципах доказательной медицины рекомендаций ЕОК по лечению ТЭЛА в остром периоде с указанием класса рекомендаций и уровней доказательности для каждого положения [41].
Таблица 29. Рекомендации ЕОК по диагностике ТЭЛА (2008) с указанием класса рекомендаций и уровней доказательности [41].
|
Рекомендации по лечению ТЭЛА в остром периоде |
Классa |
Уровеньb |
|
ТЭЛА высокого риска | ||
|
Немедленно начать антикоагулянтную терапию НФГ |
I |
A |
|
Коррекция системной гипотонии для предотвращения прогрессирования правожелудочковой недостаточности и смерти |
I |
C |
|
Вазопрессоры показаны при артериальной гипотонии |
I |
C |
|
Добутамин и допамин можно назначать больным с низким сердечным выбросом при нормальном АД |
IIa |
B |
|
Массивная нагрузка жидкостью не рекомендуется |
III |
B |
|
При гипоксемии показана кислородотерапия |
I |
C |
|
При кардиогенном шоке и/или постоянной артериальной гипотонии должны назначаться тромболитики |
I |
A |
|
Хирургическая эмболэктомия из лёгочной артерии – рекомендуемая альтернатива тромболизису в случаях, когда последний неэффективен или имеются абсолютные противопоказания к его проведению |
I |
C |
|
Если тромбоэмболы расположены в магистральных лёгочных артериях (лёгочный ствол и его главные ветви), при неэффективности тромболизиса или наличии абсолютных противопоказаний к его проведению альтернативой хирургической эмболэктомии являются катетерная эмболэктомия и фрагментация |
IIb |
C |
|
ТЭЛА невысокого риска | ||
|
Даже при продолжающемся диагностическом поиске больным с клинически высокой и промежуточной вероятностью диагноза ТЭЛА следует немедленно назначить антикоагулянты |
I |
C |
|
В большинстве случаев лечение рекомендуется начинать с НМГ или фондапаринукса |
I |
A |
|
Больным тяжёлой почечной недостаточностью или при высоком риске кровотечений следует назначить НФГ внутривенно под контролем АЧТВ (целевой уровень 1.5-2.5 верхние границы нормы в данной лаборатории) |
I |
C |
|
Введение НФГ, НМГ или фондапаринукса должно продолжаться не менее 5 дней. Полностью заменить их на АВК можно только после достижения и удержания целевых значений МНО на протяжении двух последовательных дней |
I |
A |
|
I |
C | |
|
Рутинное применение тромболизиса у больных невысокого риска не рекомендуется. Однако в некоторых случаях ТЭЛА среднего риска введение тромболитиков может обсуждаться |
IIb |
B |
|
Тромболизис не следует проводить больным ТЭЛА низкого риска |
III |
B |
|
a Класс рекомендаций b Уровень доказательности | ||
ПРОГНОЗ
Стратификация риска и прогноз
В новом руководстве Европейского общества кардиологов (ЕОК) под тяжестью ТЭЛА понимается риск ранней смерти (смерти в стационаре или в течение 30 суток после эмболии). Поэтому рекомендовано отказаться от использовавшихся ранее терминов «массивная», «субмассивная» и «немассивная» ТЭЛА, которые характеризуют только анатомический объём обструкции и могут неверно отражать прогноз, и заменить их на оценку риска ранней обусловленной ТЭЛА смерти [41]. Исходя из этих позиций, «большим» ТЭЛА будут соответствовать комбинации размера эмболов и функционального состояния сердца и лёгких, приводящие к значимому нарушению гемодинамики [20]. Предлагается использовать стратификацию больных на группы высокого и невысокого риска, а среди последних выделять подгруппы среднего и низкого риска [41].
Оценка степени риска лежит в основе выбора тактики ведения больных ТЭЛА (см. « диагностический алгоритм при подозрении на ТЭЛА », « алгоритм лечения ТЭЛА »).
Критерии стратификации риска приведены в таблице 30, в таблице 4 – алгоритм стратификации риска и соответствующей тактики ведения больных ТЭЛА.
Таблица
30. Основные критерии стратификации
риска при ТЭЛА [41]. ![]()
|
Клинические признаки |
Шок Гипотония a |
|
Признаки дисфункции правого желудочка |
|
|
Показатели повреждения миокарда |
Повышение уровня сердечных тропонинов T или I b |
|
a Определяется, как систолическое АД < 90 мм рт. ст. или падение САД ≥ 40 мм рт. ст. более чем на 15 минут вне связи с аритмией, гиповолемией или сепсисом. b В последнее время в качестве маркера повреждения миокарда также обсуждается миокардиальный белок, связывающий жирные кислоты (H-FABP), однако для определения его роли необходимы дальнейшие исследования. | |
Таблица
4. Стратификация риска в соответствии
с ожидаемой ранней летальностью
вследствие ТЭЛА [41]. ![]()
|
Группы риска ранней смерти (смерти в стационаре или в течение 30 суток после ТЭЛА) |
Факторы риска |
Тактика ведения | |||
|
Клинические (шок, гипотония) |
Дисфункция правого желудочка (хотя бы 1 признак) |
Повреждение миокарда (хотя бы 1 показатель) | |||
|
ВЫСОКОГО > 15% |
+ |
(+) a |
(+) a |
Тромболизис или эмболэктомия | |
|
НЕВЫСОКОГО |
Среднего 3-15% |
— |
+ |
+ |
Лечение в стационаре |
|
+ |
— | ||||
|
— |
+ | ||||
|
Низкого < 1% |
— |
— |
— |
Ранняя выписка или амбулаторное лечение | |
|
a Для стратификации риска при шоке и гипотонии нет необходимости в подтверждении дисфункции правого желудочка и повреждения миокарда – больные автоматически относятся к категории высокого риска. | |||||
В первую очередь необходимо разделить больных на группы высокого и невысокого риска на основании простой клинической оценки состояния больного. При шоке или артериальной гипотонии (систолическое АД < 90 мм рт. ст. или падение САД ≥ 40 мм рт. ст. более чем на 15 минут вне связи с аритмией, гиповолемией или сепсисом) больные автоматически относятся к категории высокого риска. Системной артериальной гипотонии и шоку в клинике может соответствовать потеря сознания. Разумеется, остановка сердца с последующим восстановлением сердечной деятельности также переводит пациента в категорию ТЭЛА высокого риска.
Остальные входят в группу невысокого риска, для дальнейшей классификации на подгруппы промежуточного и низкого риска необходимо проведение дополнительных исследований.
Таким образом, уже при быстром обследовании у постели больного можно определить, относится пациент к группе высокого риска ранней смерти или нет. Такой подход позволяет в кратчайшие сроки определиться с тактикой ведения больных и своевременно назначить жизнеспасающее лечение больным высокого риска. При дальнейшем обследовании тех, у кого нет клинических признаков высокого риска (шока, артериальной гипотонии), следует оценить риск более точно [41].
Подробнее ![]()
Кроме перечисленных в таблице 30 критериев дисфункции правого желудочка следует обращать внимание на такой симптом, как расширение вен шеи (если это не связано с тампонадой сердца или опухолями средостения). Систолический шум над трёхстворчатым клапаном и ритм галопа – более субъективные признаки. Можно учитывать также ЭКГ-критерии перегрузки правого желудочка (инверсия зубцов Т в отведениях V 1 -V 4 , комплекс типа QR в отведении V 1 , а также такие классические признаки, как полная или неполная блокада правой ножки пучки Гиса и сочетание S I Q III T III ), однако они обладают низкой чувствительностью. Катетеризация правых отделов сердца позволяет непосредственно измерить давление наполнения правого желудочка и сердечный выброс, однако рутинное использование данного метода только лишь для стратификации риска не рекомендуется.
К ЭхоКГ критериям плохого прогноза помимо перечисленных в таблице 30 относится обнаружение открытого овального окна при клиническом подозрении на ТЭЛА. При этом помимо ухудшения общего прогноза повышается риск инсультов (парадоксальная эмболия) [28].
КТ грудной клетки с контрастным усилением (КТ-ангиография) в последнее время стала методом выбора визуализации тромбов в лёгочной артерии, она лежит в основе диагностического алгоритма при ТЭЛА невысокого риска. Помимо оценки состояния сосудов малого круга после внутривенного введения контрастного препарата КТ позволяет оценить соотношение размеров желудочков (рис. 33). Отношение ПЖ/ЛЖ > 1 свидетельствует о дилатации правого желудочка. Прямых данных о функции правого желудочка КТ не даёт.
Наличие проксимального тромбоза глубоких вен (ТГВ) повышает риск рецидивирования венозного тромбоэмболизма (ВТЭ) у больных ТЭЛА, поэтому УЗИ глубоких вен может использоваться для стратификации риска.
Повышение уровня BNP (МНУП - мозгового натрий-уретического пептида) или его предшественника NT-proBNP (N-концевой МНУП) у больных ТЭЛА свидетельствует о дисфункции правого желудочка. Предсказательная ценность положительного результата невысока, однако низкий уровень BNP или NT-proBNP – показатель хорошего прогноза (предсказательная ценность отрицательного результата 94%-100%).
В ряде случаев смерти от массивной ТЭЛА при аутопсии обнаруживается трансмуральный инфакрт правого желудочка, несмотря на достаточную проходимость коронарных артерий. Хотя источником повышения сердечных тропонинов не обязательно является миокард правого желудочка, этот признак существенно ухудшает прогноз больных ТЭЛА. Повышение уровня тропонина Т более 0.1 мг/мл определяется в 0-35-50% случаев при немассивной, субмассивной и массивной ТЭЛА соответственно. Повышенный уровень тропонина увеличивает риск летального исхода даже среди больных с сохранной гемодинамикой (относительный риск 5.9). Больничная летальность от ТЭЛА при позитивном тесте на тропонин Т составляет 48% по сравнению с 3% - при отрицательном. Более того, уровень тропонина Т > 0.01 нг/мл связан с возрастанием летальности. Повышение уровня тропонинов I и Т ассоциируется также с осложнённым течением заболевания. Рекомендуется определять уровень тропонина при поступлении и спустя 6-12 часов, так как исходно отрицательный результат может перейти в положительный.
В последнее время в качестве маркера повреждения миокарда предлагается миокардиальный белок, связывающий жирные кислоты (H-FABP). Использование этого показателя для стратификации риска ТЭЛА при поступлении даже эффективнее, чем определение уровней миоглобина или тропонинов. Если за пороговое значение принять уровень H-FABP 6 нг/мл, то в отношении прогноза ранней смерти от ТЭЛА предсказательное значение положительного результата составит 23-37%, а предсказательное значение отрицательного результата 96-100%. Однако для определения его роли необходимы дальнейшие исследования.
Анализ значений нескольких показателей в совокупности повышает их прогностическую ценность. Так летальность от ТЭЛА в течение 40 дней среди больных с одновременным повышением уровня тропонина Т и NT-proBNP составила 30%, в то время как при изолированном повышении NT-proBNP – 3.7%. В другом исследовании сочетание повышения тропонина I > 0.1 нг/л и отношения размеров ПЖ/ЛЖ > 0.95 по данным ЭхоКГ ассоциировалось с 30-дневной летальностью 38%. Сохранная функция правого желудочка при нормальном уровне перечисленных биомаркеров – очень хороший прогностический признак.
Отсутствие общепринятых пороговых уровней для биомаркеров (в связи с недостатком доказательных данных) существенно ограничивают возможности их использования для обоснования той или иной терапевтической стратегии у больных ТЭЛА невысокого риска. Пролить свет на этот вопрос призвано проводимое сейчас многоцентровое рандомизированное исследование. Оно посвящено оценке эффективности тромболитической терапии у больных с нормальным АД, но с ЭхоКГ признаками дисфункции правого желудочка и повышенным уровнем тропонинов [41].
Данные, получаемые в процессе клинического обследования, и результаты простых лабораторных анализов также могут использоваться для оценки прогноза. Многие из них связаны с фоновыми и сопутствующими заболеваниями. Так, согласно регистру ICOPER к неблагоприятным прогностическим факторам относятся онкологические заболевания, сердечная недостаточность , ХОБЛ и возраст старше 70 лет [41]. Имеющиеся до эмболии заболевания сердца и лёгких ассоциированы с 4-7 кратным увеличением смертности от ТЭЛА. Таким образом, на прогноз ТЭЛА существенно влияет исходный сердечно-лёгочный статус [20]. В качестве предикторов риска предлагаются также уровень креатинина , D-димера , ТГВ в анамнезе, подтверждённый при УЗИ ТГВ, артериальная гипоксемия и др.
В руководстве ЕОК по диагностике и лечению ТЭЛА (2008) приводится шкала, по которой больные ТЭЛА могут быть разделены на 5 подгрупп в зависимости от риска смерти в первые 30 дней (таблица 31) [41].
Таблица
31. Показатели рутинных методов обследования
- предикторы смерти от всех причин в
течение 30 дней после эпизода ТЭЛА [41]. ![]()
|
Показатель |
Баллы |
|
Возраст |
1 балл на каждый год жизни |
|
Мужской пол |
10 |
|
Онкологическое заболевание |
30 |
|
Сердечная недостаточность |
10 |
|
Хроническое заболевание лёгких |
10 |
|
ЧСС > 110 /мин |
20 |
|
САД < 100 мм рт. ст. |
30 |
|
ЧДД ≥ 30/мин |
20 |
|
Температура тела < 36ºC |
20 |
|
Спутанность сознания (вплоть до комы) |
60 |
|
SaO 2 <90% |
20 |
|
Категории риска – сумма баллов (30-дневная летальность от всех причин, %):
К категории низкого риска относятся классы I и II (0-1%). SaO 2 – сатурация кислорода (пульсоксиметрия). | |
Кроме того, на прогноз ТЭЛА влияет быстрота распознавания и начала терапии. Так, Без лечения смертность от ТЭЛА составляет около 30%, в первую очередь в связи с рецидивирующими эмболиями. Однако постановка диагноза с проведением эффективной терапии антикоагулянтами сопровождается снижением смертности до 2-8%. Хотя даже при своевременно установленном диагнозе спасти жизнь пациента удаётся не всегда, смертность в 4-6 раз выше в случаях, когда ТЭЛА нераспознана. Таким образом, быстрая и точная диагностика ТЭЛА поистине спасает жизнь.
Учитывая, что течение ТЭЛА, в том числе рецидивирование, непредсказуемо, каждый случай ТЭЛА необходимо рассматривать как серьёзную проблему. Даже небольшие тромбоэмболы являются маркерами существования скрытой опасности и могут быть предвестниками ТЭЛА в будущем. Чтобы подчеркнуть значимость тромбоэмболий без нарушения функции сердца и лёгких, предложен термин «сигнальная эмболия» [20].
ПРОФИЛАКТИКА
Вторичная профилактика венозного тромбоэмболизма (длительная антикоагулянтная терапия, установка кава-фильтра)
Общие положения
Вторичная профилактика ТЭЛА осуществляется при развившемся флеботромбозе или легочной эмболии. Она является неотъемлемым компонентом лечения ТЭЛА, так как часто больные погибают от рецидива заболевания [33]. В большинстве случаев с этой целью назначают антагонисты витамина К (АВК). Безопасной и эффективной альтернативой им у онкологических больных могут служить низкомолекулярные гепарины (НМГ). Дозу антагонистов витамина К (АВК) подбирают так, чтобы МНО поддерживалось в пределах 2.0-3.0.
На основании ряда исследований сделаны следующие выводы:
При ВТЭ продолжительность антикоагулянтной терапии не должна ограничиваться 4–6 неделями.
Риск рецидивов по завершении антикоагулянтной терапии, проводимой в течение 6 или 12 месяцев, такой же, как при 3-месячном курсе.
При неопределённо долгом лечении антикоагулянтами риск рецидивов ВТЭ снижается на 90%, однако такое преимущество сопровождается повышением риска больших кровотечений.
Кроме риска рецидива при определении длительности антикоагулянтной терапии следует также учитывать и риск развития кровотечений. К факторам риска больших кровотечений относятся:
Пожилой возраст (особенно старше 75 лет).
Предшествующие желудочно-кишечные кровотечения.
Инсульт в анамнезе, не связанный с эмболией в сосуды головного мозга.
Хронические заболевания печени или почек.
Одновременное лечение антиагрегантами (избегать, если отказ от антикоагулянтов не повлечёт за собой высокий риск осложнений; например, после стентирования коронарных артерий отменять антиагреганты нельзя).
Тяжелые острые или хронические заболевания.
Неадекватная степень гипокоагуляции.
Невозможность обеспечения надлежащего мониторинга антикоагулянтной терапии.
Антагонисты
витамина К эффективно предотвращают
повторные эпизоды ВТЭ во время лечения,
но они не устраняют риск рецидивов после
его прекращения. Продолжительность
антикоагулянтной терапии для каждого
пациента определяется соотношением
между риском рецидивов при прекращении
лечения и риском развития кровотечений
при его продолжении. Лечение антагонистами
витамина К требует постоянного контроля
МНО, что связано с определенными
неудобствами. ![]()
Для длительного лечения ТЭЛА в идеале необходимы пероральные антикоагулянты, прием которых не требует контроля и подбора доз. В настоящее время проходят испытание селективный ингибитор тромбина дабигатран и ингибиторы фактора Ха — ривароксабан и апиксабан [41].
В качестве средств вторичной профилактики могут применяться и механические методы (см. раздел « первичная профилактика ВТЭ »). В Кокрановском обзоре 2004 года указано, что использование компрессионных чулок значительно снижает распространенность постфлебитического синдрома у больных с тромбозом проксимальных глубоких вен через 2 года после эпизода.
Вторичная профилактика ТЭЛА у онкологических больных
У больных раком частота рецидивов ВТЭ в течение года после первого эпизода составляет 20%. Среди факторов риска развития рецидивов рак находится на первом месте. Поэтому первый эпизод ТЭЛА у пациентов с онкологическими заболеваниями является показанием к проведению антикоагулянтной терапии неограниченной продолжительности. В рандомизированном исследовании пациентам с тромбозом глубоких вен и раком назначали низкомолекулярный гепарин (дальтепарин) в дозе 200 ЕД/кг один раз в сутки в течение 4–6 недель с последующим ежедневным введением 75% стартовой дозы в течение 6 месяцев. Такой подход к профилактике рецидивов дал лучшие результаты, чем длительный приём варфарина . Таким образом, после перенесённого эпизода ВТЭ больным злокачественными новообразованиями рекомендуется терапия НМГ в течение 6 месяцев с последующим продолжением или переходом на АВК до тех пор, пока не вылечено онкологическое заболевание.
Вторичная профилактика ТЭЛА при наличии устранимых факторов риска
В исследовании пациентов с первым эпизодом ТЭЛА, вызванной устранимыми факторами риска, частота рецидивов после прекращения лечения составила 2,5%, у больных с идиопатической ТЭЛА – 4,5%. Такие же результаты были получены при исследовании пациентов с тромбозом глубоких вен. К устранимым факторам риска венозного тромбоэмболизма относятся хирургические вмешательства, травмы, прием эстрогенов и беременность. При ТЭЛА, связанной с преходящими факторами риска, лечение антагонистами витамина К следует продолжать не менее 3 месяцев (в случаях тромбоза дистальных притоков глубоких вен возможна меньшая продолжительность). Не рекомендуется применять антагонисты витамина К более 3 месяцев, если фактор риска устранен.
Вторичная профилактика идиопатической и первичной ТЭЛА
У пациентов с идиопатической ТЭЛА стратификация риска остается неопределенной. К факторам высокого риска рецидива ВТЭ (относительный риск 1.5–2.0) относятся:
Один или более эпизодов ВТЭ в анамнезе.
Антифосфолипидный синдром.
Наследственные тромбофилии.
Мужской пол.
Остаточный тромбоз в проксимальных венах.
Дополнительным фактором риска рецидивирования ВТЭ у больных ТЭЛА является сохраняющаяся дисфункция правого желудочка по данным ЭХО-КГ при выписке из стационара. С другой стороны, отрицательный результат анализа по определению уровня D-димера через месяц после отмены АВК является благоприятным фактором (относительный риск рецидива 0,4) [41].
О
наследственных тромбофилиях должен
знать каждый врач (см. табл.12 и
раздел «первичные
ТЭЛА» ). ![]()
К настоящему времени описаны дефект антитромбина III (частота встречаемости гетерозиготного дефекта антитромбина III у здоровых лиц составляет 0,2%); дефект протеинат C (си) (гетерозиготный дефицит протеина С встречается в 0,2–0,4% у здоровых доноров), дефицит протеина S (распространенность дефицита протеина S в здоровой популяции неизвестна), резистентность к активированному протеину С – фактор V Лейдена (встречается у 2–15% здоровых доноров белой расы); наличие протромбина G20210А (распространенность среди больных ВТЭ составляет 2,3–6,2%), гипергомоцистеинемия (встречается в 5–10% случаев) и наличие антифосфолипидного синдрома (распространенность его в популяции составляет 1%). Вероятность формирования ВТЭ зависит от формы тромбофилии, типа ее носительства, а также от нередкого сочетания тромбофилий (как наследственных, так и приобретённых) друг с другом.
Наличие тромбофилий можно заподозриить уже при тщательном сборе анамнеза. Важными признаками являются:
Тромботическая наследственность – наличие тромбозов у ближайших родственников.
Повторные тромбозы без видимых причин (идиопатические тромбозы).
Тромбозы, возникающие во время ситуаций, обычно легко переносимых здоровыми людьми: длительные поездки, прием противозачаточных средств, беременность и т. д.
Тромбозы, возникающие в молодом возрасте (у лиц моложе 50 лет).
Сочетание артериальных и венозных тромбозов.
Сочетание тромбозов с гибелью плода.
Повторные выкидыши.
Тромбозы необычных локализаций (вен мозга, мезентериальных вен).
Тромбозы поверхностных вен.
Некрозы кожи, вызванные приемом кумаринов [46].
Выявление
этих фактов обязывает предполагать
наличие наследственной тромбофилии и
проводить ее поиски [46]. ![]()
ДНК-диагностика (методом ПЦР) используется для выявления Лейденской мутации фактора V, мутации протромбина G20210А и мутаций, лежащих в основе гипергомоцистеинемии. Для таких наследственных тромбофилий, как дефицит антитромбина III, протеинов С и S описано по несколько десятков (для дефицита протеина С более 160) мутаций, поэтому ДНК-диагностика этих форм тромбофилии практически невозможна. Для их диагностики используют иммуноферментный (выявляет I тип дефицита - количественный) анализ и коагулологические тесты (позволяют судить о снижении функциональной активности указанных факторов – II тип дефицита, качественный) [94].
Кандидатами на проведение неограниченного сроками антикоагулянтного лечения после первого эпизода неспровоцированного ВТЭ (в отсутствии явных факторов риска, характерных для вторичной ТЭЛА) являются больные с подтверждённым дефицитом протеинов С или S, наличием волчаночного антикоагулянта, гомозиготные по V-фактору Лейдена или по гену протромбина G20210А. В настоящее время нет данных, подтверждающих целесообразность длительной терапии у гетерозиготных по двум последним мутациям больных [41]. В отдельных случаях целесообразно обследовать больного на наличие более редких тромбофилий. Если диагностирована тромбофилия, может потребоваться пожизненный профилактический приём антикоагулянтов. Учитывая, что риск ВТЭ на фоне приёма оральных контрацептивов у женщин, страдающих тромбофилиями, увеличивается в 9-19 раз, им следует рекомендовать другие методы контрацепции [20, 22, 26, 48].
Таким образом, больные неспровоцированной ТЭЛА должны получать АВК на протяжении как минимум 3 месяцев. При решении вопроса о неопределённо длительном приёме антикоагулянтов в каждом конкретном случае нужно взвесить все «за» и «против». Такое лечение показано во всех случаях после второго эпизода идиопатического ВТЭ. Также неопределённо долгое лечение антикоагулянтами может назначаться больным идиопатическим ВТЭ после первого эпизода ТГВ или ТЭЛА с низким риском кровотечений при совпадении данной рекомендации с желанием больного.
Применение уменьшенных доз АВК при идиопатическом ВТЭ эффективнее плацебо, но уступает стандартным схемам. Данный подход приемлем только в особых случаях.
Эффективность длительной антикоагулянтной терапии разной продолжительности в предотвращении развития хронической тромбоэмболической легочной гипертензии не изучена [41].
Резюме рекомендаций ЕОК (2008) по вторичной профилактике ТЭЛА (длительной антикоагулянтной терапии) с указанием класса рекомендаций и уровней доказательности для каждого положения
В таблице 32 приводится резюме основанных на принципах доказательной медицины рекомендаций ЕОК (2008) по вторичной профилактике ТЭЛА (после острого события) с указанием класса рекомендаций и уровней доказательности для каждого положения [41].
Таблица 32. Рекомендации ЕОК (2008) по вторичной профилактике ТЭЛА (длительной антикоагулянтной терапии) с указанием класса рекомендаций и уровней доказательности [41].
|
Рекомендации ЕОК по длительной антикоагулянтной терапии |
Класса |
Уровеньb |
|
При наличии устранимых факторов риска больным ТЭЛА показан приём АВК в течение 3 месяцев |
I |
A |
|
При неспровоцированной ТЭЛА (идиопатической) минимальная длительность лечения АВК составляет 3 месяца |
I |
A |
|
Длительную антикоагулянтную терапию можно рекомендовать больным после первого эпизода неспровоцированной ТЭЛА при низком риске кровотечений, если удаётся достичь стабильный уровень гипокоагуляции |
IIb |
B |
|
Второй эпизод неспровоцированной ТЭЛА – абсолютное показание к проведению длительной антикоагулянтной терапии |
I |
A |
|
При длительной антикоагулянтной терапии периодически необходимо возвращаться к оценке отношения риск/польза её продолжения для данного пациента |
I |
C |
|
Больным злокачественными новообразованиями после ТЭЛА назначаются НМГ на 3-6 месяцев… По истечении этого срока терапию продолжают неопределённо долго НМГ или АВК, пока онкологическое заболевание не будет вылечено |
IIa |
B |
|
I |
C | |
|
Независимо от продолжительности лечения дозу АВК подбирают так, чтобы МНО поддерживалось на уровне 2.5 (в пределах 2.0-3.0) |
I |
A |
|
a Класс рекомендаций b Уровень доказательности | ||
Установка кава-фильтров
Перевязку нижней полой вены, как метод предотвращения ТЭЛА, впервые предложил Труссо в 1868 году. Кава-фильтр изобретён в 1960 году, его трансвенозная имплантация выполняется уже более 30 лет. Кава-фильтры устанавливают непосредственно ниже устьев почечных вен (табл. 33). Если тромб заходит за почечные вены, возможна более проксимальная позиция фильтра.
Постоянные кава-фильтры могут обеспечить длительную защиту от ТЭЛА, однако их наличие часто сопряжено с такими осложнениями, как посттромботический синдром и рецидивирование ТГВ. Тем не менее, эти осложнения в присутствии кава-фильтра редко приводят к летальному исходу. Ранние осложнения (тромбоз в месте введения фильтра) возникают в 10% случаев, поздние – чаще: рецидив тромбоза глубоких вен встречается в 20% случаев, посттромботический синдром – в 40%. Несмотря на продолжительное лечение антикоагулянтами, окклюзия нижней полой вены возникает у 22% пациентов в течение 5 лет и у 33% больных – в течение 9 лет [41].
Существуют также съёмные кава-фильтры. Их устанавливают на срок не более 2 недель при острой угрозе отрыва флотирующего тромба [46, 63]. Однако на практике временные устройства нередко оставляют на более продолжительный период, что в 10% случаев приводит к развитию поздних осложнений, включая тромбоз и миграцию фильтра.
Отношение
риск/польза установки кава-фильтра
определить нелегко, так как в большинстве
исследований проспективные наблюдения
надлежащим образом не выполнялись, а
рецидивы ТЭЛА не объективизировались.
На данный момент есть данные только по
одному рандомизированному исследованию
(начато в 1998 году), посвящённому
проспективной оценке эффективности и
безопасности применения кава-фильтров.
Больных (400 пациентов) разделили на две
группы: изолированной антикоагулянтной
терапии или лечения антикоагулянтами
в сочетании с установкой постоянного
кава-фильтра. В течение первых 12 дней
частота развития ТЭЛА составила 1,1% у
больных с кава-фильтром и 4,8% - в группе
сравнения. При наблюдении в течение 2
лет разница стала незначительной. Хотя
летальность в этих группах за первые
12 дней не отличались (по 5 смертей, 2.5%),
ТЭЛА выступила причиной 4 смертей в
группе изолированной терапии
антикоагулянтами и ни одной – в группе
больных с установленным кава-фильтром.
По обобщённым данным на 2005 год (наблюдение
в течение 8 лет) установка постоянного
кава-фильтра обеспечивает снижение
частоты ТЭЛА ценой учащения рецидивов
ТГВ и не влияет на выживаемость больных. ![]()
Рутинное использование кава-фильтров при ВТЭ не рекомендуется. В то же время их можно устанавливать при наличии абсолютных противопоказаний к проведению антикоагулянтной терапии у больных с высоким риском рецидива ВТЭ (например, в первые дни после нейрохирургических или других больших операций). Вопрос об установке кава-фильтра следует рассмотреть также при развитии тромбоза у беременных женщин за несколько недель до родов. Как только появится возможность применения антикоагулянтов, временный фильтр должен быть удалён. Однако данных относительно оптимальной продолжительности его использования нет.
Нет также доказательств целесообразности рутинного применения кава-фильтров у больных с флотирующими тромбами в проксимальных глубоких венах. Согласно материалам исследования Pacouret G. с соавт. (1997 г.) частота рецидивов ТЭЛА у таких пациентов без установки кава-фильтра при назначении адекватной антикоагулянтной терапии составила 3,3%. Планируемый тромболизис не является показанием для профилактической установки кава-фильтра [9, 41].
Таблица 33. Рекомендации ЕОК (2008) по установке кава-фильтров с указанием класса рекомендаций и уровней доказательности [41].
|
Рекомендации ЕОК 2008 по установке кава-фильтров |
Класса |
Уровеньb |
|
Устанавливка фильтра в нижнюю полую вену (кава-фильтра) возможна в случаях высокого риска рецидивирования ВТЭ при наличии абсолютных противопоказаний к антикоагулянтной терапии |
IIb |
B |
|
Рутинное применение кава-фильтров при ТЭЛА не рекомендуется |
III |
B |
|
a Класс рекомендаций b Уровень доказательности | ||
Первичная профилактика венозного тромбоэмболизма (ВТЭ)
Необходимость первичной профилактики ВТЭ обоснована следующими положениями:
Почти все стационарные больные имеют как минимум один фактор риска ВТЭ, а 40% - три и более.
Развитие ТГВ – не редкость в самых разных отделениях.
Развившиеся в стационаре ТГВ и ТЭЛА зачастую протекают бессимптомно, при этом скрининговое обследование на предмет выявления ВТЭ неэффективно и дорого.
Неблагоприятные последствия отказа от профилактики: клинически явные ТГВ и ТЭЛА, фатальные ТЭЛА, большие затраты на обследование и лечение при подозрении на ВТЭ, повышенный риск рецидивов ВТЭ и развития осложнений (посттромбофлебитический синдром, хроническая посттромбоэмболическая лёгочная гипертензия).
Использование профилактических мер эффективно снижает частоту ТГВ, в том числе проксимального, предупреждает развитие манифестных форм ТГВ и фатальной ТЭЛА.
Убедительно доказана экономическая эффективность тромбопрофилактики.
ТЭЛА – самая частая предотвратимая причина госпитальной летальности, поэтому должна рассматриваться как первая цель профилактических мероприятий.
Накоплено в избытке доказательство, что применение антикоагулянтов в профилактических дозах безопасно; частота геморрагических осложнений при этом либо не повышается, либо возрастает незначительно.
Польза от профилактики ВТЭ превышает риск [96].
В отсутствие острого венозного тромбоза профилактика ВТЭ и ТЭЛА должна организовываться и производиться следующим образом.
В
первую очередь врач должен оценить риск
развития ВТЭ у своего пациента. Определение
величины этого риска основывается на
наличии, степени выраженности или
отсутствии отдельных факторов риска. ![]()
К ним относятся (см. также табл. 11 , раздел "Первичный, вторичный и идиопатический ВТЭ" ):
Возраст старше 40 лет.
Иммобилизация (дольше 3 дней) или паралич.
Хирургические вмешательства (особенно на органах живота, малого таза и нижних конечностях).
Наличие опухолей.
Инсульты.
Инфаркт миокарда.
Наличие ВТЭ в прошлом.
Варикозное расширение вен.
Переломы костей (особенно таза, бедра, голени).
Сердечная недостаточность .
Венозные катетеры.
Воспалительные заболевания кишечника.
Нефротический синдром.
Беременность и роды.
Прием эстрогенов (контрацепция и гормональная заместительная терапия).
Гепарининдуцированная тромбоцитопения.
Наследственные тромбофилии [46].
В соответствии с рекомендациями по профилактике ВТЭ Американской Коллегии Специалистов По Заболеваниям Органов Грудной Клетки (American College of Chest Physicians (ACCP), 8-й пересмотр, 2008 г.) [96] выделяются группы риска развития ВТЭ. Разделение на группы риска лежит в основе выбора тактики профилактических мероприятий (таблица 34).
Таблица 34. Степень риска развития ВТЭ и рекомендации по его профилактике (первичной) у госпитализированных больных*[96].
|
Степень риска |
Риск развития ВТЭ без профилактики |
Профилактические мероприятия | |
|
Низкий риск |
Малые хирургические операции у активно подвижных больных |
<10% |
Проведение специфической профилактики не требуется. Показана ранняя настойчивая активизация. |
|
Терапевтическая или неврологическая патология у активно подвижных больных | |||
|
Средний риск |
Большинство общехирургических вмешательств, полостные гинекологические и урологические операции, торакальная хирургия |
10-40% |
НМГ (в рекомендуемых дозах) или низкие дозы НФГ два-три раза в сутки или фондапаринукс |
|
Нехирургическая патология у истощённых больных, при длительном постельном режиме | |||
|
Средний риск ВТЭ плюс высокий риск кровотечений |
Механические методы профилактики 1 | ||
|
Высокий риск |
Протезирование коленного или тазобедренного суставов; операции по поводу перелома бедренной кости; |
40-80% |
НМГ (в рекомендуемых дозах) или фондапаринукс или АВК (целевое МНО 2-3) |
|
Тяжёлые травмы, повреждение спинного мозга | |||
|
Высокий риск ВТЭ плюс высокий риск кровотечений |
Механические методы профилактики 1 | ||
|
*Трактовка описательных терминов специально не приводится, что делает возможной индивидуальную клиническую интерпретацию; 1 К механическим методам профилактики относятся перемежающаяся пневматическая компрессия ног, венозные помпы стопы и ношение эластичных чулок с градиентом давления (его уменьшением) от стопы к бедру. | |||
В
настоящее время степень риска ВТЭ
большинством клиницистов определяется
эмпирически. ![]()
Согласно рекомендациям ведущих специалистов ее величина представляется следующим образом:
Минимальный риск развития ВТЭ имеют лица моложе 40 лет, подвергаемые малой хирургической операции (длительность до 30 мин) или имеющие непродолжительную иммобилизацию (до 3 дней), или переносящие легкое заболевание, не требующее госпитализации, при отсутствии иных факторов риска.
Средний риск развития ВТЭ имеют лица, переносящие любую хирургическую операцию в возрасте от 40 до 60 лет при отсутствии иных факторов риска или подвергающиеся большой хирургической операции, длящейся больше 30 мин, или страдающие нефротическим синдромом, либо воспалительным заболеванием кишечника, имеющие недостаточность кровообращения, тяжелую пневмонию , хроническую гемолитическую анемию, хроническую аутоиммунную болезнь соединительной ткани, беременность в возрасте старше 40 лет или иммобилизацию дольше 3 дней.
Высокий риск развития ВТЭ имеют лица старше 60 лет, переносящие хирургическое вмешательство, продолжающееся дольше 30 мин, при отсутствии иных факторов риска, лица в возрасте от 40 до 60 лет, подвергающиеся аналогичному хирургическому вмешательству, но имеющие дополнительный фактор риска, беременные женщины, имеющие тромбофилию или ВТЭ в анамнезе, лица с инфарктом миокарда, инсультом или дегидратацией или же имеющие любое неврологическое заболевание и ВТЭ в анамнезе, лица с тяжелым хроническим заболеванием и тромбофилией, а также лица старше 70 лет.
Очень высокий риск развития ВТЭ имеют лица старше 40 лет, имеющие тромбофилию или неоплазму, или ТГВ и подвергающиеся операции, длительность которой превышает 30 мин, лица, подвергающиеся большой ортопедической операции на крупных суставах, лица с обширной травмой и лица, имеющие повреждения спинного мозга.
К сожалению, все попытки оценки степени риска для пациента не совершенны. Множество факторов риска развития ВТЭ сочетается, и каждый пациент имеет свой риск в каждой конкретной ситуации. В большинстве случаев учитываются такие факторы риска ВТЭ, как возраст, наследственность, наличие операции и онкологических заболеваний и т. д. Но возможны ситуации, когда сочетание менее значительных факторов риска также может привести к тромбообразованию [46].
Профилактика ВТЭ производится в зависимости от риска развития этой патологии немедикаментозными, в том числе хирургическими, методами и путем назначения антикоагулянтной терапии. Основные принципы профилактики ВТЭ заключаются в следующем:
Каждый больной должен быть оценен по степени риска развития ВТЭ.
Всем больным с риском развития ВТЭ необходимо проводить профилактику в зависимости от степени этого риска.
Профилактическое лечение ТЭЛА должно проводиться до тех пор, пока существует риск развития тромбоэмболических осложнений [46].
Общие рекомендации (в частности ACCP 2008) не претендуют на универсальность, они призваны помочь в индивидуальном подборе оптимальной схемы профилактических мероприятий для конкретного больного с учётом оценки функционального состояния органов, имеющихся факторов риска ВТЭ и кровотечений, противопоказаний к тем или иным методам профилактики [96].
Немедикаментозные способы первичной профилактики ВТЭ включают раннюю активизацию больных после перенесенной операции, инфаркта миокарда и инсульта, а также применение механических методов, которые улучшают венозный отток и уменьшают венозный застой: использование градуированного компрессионного лечебного трикотажа, а также проведение перемежающейся пневматической компрессии манжетами, наложенными на голени. Их обычно используют в дополнение к антикоагулянтам, а также у пациентов с высоким риском кровотечений. Для профилактического медикаментозного лечения ТГВ и ТЭЛА применяются оральные антикоагулянты – АВК, гепарины (НФГ и НМГ), фондапаринукс. Применение антиагрегантов, в частности аспирина , признано неэффективным [46].
Механические методы профилактики венозного тромбоэмболизма (ВТЭ)
К механическим методам профилактики относятся перемежающаяся пневматическая компрессия ног, венозные помпы стопы и ношение эластичных чулок с градиентом давления (его уменьшением) от стопы к бедру. Эти методы направлены на ускорение венозного кровотока [63, 96].
Для эластичного массажа применяется бинтование эластичным бинтом, ношение эластичных чулок или гольфов. Они обеспечивают максимальное сдавление ног на уровне лодыжек с постепенным его снижением в проксимальном направлении.
Перемежающаяся пневматическая компрессия ног проводится при помощи специального компрессора и манжет, разделённых на несколько камер, в которые попеременно подаётся воздух (существуют аппараты различной конструкции, в том числе однокамерные). Этот метод имитирует работу мышц нижних конечностей, стимулирует фибринолитическую активность крови. Данный метод ускорения кровотока особенно предпочтителен у больных с параличами и парезами нижних конечностей, так как они не могут двигаться самостоятельно [63].
Как и другим способам профилактики, механическим методам присущи определённые достоинства и недостатки. Достоинства состоят в том, что механические методы:
Не повышают риск кровотечений.
Могут применяться у больных с высоким риском кровотечений.
Эффективны у ряда категорий больных.
Могут усиливать эффект антикоагулянтной профилактики.
Способны уменьшать выраженность отёков.
Несмотря на перечисленные преимущества, отношение к механическим методам профилактики ВТЭ довольно сдержанное. Это объясняется следующими особенностями механических методов профилактики:
Доказательная база по их эффективности значительно слабее, чем для фармакологических методов профилактики.
Нет общепринятых стандартов по размерам устройств, режимам работы, оказываемому давлению.
Многие относящиеся к этой группе аппараты вообще не испытывались в клинических исследованиях.
Практически все исследования, посвящённые изучению механических методов профилактики ВТЭ, не были «слепыми», что может влиять на интерпретацию их результатов.
У больных с высоким риском развития ВТЭ механические методы профилактики менее эффективны, чем антикоагулянты.
Механические методы в большей степени препятствуют развитию тромбоза вен голеней, чем проксимального тромбоза.
Их влияние на развитие ТЭЛА и смертность неизвестно.
Переоценка их роли в профилактике ВТЭ может уменьшить использование более эффективных методов антикоагулянтной профилактики.
Низкая приверженность к их использованию как со стороны пациента, так и со стороны медицинского персонала.
Стоимость, которая определяется затратами на покупку, хранение, очистку.
Согласно рекомендациям ACCP по первичной профилактике ВТЭ механические методы профилактики должны применяться главным образом у больных с высоким риском кровотечений либо как дополнение к профилактике антикоагулянтами; при выборе механических способов профилактики очень важны соблюдение методики их применения и приверженность лечению [96].
Профилактическое применение антиагрегантов при ВТЭ неэффективно
По данным ряда исследований аспирин и другие антиагреганты либо вовсе неэффективны в профилактике ВТЭ, либо существенно уступают в этом антикоагулянтам. Аспирин не должен применяться в качестве самостоятельного метода профилактики ВТЭ [46, 96].
Профилактическое применение антикоагулянтов
Для медикаментозной профилактики ТГВ и ТЭЛА применяются гепарины (нефракционированный гепарин (НФГ) и низкомолекулярный гепарин (НМГ)), фондапаринукс, АВК [46]. В таблице 35 представлены современные схемы профилактического назначения антикоагулянтов при различных состояниях. В руководстве по профилактике ВТЭ ACCP 2008 г. при указании на применение тех или иных препаратов предполагаются режимы введения и дозировки, приводимые в аннотациях производителя [96].
Безусловно, любое фармакологическое вмешательство для пациента небезопасно. Прежде чем применить какой-либо препарат необходимо тщательно оценить как его пользу, так и вред, который он может нанести. В данном случае речь идёт об антикоагулянтной терапии, наиболее грозным осложнением которой является кровотечение. В ряде случаев трудно оценить вероятность развития кровотечения. Так бывает при хронических заболеваниях почек, наличии в анамнезе желудочно-кишечного кровотечения или при сопутствующей антитромбоцитарной терапии [63].
К факторам риска больших кровотечений относятся:
Пожилой возраст (особенно старше 75 лет).
Предшествующие желудочно-кишечные кровотечения.
Инсульт в анамнезе, не связанный с эмболией в сосуды головного мозга.
Хронические заболевания печени или почек.
Одновременное лечение антиагрегантами (избегать, если отказ от антикоагулянтов не повлечёт за собой высокий риск осложнений; например, после стентирования коронарных артерий отменять антиагреганты нельзя).
Тяжелые острые или хронические заболевания.
Неадекватная степень гипокоагуляции.
Невозможность обеспечения надлежащего мониторинга антикоагулянтной терапии [41].
Рекомендуемые режимы первичной профилактики ВТЭ
Таблица 35. Рекомендуемые режимы первичной профилактики ВТЭ [48 с изменениями по материалам 96].
|
Состояния |
Профилактика |
|
Общехирургические операции |
НФГ 5000 ЕД п/к 3 раза в сутки или |
|
Эноксапарин 40 мг п/к 1 раз в сутки или | |
|
Далтепарин 2500 или 5000 ЕД п/к1 раз в сутки или | |
|
Фондапаринукс 2.5 мг п/к 1 раз в сутки. | |
|
Ортопедические операции |
Варфарин с достижением целевого МНО 2.0-3.0 или |
|
Эноксапарин 30 мг п/к 2 раза в сутки или | |
|
Эноксапарин 40 мг п/к 1 раз в сутки или | |
|
Далтепарин 2500 или 5000 ЕД п/к1 раз в сутки или | |
|
Фондапаринукс 2.5 мг п/к 1 раз в сутки. | |
|
Нейрохирургия |
НФГ 5000 ЕД п/к 2 раза в сутки или |
|
Эноксапарин 40 мг п/к 1 раз в сутки и | |
|
Эластическая компрессия (чулки, бинтование) с градиентом давления (его уменьшением) от стопы к бедру/перемежающаяся пневмокомпрессия ног. | |
|
Периодически УЗДГ вен нижних конечностей с целью ранней диагностики тромбоза. | |
|
Онкохирургия |
Эноксапарин 40 мг п/к 1 раз в сутки. |
|
Торакальная хирургия |
НФГ 5000 ЕД п/к 2 раза в сутки или |
|
Эноксапарин 40 мг п/к 1 раз в сутки или | |
|
Далтепарин 2500 или 5000 ЕД п/к 1 раз в сутки или | |
|
Фондапаринукс 2.5 мг п/к 1 раз в сутки. | |
|
Эластическая компрессия (чулки, бинтование) с градиентом давления (его уменьшением) от стопы к бедру/перемежающаяся пневмокомпрессия ног. | |
|
Нехирургическая (терапевтическая, неврологическая) патология |
НФГ 5000 ЕД п/к 2 раза в сутки или |
|
Эноксапарин 40 мг п/к 1 раз в сутки или | |
|
Далтепарин 5000 ЕД п/к 1 раз в сутки или | |
|
Фондапаринукс 2.5 мг п/к 1 раз в сутки или | |
|
Эластическая компрессия (чулки, бинтование) с градиентом давления (его уменьшением) от стопы к бедру/перемежающаяся пневмокомпрессия ног при наличии противопоказаний к назначению антикоагулянтов. | |
|
Сочетание механических методов профилактики с назначением антикоагулянтов у больных очень высокого риска. | |
|
У больных в отделениях интенсивной терапии целесообразно периодически выполнять УЗДГ вен нижних конечностей с целью ранней диагностики тромбоза. |
При почечной недостаточности нарушается элиминация НМГ и фондапаринукса, в результате чего они могут накапливаться и повышать риск геморрагических осложнений. При этом различные препараты из группы НМГ по-разному выводятся почками. Так, при назначении далтепарина в дозе 5000 ЕД один раз в сутки больным с клиренсом креатинина менее 30 мл/мин аккумуляции препарата не было (судя по мониторингу анти-фактор Xa активности плазмы). Тем не менее, при решении вопроса о профилактическом назначении НМГ, фондапаринукса или других препаратов, выводящихся почками, необходимо оценить функцию почек, особенно у пожилых людей, больных, страдающих сахарным диабетом, и при высоком риске кровотечений. Препаратом выбора для профилактики ВТЭ у больных с тяжёлой почечной недостаточностью (клиренс креатинина менее 30 мл/мин) является НФГ. При выявлении почечной недостаточности возможно три подхода: отказ от назначения склонных к аккумуляции при почечной недостаточности препаратов (НМГ, фондапаринукса), уменьшение их дозы, мониторинг уровня препаратов в крови или антикоагулянтной активности [96, 97].
При наличии гепарин-индуцированной тромбоцитопении в анамнезе препаратами выбора для профилактики ВТЭ являются фондапаринукс и данапароид (низкомолекулярный гепариноид, используемый для лечения гепарин-индуцированной тромбоцитопении) [97].
Подходы к первичной профилактике ВТЭ у разных категорий больных
Первичная профилактика ВТЭ в хирургии
При выполнении больших открытых операций в общей хирургии, гинекологии, урологии, торакальной хирургии, в травматологии и ортопедии показано рутинное применение антикоагулянтной тромбопрофилактики (табл. 35).
Антикоагулянты назначаются за 2-12 часов до операции. Продолжительность антикоагулянтной профилактики определяется объёмом операции, наличием дополнительных факторов риска. При неосложнённом течении послеоперационного периода после неонкологических операций антикоагулянтная тромбопрофилактика обычно продолжается до выписки пациента из стационара (когда больной активно подвижен). После операций по поводу рака, а также при наличии эпизодов ВТЭ в анамнезе тромбопрофилактика продолжается до 28 дней.
При больших ортопедических операциях (протезирование тазобедренного и коленного суставов, операции по поводу перелома бедренной кости) антикоагулянты назначаются непосредственно перед операцией (НМГ) или после операции (НМГ и фондапаринукс через 6-8 часов или на следующий день). Продолжительность антикоагулянтной профилактики составляет 10-35 дней (АВК с поддержкой МНО на уровне 2-3 или НМГ или фондапаринукс).
После нейрохирургических операций показано применение механических методов профилактики ВТЭ или антикоагулянтов, а также их сочетание при наличии дополнительных факторов риска ВТЭ.
Антикоагулянтная профилактика показана после больших травм, в особенности при повреждении спинного мозга; при распространённых ожогах, особенно у больных с дополнительными факторами риска ВТЭ.
При высоком риске кровотечений у больных, которым показана тромбопрофилактика, назначаются механические методы профилактики. Антикоагулянты назначаются, как только появляется такая возможность.
Сосудистая хирургия – единственная область хирургии, в которой при больших операциях рутинная антикоагулянтная профилактика не применяется. Это связано с тем, что: 1) риск развития ВТЭ во время таких операций невысок; 2) в большинстве случаев во время операций на сосудах больным вводятся антикоагулянты, а в послеоперационном периоде назначаются антиагреганты; 3) согласно данным небольшого количества исследований польза от профилактического назначения антикоагулянтов в этой группе больных не оправдывает риск кровотечений. Показана ранняя настойчивая активизация больных. Решение о проведении антикоагулянтной профилактике ВТЭ у этих больных принимается лечащим врачом на основании анализа индивидуальных факторов риска больного и локальных инструкций данного стационара [21, 55, 96].
Первичная профилактика ВТЭ в терапии и неврологии
От 50 до 70% клинически явных эпизодов ВТЭ и 70-80% летальных ТЭЛА приходится на нехирургических больных. Согласно рекомендациями ACCP 2008 по профилактике ВТЭ антикоагулянтную тромбопрофилактику (НМГ, низкие дозы НФГ, фондапаринукс) должны получать все госпитализированные больные с застойной сердечной недостаточностью, тяжёлыми заболеваниями дыхательной системы, нуждающиеся в длительном постельном режиме, а также при наличии одного или нескольких дополнительных факторов риска: имеющееся онкологическое заболевание, сепсис, воспалительные заболевания кишечника, острое неврологическое заболевание, эпизоды ВТЭ в анамнезе (см. таблицу 36). При наличии противопоказаний к применению антикоагулянтов (таблица 37) используются механические методы профилактики ВТЭ [96]. В таблице 38 приводятся режимы дозирования антикоагулянтов для первичной профилактики ВТЭ у больных нехирургического профиля (см. также табл. 35).
Относительно продолжительности профилактики у больных нехирургического профиля нет единого мнения. Обычно антикоагулянты назначаются на 7-10 дней. В недавно проведённом исследовании эноксапарин по 40 мг один раз в сутки с профилактической целью вводился в течение 5 недель (группа сравнении – 10 дней), при этом существенно снижалась частота ВТЭ, однако возрастал риск больших кровотечений (0.6% в основной группе против 0.15% в группе сравнения) [97].
Таблица
36. Показания к проведению первичной
антикоагулянтной профилактики ВТЭ у
госпитализированных больных
нехирургического профиля [97 с изменениями
по 96]. ![]()
|
Показания к проведению первичной профилактики ВТЭ |
Комментарии |
|
Уменьшенная подвижность |
Унифицированного определения «уменьшенной подвижности» нет |
|
Профилактика ВТЭ показана больных при строгом постельном режиме (даже если разрешено посещение ванны и туалета), а также в случаях, когда больной не встаёт с постели в течение дня более 50% времени | |
|
ТГВ или ТЭЛА в анамнезе |
Большие факторы риска развития ВТЭ в стационаре |
|
Недавняя госпитализация |
Большой фактор риска развития ВТЭ в стационаре |
|
Ишемический инсульт |
В отсутствии профилактики риск развития ТГВ при парезах и параличах нижних конечностей составляет 40-60% |
|
Застойная сердечная недостаточность |
Большинство госпитализированных больных с этой патологией имеет III-IV функциональный класс сердечной недостаточности по NYHA |
|
ХОБЛ и интерстициальные заболевания лёгких |
Большинство госпитализированных больных страдает тяжёлыми формами указанных заболеваний |
|
Тяжёлые воспалительные заболевания |
Например, обострения воспалительных заболеваний кишечника, ревматоидного артрита, системной красной волчанки |
|
Тяжёлые инфекционные заболевания |
Например, пневмония, пиелонефрит, целлюлит, менингит, сепсис |
Таблица
37. Противопоказания к проведению
антикоагулянтной профилактики ВТЭ у
госпитализированных больных
нехирургического профиля [97]. ![]()
|
Противопоказания |
Комментарии |
|
Активное кровотечение |
Например, больные, поступившие с желудочно-кишечным кровотечением или внутримозговым кровоизлиянием |
|
Высокий риск кровотечения |
Субъективная оценка (например, больные, которые в течение последнего месяца госпитализировались по поводу кровотечения) |
|
Нарушенный гемостаз |
Например, МНО > 1.5, АЧТВ > 40 секунд, тромбоциты < 75x10 9 /л |
Таблица
38. Антикоагулянтные методы профилактики
ВТЭ у больных нехирургического профиля
[97]. ![]()
|
Антикоагулянт |
Режим дозирования |
Комментарий |
|
Нефракционированный гепарин (НФГ) |
5000 ЕД п/к 2 раза/сутки |
Обычный режим для больных нехирургического профиля |
|
5000 ЕД п/к 3 раза/сутки |
Режим, который может назначаться при очень высоком риске ВТЭ, а также у больных с выраженным ожирением (ИМТ более 35 кг/м 2 ) | |
|
|
Препарат выбора при почечной недостаточности | |
|
Эноксапарин |
40 мг п/к 1 раз/сутки |
Не изучался у больных с почечной недостаточностью |
|
30 мг п/к 2 раза/сутки |
Повышенная доза; эффективно предотвращает ВТЭ у хирургических больных и может назначаться при выраженном ожирении | |
|
|
Единственный на данный момент препарат, который с профилактической целью назначался в исследованиях на длительный срок (около 5 недель) | |
|
Далтепарин |
5000 ЕД п/к 1 раз/сутки |
Альтернатива НФГ у больных с почечной недостаточностью |
|
Тинзапарин |
75 МЕ/кг п/к 1 раз/сутки или 4500 МЕ п/к 1 раз/сутки |
Эффективная доза в плане предотвращения ВТЭ у больных после больших операций, однако эта схема не изучалась в исследованиях по профилактике ВТЭ у больных нехирургического профиля |
|
Фондапаринукс |
2.5 мг 1 раз/сутки |
Не изучался у больных с почечной недостаточностью |
|
Более длительный период полувыведения (17 часов) по сравнению с НМГ (4-6 часов) | ||
|
Используется для профилактики у больных, с гепарин-индуцированной тромбоцитопенией в анамнезе. |
Первичная профилактика ВТЭ у онкологических больных
Согласно рекомендациями ACCP 2008 при онкологических заболеваниях первичная профилактика ВТЭ должна проводиться в соответствии с программами для хирургических или нехирургических больных. Если у больного раком не планируется оперативное вмешательство и нет тяжёлого терапевтического или неврологического заболевания, рутинное назначение антикоагулянтов в качестве первичной профилактики ВТЭ не оправдано, даже если установлен центральный венозный катетер, проводится химиотерапия или лечение гормонами [96].
Первичная профилактика ВТЭ при длительных перелётах
Согласно рекомендациям ACCP 2008 люди, совершающие перелёты длительностью более 8 часов, должны соблюдать следующие правила, предотвращающие развитие ВТЭ: не надевать на время путешествия одежду, сдавливающую талию или ноги, потреблять достаточное количество воды, периодически вставать и ходить по салону (активация мышечной венозной помпы). Если путешественник относится к группе высокого риска развития ВТЭ, ему следует рекомендовать на время полёта надевать эластичные чулки ниже колен, создающие градиент давления от 15 до 30 мм рт. ст., или однократную инъекцию профилактической дозы НМГ до полёта. Применение аспирина с целью профилактики ВТЭ не рекомендуется [16, 96].
Список литературы
1. Мельник М.В., Санодзе И.Д., Сиротина И.Л., Шилов А.М. Тромбоэмболия ветвей легочной артерии: патофизиология, клиника, диагностика, лечение. РМЖ 2003 г, том 11, № 9.
http://www.rmj.ru/articles_623.htm
2. Матюшенко А.А. Тромбоэмболия легочных артерий как общемедицинская проблема. РМЖ, 1999 г, том 7, № 13.
http://www.rmj.ru/articles_1925.htm
3. Simpson V.M.A., Pescott M., Peebles D., Cohen H. Anti-Xa monitoring is required in pregnant women on low molecular weight heparin (LMWH). Journal of Thrombosis and Haemostasis 2009; Volume 7, Supplement 2: abstract number PP-TH-384.
http://www.blackwellpublishing.com/isth2009/abstract.asp?id=79021
4. В.Б.Яковлев, М.В.Яковлева. Тромбоэмболия легочной артерии: патофизиология, диагностика, лечебная тактика. Consilium medicum, том 07/N 6/2005.
http://www.consilium-medicum.com/media/consilium/05_06/493.shtml
5. А.Л.Верткин, В.Л.Бараташвили, С.А.Беляева. Тромбоэмболия легочной артерии. Consilium medicum, том 08/N 12/2006.
http://www.consilium-medicum.com/media/consilium/06_12/30.shtml
6. Kostadima E, Zakynthinos E. Pulmonary embolism: pathophysiology, diagnosis, treatment. Hellenic J Cardiol. 2007 Mar-Apr;48(2):94-107.
http://www.hellenicjcardiol.org/archive/full_text/2007/2/2007_2_94.pdf
7. Carlbom DJ, Davidson BL. Pulmonary embolism in the critically ill. Chest. 2007 Jul;132(1):313-24.
http://www.chestjournal.org/cgi/content/full/132/1/313
8. Cloutier LM. Diagnosis of pulmonary embolism. Clin J Oncol Nurs. 2007 Jun;11(3):343-8.
9. Patel SH, Patel R. Inferior vena cava filters for recurrent thrombosis: current evidence. Tex Heart Inst J. 2007;34(2):187-94.
http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=17622366
10. Scarsbrook AF, Gleeson FV. Investigating suspected pulmonary embolism in pregnancy. BMJ. 2007 Feb 24;334(7590):418-9.
http://www.bmj.com/cgi/content/full/334/7590/418
11. Snow V, Qaseem A, Barry P, Hornbake ER, Rodnick JE, Tobolic T, Ireland B, Segal J, Bass E, Weiss KB, Green L, Owens DK; The Joint American College Of Physicians/american Academy Of Family Physicians Panel On Deep Venous Thrombosis/pulmonary Embolism. Management of venous thromboembolism: a clinical practice guideline from the American College of Physicians and the American Academy of Family Physicians. Ann Fam Med. 2007 Jan-Feb;5(1):74-80.
http://www.annfammed.org/cgi/content/full/5/1/74
12. Summaries for patients. Treatment of venous thromboembolism: recommendations from the American College of Physicians and the American Academy of Family Physicians. Ann Intern Med. 2007 Feb 6;146(3):I43. Epub 2007 Jan 29.
http://www.annals.org/cgi/content/full/146/3/I-43
13. Blann AD, Lip GY. Venous thromboembolism. BMJ. 2006 Jan 28;332(7535):215-9.
http://www.bmj.com/cgi/content/full/332/7535/215
14. Segal JB, Eng J, Tamariz LJ, Bass EB. Review of the evidence on diagnosis of deep venous thrombosis and pulmonary embolism. Ann Fam Med. 2007 Jan-Feb;5(1):63-73.
http://www.annfammed.org/cgi/content/full/5/1/63
15. Qaseem A, Snow V, Barry P, Hornbake ER, Rodnick JE, Tobolic T, Ireland B, Segal J, Bass E, Weiss KB, Green L, Owens DK; Joint American Academy of Family Physicians/American College of Physicians Panel on Deep Venous Thrombosis/Pulmonary Embolism. Current diagnosis of venous thromboembolism in primary care: a clinical practice guideline from the American Academy of Family Physicians and the American College of Physicians. Ann Fam Med. 2007 Jan-Feb;5(1):57-62.
http://www.annfammed.org/cgi/content/full/5/1/57
16. Brenner B. Travel-related thrombosis: is this a problem? Isr Med Assoc J. 2006 Dec;8(12):859-61.
http://www.ima.org.il/imaj/dynamic/web/ArtFromPubmed.asp?year=2006&month=12&page=859
17. Peacock A, Simonneau G, Rubin L. Controversies, uncertainties and future research on the treatment of chronic thromboembolic pulmonary hypertension. Proc Am Thorac Soc. 2006 Sep;3(7):608-14.
http://pats.atsjournals.org/cgi/content/full/3/7/608
18. Tapson VF, Humbert M. Incidence and prevalence of chronic thromboembolic pulmonary hypertension: from acute to chronic pulmonary embolism. Proc Am Thorac Soc. 2006 Sep;3(7):564-7.
http://pats.atsjournals.org/cgi/content/full/3/7/564
19. Via G, Braschi A. Pathophysiology of severe pulmonary hypertension in the critically ill patient. Minerva Anestesiol. 2004 Apr;70(4):233-7.
http://www.minervamedica.it/index2.t?show=R02Y2004N04A0233
20. Kroegel C, Reissig A. Principle mechanisms underlying venous thromboembolism: epidemiology, risk factors, pathophysiology and pathogenesis. Respiration. 2003 Jan-Feb;70(1):7-30.
http://content.karger.com/produktedb/produkte.asp?typ=fulltext&file=RES70007#OLN
21. Cardiovascular Disease Educational and Research Trust; Cyprus Cardiovascular Disease Educational and Research Trust; European Venous Forum; International Surgical Thrombosis Forum; International Union of Angiology; Union Internationale de Phlébologie. Prevention and treatment of venous thromboembolism. International Consensus Statement (guidelines according to scientific evidence). Int Angiol. 2006 Jun;25(2):101-61.
http://www.minervamedica.it/index2.t?show=R34Y2006N02A0101
22. Tapson VF. Acute pulmonary embolism. N Engl J Med. 2008 Mar 6;358(10):1037-52.
http://content.nejm.org/cgi/content/full/358/10/1037
23. Riedel M. Diagnosing pulmonary embolism. Postgrad Med J. 2004 Jun;80(944):309-19.
http://pmj.bmj.com/cgi/content/full/80/944/309
24. Fedullo PF, Tapson VF. Clinical practice. The evaluation of suspected pulmonary embolism. N Engl J Med. 2003 Sep 25;349(13):1247-56.
http://content.nejm.org/cgi/content/full/349/13/1247?ijkey=b2ac3b931618099823dcdc3880df65773db8e8ba&keytype2=tf_ipsecsha
25. НЕОТЛОЖНАЯ ПОМОЩЬ. ТРОМБОЭМБОЛИЯ ЛЕГОЧНОЙ АРТЕРИИ. РМЖ, 1998 г, том 6, № 24.
http://www.rmj.ru/articles_2359.htm
26. Dalen JE. Pulmonary embolism: what have we learned since Virchow? Natural history, pathophysiology, and diagnosis. Chest. 2002 Oct;122(4):1440-56.
http://www.chestjournal.org/cgi/content/full/122/4/1440
27. British Thoracic Society Standards of Care Committee Pulmonary Embolism Guideline Development Group. British Thoracic Society guidelines for the management of suspected acute pulmonary embolism. Thorax. 2003 Jun;58(6):470-83.
http://thorax.bmj.com/cgi/content/full/58/6/470
28. Guidelines on diagnosis and management of acute pulmonary embolism. Task Force on Pulmonary Embolism, European Society of Cardiology. Eur Heart J. 2000 Aug;21(16):1301-36.
http://eurheartj.oxfordjournals.org/cgi/content/refs/21/16/1301
29. Kucher N. Catheter embolectomy for acute pulmonary embolism. Chest. 2007 Aug;132(2):657-63.
http://www.chestjournal.org/cgi/content/full/132/2/657
30. Galiè N, Kim NH. Pulmonary microvascular disease in chronic thromboembolic pulmonary hypertension. Proc Am Thorac Soc. 2006 Sep;3(7):571-6.
http://pats.atsjournals.org/cgi/content/full/3/7/571
31. Riedel M. Acute pulmonary embolism 1: pathophysiology, clinical presentation, and diagnosis. Heart. 2001 Feb;85(2):229-40.
http://heart.bmj.com/cgi/content/full/85/2/229
32. Riedel M. Acute pulmonary embolism 2: treatment. Heart. 2001 Mar;85(3):351-60.
http://heart.bmj.com/cgi/content/full/85/3/351
33. И.Кириенко, А.А.Матюшенко, В.В.Андрияшкин, Д.А.Чуриков. Тромбоэмболия легочных артерий: диагностика, лечение и профилактика. Consilium medicum, Том 3/N 6/2001.
http://www.consilium-medicum.com/media/consilium/01_06/289.shtml
34. Goldhaber SZ, Morrison RB. Cardiology patient pages. Pulmonary embolism and deep vein thrombosis. Circulation. 2002 Sep 17;106(12):1436-8.
http://circ.ahajournals.org/cgi/content/full/106/12/1436
35. Goldhaber SZ. Pulmonary embolism. N Engl J Med. 1998 Jul 9;339(2):93-104.
http://content.nejm.org/cgi/content/full/339/2/93?ijkey=16fe064520cce2b0525b7dc2ad118cb3ecffbb01&keytype2=tf_ipsecsha
36. Anderson FA Jr, Spencer FA. Risk factors for venous thromboembolism. Circulation. 2003 Jun 17;107(23 Suppl 1):I9-16.
http://circ.ahajournals.org/cgi/content/full/107/23_suppl_1/I-9
37. Richard H. White. The Epidemiology of Venous Thromboembolism. Circulation. 2003;107:I-4-I-8.
http://circ.ahajournals.org/cgi/content/full/107/23_suppl_1/I-4
38. Clive Kearon. Natural History of Venous Thromboembolism. Circulation. 2003;107:I-22-I-30.
http://circ.ahajournals.org/cgi/content/full/107/23_suppl_1/I-22
39. Lee AY, Levine MN. Venous thromboembolism and cancer: risks and outcomes. Circulation. 2003 Jun 17;107(23 Suppl 1):I17-21.
http://circ.ahajournals.org/cgi/content/full/107/23_suppl_1/I-17
40. Parmet S, Lynm C, Glass RM. JAMA patient page. Pulmonary embolism. JAMA. 2006 Jan 11;295(2):240.
http://jama.ama-assn.org/cgi/content/full/295/2/240
41. Guidelines on the diagnosis and management of acute pulmonary embolism: the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). Eur Heart J. 2008 Sep;29(18):2276-315.
http://www.ncbi.nlm.nih.gov/pubmed/18757870?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSum
http://www.escardio.org/guidelines-surveys/esc-guidelines/Pages/acute-pulmonary-embolism.aspx
42. Le Gal G, Righini M, Roy PM, Sanchez O, Aujesky D, Bounameaux H, Perrier A. Prediction of pulmonary embolism in the emergency department: the revised Geneva score.
http://www.annals.org/cgi/content/full/144/3/165
43. Wells PS, Anderson DR, Rodger M, Ginsberg JS, Kearon C, Gent M, Turpie AG, Bormanis J, Weitz J, Chamberlain M, Bowie D, Barnes D, Hirsh J. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer. Thromb Haemost. 2000 Mar;83(3):416-20.
http://www.schattauer.de/index.php?id=1268&pii=th00030416&no_cache=1
44. Wicki J, Perneger TV, Junod AF, Bounameaux H, Perrier A. Assessing clinical probability of pulmonary embolism in the emergency ward: a simple score. Arch Intern Med. 2001 Jan 8;161(1):92-7.
http://archinte.ama-assn.org/cgi/content/full/161/1/92
45. Панченко Е. Профилактика и лечение венозных тромбозов в клинике внутренних болезней. Врач, №7, 2003.
46. И.Н.Бокарев, Л.В.Попова, Т.Б.Кондратьева. Венозный тромбоэмболизм: лечение и профилактика. Consilium medicum, том 07/N 1/2005.
http://www.consilium-medicum.com/media/surgery/05_01/5.shtml
47. Piazza G, Goldhaber SZ. Acute pulmonary embolism: part I: epidemiology and diagnosis. Circulation. 2006 Jul 11;114(2):e28-32.
http://circ.ahajournals.org/cgi/content/full/114/2/e28
48. Piazza G, Goldhaber SZ. Acute pulmonary embolism: part II: treatment and prophylaxis. Circulation. 2006 Jul 18;114(3):e42-7.
http://circ.ahajournals.org/cgi/content/full/114/3/e42
49. Geibel A, Zehender M, Kasper W, Olschewski M, Klima C, Konstantinides SV. Prognostic value of the ECG on admission in patients with acute major pulmonary embolism. Eur Respir J. 2005 May;25(5):843-8.
http://erj.ersjournals.com/cgi/content/full/25/5/843
50. Анна Карташева. Тромбоэмболия легочной артерии. Новые рекомендации ESC (2008). Medicine Review, №4, 2008, стр. 56-64.
http://medreview.com.ua/issues/4/article5
51. Г.Е. Ройтберг, А.В. Струтынский. Внутренние болезни. Сердечно-сосудистая система. М.: Бином, 2007 г.
http://medbook.medicina.ru/index.php?id_level=1
52. Руководство по кардиологии: Учебное пособие в 3 т. /Под ред. Г. И. Сторожакова, А. А. Горбанченкова. – М.: Гэотар-Медиа, 2008. – Т. 2.
53. Heit JA. The epidemiology of venous thromboembolism in the community. Arterioscler Thromb Vasc Biol. 2008 Mar;28(3):370-2.
http://atvb.ahajournals.org/cgi/content/full/28/3/370
54. Котельников М.В., Котельникова Н.Ю. Диагностика и лечение тромбоэмболии легочной артерии. РМЖ, 2008 г, том 16, № 17.
http://www.rmj.ru/articles_6059.htm
55. Jaffer AK, Amin AN, Brotman DJ, Deitelzweig SB, McKean SC, Spyropoulos AC. Prevention of venous thromboembolism in the hospitalized medical patient. Cleve Clin J Med. 2008 Apr;75 Suppl 3:S7-16.
http://www.ccjm.org/content/75/Suppl_3/S7.long
56. Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST электрокардиограммы. Российские рекомендации Разработаны Комитетом экспертов Всероссийского научного общества кардиологов. Москва 2007.
57. Van de Werf F, Bax J, Betriu A, Blomstrom-Lundqvist C, Crea F, Falk V, Filippatos G, Fox K, Huber K, Kastrati A, Rosengren A, Steg PG, Tubaro M, Verheugt F, Weidinger F, Weis M; ESC Committee for Practice Guidelines (CPG), Vahanian A, Camm J, De Caterina R, Dean V, Dickstein K, Filippatos G, Funck-Brentano C, Hellemans I, Kristensen SD, McGregor K, Sechtem U, Silber S, Tendera M, Widimsky P, Zamorano JL, Silber S, Aguirre FV, Al-Attar N, Alegria E, Andreotti F, Benzer W, Breithardt O, Danchin N, Di Mario C, Dudek D, Gulba D, Halvorsen S, Kaufmann P, Kornowski R, Lip GY, Rutten F. Management of acute myocardial infarction in patients presenting with persistent ST-segment elevation: the Task Force on the Management of ST-Segment Elevation Acute Myocardial Infarction of the European Society of Cardiology. Eur Heart J. 2008 Dec;29(23):2909-45.
http://eurheartj.oxfordjournals.org/cgi/content/full/29/23/2909
58. Современные подходы к диагностике и лечению хронической постэмболической легочной гипертензии. О.Я. Бабак, Е.О. Крахмалова. Український кардіологічний журнал 3/2006, 114-125.
59. Kurzyna M, Torbicki A, Pruszczyk P, Burakowska B, Fijałkowska A, Kober J, Oniszh K, Kuca P, Tomkowski W, Burakowski J, Wawrzyńska L. Disturbed right ventricular ejection pattern as a new Doppler echocardiographic sign of acute pulmonary embolism. Am J Cardiol. 2002 Sep 1;90(5):507-11.
http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B6T10-46MCCD3-D&_user=10&_rdoc=1&_fmt=&_orig=search&_sort=d&_docanchor=&view=c&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=8a0bd7db0d245bd93e2f5ac78488b1e8
60. Grifoni S, Olivotto I, Cecchini P, Pieralli F, Camaiti A, Santoro G, Pieri A, Toccafondi S, Magazzini S, Berni G, Agnelli G. Utility of an integrated clinical, echocardiographic, and venous ultrasonographic approach for triage of patients with suspected pulmonary embolism. Am J Cardiol. 1998 Nov 15;82(10):1230-5.
61. Roy PM, Meyer G, Vielle B, Le Gall C, Verschuren F, Carpentier F, Leveau P, Furber A; EMDEPU Study Group. Appropriateness of diagnostic management and outcomes of suspected pulmonary embolism. Ann Intern Med. 2006 Feb 7;144(3):157-64.
62. Тромбоэмболия легочной артерии в практике интерниста: Учебное пособие / А. М. Бахирев, М. В. Лизенко, В. И. Петровский. – Петрозаводск.: Изд-во ПетрГУ, 2006. – 92 с.
63. Бокарев И. Н., Попова Л. В. Венозный тромбоэмболизм и тромбоэмболия лёгочной артерии. - М.: Медицинское информационное агентство, 2005. - 208 с.
64. О. С. Елагин. Тромбоэмболия лёгочной артерии. Часть I. Клиника и диагностика. Кардиология, 10, 1994. 46-56.
65. М. И. Теодори. Массивные лёгочные эмболии (К диагностике и профилактике). Клиническая медицина, 1963 г., т. 41, №6, с. 5-14.
66. М. И. Теодори, Р. Д. Штерн, Н. Я. Шведова, М. Д. Момот, В. Д. Арутюнов. Об эмболии (тромбозе) лёгочной артерии (клинико-анатомические параллели). Труды XV всесоюзного съезда терапевтов (под ред. А.Л. Мясникова), 1962 г, с. 230-239.
67. Е. Б. Кривчиков. Об ошибках в диагностике тромбоэмболии лёгочной артерии. Материалы научно-практической конференции врачей белгородской области и 1-й клинической больницы г. Харькова по вопросам кардиологии и гастроэнтерологии. Белгород – 1969, с. 42-47.
68. Е. С. Брусиловский, И. П. Лернер. Тромбоэмболии лёгочной артерии и их дифференциальная диагностика с инфарктом миокарда. Вопросы лёгочной патологии и лёгочного сердца. Государственное медицинское издательство УССР, Киев – 1962., стр. 308-317.
69. П. М. Золочевский. Вопросы дифференциальной диагностики тромбоэмболии легочной артерии. Материалы первого всероссийского съезда кардиологов (1-5 октября 1968 года). Издательство воронежского университета, Воронеж, 1968 г., стр. 377-379.
70. Мурашко В. В., Струтынский А. В. Электрокардиография: учебное пособие. – 4-е изд. – М.: МЕДпресс, 2000. – 312 с., илл.
71. Орлов В. Н. Руководство по электрокардиографии. 3-е издание. – М.: ООО «Медицинское информационное агентство», 2003. – 528 с.: ил.
72. Van Mieghem C, Sabbe M, Knockaert D. The clinical value of the ECG in noncardiac conditions. Chest. 2004 Apr;125(4):1561-76.
http://www.chestjournal.org/content/125/4/1561.long
73. Hendel RC, Satran A, Hoffberger J, Savage EB. Images in cardiovascular medicine. Massive pulmonary embolization: diagnostic and therapeutic images. Circulation. 2003 Jul 1;107(25):e224-5.
http://circ.ahajournals.org/cgi/content/full/107/25/e224
74. Cheng AS, Money-Kyrle A. Instructive ECG series in massive bilateral pulmonary embolism. Heart. 2005 Jul;91(7):860-2.
http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=15958344
75. Livaditis IG, Paraschos M, Dimopoulos K. Massive pulmonary embolism with ST elevation in leads V1-V3 and successful thrombolysis with tenecteplase. Heart. 2004 Jul;90(7):e41.
http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=15201267
76. Van Opstal JM, Bekkers SC, Gorgels AP. A dancing thrombus in the right atrium going hand-in-hand with the electrocardiogram. Eur J Echocardiogr. 2008 Jan;9(1):80.
http://ejechocard.oxfordjournals.org/cgi/content/full/9/1/80#JEUJE200701004F1
77. Han D, Lee KS, Franquet T, Müller NL, Kim TS, Kim H, Kwon OJ, Byun HS. Thrombotic and nonthrombotic pulmonary arterial embolism: spectrum of imaging findings. Radiographics. 2003 Nov-Dec;23(6):1521-39.
http://radiographics.rsna.org/content/23/6/1521.long
78. Sreenivasan S, Bennett S, Parfitt VJ. Images in cardiovascular medicine. Westermark's and Palla's signs in acute pulmonary embolism. Circulation. 2007 Feb 27;115(8):e211.
79. Blaustein HS, Schur I, Shapiro JM. Acute massive pulmonary embolism in a Jehovah's witness: successful treatment with catheter thrombectomy. Chest. 2000 Feb;117(2):594-7.
http://www.chestjournal.org/content/117/2/594.long
80. Wittram C, Maher MM, Yoo AJ, Kalra MK, Shepard JA, McLoud TC. CT angiography of pulmonary embolism: diagnostic criteria and causes of misdiagnosis. Radiographics. 2004 Sep-Oct;24(5):1219-38.
http://radiographics.rsna.org/content/24/5/1219.full?maxtoshow=&HITS=150&hits=150&RESULTFORMAT=&fulltext=pulmonary+embolism&searchid=1FIRSTINDEX=0resourcetype=HWFIG
81. Patel S, Kazerooni EA. Helical CT for the evaluation of acute pulmonary embolism. AJR Am J Roentgenol. 2005 Jul;185(1):135-49.
http://www.ajronline.org/cgi/content/full/185/1/135
82. Wittram C. How I do it: CT pulmonary angiography. AJR Am J Roentgenol. 2007 May;188(5):1255-61.
http://www.ajronline.org/cgi/content/full/188/5/1255
83. Moll S. A clinical perspective of venous thromboembolism. Arterioscler Thromb Vasc Biol. 2008 Mar;28(3):373-9.
http://atvb.ahajournals.org/cgi/content/full/atvbaha;28/3/373
84. Pond GD, Ovitt TW, Capp MP. Comparison of conventional pulmonary angiography with intravenous digital subtraction angiography for pulmonary embolic disease. Radiology. 1983 May;147(2):345-50.
http://radiology.rsna.org/content/147/2/345.long
85. Ikenouchi H, Sugishita Y, Tabei F, Itoh N, Nozaki A, Tanaka S, Kasahara K, Kamata S. Images in cardiovascular medicine. Pulmonary embolism due to popliteal venous aneurysm. Circulation. 2008 Jan 29;117(4):585-7.
http://www.circ.ahajournals.org/cgi/content/full/117/4/585
86. Acar G, Köroğlu S, Sökmen A, Tuncer C. Case images: pulmonary thromboembolism caused by a giant free-floating right atrial thrombus. Turk Kardiyol Dern Ars. 2008 Mar;36(2):131.
87. Wilson GT, Schaller FA. Pulmonary embolism mimicking anteroseptal acute myocardial infarction. J Am Osteopath Assoc. 2008 Jul;108(7):344-9.
http://www.jaoa.org/cgi/content/full/108/7/344
88. Teng Moua, Kenneth Wood. COPD and PE: A clinical dilemma. International Journal of COPD 2008:3(2) 277–284.
89. Клинические рекомендации: хроническая обструктивная болезнь лёгких. Под ред. Чучалина А. Г. – М.: Издательство «Атмосфера», 2003. – 168 с., ил.
90. Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких (пересмотр 2007 г.) / Пер. с англ. под ред. Чучалина А.Г. — М.: Издательский дом «Атмосфера», 2008. — 100 с., ил.
91. A. E. L. Stebbings and Tow K. Lim. A Patient With Acute Exacerbation of COPD Who Did Not Respond to Conventional Treatment. Chest 1998;114;1759-1761.
92. Интенсивная терапия/ В. Д. Малышев, И. В. Веденина, Х. Т. Омаров и др.; под ред. Проф. В. Д. Малышева. – М.: Медицина, 2002. – 584 с.: ил.
93. Руководство по кардиологии: Учебное пособие в 3 т. /Под ред. Г. И. Сторожакова, А. А. Горбанченкова. – М.: Гэотар-Медиа, 2008. – Т. 3.
94. Н. Л. Козловская. Тромбофилические состояния. Клиническая фармакология и фармакотерапия, 2003, том 12, №1, с. 74-80.
95. А. И. Кириенко. Профилактика венозных тромбозов и лёгочных эмболий в хирургической практике. Тромбофилические состояния. Клиническая фармакология и фармакотерапия, 2005, том 14, №4, с. 26-30.
96. Geerts WH, Bergqvist D, Pineo GF, Heit JA, Samama CM, Lassen MR, Colwell CW; American College of Chest Physicians. Prevention of venous thromboembolism: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest. 2008 Jun;133(6 Suppl):381S-453S.
http://www.chestjournal.org/content/133/6_suppl/381S.long
97. Douketis JD, Moinuddin I. Prophylaxis against venous thromboembolism in hospitalized medical patients: an evidence-based and practical approach. Pol Arch Med Wewn. 2008 Apr;118(4):209-15.
http://tip.org.pl/pamw/issue/article/164.html
98. Клиническае классификации внутренних заболеваний. Пособие для врачей. Под редакцией проф. Гасилина В. С., проф. Григорьева П. С. Москва.: 2000 г.
99. Машковский М Д. Лекарственные средства: в 2-х томах. Т.1. – 10-е изд стер. – М.: Медицина, 1987. – 624 с.
100. Dresang LT, Fontaine P, Leeman L, King VJ. Venous thromboembolism during pregnancy. Am Fam Physician. 2008 Jun 15;77(12):1709-16.
http://www.aafp.org/afp/20080615/1709.html
