
- •Федеральное агентство по образованию
- •Пояснительная записка
- •Тематический план
- •Содержание курса
- •Тема 1. Предмет и задачи экологии
- •Тема 2. Взаимодействие организма и среды. Экологические факторы
- •Тема 7. Охрана окружающей среды. Экологическая защита
- •Тема 8. Правовые и экономические аспекты охраны окружающей среды
- •2.1. Теоретическая часть
- •2.2. Практическая часть
- •3.1. Теоретическая часть
- •3.2. Практическая часть
- •Моделирование экосистемы с помощью системы «водоем»
- •Рекомендуемая литература
- •Периодические издания
2.2. Практическая часть
1. Измерение pH производится с использованием установки, представленной на рис. 2.1. Для этого наливаем в стакан (1) по 20мл. исследуемых образцов воды и измеряем pH с помощью рН-метра типа «Cheker» в соответствии с инструкцией к прибору.
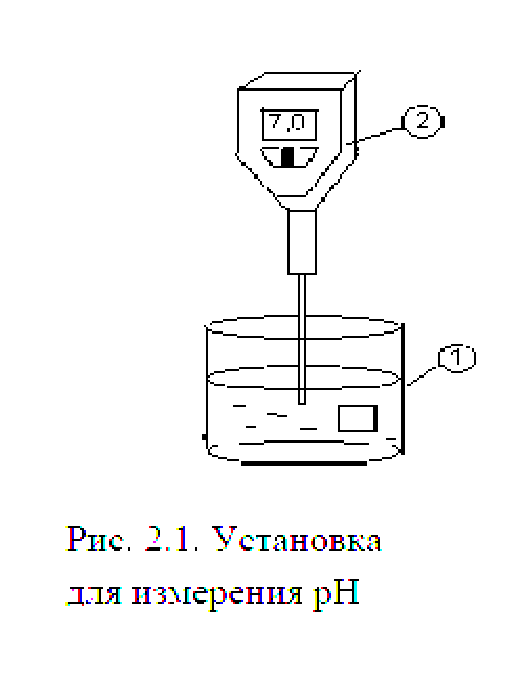
Результаты измерений записываем в таблицу 2.2.
2. Определение содержания кислот методом нейтрализации.
20 мл пробы помещаем в коническую колбу. К исследуемой пробе приливаем раствор щелочи NaOH с эквивлентной концентрацией 0,1 моль/л (СЩ = 0,1) до
появления малиновой окраски. Расчет концентрации кислоты проводим по формуле:
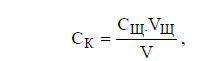 где
СЩ
и СК
- концентрация щелочи и кислоты, моль/л,
где
СЩ
и СК
- концентрация щелочи и кислоты, моль/л,
VЩ и V - объем щелочи и воды (проба 4).
Для расчета концентрации кислоты в образце воды в мг/л (СК1) используем следующее выражение:
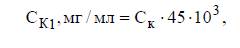 где
СК
–
концентрация кислоты, моль/л,
где
СК
–
концентрация кислоты, моль/л,
45 г/моль – эквивалентная масса щавелевой кислоты.
3. Определение окисляемости воды перманганатным методом.
Реактивы: раствор KMnO4 c молярной концентрацией эквивалентна 0,01 моль/л, раствор H2C2O4 c молярной концентрацией эквивалентна 0,01 моль/л, раствор H2SO4 (1:3).
Посуда: бюретки 25 мл-3, конические колбы 250 мл-3,мерный цилиндр 100мл-1,мерный цилиндр 10 мл-1,бусинки или капиллярчики-6, электрическая плитка.
В коническую колбу вместимостью 250 мл наливаем 10 мл анализируемой воды, 90 мл дистиллированной, 5мл серной кислоты и из бюретки 10 мл 0,01 н раствора перманганата калия. Полученный раствор нагреваем и 10 мин с момента закипания кипятим на плитке с асбестовой сеткой. Для равномерного кипения помещаем в колбу бусинки или капиллярчики. Если при нагревании раствор обесцвечивается, то опыт повторяем с меньшим количеством анализируемой воды. В горячий раствор приливаем из бюретки 10 мл 0,01 н раствора щавелевой кислоты. Избыток перманганата калия, оставшийся в пробе после окисления вещества, реагирует со щавелевой кислотой, согласно уравнению по схеме:
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+10CO2+K2SO4+8H2O
Раствор при этом обесцвечивается. Избыток щавелевой кислоты оттитровываем раствором перманганата калия до появления слабо-розового окрашивания, сохраняющегося примерно минуту.
Параллельно проводим холостой опыт со 100 мл дистиллированной воды в той же последовательности, что и с анализируемой водой.
Окисляемость воды или химическое поглощение кислорода в мг/л кислорода вычисляют по формуле:
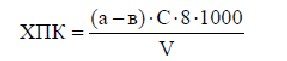
где «в» - объем раствора перманганата калия, израсходованного на титрование в холостом опыте, мл;
«а» -объем того же раствора, израсходованного на титрование пробы, мл;
«С» - молярная концентрация эквивалента раствора перманганата калия,
моль/л;
«V» − объем анализируемой воды, мл;
8- молярная концентрация эквивалента кислорода, моль/л.
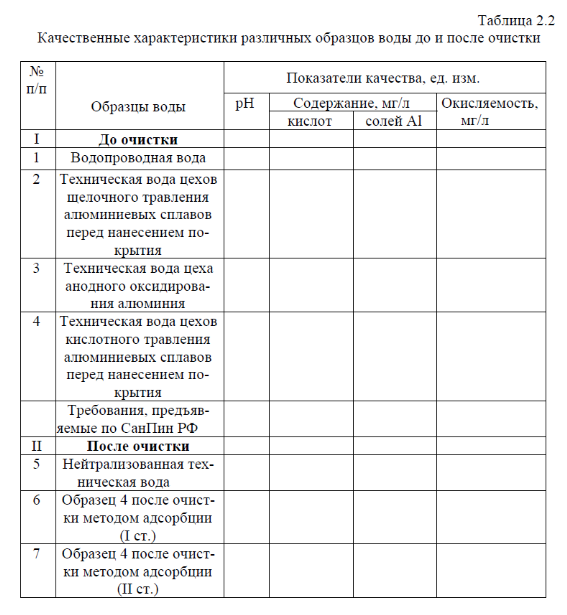
Результаты измерений показателей качества образцов воды, определенных в соответствии с методиками 1,2, 3, внесите в таблицу 2.2.
Сделайте заключение о соответствии качества исследуемых образцов воды требованиям СанПин (см. таблицу 2.1). До каких значений должны быть
доведены показатели качества образцов воды, не соответствующие установленным требованиям?
ЛАБОРАТОРНАЯ РАБОТА № 3
ЭКОЗАЩИТНАЯ ТЕХНИКА И ТЕХНОЛОГИИ
Цель работы: Провести очистку исследуемых образцов воды (см. Л/р.№2)
с использованием методов: а) адсорбции (образец 4) и б) нейтрализации (образцы 2, 3).
